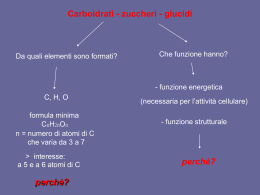
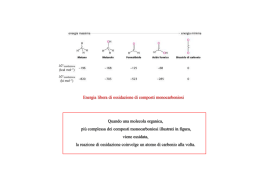
Glucosio endogeno gluconeogenesi Glucosio esogeno glicogenolisi assorbimento dei carboidrati del pasto Glucosio plasmatico utilizzazione periferica eliminazione renale Principali effetti della insulina muscolo tessuto adiposo Insulina • Aumento trasporto ed utilizzazione del glucosio • Aumento trasporto ed utilizzazione del glucosio • Immagazzinamento dei grassi • Riduzione della liberazione dei grassi fegato •Aumento della utilizzazione del glucosio •Riduzione del rilascio di glucosio 100 grammi Curva risposta livelli insulina Metodi determinazione Glucosio • Metodi che sfruttano il potere riducente del glucosio (acido picrico,ioni rameici, ferricianuro,acido 3,5 dinitrosalicilico) • Metodo dell’ o-toluidina • Metodi enzimatici: • Glucosio ossidasi • Esochinasi • Uso di un elettrodo a ossigeno Spettro visibile 390 UV 450 Wavelength (nm) 520 590 620 Increasing Energy Increasing Wavelength “Red-Orange-Yellow-Green-Blue” 780 IR H + Ac.Carbossilico + Aldeide Riscaldamento 90° 5-15 min, colore a 540-575nm Acido 3,5-dinitrosalicilico NH2 + Ac.Carbossilico + Aldeide Ac.picrico Col.giallo Ac.picramico Col.rosso Fe(CN)6K4 Fe(CN)6K3 giallo ferrocianuro 2Cu 2+ + Aldeide Cu+ + Neocuproina 2,9-dimetil-1,10-fenantrolina Lettura 410 nm incolore Cu+ + Ac.carbossilico Lettura 454 Cu+ Glucosio +H2O -------(glucosio ossidasi)-------- Glucolattone +H2O2 H2O2 + Cromogeno (ridotto) in presenza di perossidasi H2O + Cromogeno ox O-CH3 CH3 Cromogeni utilizzati: o-anisidina o-toluidina abbandonati perché cancerogeni 4-aminoantipirina glicosamina perossidasi 4-aminoantipirina fenolo Chinonimina Chinonimina lettura a 480-520 NADP+ NADPH+H+ Rappresentazione schematica di un biosensore ad O2 BIOSENSORI ELETTROCHIMICI AMPEROMETRICI O-ring Membrana enzimatica Elettrodo di Supporto lavoro di Pt Membrana di policarbonato Membrana di acetato di cellulosa Elettrodo di riferimento (Ag/AgCl) Elettrodo ad ossigeno Un comune elettrodo ad ossigeno è l’elettrodo di Clark: catodo (elettrodo di lavoro) di platino o d’oro, anodo (elettrodo di riferimento) di Ag/AgCl, separati da una resina epossidica isolata. I due elettrodi sono fissati in un supporto di plastica contenente una soluzione elettrolitica. Il tutto è separato dalla soluzione esterna, in cui verrà addizionato il campione da misurare, da una membrana gas permeabile (membrana di teflon). L’elettrodo di lavoro è mantenuto ad un potenziale di circa -700 mV rispetto all’elettrodo d’argento ed è posto in intimo contatto con la membrana a gas al fine di ottenere una risposta rapida. In queste condizioni si registra una variazione di corrente dovuta alla riduzione dell’ossigeno al catodo secondo la seguente reazione: Pt= catodo O2 + 4H++ 4e- 2 H2O mentre all’anodo Ag/AgCl 4Ag + 4Cl- 4AgCl + 4e- Elettrodo ad ossigeno Il sensore ad O2 può essere accoppiato con un grande numero di enzimi ossidasi immobilizzati su opportune membrane polimeriche che vengono sovrapposte alla membrana di teflon. Come esempio riportiamo il classico sensore sviluppato da Clark e Lyons nel 1962 con l’enzima glucosio ossidasi che catalizza la seguente reazione in due passaggi: Glucosio + Enzima-FAD + H2O acido gluconico + Enzima-FADH2 Enzima-FADH2 + O2 H2O2 + Enzima-FAD La corrente dovuta alla riduzione dell’ossigeno al catodo diminuisce all’aumentare della concetrazione di glucosio in soluzione. Se l’analita da misurare non è substrato di un’ossidasi è possibile utilizzare, in alcuni casi, una sequenza enzimatica che, partendo dall’analita, generi un composto che è substrato di una ossidasi. Sensore ad H2O2 La stessa reazione catalizzata dalla glucosio ossidasi può essere utilizzata per la determinazione del glucosio monitorando la produzione di H2O2 con un sensore specifico per quest’ultima specie. Questo sensore amperometrico ha la stessa configurazione di quello ad ossigeno, in questo caso però la polarità è invertita, + 650 mV, e l’elettrodo di lavoro di platino funziona da anodo, mentre l’elettrodo di riferimento di Ag/AgCl funziona da catodo. La reazione di ossidazione dell’acqua ossigenata all’anodo è la seguente: H2O2 O2 +2H+ +2eLa membrana gas permeabile dell’elettrodo ad O2 viene sostituita con una membrana di acetato di cellulosa che impedisce il passaggio di composti con peso molecolare superiore a 100-150 dalton che potrebbero essere elettroattivi o potrebbero avvelenare gli elettrodi. L’enzima è immobilizzato e tenuto il piu’ vicino possibile all’elettrodo di lavoro, quindi l’H2O2 che si produce dalla reazione enzimatica diffonde attraverso la barriera di acetato di cellulosa, raggiunge l’elettrodo di lavoro e produce un aumento di corrente che è direttamente proporzionale alla concentrazione dell’analita da analizzare. Volume del campione si passa da 30 to 0.3 μl. Tempi da 2 min a 5 sec Riflettanza localizzata temperatura-mediata Si basa sull'osservazione che variazioni di temperatura pro vocano variazioni dell’ indice di rifrazione dei tessuti (che influenza la dispersion e della luce), ma l'entità di questi cambiamenti dipende anche dalla concentrazione di glucosio [73], la quale è stimata con i segnali di riflettanza localizzati a 590 e 935 nm. Altri test diagnostici • • • • Insulina Emoglobina glicosilata Autoanticorpi Corpi chetonici RIA=tracciante radioattivo EIA=tracciante enzimatico HbAo Hb glicata HbA1c HbA3 HbF HbA1a+b a-chain uso di un anticorpo secondario La procedura implica l’uso di un anticorpo secondario marcato, in grado di riconoscere la regione costante dell’anticorpo primario, precedentemente incubato su fase solida. La reazione di competizione avviene fra l’antigene immobilizzato e quello libero in soluzione come standard o proveniente dal campione, nei confronti dell’anticorpo presente in concentrazione fissa. La misura del prodotto enzimatico sarà direttamente proporzionale nel caso della misura del titolo dell’anticorpo da determinare, mentre inversamente proporzionale per l’analita. I corpi chetonici si possono testare con strisce reattive • Il reagente è il nitroprussato di sodio • Reagisce con acido acetoacetico e con acetone, mnon con beta-OH-butirrato • Colorazione viola • Range: 5-160 mg/dl
Scaricare