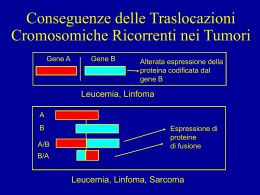
corso di Genomica 2010-2011 lezione 13-14 giovedì 25.XI.2010 • laurea magistrale Biotecnologia Industriale aula 6A orario : Martedì ore 14.00 - 16.00 Giovedì ore 13.00 - 15.00 D. Frezza approcci diversi su topo esperimento per fare topi transgenici in ogni parte del genoma trascritta e tradotta (esoni) creare una collezione (library) di cellule embrionali ricombinanti in ogni gene Organismi Transgenici - Alterazione del genoma tramite tecniche di manipolazione del DNA - Metodo diverso rispetto all’induzione di mutazioni - Le mutazioni indotte avvengono in maniera random - Prime prove di organismi transgenici : inserzione di un elemento esogeno nel genoma - Preparazione di costrutti adatti per essere attivi in genomi di origine diversa, Nei genomi eucariotici non esistono unità autonome autoreplicanti come i plasmidi nei batteri. Perché? Meiosi e mitosi vogliono strutture cromosomiche con centromero OGM e organismi transgenici modi di dire e luoghi comuni confusioni mediatiche un OGM è anche un batterio che ha subito mutagenesi o in cui abbiamo inserito un plasmide o un vettore di espressione adesso i giornali chiamano OGM gli organismi vegetali trasformati o “ricombinanti” per un gene esogeno organismi transgenici e topi trnsg. le tecniche per ottenere organismi transgenici variano molto da organismo ad organismo metodologia: trasfezione del vettore transiente o per integrazione - ricombinazione uso di cellule staminali, zigoti, embrioni, trapianti (drafts) sono pseudo ricombinanti o pseudo transgenici non c’è mescolamento di genomi le piante si innestano comunemente piante da frutto usano l’innesto da centinaia di anni o più da quando è stato possibile usare il DNA e clonarlo è uscita la tecnica del DNA ricombinante il salto dai batteri (metà anni ‘60) ai mammiferi (topo, anni ‘80) ha fatto un grande scalpore esempio dei topi transgenici non abbiamo tempo per poter vedere le differenti tecniche usate nei vari organismi eucariotici negli organismi eucariotici non si possono usare plasmidi o regioni autonome di replicazione, solo cromosomi si deve ottenere un evento di ricombinazione del vettore nel genoma e rendere l’integrazione del DNA eterologo stabile il vettore deve essere veicolato nell’organismo (trasfezione) il vettore si deve esprimere se vogliamo un fenotipo il vettore deve entrare nella linea germinale per avere la linea transgenica: sarà monoclonale? Topi transgenici per espressione e knock-out Inserzione random Ricombinaz. omologa (cellule ES) Embrioni tetraploidi Costrutti con BAC Mutanti condizionali Espressione inducibile come si fanno i topi transgenici? metodo di iniezione diretta del vettore nella blastocisti ed inserzione random del vettore nel genoma ostite anche in più copie (metodo di espressione di un gene esogeno) metodo per ricombinazione omologa con vettori con regioni omologhe alle regioni in cui vogliamo inserire il vettore, necessario l’uso di cellule embrionali staminali ES (metodo per ottenere KO di geni) Topi transgenici per inserzione random nel genoma Primi topi transgenici solo di espressione di marcatori, geni eterologhi, sovrannumerari, - iniezione diretta del DNA nella blastocisti - inserzione in una o più copie nel genoma ospite, - inizialmente un marcatore carrier per il colore del mantello come controllo della ricombinazione ed espressione Metodologia di base - organismo transgenico Come si ottiene: trasfezione batterica come modello Trasfettare cellule eucariotiche animali e vegetali col DNA Tecnica del DNA ricombinante per i vettori Cellule vegetali hanno anche la parete di cellulosa: metodi di trasfezione più complessi Cellule animali hanno solo la membrana meno resistente Tecniche di trasfezione diverse e con efficienze diverse Necessità della tecnica adeguata per veicolare il DNA Organismi Transgenici La selezione tramite incroci produce organismi “innaturali” ? come gli organismi transgenici? Innaturale = manipolato ? - la trasmissione orizzontale di informazione genetica per via naturale esiste: es MIRs (mamm. interspersed regions) SINE (short interspersed nucl. Elements) Vipera-Bovini - pericolo (soprattutto in agricoltura) per il passaggio di geni esogeni in altre specie che ne sono privi (batteri simbionti). - i geni che si usano possono creare rischio? - uso del criterio di cautela Le stesse preoccupazioni sono state poste quando iniziarono i clonaggi nei plasmidi e poi con vettori di espressione usando batteri e reistenze ad antibiotici. Sono nati i laboratori a contenimento negativo da cui non possono uscire batteri ricombinanti. Organismi trangenici II Dopo i procarioti è stato possibile fare organismi transgenici con organismi eucariotici. - fattore limitante la tecnica adatta. - manipolazione del DNA è sempre la stessa, - cambia la veicolazione e stabilità nei genomi. - non ci sono plasmidi nelle cellule degli organismi complessi. L’integrazione in un genoma può creare dei problemi sia al frammento da integrare sia al genoma ospite. C’è stata e c’è una notevole differenza tra i modi di produrre organismi transgenici vegetali o animali. Per alcuni organismi vegetali si possono usare con facilità dei trasposoni che facilitano l’integrazione nel genoma. Per integrarsi un costrutto deve comunque ricombinare. Finchè non erano note molte sequenze la ricombinazione era esclusa anche perché è un evento raro (≈ 10-6) Oragnismi transgenici III Organismi modello transgenici: Drosofila, Coenorabditis el. ed il Topo e tra i vegetali Arabidopsis e Nicoziana. - sono stati usati organismi modello già usati in genetica con sufficienti informazioni. - per gli organismi vegetali: come veicolare il DNA attraverso le protezioni esterne come la parete di cellulosa, - sono stati usati virus o batteri trasformanti o micro sfere di metallli pesanti (oro) come proiettili adsorbiti col DNA. - negli animali le cellule sono più facilmente penetrabili - l’uso dei virus come veicolo è il metodo più efficiente, i virus devono essere non infettivi e non ricombinare per ridare origine al virus “wild type” infettivo. Nel topo la tecnica iniziale è stata quella di utilizzare la blastocisti che era già utilizzata dai biologi dello sviluppo. Il primo successo è stato ottenuto generando un topo chimerico. Topi chimerici e transgenici - un organismo transgenico deve avere trasfomrate le cellule della linea germinale oppure il nucleo dello zigote. Nel topo in cui è problematico intervenire sugli uni e sull’altro è stato utilizzata la blastocisti su cui già veniva fatta sperimentazione. La topolina da accoppiare viene trattata con estrogeni per far avvenire l’ovulazione e per avere un buon numero di blastocisti. La blastocisti si riconosce più facilmente da uno zigote (annessi) e si riesce a trovare facilmente nell’utero di una topolina accoppiata poco prima. Dopo l’accopiamento in poche ore si forma un tappo vaginale che è il segno dell’avvenuta fecondazione. I primi topi chimerici sono stati ottenuti iniettando direttamente il DNA nella blastocisti che lo riassorbe e con buona probabilità riesce a trasformare le cellule. Dal chimerico al transgenico Iniettando il DNA nella blastocisti qualche cellula potrà assorbire il DNA, ma non tutte e quindi si otterrà un topo chimerico in cui non tutti i tessuti hanno nel genoma il DNA iniettato (con un costrutto adatto per essere funzionale ed esprimersi, cioè un gene completo e più spesso artificiale, recante un promotore forte costitutivo come quello di un virus). Questo tipo di vettore se porta un gene per una resistenza ad un antibiotico non deve essere diffuso fuori dal laboratorio. Tra i topi chimerici ci potrebbe essere quello che ha assorbito e ricombinato nella linea germinale e che può dare origine ad una linea transgenica. - un incrocio con un topo della linea isogenica per poter riconoscere eventualmente dal pelo se si è trasmesso il gene marcatore. Quindi se si ottiene una F1 transgenica si reincrocerà sempre con topi isogenici a quelli utilizzati per fare il topo chimerico. Si ottiene sempre un eterozigote! 1 allele resta wt! Controllo del topo transgenico Come si può essere certi che il topo sia transgenico a parte il colore del pelo (non sempre si associa un marcatore per il colore del pelo) ? Si deve analizzare il DNA dell’animale, nel caso del topo si prende un frammento della coda che non provoca troppo trauma o danno fisico e se ne analizza il DNA tramite Southern blot o tramite PCR. Per sapere dove si è integrato si deve clonare il frammento corrispondente a quello del Southern con PM alterato e sequenziarlo, - tramite PCR inversa cercare la sequenza dei frammenti limitrofi al costrutto integrato. - il gene che si esprime corrisponde ad un fenotipo atteso, oppure diverso dal wt.? - Per sapere se si sono integrate più copie con il Southern si ha risoluzione migliore e cosa si vede? Per PCR inversa cosa si deve fare per vedere se c’è più di una copia ? Schema in cui si mostra l’iniezione con cellule, col DNA è uguale Iniezione con ES cells o DNA Come si forma la blastocisti Stadi diversi di maturazione dalla morula alla blastocisti Ricombinazione omologa e cellule ES Topi transgenici con iniezione diretta del DNA nella blastocisti possono avere il gene esogeno in un punto qualunque del genoma e non sempre si potrà esprimere come vorremmo, dipende dal sito in cui si inserisce. Potrebbe essere un sito silente oppure che provoca danno ad una funzione del topo, per cui non è vitale. Soprattutto si riesce solo a fare esprimere un gene e non si può interferire con una funzione genetica endogena del topo, caso mai si interferisce col metabolismo. Capecchi ed alcuni altri sono riusciti a coltivare cellule ES embrionali staminali di topo e a trasformarle per cui si poteva ottenere un topo chimerico con efficienza iniettando le cellule già con il DNA integrato, sapendo anche dove è integrato. La cosa più eclatante è stata la possibilità di ottenere cellule ES trasformate con DNA ricombinato in un sito specifico per ricombinazione omologa. Prime prove con gene HPGRT Vettore per Ricombinazione omologa I primi esperimenti di ricombinazione omologa furono fatti da Capecchi con il gene per la resistenza HGPRT ipoxantina-guanina fosforibosil Transferasi. Il problema e’ di selezionare le cellule con un fenotipo, ma sono pochi i geni con un fenotipo selettivo, in tale assenza si utilizza la res. per un antibiotico. Il costrutto per far avvenire la ricombinazione omologa deve avere una regione omologa a quella con cui vogliamo ottenere la ricombinazione: mut. x x vettore a struttura W w.t. Di solito si utilizza un costrutto che abbia due regioni di omologia (spalle) rispetto alla regione che si vuole inserire. La frequenza e’ stata studiata ed e’ ~ 1- 2 x10 -6 A analisi olistica per cercare geni A) analisi chiamata di “trapping” a seconda se si cercano regioni codificanti = “gene trapping” B) se si cercano regioni regolative = “regulative region trapping” olistico perchè non si sa a priori cosa andiamo a trovare, il meccanismo di ricerca dipende dal costrutto, si deve preparare un costrutto intelligente che possa rispondere alle possibilità che il ricercatore ha saputo prevedere con la sua creatività e informazione Metodo del gene trapping Per fare topi transgenici su vasta scala generalizzata, senza un solo target In realtà il topo transgenico “trapped” si ottiene solo dopo aver selezionato la cellula staminale, -la fase cruciale è lo screening per ottenere la collezione di cloni di cellule staminali ES mutagenizzate nei diversi geni. - il buon trapping mi deve trovare dei geni noti che danno la rappresentatività della collezione di cellule ES mutagenzzate (trasfettate col vettore) Gene trapping tramite Victr 3 e 20 vettori per il 3’o 5’ “trapping”(presenza di LTR virali per l’integrazione nel genoma ospite) LTR VICTR3 VICTR20 LTR PGK SA IRES geo puro pA SD PGK LTR puro 5’ trap 3’trap SD LTR 3’ trap Wild-type locus SA IRES geo pA AAAAAn PGK G LTR puro SD LTR AAAAAn G costrutti per gene trapping PT1 geo lacz neo (5’ trap) ei geo ee pA ei engrailed 2 intron; ee eng 2 exon geo = lac z - neo fusion pA poly adenilation signal U3 geo U3 LTR region enhancerless Mol mur Leuk Sup 5 E. coli sup F tRNA geo U3 geo RU5 Sup 5 U3 RU5 Mason-Pfizer monkey virus translational enhancer sa TS4 Lac Z P-neo RU5 vettori per analisi olistica il genoma dei mammiferi: basso numero di geni (trascritti e tradotti) rispetto alla grandezza dell’intero genoma A) ricerca di geni nel topo non ancora conosciuti a partire da ricombinanti ES con vettore intelligente B) ricerca di regioni regolative non ancora conosciute a partire da ricombinanti ES con vettore con reporter se un topo transgenico KO non da fenotipo può essere recessivo ed è necessario fare un omozigote se è dominante letale non si riesce a sapere cosa modifica è stato inventato un metodo con cui ottenere mutanti condizionali si ottiene un topo transgenico con fenotipo normale, il vettore è inserito per lasciare la funzione normale al momento voluto si induce ricombinazione e si inattiva la funzione del gene si può arrivare alle fasi di sviluppo successive a quella che provoca la morte e studiare il fenotipo Il costrutto per il gene floxed costrutto esone x induz. di Cre ricombinaz. e delez. neo esone y esone x introne x loxP - neo - loxP neo esone x introne x loxP esone z gene tk loxP loxP - neo - loxP ricombinaz. omologa costrutto ricomb. introne x esone z esone y gene tk loxP esone y esone z loxP gene tk Il gene per la timidino kinasi del virus Herpes simplex rende le cellule sensibili al Ganciclovir Nel caso di ricombinazione non omologa il gene tk non verra’ eliminato e le cellule potranno essere eliminate con la selezione dell’antibiotico Dopo l’eliminazione della resistenza alla neomicina per l’induzione del gene Cre le cellule ES mutanti sono pronte per essere iniettate nelle blasocisti sito per topi con costrutti Cre http://authors.elsevier.com. http://www.mshri.on.ca/nagy/Cre-pub.html Ceppi di topo che esprimono il gene Cre in tessuti diversi Analisi del topo transgenico Dopo l’analisi del DNA della coda per PCR Analisi dell’espressione con anticorpi anti CRE, scarsa espressione eccetto nell’epidermide. Analisi della presenza dell’ RNA estratto da vari tessuti Transgene Cre - ERT PvuII CMV promoter 3 globin intron SV40 polyA signal inizio trascrizione INTRON Cre-ERT 1 poly A 4 2 PvuII costrutto per un gene del SNC pJOJO cDNA Ngi CMV-IE actina loxP-GFP-loxP IRES lacZ - poly A Ngi Nerve growth inibitor da gene trapping CMV promotore del citomegalovirus IE enhancer actina di pollo GFP green fluor. protein floxed IRES internal ribosome entry site di encefalomiocardite Lac Z per la galattosidasi Prova di espressione e funzionamento su un topo transgenico “floxed” per il gene del recettore dell’acido retinoico RXR dopo induzione di Cre (controllo di funzionalità di Cre) 7 E8 E9 8 RXR(targetet floxed gene) 5 Tk neo E8 LoxP RXR(targetet floxed gene Excision of floxed marker After CRE recombinase) 50 40 30 20 Prodotto di PCR 156 bp Primers 7 e 8 7 E8 E9 8 E9 6 LoxP Prodotto di PCR 190 bp Primers 7 e 8 100 80 60 40 10 20 0 0 mRNA CRE Er % RXR wt Livello di espressione di CRE (pallini) e di excisione dopo 3 giorni e dopo 1 giorno nella coda RNA interference (hairpin double strand RNA) Metodi per interferire con l’espressione di un gene: “stable suppression of gene expression by RNAi in mammalian cells” P.N.A.S. vol.99 n.3 pp 1443-8 P.J.Paddison et al. - mutagenesi, mutazioni termo sensibili(condizionali), soppressori - knock out per ricombinazione - anticorpi contro la proteina (prodotti da un vettore) - RNA antisenso trascritto da un vettore - oligo antisenso Questi metodi hanno il difetto di non essere sempre applicabili ai sitemi eucarioti; in certi casi non sono regolabili. L’RNA antisenso per funzionare deve essere aggiunto in dosi massicce, oppure deve essere trascritto dentro la cellula, ma il funzionamento della interferenza e’ legata al sistema Dicer, cioe’ ad un pathway enzimatico che riduce l’RNA specifico del messaggero in frammenti. E’ stato fatto un esperimento sfruttando il metodo CRE Lox per produrre un RNA a doppio filamento per bloccare l’enzima Dicer stesso Soppressione stabile dell’espressione genica tramite RNA interference in cellule di mammifero Sistema cellulare di difesa antivirale dimerizzazione PKR fosforilazione Blocco non specifico della traduzione EIF2 (kinasi) dsRNA esogeno (~ 500 bp) attiva Cofattore per la ribonucleasi non - specifica (Rnasi L) 2’- 5’ oligodenilato polimerasi pcDNA3 P GFP ZEO r L GFP L ZEO r Gene per la resistenza alla zeocina; L Lox P; GFP Le prime 500 bp codificanti di enhanced gr. fluor. prot. EGFP; P Promotore di citomegalovirus; vettore per interference GFP P GFP ZEO r L GFP L Ricombinasi CRE P GFP ZEO r ZEO si interferisce con la GFP endogena nella linea cellulare e si blocca L GFP L r dsGFP può essere trasfezione transiente o stabile Rapporto FF:REN esperimento di controllo Riduzione di 10 volte dell’espressione di FF in cellule trasfettate con i due plasmidi FF/REN FF = firefly luciferase REN = renilla luciferase ds = double strand ss = single strand as = antisense
Scaricare