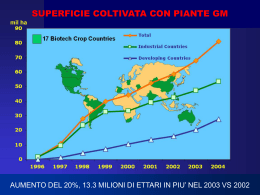
OPENLAB Roma 7/9 Ottobre 2004 Dipartimento di Genetica e Biologia Molecolare Università di Roma La Sapienza Venerdì 8 Ottobre Parte sperimentale h 9.15-10.30 h 11.30-12.45 OGM ORGANISMI GENETICAMENTE MODIFICATI Tecniche di trasformazione degli organismi vegetali Applicazioni Considerazioni sugli aspetti safe/unsafe Paola Vittorioso Dipartimento di Genetica e Biologia Molecolare Università di Roma La Sapienza QUALI SONO I METODI DI TRASFORMAZIONE? I metodi indiretti mediati da Agrobacterium tumefaciens I metodi diretti che non utilizzano Agrobacterium (trasformazione di protoplasti, microiniezione, elettroporazione di cellule e tessuti, tecniche biolistiche) Caratteristiche delle cellule vegetali A differenza delle cellule animali che possono rigenerare altri organismi SOLO a partire da cellule della linea germinale, nelle piante qualunque tessuto può rigenerare una pianta intera lo stadio differenziativo dei tessuti vegetali è reversibile e può essere manipolato in vitro I metodi indiretti Agrobacterium batterio Gram-negativo del suolo in grado di infettare numerose piante inducendo, in corrispondenza di una lesione, caratteristiche alterazioni tumorali La virulenza di questi batteri è associata alla presenza di grossi plasmidi, cioè molecole di DNA autonome ed indipendenti dal resto del genoma un frammento di DNA batterico (T-DNA) viene trasferito dal batterio alla cellula vegetale e si integra STABILMENTE nel genoma della pianta Agrobacterium tumefaciens E i suoi………”rapporti” con la cellula vegetale Cellula vegetale T-DNA LB Per vedere questa immagine occorre QuickTime™ e un decompressore Photo - JPEG. RB Cromosomi vegetali Plasmide Ti Cellula di Agrobacterium Dal plasmide di Agrobacterium vengono derivati vettori di trasferimento in cellule vegetali RB e LB sono essenziali per il trasferimento del T-DNA, mentre il T-DNA stesso non lo è Qualunque sequenza di DNA inclusa RB e LB viene trasferita nelle cellule vegetali Vettore binario Per la trasformazione di cellule vegetali Marker batterico LB Marker vegetale RB gene d’interesse Arabidopsis thaliana pianta modello per la biologia molecolare vegetale Perché: tempo di generazione molto breve: 6 sett./ciclo taglia piccola e gran numero di “eredi” genoma nucleare piccolo (125 Mb) poco DNA ripetuto facilmente trasformabile ad alta efficienza Specie Genoma (Mb) N. Geni Refer. 125 25.500 (2000) Drosophila Homo sapiens S.cerevisiae 180 3200 12,1 13.600 30.000/40.000 5.800 Escherichia coli 4,64 Arabidopsis thaliana 4.400 (2000) (2001) (1996) (1987) La trasformazione di Arabidopsis thaliana: Infiltrazione sotto vuoto con Agrobacterium Isolamento di linee transgeniche Trasformazione mediata da Agrobatterio Raccolta semi T1 T0 T2 sensibili resistenti Analisi in vitro segregazione Selezione dei trasformanti T1 in vitro Autoimpollinazione Raccolta semi T2 Isolamento di piante omozigoti per il gene d’interesse I geni reporter sono sequenze di acidi nucleici codificanti per proteine facilmente evidenziabili/quantificabili Sono principalmente utilizzati per Studiare l’attività di sequenze regolative di un gene La localizzazione di proteine Per vedere questa immagine occorre QuickTime™ e un decompressore GIF. Tengo el gen de la luciferasa!!!! Tra i geni reporter più utilizzati: CAT (cloramfenicolo acetiltrasferase) GAL (b-galattosidasi) GUS (b-glucuronidasi) idrolizza glucuronidi incolori in prodotti colorati LUC (luciferasi) GFP (green fluorescent protein) fluoresce in seguito a irragiamento con UV Analisi di espressione con il gene reporter GUS Venerdì 8 Ottobre Parte teorica h 10.30-11.00 h 12.45-13.15 OGM ORGANISMI GENETICAMENTE MODIFICATI Tecniche di trasformazione degli organismi vegetali Applicazioni Considerazioni sugli aspetti safe/unsafe Paola Vittorioso Dipartimento di Genetica e Biologia Molecolare Università di Roma La Sapienza TRASFORMAZIONE di ORGANISMI VEGETALI In teoria la trasformazione vegetale offre l'opportunita' di introdurre geni di qualunque origine nelle cellule vegetali, superando ogni barriera di specie e modificando esclusivamente i geni desiderati La prima cellula vegetale resistente agli antibiotici è stata prodotta dalla Monsanto nel 1982. La prima pianta trasgenica è stata invece prodotta nell’università belga di Gent nel 1983 Ad oggi si trasformano con successo piu' di 120 specie vegetali Il “classico”…………. Induced mutation-assisted breeding ha permesso l’introduzione di nuove varietà di prodotti agricoli quali riso, mais, orzo, e banana Pro……… Facilità di esecuzione Non richiede intervento di laboratori, multinazionali, etc. Contro……... No controlli sull’impatto ambientale ne’ sui rischi per la salute delle nuove varietà ottenute per “breeding” convenzionale Il “nuovo”……….. dalla “Green Revolution” alla “Gene Revolution” OGM s Organismi in cui un transgene è incorporato nel genoma ospite, o un gene residente è modificato nei livelli di espressione Perché……... La popolazione mondiale raggiungerà i 10 miliardi a metà di questo secolo, cioè 2 miliardi in più di persone da nutrire Nei prossimi 20 anni, la richiesta di cereali aumenterà del 50%, quindi la produttività dei terreni già in uso deve essere migliorata Oggi…. Circa 1000 persone sono in uno stato di fame cronica e miliardi di persone soffrono di carenze nutrizionali Perché NO…… rischio di reazioni allergiche: gli OGM DEVONO essere testati per eventuali reazioni allergiche trasferimento genico orizzontale per gli antibiotici rischi per l’ambiente? (minaccia alla biodiversità, insorgenza di insetti resistenti) effetti indesiderati?????? PERCHÉ TRASFORMARE GLI ORGANISMI VEGETALI? Controllare lo sviluppo delle piante e la loro resa: Nell’endosperma dei semi del grano l’incrementata attività di un proteina coinvolta nella regolazione della biosintesi dell’amido aumenta la resa di quasi il 40%. Aumento della produttività Sviluppo nei paesi poveri Utilizzare le piante per produrre molecole di interesse: Può essere modificato il contenuto di metaboliti indispensabili per la nutrizione umana ed animale (es. vitamine, aminoacidi essenziali). Migliorare non solo la quantità ma anche la qualità dei raccolti. Migliorare la tolleranza delle piante agli stress biotici: Introduzione di geni che conferiscano una maggiore capacità di adattamento a condizioni estreme, tra cui: presenza di metalli pesanti nel terreno, elevate concentrazioni saline, siccità, elevate temperature. Coltivazione in zone inadatte Creare piante resistenti a malattie, pesticidi, erbicidi: Un esempio classico riguarda il mais-BT: la tossina BT che viene prodotta grazie all’inserzione di un gene batterico agisce come un insetticida naturale contro la piralide (lepidotteri). Il batterio in questione è un Bacillus thuringiensis e produce un’ elevata quantità di tossine attive sulle larve stesse. Risparmio economico (meno diserbanti e risparmio sul costo del lavoro) Riduzione dell’uso di pesticidi E, dulcis in fundo………………. Creazione di mutanti per studiare la funzione dei geni Ricerca di base, perché………... “fatti non foste per viver come bruti……………………” Dante Incremento di coltivazioni OGM negli anni Caratteri delle piante transgeniche nei paesi industrializzati Resistenza insetti 19 Resistenza erbicidi 29 Qualità prodotto 16 Resistenza Caratter. Virus Agronomiche 8 5 Resistenza Funghi/batteri 5 Geni vari 18 Caratteri delle piante transgeniche nei paesi NON industrializzati Resistenza erbicidi 29 Resistenza insetti 37 Qualità prodotto 6 Resistenza Virus 10 Geni vari 14 Resistenza Caratter. Agronomiche Funghi/batteri 3 1 IL GOLDEN RICE Una dieta basata su poche varietà agricole determina carenze di micronutrienti come ferro, iodio, vitamine La carenza di vitamina A causa 500.000 casi di cecità permanente l’anno Negli anni ‘90 finanziato dalla Fondazione Rockefeller un progetto per “ingegnerizzare il pathway della provitamina-A nell’ endosperma di riso”. L’ultimo precursore del b-carotene prodotto dai chicchi di riso è il geranil geranil difosfato (GGPP) per ottenere il prodotto finale sono necessari solo altri 4 enzimi: 1-fitoene sintasi, 2-fitoene desaturasi, 3-zeta carotene Desaturasi, 4-licopene ciclasi Il progetto fu giudicato a bassa probabilità di successo ma meritevole in quanto potenzialmente di grande utilità………………. Il progetto è stato svolto e realizzato COMPLETAMENTE in strutture Accademiche: I. Potrykus, Inst. of Plant Sciences, Swiss Federal Institut of Technology, ETH-Zurich,Switzerland P. Beyer, University of Freiburg, Germany Il PROTATO o LA PRATATA Una dieta molto ricca in carboidrati (patate) comporta una carenza proteica, e in molti aminoacidi essenziali, problema molto diffuso nelle popolazioni più povere dell’ India Un consorzio di istituti pubblici, scienziati, organi del governo, ed industrie ha sviluppato la “pratata” nell’ambito di un programma volto a sconfiggere la mortalità infantile La pratata contiene un gene derivato da una pianta a seme ad alto contenuto proteico (Amaranthus) originaria del Sud America, e contiene 1/3, 1/2 più proteine della classica patata Greenpeace: E’ uno “specchietto per le allodole” per rendere più attraenti gli OGM, mentre è di nulla utilità per risolvere il problema della malnutrizione Saggio Istochimico di attività b-glucuronidasica (modificato da Jefferson et al., 1987) Il seguente esperimento permette di conoscere in quale tessuto della pianta e a quale stadio di sviluppo il gene di nostro interesse viene espresso. L’approccio scelto prevede che le sequenze di DNA che sono situate a monte del gene, necessarie per la regolazione dell’espressione, siano clonate a monte di un gene, cosidetto reporter, che codifica per un prodotto facilmente misurabile. Il gene reporter scelto è GUS proveniente dal batterio Escherichia Coli, codificante per l’enzima b-glucuronidasi. Nelle piante trasformate con questo DNA, se sono attive le sequenze regolative clonate, sarà espresso il gene per la b-glucuronidasi. Quindi incubando i tessuti con un substrato che l’enzima è in grado di trasformare in un prodotto colorato, è possibile osservare al microscopio quali tessuti sono colorati e dove è localizzata l’espressione di GUS (quindi del nostro gene). .Preparazione dei campioni Prelevare le plantule (almeno 5 per ogni trasformante) e porle nella piastra multiwell .Reazione istochimica: Aggiungere ai campioni 1/2ml della soluzione di reazione Infiltrare sotto vuoto per 10’ Staccare il vuoto con molta attenzione Incubare i campioni per un periodo di 1h-12h, a 37°C o a RT a seconda del trasformante .Lavaggio dei campioni: Eliminare la soluzione e lavare con metanolo:ac.acetico (3:1) Lavare con EtOH 70% Conservare i campioni in EtOH 96%-100% o glicerolo 50% Trasformazione sotto vuoto di piante di Arabidopsis Le piante vengono trasformate dopo circa 3 settimane dalla germinazione, mediante infiltrazione con Agrobacterium. Le piante devono avere tante gemme, tanti fiori e poche silique. •.Preparare una coltura da 500 ml del clone batterico ricombinante da utilizzare, cresciuta in LB, o/n a 28°C, in agitazione (~150rpm) •.Centrifugare i batteri a 3000rpm, 5 min., a 4°C •Eliminare il sopranantante e risospendere bene i batteri nel terreno di infiltrazione (200ml) •.Capovolgere 1 vasetto con 10-15 piante in una scatola Magenta contenente ~200ml della sospensione batterica. Fare attenzione che i fiori siano completamente immersi nella sospensione •.Porre il tutto in una campana da vuoto e attacare la pompa per fare il vuoto (per ~2min,). Poi lasciare la campana sotto vuoto per altri 10min. •.Staccare il vuoto non troppo dolcemente (per favorire l’infiltrazione batterica) e poi porre la pianta (T0) in un sacchetto da autoclave, per mantenere l’umidità, in camera climatica •.Dopo 2/3 giorni la pianta può essere estratta dal sacchetto, e normalmente annaffiata fino a completa maturità (produzione di semi) •.Quando la pianta è completamente secca, raccogliere i semi per poi procedere alla selezione dei trasformanti primari (T1)
Scaricare