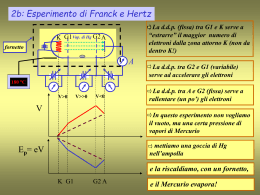
Appunti di Complementi di Fisica Atomica di Elio Colavita, Tommaso Caruso e Vincenzo Formoso Modello di Bohr dell’atomo n 40 rn Z me2 2 • orbite circolari: 2 • energia dipende soltanto da n: 4 2 2 1 e m Z Z En R 2 2 2 2 (4 0 ) n n 4 1 e m R 13.6eV costante di Rydberg 2 2 (4 0 ) Modello di Sommerfeld dell’atomo •orbite ellittiche: an=a0n2/Z ; bn= a0nk/Z. •energia dipende soltanto da n: 1 e4 m Z 2 Z2 En R 2 2 2 2 (4 0 ) n n R costante di Rydberg Nota bene •Possono esistere più orbite in corrispondenza dello stesso valore di energia:degenerazione. •La ellitticità dell’orbita dipenda dal numero quantico k. Esperienza di Franck ed Hertz •Dimostra la quantizzazione dell’energia dell’atomo; •Dimostra che l’atomo è caratterizzato dalla sua struttura energetica; •Dimostra che l’energia può essere assorbita dall’atomo secondo quantità definite dalla sua struttura energetica. 3 Esperienza di Stern e Gerlach dimostra l’esistenza del numero quantico di spin. Ciascuno stato è quindi caratterizzato da quattro numeri quantici: n, l, ml, ms . Uno stato energetico può essere degenere rispetto ad l, ml, ms . Una perturbazione esterna o interna può togliere l’eventuale degenerazione. Moto del vettore momento angolare J Il vettore J precede intorno alla direzione del campo magnetico interno Bint dell’atomo con la velocità angolare di precessione di Larmor w. w è proporzionale a Bint. Bint è dell’ordine del Tesla. 6 Bint B int L -e Ze v J L S -e Bint " ' S B int zˆ zˆ J L S S L Dipolo magnetico di un atomo: ml= -gl mB/h L ms= -gs mB/h S L’interazione spin- orbita (interazione di tipo magnetico) modifica i livelli di energia dell’atomo e definisce il momento angolare totale dell’atomo J=L+S. Ne segue che il dipolo magnetico totale dell’atomo mJ= ml + ms 5
Scaricare