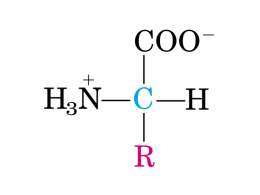
Biosintesi e catabolismo delle selenoproteine Assorbimento Non vi è controllo omeostatico per l’assorbimento del Se Alta biodisponibilità in ogni forma inorganica ed organica SeMet ~ 90% Limitante non l’assorbimento ma la trasformazione in forma attiva Met (AA essenziale per gli animali) e Se-Met sintetizzati da piante e lieviti Se-Met inserita in maniera non specifica nelle proteine come analogo della Met sia nelle piante che negli animali la sostituzione è casuale e dipende dalla % dei due amino acidi Metionina Se-Metionina Negli animali: Se-Cisteina (SeC) presente nelle selenoproteine ruolo specifico e controllo omeostatico non esiste un pool di SeC libera COO– +H N 3 –C–H CH2SeH Metionina - precursore della cisteina Se-Met NON è precursore della SeC presente nelle selenoproteine I) Indipendentemente dalla forma di assunzione il Se per essere utilizzato deve essere ridotto a selenuro (SeH-) 1. 2. Sale (selenato, selenito): riduzione GSH dipendente SeC + SeC-liasi PLP-dipendente SeH- + alanina enzima specifico che non scinde la Cys II) selenuro è trasformato in selenofosfato ad opera della selenofosfato sintetasi (a sua volta selenoproteina) SeH- + ATP + H2O HPO3Se2- + Pi + AMP O -Se – P = O OH selenofosfato III) biosintesi di SeC nel corso della traduzione seril-tRNASeC selenocisteina sintasi (enzima a PLP) + selenofosfato selenocisteil-tRNASeC Il livello di Se regola il livello di selenofosfato e quindi il livello SeC-tRNASeC IV) inserzione della SeC nella proteina mRNA: struttura a forcina denominata SECIS (Seleno Cysteine Insertion Sequence) a valle del codone UGA nella regione 3’ non tradotta permette la distinzione tra UGA/SeC ed UGA/codone di stop SECIS - Seleno Cysteine Insertion Sequence a valle del codone UGA nella regione 3’ non tradotta permette la distinzione tra UGA/Sec ed UGA/codone di stop Finora identificate 25 proteine a Se sulla base dello screening del genoma contenente - sequenza UGA - elemento SECIS (le 2 condizioni necessarie per la sintesi) le proteine a Se potrebbero essere oltre 50 Proteine Se-proteine Selenito (come Secisteina) Selenometionina selenofosfato GS-Se-SG (transulfurazione) selenocisteina H2Se GS + SeH S-adenosilMetionina derivati metilati CH3SeH CH3Se-GalN (CH3)2Se respiro 1-metilseleno-N-acetil-galattosamina + (CH ) Se urine 3 3 escrezione Alti livelli di Se o intossicazione da Se dimetilSelenuro - volatile – Eliminato con la respirazione - odore simile all’aglio «garlic breath» Fonti alimentari SUOLO PIANTE ANIMALI UOMO La quantità presente negli alimenti dipende dalla ricchezza in Se del terreno bassa in Europa, Asia centrale - alta in Usa, Giappone Cereali : può variare tra <10 e > 80 g/100 g grano riso PIANTE: non usano Se ma lo metabolizzano come lo S assorbono selenato (compete con il solfato), quindi incorporato nella Se-Met e Se-Cys senza ruolo funzionale per evitare l’eccesso nelle proteine con conseguente danno funzionale, - piante accumulatrici trasformano in composti non tossici quali gli AA non proteici metil-Se-cisteina e metil- Se-Met - piante non accumulatrici nel composto volatile dimetil-selenuro disperso nell’aria Eccesso nel suolo - suolo arido selenifero dopo abbondante irrigazione - acqua di scarico industriale piante non accumulatrici utili per disinquinare il terreno dal Se Carenza nel suolo Fertilizzazione del suolo (Finlandia, Cina) tramite selenito broccoli, aglio, leguminose accumulano fino a 10 mg/kg Mangime (selenito, metodo a basso costo) per maiale più biodisponibile che per ruminanti (selenito trasformato in selenuri insolubili dai batteri del rumine) Lievito selenizzato supplementato in selenito che viene trasformato in Se-Met lievito per il pane (Nord Ucraina) ALIMENTI g/100g rognone, fegato carni, pesce cereali e derivati latte e derivati frutta e verdura 40-150 10-40 10-80 1-3 1-2 variazioni in base al paese di provenienza sotto forma di sale inorganico: selenato. selenito Se-Met, Se-Cys più abbondante in grano, legumi, soia metil-Se-Cys in piante che concentrano Se : aglio, cipolla, broccoli Assunzione di Selenio (Br J Nutr 100: 254, 2008) Paese g Se/ per persona al giorno ————————————————————————————— Canada 98-224 Giappone 104-199 USA 106 Australia 57-87 Nuova Zelanda 55-80 Svizzera 70 Austria 48 Gran bretagna 29-39 Belgio 28-61 Danimarca 38-47 Italia 43 Francia 29-43 Repubblica ceca 10-25 India 27-48 Egitto 29 Arabia Saudita 15 Non facile da stabilire, si basa su parametri biochimici RDA 1989 (FAO, WHO) 30-40 g/die per la max attività GPx3 (+ 30% per sicurezza) 70 g/die M adulto - 55 g/die F adulta RDA 2000 (al momento considerato valido) altri studi con bassa o alta supplementazione in Se ed attività GPx3 55 g/die M e F adulto (60 gravidanza, 70 allattamento) 15 e 20 g/die infante fino a 6 e 12 mesi World Health Organization (sulla base attività GPx3) Iimite inferiore per mantenere buono stato di salute: 40 g/die M adulto, 30 g/die F Cina (area di Keshan): livello protettivo 21 g/die M e 16 g/die F Nuova Zelanda: livello protettivo 33 g/die M e 23 g/die F UK 1 g Se/ kg peso corporeo Livelli di assunzione per la popolazione Italiana (2013) Bambini-Adolescenti 1-3 anni 4-6 anni 7-10 anni fabbisogno medio 15 g/die 20 30 assunzione raccomandata 20 g/die 25 35 Maschi - femmine 11-14 anni 15-17 anni 40 45 50 55 Adulti Maschi –femmine 18 > 75 anni 45 55 Gravidanza 50 60 Allattamento 60 70 Due livelli di gerarchia in carenza di Se 1. Cervello, sistema endocrino e sistema riproduttivo al top: in carenza perdono poco Se dopo somministrazione rapido accumulo fegato e muscolo scheletrico ne perdono buona parte 2. gerarchia fra le proteine attività GPx cala di più della Se-proteina P o della deiodinasi attività GPx potrebbe non essere indice funzionale non è nota la saturazione delle altre Se-proteine UL = 300 g/die TOSSICITA’ L’ambito di valori entro i quali l’introito di Se è adeguato e non tossico è molto stretto con un rapporto di ~1/10 fra quantità richiesta e tossicità Fino a 800 g/die non vi è tossicità apparente Avvelenamento da Se (rari casi - ingestione di grammi) disturbi gastrointestinali, neurologici, respiratori, infarto del miocardio, danno renale. Selenosi (acuta o cronica) (introito superiore a 1250 mg/die). Acuta: lavoratori microelettronica per inalazione selenio volatile difetti respiratori, edema polmonare, dermatite, irritazione occhio Cronica: per introito eccessivo (alti livelli suolo ed acqua - Cina) associata a caduta dei capelli (forse distruzione cheratine) EFFETTI TOSSICI VANNO TENUTI PRESENTI PER 1. Alimenti arricchiti 2. Supplementi Si considera che se - l’alimento contiene più di 1 mg Se / kg può indurre tossicità - l’alimento meno di 0,1 mg Se / kg può indurre carenza Importante la misura del selenio presente Amminoacidi e Proteine: Ruolo Metabolico e Nutrizionale Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi Qualsiasi processo vitale dipende da questa classe di molecole: la catalisi delle reazioni metaboliche (enzimi) le difese immunitarie (immunoglobuline) il trasporto di ossigeno (emoglobina) il trasporto di nutrienti (albumina) il movimento (actina, miosina) Il problema principale correlato a questa classe di biomolecole riguarda il gruppo funzionale –NH2 Sintesi e degradazione PROTEINE • Sintesi Proteine – la sintesi di nuove proteine è importante durante l’accrescimento. • Adulto – la sintesi riguarda il ricambio di proteine • Sintesi di una grande varietà di altri composti – es. Purine e Pirimidine (nucleotidi), catecolammine (adrenalina e noradrenalina) e neurotrasmettitori (serotonina) Come carburante biologico - circa 10% dell’energia prodotta deriva dagli amminoacidi AZOTO essenziale per la vita amminoacidi proteine nucleotidi acidi nucleici In natura - N2 atmosferico ( NN triplo legame, molta energia per metabolizzarlo) - ione nitrato NO3– presente nel suolo Nei sistemi biologici sono presenti le forme ridotte - ione ammonio NH4+ libero - gruppo amminico (-NH3+) e gruppo ammidico (-NH-C=O ) presenti in composti organici Metabolismo dell’azoto • Le specie ossidate vengono convertite nella specie ridotte da due diversi processi: Assimilazione del nitrato (avviene negli eucarioti fototrofi, piante verdi) NO3- NH4+ Fissazione dell’azoto (avviene nei procarioti sia autonomi che simbionti di eucarioti) N2 NH4+ GLI ANIMALI DIPENDONO DA BATTERI E PIANTE PER L’AZOTO I. Soltanto alcuni batteri anaerobi, simbionti nelle radici delle leguminose, sono in grado di fissare (ridurre) l’N2 atmosferico con produzione di NH4+, che è quindi ossidato da altri batteri a nitrato NO3– II. Le piante sono in grado di utilizzare NO3– con produzione di NH4+, che è quindi incorporato nei composti organici azotati (punto d’ingresso glutammato e glutammina) III. Gli animali assumono composti organici azotati (amminoacidi) Fonte primaria di azoto: amminoacidi forniti dalle proteine alimentari Destino di NH4+ NH4+ Carbamilfosfato sintasi I EC 6.3.4.16 2ATP + HCO3- O 2ADP + Pi + 2H+ O H2N O O P O O O Carbamilfosfato Glutamato deidrogenasi EC 1.4.1.2 EC 1.4.1.3 EC 1.4.1.4 (GDH) O O O -chetoglutarato NADH NAD(P)H NADPH NAD+ NAD(P)+ NADP+ H2O O O O Glutamina sintasi EC 6.3.1.2 (GS) ATP O NH3+ ADP + Pi Glutamato O 2 HN O O NH3+ Glutamina Tre enzimi NH4+ Carbamilfosfato sintasi I EC 6.3.4.16 1 2ATP + HCO3O 2ADP + Pi + 2H+ O H2N O O P O O O Carbamilfosfato Glutamato deidrogenasi EC 1.4.1.2 EC 1.4.1.3 EC 1.4.1.4 (GDH) 2 O O O -chetoglutarato NADH NAD(P)H NADPH NAD+ NAD(P)+ NADP+ H2O O O O Glutamina sintasi EC 6.3.1.2 (GS) 3 ATP O NH3+ ADP + Pi Glutamato O 2 HN O O NH3+ Glutamina Biosintesi degli amminoacidi • Non tutti gli organismi viventi riescono a sintetizzare gli amminoacidi a partire dallo ione NH4+ • Piante, batteri e lieviti: NO3- NH4+ glutammato Amminoacidi (tutti) • Nei mammiferi: • Amminoacidi essenziali: – Arg, His, Ile, Leu, Lys, Met, Phe, Thr, Trp, Val. • Amminoacidi non essenziali: – Ala, Asp, Asn, Cys, Glu, Gln, Gly, Pro, Ser, Tyr. CLASSIFICAZIONE NUTRIZIONALE AMMINOACIDI ESSENZIALI : devono necessariamente essere introdotti preformati con la dieta valina* leucina* isoleucina* metionina* fenilalanina* triptofano* istidina lisina treonina * possono essere ottenuti per transaminazione dai rispettivi -chetoacidi gli altri tre vanno introdotti come tali AMMINOACIDI NON ESSENZIALI semi-indispensabili risparmiano i precursori essenziali tirosina (sintetizzata da fenilalanina) cisteina (sintetizzata da metionina) condizionatamente essenziali glicina, serina, prolina, glutammina, arginina possono non essere sufficienti in alcuni stati particolari quali infezioni, traumi, bambini prematuri, .. non essenziali alanina, aspartato, asparagina, glutammato Biosintesi degli amminoacidi • Gli amminoacidi vengono, nella maggior parte dei casi, sintetizzati a partire dall’-chetoacido corrispondente attraverso una specifica amminotransferasi (transaminasi): AA1 + -chetoacido2 -chetoacido1 + AA2 • Le transaminasi trasferiscono un gruppo amminico da un AA ad un chetoacido Le reazioni di transaminazione, reversibili, permettono di ridistribuire il gruppo NH3 fra gli amminoacidi Vanno comunque integrati con la dieta e l’apporto deve essere bilanciato in quanto: - Il pool di amminoacidi non è totalmente riutilizzabile - NH3 principalmente prodotto di rifiuto, anche se vi è un riutilizzo limitato a riformare amminoacidi Biosintesi degli amminoacidi • Gli amminoacidi possono essere raggruppati in base agli intermedi dai quali provengono: – Famiglia dell’-chetoglutarato: • Glu, Gln, Pro, Arg – Famiglia dell’aspartato: • Asp, Asn, Met, Thr, Lys – Famiglia del fosfoenolpiruvato e dell’eritrosio-4-fosfato: • Phe, Tyr, Trp – Famiglia del piruvato: • Ala, Val, Leu, Ile – Famiglia del 3-fosfoglicerato: • Ser, Gly, Cys – Dal fosforibosilpirofosfato: • His BIOSINTESI DEGLI AMMINOACIDI NON ESSENZIALI piruvato alanina ossalacetato aspartato (+ glutammina) asparagina -chetoglutarato glutammato + (NH3) glutammina glutammato prolina, arginina 3-fosfoglicerato serina glicina fenilalanina tirosina carenza Phe idrossilasi causa fenilchetonuria: porta a ritardo mentale 1:10.000 - 2% popolazione portatori sani - screening di routine sui neonati (si formano fenilpiruvato, fenillattato, fenilacetato 1-2 g/die nelle urine) Dieta povera in Phe e ricca in Tyr metionina cisteina La velocità di sintesi può non essere sufficiente malati, stress, neonati a basso peso, ustionati, Classificazione in base alla struttura Funzioni degli L--amminoacidi • Substrati per la sintesi proteica 20 AA - con codone - riconoscimento via tRNA 21 AA selenocisteina - seril-tRNA Se-cisteinil tRNA più numerosi in seguito a modificazione post-sintetica idrossiprolina N-metil istidina acido carbossiglutammico Componenti di peptidi glutatione (GSH) Glu-Cys-Gly Intermedi metabolici ornitina Fonte energetica a.a. glucogenici, a.a. chetogenici Regolatori del turnover proteico Trasporto di azoto leucina, glutammina glutammina, alanina Precursori per la biosintesi di altri composti contenenti azoto composti derivati amminoacidi precursori –––––––––––––––––––––––––––––––––––––––––––––––––––––––––– Eme glicina (+ succinil CoA) Nucleotidi glutammina, glicina, acido aspartico Carnitina lisina, metionina Creatina arginina, glicina, metionina Ammine biogene istidina, triptofano, tirosina, glutammato (ormoni, neurotrasmettitori, ammine di interesse farmacologico) Tiroxina, adrenalina tirosina Taurina cisteina (sali biliari, neuromodulatore) Glucosammina glutammina (amminozuccheri) Ossido nitrico (NO) arginina (vasodilatatore, inibisce aggregazione piastrinica, neurotrasmettitore) Niacina triptofano (1mg vit equivale a 60 mg a.a.) Degradazione degli amminoacidi • A differenza degli acidi grassi e dei glucidi gli amminoacidi in eccesso non possono né essere immagazzinati in macromolecole di deposito né essere escreti come tali, vengono quindi demoliti. Proteine Proteolisi Amminoacidi Catena carboniosa • • • • Acetil-CoA Acetoacetil-CoA Piruvato Intermedi ciclo di Krebs Liasi (deaminasi) Acidi grassi Corpi chetonici Glucosio … NH4+ • Urea • NH3 • Altri composti azotati semplici Overview del catabolismo degli amminoacidi nei mammiferi
Scaricare