MUTAZIONI Mutazione genica: cambiamenti a livello del singolo gene o al suo interno, vengono chiamate mutazioni puntiformi. Mutazione cromosomica:cambiamenti che interessano tratti di cromosomi, cromosomi interi e ancora, interi assetti cromosomici. Mutazioni • Genomiche: (±Ch). Sono dovute a non disgiunzioni meiotiche (es. Trisomia 21). • Cromosomiche: Traslocazioni, amplificazioni, macrodelezioni. • Geniche: microdelezioni, sostituzioni, inserzioni di uno o pochissimi nucleotidi (puntiformi). Associate a malattie ereditarie Mendeliane. Meccanismi patogenetici delle mutazioni • • Alterazione strutturale di una proteina con formazione di un prodotto anomalo. -Carenza del prodotto normale; -Prodotto alterato che interferisce con quello normale; -prodotto alterato con funzione diversa. Alterazione quantitativa (riduzione o abolizione di una proteina ), per mutazioni che riguardano le sequenze di splicing o dei promotori. TIPI DI MUTAZIONI Mutazioni morfologiche Mutazioni letali Mutazioni condizionali Mutazioni biochimiche Mutazioni per resistenza Mutazione: alterazione stabile ed ereditabile del DNA • Non sempre é un evento negativo. • Può essere spontanea (molto rara) o indotta (agenti chimici, fisici o virali). • Se coinvolge le cellule germinali viene trasmessa alla progenie (Malattie ereditarie) • Se coinvolge cellule somatiche può essere implicata nella tumorogenesi MUTAGENI Mutageni fisici: raggi-X e raggi Ultravioletti. I primi producono composti chimici che alterano il DNA, i secondi la formazione di dimeri di timina. Mutageni chimici: Sostanze chimiche che agiscono in modo diverso, per esempio sostituendo le basi normali durante la replicazione del DNA (5-bromouracile e 2aminopurina),modificando chimicamente le basi (acido nitroso, idrossilamina) oppure intercalandosi tra basi adiacenti durante la replicazione del DNA (acridine, bromuro d’etidio). DANNI DEL DNA •Depurinazione: consiste nella rimozione di una purina (adenina o guanina) per rottura del legame tra essa ed il desossiribosio, con formazione di un sito apurinico (AP). La depurinazione può avvenire spontaneamente a seguito di idrolisi oppure essere indotta da mutageni. •Deaminazione: rimozione di un gruppo amminico da una base del DNA. •Intercalazione: inserimento di un agente intercalante tra due coppie successive di base, con conseguente alterazione della struttura a doppia elica del DNA (acridine e bromuro d’etidio). Mutation • UV radiation causes thymine dimers • Light-repair separates thymine dimers Figure 8.20 Spontaneous and induced mutations: Induced mutations Radiation (e.g., X-rays, UV) Ionizing radiation breaks covalent bonds including those in DNA and is the leading cause of chromosome mutations. Ionizing radiation has a cumulative effect and kills cells at high doses. UV (254-260 nm) causes purines and pyrimidines to form abnormal dimer bonds and bulges in the DNA strands. Thymine dimers induced by UV light. Mutagenic effects of 5bromouracil Mutagenic effects of 5-bromouracil Base-modifying agents Base-modifying agents Induced mutations: chemical mutagens Intercalating agents: • Thin, plate-like hydrophobic molecules insert themselves between adjacent base-pairs, • Mutagenic intercalating agents cause insertions during DNA replication. • Loss of intercalating agent can result in deletion. • Examples: acridine, proflavin, ethidium bromide Deamination Mutazioni Geniche • Transizione: Un tipo di sostituzione di coppia nucleotidica che implica la sostituzione di una purina con un’altra purina o di una pirimidina con un’altra pirimidina; per esempio GC AT. • Trasversione: Un tipo di sostituzione di coppia nucleotidica che comporta la sostituzione di una purina con una pirimidina o viceversa; per esempio GC TA. Mutation caused by mismatch wobble base pairing. MUTAGENI CHIMICI • Molte sostanze chimiche, di per se’ non mutageni, lo diventano dopo attivazione metabolica, subita sia nel corso dei processi di assimilazione digestiva sia per opera di organi, quale il fegato, deputati al loro metabolismo. Nel valutare l’effetto mutageno di una sostanza chimica, occorre quindi verificare che la sostanza non sia mutagena neppure dopo attivazione metabolica. Ames test RIPARAZIONE DEI DANNI AL DNA Mutazione genica • Mutazione silente: è conseguente alla sostituzione di una coppia di basi, che, pur cambiando la sequenza di un codone, non ne modifica il significato • Missense:(di senso errato) è una mutazione nella quale la sostituzione di una coppia di basi cambia la sequenza di un codone, modificandone il significato • Nonsense: è dovuta alla sostituzione di una coppia di basi del DNA che da luogo alla formazione di una tripletta che non codifica per alcun amminoacido (tripletta di stop) • Mutazione di allungamento: si origina quando una tripletta non senso presente nel gene selvatico, a seguito di una sostituzione di base, diventa una tripletta “senso”, vale a dire una tripletta che codifica per un amminoacido • Frameshift: consiste in una inserzione o delezione di basi Base substitution (point mutation) • Missense mutation - Change in one base result in change in amino acid Base substitution (point mutation) • Nonsense mutation - Change in one base results in a nonsense codon Mutation – deletion and insertion • Frameshift mutation - Insertion or deletion of one or more nucleotide pairs MUTAZIONI GENICHE Mutazioni per amplificazione • In zone non tradotte (malattie da triplette di tipo 1). Si ripete CAG che allunga i tratti poliglutammici delle pt. Associate a malattie neurodegenerative (atrofia muscolare spino bulbare). • In zone fuori dal tratto non tradotto (malattie da triplette di tipo 2) con amplificazioni molto più ampie.Es. sindrome dell’ X fragile (ritardo mentale) ; distrofia miotonica (distrofia muscolare, miotonia, aritmie). Sindrome dell’X-Fragile La malattia è dovuta alla mutazione di un gene situato sul cromosoma X. L’alterazione responsabile della sindrome è l’espansione di una sequenza ripetuta di tre basi nucleotidiche (CGG). Nelle persone normali questa tripletta è ripetuta un numero variabile di volte da 6 a 55. Nelle persone affette il numero di ripetizioni CGG supera le 200. Il primo segno della malattia è il ritardo nello sviluppo psicomotorio, in particolare nell’apprendimento del linguaggio. Le persone affette da FraX hanno tratti somatici tipici: viso allungato,mandibola prominente, nei maschi, ingrossamento dei testicoli (macrorchidismo), si possono avere anche, iperestensibilità delle articolazioni, piede piatto e il prolasso della valvola mitrale Sindrome dell’ X fragile • Una parte del cromatide è attaccato al cromosoma da un sottile filo di DNA: sito fragile • La posizione dei siti fragili è conservata nelle cellule di un individuo e di una famiglia • Nell’ X fragile la tripletta CGG è ripetuta da 200 a 1000 volte (50 nell’ X normale) • La sindrome, più evidente nei maschi comporta ritardo mentale • E’ alterata la funzionalità di un gene che codifica per la Proteina del Ritardo Mentale da X Fragile (FMRP) Delezione Queste mutazioni cromosomiche sono sbilanciate, perchè determinano una perdita d’informazione genetica e, come tali, sono generalmente molto gravi o letali. Naturalmente, le conseguenze cliniche dipendono dall’entità del tratto perduto e dai geni in esso presenti Compensation Loop in a Polytene Chromosome Sindrome del CRI DU CHAT La sindrome del cri du chat è una malattia cromosomica dovuta alla perdita (delezione) di una parte del braccio corto del cromosoma 5. Il nome deriva dal caratteristico suono, simile ad un miagolio, che emettono i neonati affetti da questa malattia nel piangere. I bambini affetti presentano generalmente basso peso alla nascita, volto tondo, fronte sporgente, mandibola piccola e retratta, ritardo mentale, microcefalia. INVERSIONE • Sono anomalie che interessano un solo cromosoma; insorgono quando in seguito a due rotture, il segmento compreso tra i due punti di rottura si reinserisce nello stesso cromosoma dopo rotazione di 1800. Se l’inversione comprende il centromero è detta pericentrica, se non lo comprende è detta paracentrica. TRASLOCAZIONE • Consiste nello scambio di parti tra cromosomi non omologhi Traslocazione Robertsoniana Questa traslocazione coinvolge due cromosomi acrocentrici e i punti di rottura avvengono nei due cromosomi a livello della regione centromerica, ma sul lato opposto rispetto al centromero Sindrome 18-p Consiste nella delezione del braccio corto del cromosoma 18. Il ritardo mentale, di vario grado, è una caratteristica molto frequente, così come i problemi di linguaggio. I bambini sono spesso più bassi della media, alterazioni dei padiglioni oculari, ritardo mentale. CARIOTIPO • • • • Euploide: numero normale di Ch. Diploide:2n Ch nelle cellule somatiche (46) Aploide: n Ch nelle cellule germinali (23) Poliploide: aumento numerico del corredo di Ch (3n,4n ecc.). La poliploidia nel feto causa aborto, avviene nella rigenerazione e nei tumori. • Aneuploide: Ch multipli imperfetti di n (23) (Down 47, Turner 45) ALTRE ANEUPLOIDIE DEI Ch SESSUALI • 47,XYY:♂ alta statura, aggressività, basso QI • 47,XXX: fenotipicamente silente • 48,XXXX: ritardo mentale ± grave • 49,XXXXX: grave ritardo mentale, anomalie somatiche • 48, XXYY, 48,XXXY, 49,XXXYY, 49,XXXXY sono varianti di Klinefelter Sindrome di Down La sindrome di Down è causata dalla presenza di un cromosoma 21 in più, si parla infatti del trisomia del 21. I caratteri fisici delle persone affette dalla sidrome sono: occhi a mandorle, naso corto, la bocca spesso aperta con lingua tozza e spesso protrudente, le dita tozze, ritardo mentale, difetti cardiaci e un parziale deficit delle difese immunitarie. Sindrome di Edwards Detta anche trisomia 18 perché è causata dalla presenza di 3 copie del cromosoma 18, anziché di 2 copie. Il numero totale di cromosomi è quindi 47 e non 46. I bambini affetti presentano grave ritardo di crescita, grave ritardo mentale, malformazioni multiple: occipite prominente, alterazione degli arti, cardiopatia, anomalie renali TRISOMIE AUTOSOMICHE • • • • • • • • Trisomia 13 (Sindrome di Patau) (Incidenza 1:15000) Simile alla sindrome di Down 80% di mortalità nel primo anno di vita Gravi malformazioni facciali Grave ritardo mentale Difetti del setto ventricolare Labbro leporino e palatoschisi MALATTIE GENETICHE • Malattie cromosomiche: Aneuploidie (±Ch). Lesioni visibili al microscopio. • Malattie monogeniche: Trasmesse con meccanismo Mendeliano. • Malattie multifattoriali: Causate da interazioni fra diversi fattori genetici ed ambientali. • Malattie legate ad eredità mitocondriale:si trasmettono solo in linea femminile. DUPLICAZIONE • Mutazione cromosomica con raddoppio di un tratto di Ch. • Importante nello sviluppo di famiglie geniche (es. Globina). • Tratti duplicati vicini (tandem) o distanti. • Conseguenze legate all’ eccesso di materiale genico e alla difficoltà di appaiamento degli omologhi (es. Neuropatia demielinizzante da duplicazione del gene PM22) CLONAZIONE • CLONARE un embrione significa sostituire il nucleo di un ovulo con il nucleo della cellula adulta della persona di cui si vuole produrre una fotocopia genetica • CLONAZIONE TERAPEUTICA: per ottenere da una blastocisti cellule con lo stesso patrimonio genetico dell’individuo in cui impiantarla • CLONAZIONE RIPRODUTTIVA: proibita La storia della pecora Dolly Cos’è una Cellula Staminale E’ una cellula non specializzata capace di dividersi e di dare origine a cellule dei diversi tessuti adulti. Le distinguiamo in: • EMBRIONALI, sono totipotenti, possono dare origine a qualsiasi tipo di cellula; • FETALI, sono pluripotenti, possono dare origine solo ad alcuni tipi di cellule; • PLACENTARI, sono pluripotenti, prelevate dal sangue del cordone ombelicale o dalla placenta; • ADULTE, sono pluripotenti ed ematopoietiche. Cellule staminali Sono dotate di capacità di autorinnovamento Sono in grado di differenziare dando luogo a uno o più tipi di cellule mature Le cellule staminali embrionali derivano da blastocisti (stadio precoce pre-impianto) e sono toti- o pluri-potenti Le cellule staminali adulte o somatiche derivano da tessuti adulti e sono pluri- o multi-potenti Entrambi i tipi di cellule possono essere coltivati in vitro e indotti a differenziare Cellule totipotenti, pluripotenti, multipotenti, unipotenti Le cellule staminali I compartimenti di cellule staminali e differenziate nella proliferazione delle cellule epiteliali intestinali Il differenziamento non è un processo esclusivamente embrionale DIABETE • Un nuovo studio sulle cellule staminali sta aprendo nuove prospettive anche per il trattamento del diabete. E' stata messa a punto ed è già in fase di sperimentazione una terapia con cellule staminali che ha permesso agli ammalati di diabete di evitare le quotidiane iniezioni di insulina. Il loro organismo, infatti, trattato con le staminali ha di nuovo imparato, per così dire, a produrre l'ormone in modo naturale e autonomo. RIPARAZIONE DI TENDINI E ARTICOLAZIONI • Staminali estratte dal grasso superfluo per riparare danni ai tendini e alle articolazioni. E' la nuova frontiera sperimentata dai ricercatori dell'università di Oslo (Norvegia), che hanno individuato un meccanismo utile a selezionare le cellule più 'adatte' a essere riprogrammate come 'cura' per queste lesioni. Secondo gli esperti, infatti, per una staminale adulta, prelevata dal grasso aspirato via con la liposuzione, le probabilità di essere riutilizzata con successo dipendono dall'abbassamento dei livelli di metilazione, cioè della regolazione dei geni del Dna. Terapia Genica Terapia genica Insieme di procedimenti atti a curare o ad alleviare una malattia modificando geneticamente le cellule dei pazienti. Vantaggi teorici della terapia genica • Correzione radicale dei difetti • Possibilità di agire su meccanismi molecolari per i quali risulta estremamente difficile sviluppare farmaci specifici • Vantaggi economici (se fosse permanente eviterebbe la necessità di trattamenti ripetuti) Limitazioni della terapia genica •Rischio troppo elevato in presenza di terapie alternative • Mancanza di efficacia dovuta a problemi tecnici (inefficiente trasferimento genico, inattivazione del gene terapeutico) • Costi elevati • Alto rischio di effetti indesiderati (espressione non regolata, mutagenesi inserzionale, passaggio delle modifiche alla linea germinale) Attuali problemi tecnici della terapia genica • Efficienza di trasferimento genico • Selettività del sistema di trasferimento • Espressione instabile nel tempo • Espressione non regolata • Reazioni del sistema immunitario •Possibili interferenze con il genoma (mutagenesi inserzionale) • Problemi etici Quando si può pensare di curare una malattia con la terapia genica allo stato attuale? • Malattia pericolosa per la vita, ma dagli effetti potenzialmente reversibili. • Gene clonato. • Disponibile sistema di trasferimento genico efficiente per le cellule affette, che garantisca espressione stabile nel tempo. • Non richiesta regolazione precisa del gene in questione. Perché qualcuno sta pensando seriamente alla clonazione umana? Cellula somatica normale Cellule somatiche paziente Cellule totipotenti sane istocompatibili Ovocita
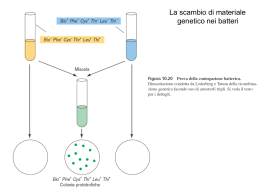
Scarica