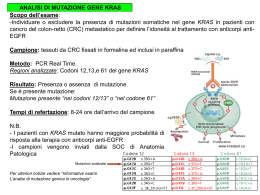
Test - Sreening - Acondroplasia Lezione 3 By NA Cos’e’ l’analisi analisi genetica L’analisi individua il genotipo di individui a rischio per ben definite patologie. Oggi possono essere identificate anche prima della nascita piu’ di 300 malattie genetiche. La maggior parte sono rare e l’analisi viene fatta solo quando c’e’ una indicazione precisa By NA Cos’e’ lo screening Lo screening genetico si effettua su una popolazione o su un gruppo di individui non imparentati. Non si possono fare screening per tutte le possibili malattie: si effettua su una popolazione in cui una particolare patologia ha un’incidenza significativa: es.Tay-Sachs nei canadesi francofoni o negli ebrei orientali. L’anemia falciforme nel bacino mediterraneo, la talassemia....... By NA Quando eseguire i test genetici I Rischio noto di una particolare malattia in un feto o in sospetti portatori Se la mutazione e’ gia’ nota perche’ si e’ studiato il precedente affetto e’ relativamente semplice. Se la patologia e’ recessiva le mutazioni da ricercare potrebbero essere 2 Se la mutazione non e’ nota la strategia e’ piu’ complessa e potrebbe non portare a dei risultati utili: come per CF. In questo caso si ricorre al linkage By NA Quando eseguire i test genetici II Screening nei neonati La popolazione da testare e’ ben identificata L’analisi e’ economica e rapida E’ possibile anche nel caso degli affetti intervenire per impedire la comparsa della patologia: fenilchetonuria By NA Quando eseguire i test genetici III Confermare o smentire una diagnosi clinica: penetranza, eterogenita’ genetica, fenocopie Identificare lo stato di portatore nel caso di patologie ad insorgenza tardiva o di suscettibilita’ a patologie tumorali Confermare il coinvolgimento nella patogenesi di una malattia di un gene candidato clonato In futuro identificare geni che predispongono alla comparsa di patologie complesse By NA Premesse By NA Premesse Le tecniche vanno scelte caso per caso in relazione a quello che si sa della patologia in studio, al caso che si sta studiando, alla struttura della famiglia in relazione al modello di trasmissione della malattia, alla possibilita’ di mosaicismo, al perche’ si fa la diagnosi (conferma diagnostica, ricerca degli eterozigoti, diagnosi prenatale....). Per una particolare famiglia puo’ non bastare l’approccio standard e bisogna cambiare strategia ricorrerendo a tecniche aggiuntive. By NA Quando non si e’ trovato niente di noto Quando si sono testate le mutazioni gia’ note e non si e’ arrivati a definire la presenza della mutazione, prima di ricorrere al sequenziamento vero e proprio di tutto il gene, si puo’ ricorrere a tecniche per evidenziare differenze fra la sequenza normale e la mutata, anche senza conoscerne la sequenza (SSCP, DDGE....) Il principio su cui si basano e’ quello per cui una variazione anche di una sola base modifica la conformazione del DNA in condizioni sperimentali definite,o evidenziano grosse alterazioni della sequenza (delezioni, duplicazioni...) attenzione pero’ a variazioni polimorfiche Polimorfismo: variazione la cui frequenza sia maggiore di 0,01(1%) Eterozigosi media per il DNA genomico umano:~ 0,0037 (0,37%). Cio’ significa che in due alleli circa 1:250-1:1000 basi sono diverse By NA Strategie per seguire le tracce del gene (gene tracking) Non si puo’ fare l’analisi diretta della mutazione: gene non clonato o non si sono individuate mutazioni nella sequenza del gene Prerequisiti: 1) Malattia mappata per poter identificare in banca dati marcatori il piu’ strettamente associati. 2) la struttura della famiglia e la disponibilita’ dei campioni devono permettere di ricostruire la fase. Tre fasi: 1) Distinguere i due cromosomi(aplotipi) del(i) gentore(i) che possono aver trasmesso il gene malattia 2) Determinare la fase 3) definire quale aplotipo ha ereditato il probando dai genitori Questa logica si applica a fenotipi con qualunque tipo di ereditarieta’. L’informativita’ dei marcatori non e’ piu’ un problema: ci sono oggi microsatelliti altamente informativi mappati su tutto il genoma. Il limite piu’ grosso e’ dato dalla struttura della famiglia By NA Strategie per seguire le tracce del gene (gene tracking) Patologia dominante (espressivita’ variabile, penetranza risotta, insorgenza tardiva) I1 2) identificato un marcatore per cui II3 e’ eterozigote I2 II4 II3 2-1 III1 III2 1) richiesta del test 3) identificare con quale allele segrega il fenotipo (fase) I1 I1 I2 2-4 By NA III2 I2 2-4 II4 1-3 II3 2-1 II4 II3 2-1 III1 4) identificare il genotipo di III2, analizzando lei e II4 Quali sono i risultati possibili? III1 III2 Strategie per seguire le tracce del gene (gene tracking) Patologia dominante (espressivita’ variabile, penetranza risotta, insorgenza tardiva) Risultati possibili I1 I2 2-4 II3 III2: 2-1 o 2-3 NON e’portatrice, perche’ in questa famiglia la regione mutata e’ identificata dall’allele 1 II4 2-1 III1 1-3 III2 III2: 1-1 o 1-3 E’ portatrice, perche’ in questa famiglia la regione mutata e’ identificata dall’allele 1 ATTENZIONE: e’ importante la segregazione all’interno della famiglia e non il particolare genotipo: se III2 avesse 2-1 cioe’ lo stesso genotipo della madre malata, non sarebbe portatrice By NA Strategie per seguire le tracce del gene (gene tracking) L’informativita’ dei marcatori non e’ piu’ un problema: ci sono oggi microsatelliti altamente informativi mappati su tutto il genoma il limite piu’ grosso e’ dato dalla struttura della famiglia Stesso fenotipo recessivo e segregazione in 4 famiglie diverse 2-1 2-1 Impossibile il test perche’ non c’e’ il DNA di riferimento dell’affetto 1-1 2-1 2-1 2-1 50%N, 50% affetto:non si puo’ definire di chi sono gli alleli ereditati dal feto. L’allele 2 del feto e’ lo stesso della sorella? 2-1 2-2 2-1 Nessuna previsione come prima Normale 1-1 Portatore 2-1 2-1 2-2 Affetto 2-2 L’errore diagnostico puo’ venire dalla ricombinazione che deve essere la piu’ bassa possibile By NA Diagnostica I le informazioni sulle malattie sono reperibili oltre che come PDF anche direttamente al sito http://www.genetests.org: cliccare su laboratory directory By NA nella barra il sito By NA il sito By NA il sito By NA Acondroplasia Velazquez By NA Acondroplasia I Il gene coinvolto in questa patologia e’ FGFR3 (Fibroblast growth factor receptor-3), che mappa in 4p16.3 (telomero del cromosoma 4), contiene 19 esoni, e’ lungo 16.5 Kb ed e’ l’unico le cui mutazioni siano state collegate all’acondroplasia. Il recettore ha 3 domini Ig-like, un dominio transmembrana e un dominio citoplasmatico tirosinochianasico Sembra che il ruolo fisiologico di questo recettore sia quello di controllare negativamente la proliferazione e il differenziamento nel centro di ossificazione. Le mutazioni avrebbero come risultato di mantenere sempre attivo il recettore e quindi il loro effetto si puo’ configurare come aumento di funzione By NA considerazione importante Sembra che il ruolo fisiologico di questo recettore sia quello di controllare negativamente la proliferazione e il differenziamento nel centro di ossificazione. Le mutazioni avrebbero come risultato di mantenere sempre attivo il recettore e quindi il loro effetto si puo’ configurare come aumento di funzione Bisogna sempre ricordare che la dominanza attiene al fenotipo e quindi e’ l’effetto della mutazione sulla funzione del prodotto che provoca la dominanza del fenotipo mutato sul wildtype. Quindi l’effetto della mutazione dipende da: quale e’ la funzione del wt: e’ sensibile alla dose sia in piu’ che in meno? e quindi: la mutazione provoca un aumento o una diminuzione dell’attivita’ del prodotto? Questo vale per tutti i geni e i loro prodotti !!! By NA Acondroplasia II L’acondroplasia e’ una patologia originata ad un anormale sviluppo osseo. E’ una patologia autosomica dominante, oltre l’80% degli affetti hanno genitori con statura normale e sono originati da una mutazione de novo, quindi il rischio di ricorrenza e’ basso (attenzione al mosaicismo germinale) Nel caso di una coppia in cui uno dei partner sia affetto, il rischio di ricorrenza e’ 50%, se entrambi sono affetti: 25% non affetti, 50% affetti, 25% letali per l’omozigosi. Sembrerebbe collegata con aumentata eta’ paterna, proprio per il relativamente alto tasso di nuove mutazioni. Il mosaicismo germinale sembra essere la causa delle rare famiglie con ricorrenza Perche’ la diagnosi molecolare? per confermare un sospetto diagnostico per una diagnostica prenatale ( mosaicismo germinale) By NA Acondroplasia III Analisi di mutazioni note: sono note 2 mutazioni patogenetiche che vengono ritrovate (una sola!) nel 99% degli affetti. Entrambe sono a carico del codone 380 al nucleotide 1138 e provocano, a causa della sostituzione della prima base della tripletta, la sostituzione di una glicina con una arginina nel dominio transmembrana G380R. Nel 98% e’ una transizione G>A nell’1% e’ una trasversione G>C il restante 1% puo’ essere dovuto ad altri alleli rari: G>T codone 375 glicina>cisteina A>G codone 650 lisina> glutamina (letale:nanismo thanatoforo) ....... Per tutte la tecnica e’ la ARMS o analoghe: la sequenza wt e mutata sono note. E se non ci sono le mutazioni note? e si deve fare una diagnosi prenatale? By NA Test per mutazioni note Ricerca di mutazioni puntiformi: ARMS (Amplification Refractory Mutation System): si eseguono 2 reazioni di PCR in parallelo IN 2 PROVETTE in una i primer sono entrambi per la sequenza normale, nell’altra un primer e’ un ASO specifico per la mutazione. Si ha la banda di amplificazione solo se entrambi i primer si appaiano. Di solito il test e’ multiplex utilizzando primer che permettano di vedere piccole variazioni nella corsa elettroforetica. By NA 1. I multiplex Allele A M Allele B N Allele C N DF508N Allele D N Allele E N Allele A N Allele B N Allele C N DF508N Allele D M Allele E N CFTR A m B m C m DF508 n Contr D m E m DF508 M Contr. PCR A M DF508 n Contr, D M Contr. AM DM D508N Contr. Reazione 1 By NA Reazione 2 Reazione 1 Reazione 2 1 2 Acondroplasia IV Sequenziamento tenendo presente che se si trova una mutazione: Mutazione mai descritta in letteratura, ma che potrebbe essere patogenetica (il meccanismo di azione del prodotto e’ noto): e’ presente in altri soggetti sani della famiglia? Mutazione mai descritta in letteratura, con effetto ignoto sulla funzionalita’: e’ presente in soggetti sani della famiglia? Mutazione mai descritta in letteratura, ma il cui effetto si ritiene innocuo sulla funzionalita’: e’ presente in soggetti sani della famiglia? Mutazione descritta in letteratura, il cui effetto e’ accertato essere innocuo sulla funzionalita’ (come?) By NA Acondroplasia V Sequenziamento: si e’ risposto SI a tutte le domande precedenti, quindi non si e’ trovato niente di chiaramente patogenetico. Che vuol dire? Il probando, chiaramente malato, ha una mutazione ad un altro locus, Diagnosi errata o il prodotto del secondo ipotetico locus interagisce con il primo e quindi il fenotipo e’ uguale Il probando, chiaramente malato, ha una mutazione non visibile perche’ si manifesta durante la maturazione dell’RNA. E quindi che faccio? Nel caso dell’acondroplasia l’ecografia prenatale mi aiuta e non e’ il caso di ricorrere al linkage perche’ non esistono portatori “silenti”: la penetranza e’ totale e non c’e’ espressivita’ variabile. By NA Acondroplasia VI By NA Acondroplasia VII By NA
Scaricare