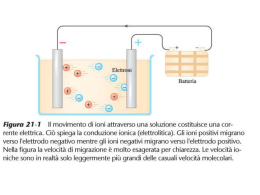
INTRODUZIONE ALL’ELETTROCHIMICA REAZIONI DI OSSIDORIDUZIONE Le reazioni di ossidoriduzione implicano un trasferimento di elettroni tra specie chimiche: la specie che cede gli elettroni si ossida mentre quella che li riceve si riduce. Una reazione di ossidoriduzione 5Fe2+ + MnO4- + 8H+ 5Fe3+ + Mn2+ + 4H2O può essere scritta come somma di due semireazioni, ciascuna relativa ad una coppia coniugata di ossidoriduzione (O1/R1 e O2/R2) 5Fe2+ 5Fe3+ + 5e- MnO4- + 8H+ + 5 e- Mn2+ + 4H2O Al contrario di quelle acido-base, che sono generalmente molto veloci, le reazioni di ossidoriduzione possono procedere molto lentamente. Se necessario, la velocità di reazione può essere incrementata aumentando la temperatura della soluzione. 1 Un caso particolare di reazione di ossidoriduzione cineticamente sfavorita è quello dell'ossidazione dell'acqua da parte del permanganato di potassio. Infatti, l'uso del permanganato come ossidante in soluzioni acquose è reso possibile solo dalla velocità estremamente bassa della reazione 4MnO4- + 2H2O 4MnO2(s) + 3O2(g) + 4OH- I pedici (s) e (g) indicano che le specie sono presenti, rispettivamente, allo stato solido e gassoso. In una soluzione esente da impurezze la reazione non avviene a velocità apprezzabile. D'altra parte la reazione è catalizzata dalla presenza del biossido di manganese, e decorre rapidamente quando tracce di quest'ultimo vengono prodotte per reazione del permanganato con impurezze presenti in soluzione: il meccanismo autocatalitico della reazione rende necessaria l'eliminazione (mediante filtrazione) delle tracce di MnO2 dalle soluzioni appena preparate di permanganato. 2 Una reazione di ossidoriduzione può essere realizzata per via chimica o per via elettrochimica. Nel primo caso la reazione di ossidoriduzione avviene per mescolamento dei reagenti, e quindi per trasferimento diretto degli elettroni dalla specie che si ossida a quella che si riduce. Un esempio classico è quello del sistema costituito da una lamina di rame metallico immersa in una soluzione contenente ioni Ag+. Nella reazione spontanea Cu + 2Ag+ Cu2+ + 2Ag Il rame passa in soluzione come Cu2+ mentre gli ioni Ag+ si depositano sul rame come argento metallico. V Nel secondo caso le due semireazioni Cu Cu2+ + 2e- Ag+ + e- Setto poroso Ag Cu Ag sono separate nello spazio in una cella elettrochimica, cioè in un sistema che non consente il contatto diretto tra i reagenti. Zn2+ Ag+ Cu2+ Cu2+ 3 Per definizione anodo e catodo sono gli elettrodi dove avvengono l'ossidazione e, rispettivamente, la riduzione. La differenza di potenziale ai capi dei due elettrodi, DE, misurata mediante un voltmetro inserito nel circuito esterno, è la manifestazione della diversa tendenza dei due metalli a passare in soluzione. Le celle elettrochimiche possono essere • galvaniche (o voltaiche), ovvero spontanee • elettrolitiche, ovvero non spontanee Rappresentazione schematica delle celle: Pt/Fe 2 (a 0,02), Fe 3 (a 0,003) // Zn2 (a 0,0001) / Zn / indica un cambiamento di fase // indica un ponte salino 4 – + Cella galvanica (spontanea) 5 – + Cella elettrolitica (non spontanea) 6 POTENZIALE DI GIUNZIONE LIQUIDA Immaginiamo di mettere a contatto due soluzioni di HCl a diversa concentrazione senza provocarne il mescolamento, e di poter osservare la diffusione degli ioni idrogeno e cloruro dalla soluzione più concentrata alla più diluita. Immediatamente dopo il contatto, gli ioni H+ e Cl- cominceranno a diffondere dalla soluzione più concentrata a quella più diluita. Dato che gli ioni H+ hanno una mobilità, u, maggiore (uH = 362.8 10-5 cm2/Vs e uCl = 79.1 10-5 cm2/Vs, a 25°C) essi sopravanzano gli ioni cloruro nel moto diffusivo: si genera una separazione di carica, positiva verso la soluzione più diluita e negativa verso la più concentrata. Tale separazione di carica si oppone all'ulteriore diffusione degli ioni. H+ ClH+ Cl- Cl- - Cl- + H+ H+ La ddp associata alla separazione di carica viene chiamata potenziale di giunzione liquida 7 Un ponte salino è un dispositivo idoneo a diminuire il potenziale di giunzione liquida. Il più semplice consiste in un tubo a U riempito di un gel contenente un sale concentrato costituito da ioni aventi mobilità quasi uguale (per esempio KCl: si confronti la mobilità dello ione potassio uK = 76.2 10-5 cm2/Vs, con quella sopra riportata del cloruro) e chiuso alle estremità da setti porosi. Quando due soluzioni sono collegate mediante un ponte salino, la diffusione avviene prevalentemente dal ponte salino verso l’esterno. Dato che gli ioni del ponte hanno praticamente la stessa mobilità, il potenziale di giunzione liquida, a ciascuna estremità del tubo a U, risulta minore di quello che si sarebbe verificato per contatto diretto tra le due soluzioni. KCl saturo Ponte salino 8 La diversa mobilità degli ioni genera una differenza di potenziale ogni volta che si pongono a contatto due soluzioni Questa differenza di potenziale è quella chiamata potenziale di giunzione. Il ponte salino minimizza il potenziale di giunzione. 9 Il potenziale elettrodico assoluto di una semicella non può essere misurato in quanto, per effettuare la misurazione, devono essere utilizzati due contatti elettrici e quindi due semicelle, a ciascuna delle quali deve avvenire una reazione di ossidoriduzione: gli strumenti di misura sono in grado di misurare solo differenze di potenziale. È però possibile attribuire un valore relativo ai potenziali elettrodici assegnando arbitrariamente il valore 0.00V, a qualsiasi temperatura, ad una semicella particolare. L'elettrodo prescelto è quello standard a idrogeno (SHE) ed al suo potenziale sono riferiti i valori di tutte le altre semicelle. 10 L'assegnazione del valore 0.000 V al potenziale standard dell'elettrodo standard a idrogeno è arbitraria, ma consente di definire una serie elettrochimica di potenziali elettrodici standard relativi. Questi possono essere usati nei calcoli. Per assegnare il potenziale ad una certa semicella, M/Mn+, si costruisce una cella elettrochimica formata da un elettrodo standard a idrogeno e dalla semicella in esame, e se ne misura la differenza di potenziale, DEcella: a) poiché per definizione il potenziale elettrodico dello SHE è uguale a 0.000 V, il potenziale elettrodico della semicella Mn+/M, EMn+/M, è uguale alla differenza di potenziale misurata tra i due elettrodi della cella elettrochimica, DEcella; b) se l'elettrodo Mn+/M è il polo positivo rispetto allo SHE (cioè è caricato positivamente) al suo potenziale elettrodico, EMn+/M, viene assegnato il segno + (in tal caso l'elettrodo è il catodo); c) se l'elettrodo Mn+/M è il polo negativo rispetto allo SHE (cioè è caricato negativamente) al suo potenziale elettrodico, EMn+/M, viene assegnato il segno - (in tal caso l'elettrodo è l'anodo). 11 Nella serie elettrochimica così definita i potenziali elettrodici standard delle semicelle Zn/Zn2+ e Cu/Cu2+ sono uguali a -0.763 V e +0.337 V a 25°C, rispettivamente. La misura della differenza di potenziale di una cella deve essere effettuata senza far passare corrente attraverso di essa, in caso contrario durante la misura avverrebbero reazioni elettrodiche che porterebbero alla variazione delle attività degli analiti, e quindi alla variazione del potenziale di cella stesso. Le misure condotte a corrente nulla, o comunque in pratica trascurabile, sono dette misure potenziometriche. 12 POTENZIALI ELETTRODICI STANDARD 13 Equazione di Nernst L'equazione di Nernst permette di calcolare il potenziale di un elettrodo, o la differenza di potenziale ai capi di una cella elettrochimica, in funzione delle attività delle specie coinvolte nel processo ossidoriduttivo. Per una semicella: E E a RT ln ox nF a rid R è la costante universale dei gas, uguale a 8,314 J/(mole K), T è la temperatura assoluta, n è il numero di elettroni trasferiti nella semireazione da ogni mole di reattivo e F è il Faraday, cioè la carica associata ad una mole di elettroni (96485 C). ΔE Ecat Ean Per una cella: Ecat a a RT RT ln ox Ean ln ox nF nF a rid cat a rid an a ox a rid RT cat an ΔE ΔE ln nF a rid a ox cat an 14 Sostituendo i valori delle varie costanti si ottiene: aox a rid 2.303 8.314 298.15 cat an ΔE ΔE log n 96485 a rid a ox cat ΔE 0.0591 n log aox a rid cat cat a rid a ox an an an Normalmente, almeno a livello didattico, nell’equazione di Nernst sono usate le concentrazioni: C 0.0591 E E log ox n C rid e quindi, ad esempio, per la reazione Fe2+ + Ce4+ Fe3+ + Ce3+ si può scrivere ΔE (ECe EFe ) ΔE 0.0591 n 0.0591 n C Ce 4 C Fe 2 log C Ce 3 C Fe 3 C Ce 4 C Fe 2 log C Ce 3 C Fe 3 15 Esempi Calcolare la differenza di potenziale ai capi della cella: Pt/Fe2+ (0,03 M), Fe3+ (0,01 M)// Cd2+ (0,002 M)/Cd EFe 0.771 E Cd 0.403 0.059 0.01 log 0.743 V 1 0.03 0.059 log 0.002 0.483 V 2 La semicella di sinistra è il catodo (perché ha il potenziale più positivo, quella di destra è l’anodo (perché ha il potenziale più negativo). La differenza di potenziale è ΔE EFe E Cd 0.743 (0.483) 1.226 V N.B. La differenza di potenziale di una cella spontanea NON può essere mai negativa. 16
Scarica