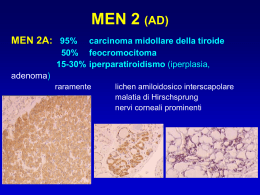
Università di Torino Dipartimento di Genetica Biologia e Biochimica barbara pasini Predisposizioni ereditarie allo sviluppo di tumori neuroendocrini MEN2 e MEN1 HPT-JT MEN2 CDK-Inhibitors MEN1 iperplasia / adenoma paratiroidi carcinoma midollare della tiroide AIP PRKAR1A feocromocitoma paraganglioma tumori endocrini pancreatici angiomatosi retinica emangioblastoma SNC carcinoma renale (CC) adenoma ipofisi gastrinomi duodenali carcinoidi ecc. VHL SDHB-SDHD SDHC, SDHAF2SDH5, SDHA TMEM127 e NF1 caratteristiche generali delle neoplasie endocrine multiple • autosomiche dominanti • combinazione di “lesioni” specifiche - istologia / clinica caratteristica - - età caratteristiche di insorgenza - - PT: iperplasia in MEN2A / adenomi in MEN1 / adenoma cistico HPT-JT PiA: frequente PRL in MEN1 – frequente GH in AIP PNET: spesso secernenti in MEN1 / non secernenti VHL MTC con CCH in MEN2 più manifestazioni presenti contemporaneamente sviluppo di manifestazioni in successione manifestazioni cutanee, cistiche ecc. malformazioni, dismorfismi (MEN2B) • penetranza alta ma espressività variabile • correlazione genotipo-fenotipo - MEN2, VHL, SDH (no MEN1) test genetico nelle neoplasie endocrine multiple • indicazione al test • sospetto clinico: almeno due segni di malattia o famigliarità • vantaggio del test genetico rispetto alla diagnosi clinica - paziente giovane alla prima manifestazione - le altre manifestazioni attese sono più tardive - lo screening clinico è costoso / impegnativo - il test genetico è informativo • utilità del test • • • • • • confermare la diagnosi (può venire negativo !) correlazioni genotipo-fenotipo stimare il rischio per ulteriori manifestazioni di malattia curare in modo opportuno le manifestazioni di malattia screening dei famigliari a rischio (età precoce) diagnosi prenatale MEN 2 (AD) MEN 2A: 95% carcinoma midollare della tiroide 50% feocromocitoma 15-30% iperparatiroidismo (iperplasia >> adenoma) raramente lichen amiloidosico interscapolare malattia di Hirschsprung nervi corneali prominenti MEN 2 (AD) MEN 2A - 1 : MTC + pheo + HPT MEN 2A - 2 : MTC + pheo MEN 2A - 3 : MTC + HPT FMTC : almeno 4-8 casi di MTC in famiglia parenti affetti viventi con sorveglianza clinica negativa per pheo e HPT MEN 2B : insorgenza precoce di MTC con o senza pheo dismorfismi facciali, neuromi delle mucose (labbra) habitus marfanoide, cifoscoliosi ganglioneuromatosi intestinale pectus excavatum, pes cavus MEN 2B Spinelli e Bernini in Endocrinopatie pediatriche di interesse chirurgico R. Domini et al. Andrioli M. proto-oncogene RET (10q11.2) RTK (receptor tyrosine kinase) Ligandi : fattori neurotrofici della famiglia del transforming growth factor b : GDNF, Neurturina, Persefina, Artemina cadherine-like cys-rich region trans-membrane tyrosine kinase domain 3 isoforms: - 1072 (ex 19) - 1114 (ex 20) - 1106 (ex 21) Co-recettori : Proteine legate al glicosil-fosfatidil-inositolo GFRa1, GFRa2, GFRa3, GFRa4 Mutazioni “germinali” in recettori TK • • • • RET : neoplasie endocrine multiple tipo 2 MET : carcinoma renale ereditario papillare KIT : GIST (gastro-intestinal stromal tumors) famigliari PDGFRa : GIST e neurofibromatosi intestinale “Caratteristiche comuni” : - predisposizioni ai tumori AD - pattern limitato di espressione dei geni - origine dei tumori dalle cellule che li esprimono - possible presenza di difetti di sviluppo Polimorfismi Glu616del ?? ex 5 Gly321Arg (1 family) ex 8 Gly533Cys (1 family) ex 9 Cys855Tyr (HD, MEN2 ??) ex 10 Mutazioni Lys603 Gln (1 family FMTC – PTC ??) Cys609 , Cys611 (mut Cys611 + Arg886Trp in cis) Cys618, Cys620 Cys630 Asp623Lys ?? Asp631Val+His665Gln ?? ex 11 Ile647 (ATC>ATT) Gly691Ser Leu769 (CTT>CTG) Tyr791Phe (TAT>TTT) Tyr806Cys ?? ex 13 Glu768Asp (GAT, GAC) Asn777Ser Val778Ile (multifocal MTC ??), Gln781Arg (FMTC ??) Leu790Phe (TTT, TTC) ex 14 Ser836 (AGC>AGT) Ser904 (TCC>TCG) Asp631Tyr ?? Cys634 (mut Cys634 + Asp631Glu, Arg635Gly, Ala640Gly, Ala641Ser in cis) (mut Cys634 + Val 648Ile in trans in ACTH producing Pheo) Ser649Leu (CCH ??), Lys666Glu (??) Val804Leu, Met Val804Met + Tyr806Cys in cis, Val804Met + Ser904Cys in cis Val804Met + Arg844Leu in cis Met848Thr (MTC ??), Ile852Met (MTC ??) ex 15 Ala883Phe, Ala883Thr (MTC ??) Ser891Ala, Ser904Phe (MTC ??) ex 16 Arg912Pro (1 family) Met918Thr, Ser922Pro/Tyr (MTC ??) Mutazioni RET extra-cellulari: livello di rischio 2, 3 ex 10 Cys609 # Cys611 Cys618 # Cys620 # 12 bp dup (634-635) cys-rich region ex 11 MEN2A-1: 8% MEN2A-2: 31% MEN2A-3: 20% FMTC : 60 % HSCR: 65 casi Cys630 Cys634 trans-membrane tyrosine kinase domain MEN2A-1: MEN2A-2: MEN2A-3: FMTC : Effetto biologico : dimerizzazione ligando-indipendente del recettore RET 92% 69% 80% 30 % 03 RET esone 11 p.Cys634Tyr Uterus MTC Pheo Bil HPT mut 3 9 3 MTC 33 Pheo Bil 40 MTC 17 Pheo Bil 35 wt 4 RET esone 11 p.Cys634Tyr Uterus MT C Pheo Bil HPT + 3 wt + 9 + + MT C 17 Pheo Bil 35 + + wt + wt + wt wt 3 MT C 33 Pheo Bil 40 + wt + wt 4 RET esone 11 p.Cys634Tyr Uterus MT C Pheo Bil HPT 3 9 3 MT C 33 Pheo Bil 40 MT C 18 MT C 13 MT C 35 CCH 14 CCH 11 MT C 30 Pheo 31 MT C 11 MT C 10 MT C 17 Pheo Bil 35 4 3 RET esone 14 p.Val804Met 80 mut 8 64 MTC 52 wt 70 wt mut CT al test genetico 57 51 mut mut wt basale : 2.60 pg/ml picco : 18.20 pg/ml mut 2 36 34 micro MTC 30 CT al test genetico basale : 10.36 pg/ml picco : 215.36 pg/ml 30 27 18 RET esone 10 p.Cys618Arg 1 1 2 2 3 4 5 wt Pheo 74 MTC 75 1 2 3 4 5 6 7 8 9 10 wt 1 2 2 wt wt 3 4 3 5 3 MTC 45 6 7 8 MTC 41 HPT 9 2 10 MTC 37 11 12 14 15 16 3 CCH 12 CCH 9 wt MTC 8 wt CCH 7 NO CCH 9 HSCR 12 wt 8 2 13 2 wt MTC 34 13 7 wt 11 3 CNS 44 6 14 2 wt 2 3 Pheo 74 MTC 75 6 7 MTC 45 7 8 8 MTC 41 HPT 9 10 9 MTC 37 11 12 MTC 34 13 14 15 16 3 CCH 12 CCH 9 wt MTC 8 wt CCH 7 NO CCH 9 HSCR wt Mutazioni RET in Cys esone 10 : MEN2A-FMTC e malattia di Hirschsprung 23 famiglie 65 casi MEN2A – HD aganglionosi del colon distale ostruzione e megacolon a monte MEN2B – ganglioneuromatosi perdita del “tono” muscolare distensione, dilatazione segmentaria megacolon Mutazioni RET intra-cellulari: Livello di rischio 1 (MEN2B) Effetto biologico: cambiamento della specificità di substrato transmembrane Livello di rischio 3 (FMTC) (raramente MEN2A) ATP binding domain ex 13 inter-TK ex 14 Catalytic core pocket Glu768 Asp Leu790 Phe Tyr791 Phe (variante genetica con modesto effetto biologico) Val804 Leu Val804 Met ex 15 Ala883 Phe Ser891 Ala ex 16 Met918 Thr RET esone 16 p.Met918Thr 71 51 54 73 89 85 83 91 85 80 55 52 Mammella (F) 41 + 11 CMT Tiroide 70 56 Endometrio (ginecologica?) 71 83 50 Polmone 75 Nato nel 1998: - labbra e neurofibromi linguali tipici - dal 2001, accertamenti per ripetuti episodi di stipsi -2007: biopsia lesione lingua e dosaggio calcitonina (187.6 pg/ml vn < 10) cromogranina A (143.7 ng/ml vn < 98) normali valori del paratormone (27.4), calcemia (9.7) e catecolamine urinarie eco tiroide: nodulo di 5 mm del lobo destro e nodulo solido, ipoecogeno, a margini irregolari di 6 x 5 mm del lobo sinistro test da stimolo: calcitoninemia basale di 90.6 ng/l picco al 3' di 1032.0 e al 5' di 811.3, cromo A: 90 ng/ml EI: carcinoma midollare della tiroide bilaterale (dx: 4 mm, sin: 5 mm) associato ad iperplasia delle cellule C, iperplasia reattiva in 12 linfonodi analizzati 2008: calcitonina basale 13 pg/ml (picco a 3’: 58, a 5’: 51), CromoA 117 ng/ml 2009: calcitonina 21 pg/mL, cromoA 91 ng/m RET esone 10 c.1852T>A (p.Cys618Ser) + 83 + - + - 64 Colon 45 Pancreas 62 74 + 33 - 46 + 41 CMT Tiroide 36 Genitale (M) (stromale testicolo) 32 33 1 12.05.2005 tiroidectomia totale con linfoadenectomia laterocervicale bilaterale asportazione del timo reimpianto di tessuto paratiroideo EI: carcinoma midollare della tiroide monolocale di 3,5 x 1,8 cm non segnalata iperplasia delle cellule C, pT2N0 66 Prostata 62 RR 50% MEN2 10% stenosi piloro < 2% HSCR 37 Nato nel 1968 con stenosi del piloro 12.2000 (32): tumefazione del testicolo sinistro Ecografia: lesione nodulare solida di circa 1,5 cm CEA 71.1 ng/ml (vn < 5), aFP 1.7 UI/ml (vn < 5) BHCG < 1 mUI/ml intervento di orchi-funicolectomia sinistra EI: neoplasia stromale del testicolo (basso grado di atipie, CEA negativo) TC addome completo nella norma CEA 77.3 ng/ml (vn < 5) 2005 (36): CEA 92.6 esame PET: area di captazione in regione paratracheale sinistra alla base del collo cui segue esame ecografico nodulo tiroideo sinistro di 2,9 cm risultato negativo per CTM calcitonina 621 pg/ml, PTH (28) e catecolamine urinarie neg. RET esone 13 p.Glu798Asp 93 92 35 2 89 85 2 83 69 67 Leukemia 24 40 46 mut 59 MTC 54 Pheo 59 Paraganglioma 59 HUMARA TEST Breast Cancer 58 Blood wt wt 31 27 Hpa II + - Pheo Celiac mass + - + - RET esone 13 p.Leu790Phe 80 94 40 3 2 50 40 2 51 46 83 mut 62 Pheo 31 MTC 62 mut 40 38 Calcitoninemia 9.7 pg/ml RET esone 13 p.Leu790Phe 51 46 + 66 Feocromocitoma 31 CMT 62 - + 45 42 CMT 39 41 + 17 15 8 analisi RET nel carcinoma midollare della tiroide - apparentemente sporadico e nel feocromocitoma 138 casi analizzati di CMT sporadico: mutazioni RET in 12 casi (8.7%): 35 casi analizzati di PHEO sporadici, bilaterali, famigliari: nessuna mutazioni RET (0%) - 7 in cisteine esone 10 (Cys611, 618, 620) - 1 esone 13 (p.Glu768Asp) p.s. 8 mutazioni VHL (23%) - 3 esone 14 (p.Val804Met) - 1 esone 16 (p.Met918Thr metastatico a 29 aa) età alla diagnosi dai 28 ai 77 anni gene RET 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Mutazioni germinali in feocromocitomi (surrene) - paragangliomi Mutazioni germinali in feocromocitomi (surrene) – paragangliomi maligni Mutazioni germinali in feocromocitomi (surrene) – paragangliomi “sospetti” ereditari analisi RET in sospetta MEN2 e altri fenotipi CMT famigliare: 1 mut / 3 (33%): esone 14 (p.Val804Met) sospetta MEN2A: 4 mut / 9 (44%): esone 10 (1) e 11 (3) nessuna mutazioni RET in: - 6 casi con CCH - 4 casi di iperparatiroidismo - 3 casi con diade/ triade di Carney casi negativi: CMT + HPT, PHEO con CCH sospetta MEN2B: 3 mut / 3 (100%): esone 16 (p.Met918Thr) Screening dei famigliari per mutazione RET nota in fam. (73): - 26 mutati - 47 non portatori gene RET 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 MEN2: Gestione clinica 611, 618, 620, 634 609, 768, 790, 804, 891 Neoplasie endocrine multiple tipo 1 (AD) Autosomica dominante alta penetranza ma espressività variabile Altre manifestazioni • lipomi • angiofibromi facciali • collagenomi • ependimoma • feocromocitoma • noduli corteccia surrenalica Neoplasie endocrine multiple tipo 1 (AD) Penetranza del 50% a 20 anni – 95% a 40 anni Gastrinomi: - in circa il 40% dei casi - sintomi di ZES di solito < 40 anni - spesso multipli e < 1 cm - triangolo del gastrinoma: duodeno testa del pancreas legamento epatoduodenale (NO gastrici !!!) - trattamento alla diagnosi (segni biochimici o > 1 cm) - metastasi alla diagnosi nel 50% (pancreas > duodeno) - mortalità nel 30% dei casi metastatici al fegato <> Insulinomi: - in circa il 10% dei casi - tumori per lo più unici e solitamente benigni - iper-insulinismo se 1- 4 cm - associati a macro-adenomi <> VIPoma: 2% dei casi <> Glucagonoma: 2% dei casi <> Non funzionanti: frequenti gene MEN1 localizzato nel 1988 in 11q13 proteina menina di 610 aa – 67 kDa espressa in molti tessuti localizzazione nucleare nelle cellule quiescenti localizzazione citoplasmatica nelle cellule in divisione clonato nel 1997 10 esoni in 9 Kb Mutazioni germinali MEN1 riportate 1133 mutazioni (459 differenti) • • • • 73% mutazioni troncanti - 41% delezioni / inserzioni - 23% nonsenso - 9% difetti di splicing 6% inserzioni / delezioni in frame 20% missenso - 68% in aa conservati nei geni omologhi - 27% in aa non identici ma affini - 5% in aa non conservati 1% delezioni genomiche assenza di correlazioni tra genotipo e fenotipo (nel FIHP le mutazioni missenso sono il 38%) 4 hot-spots mutazionali (12.3% delle mutazioni) (0/11) (1/11) (6/11) (4/11) (0/11) Mutazioni germinali MEN1 • • • • 77 % dei casi famigliari MEN1 64 % dei casi isolati di MEN1 11/71 (15.5%) 20 % dei casi famigliari di HPT assenti nei casi famigliari di prolattinoma o acromegalia (gene AIP in 11q13) • rare nei casi sporadici di : - gastrinoma (5%) - carcinoide timico (7%) - adenoma delle paratiroidi (< 1%) - prolattinoma (< 1%) - angiofibroma (< 1%) MEN117/05/2005 p.Lys557X MEN1 IVS3+1G>A 2 3 65 37 74 83 17/05/2005 + + 49 51 Adenoma Ipofisi 35 Adenoma Paratiroide 35 Tumore endocrino Pancreas 37 Tumore endocrino Stomaco 37 Tumore endocrino Duodeno 37 41 Carcinoide 36 mediastino 3639 Tumore endocrino Carcinoide Tumore endocrino Pancreas 39 - - + 10 25 20 41 3 MEN1 IVS6-2A>G 80 Colon 70 Mammella (F) 54 Tumore endocrino Pancreas Esofago Stomaco 68 + 35 40 Adenoma Paratiroide 23 Tumore endocrino Pancreas 26 MEN1 p.Arg415X 16/10/2009 45 82 70 84 4 79 Stomaco 78 80 81 2 84 26 Leucemia 25 + 47 57 51 54 60 43 Adenoma Paratiroide 52 Adenoma Paratiroide 41 58 Adenoma Ipofisi 49 Tumore endocrino Pancreas 49 - 32 28 21 27 26 13 26 11 7 27 - 27 55 Adenoma Paratiroide 47 16/10/2009 MEN1 IVS4-9G>A 76 47 63 Fegato 65 + 61 Adenoma Ipofisi 44 Tumore endocrino Pancreas 48 Adenoma Paratiroide 51 Adenoma Paratiroide 48 58 Adenoma Ipofisi 29 Tumore endocrino Pancreas 44 Tumore endocrino Pancreas 44 Tumore endocrino Pancreas 44 Adenoma Paratiroide 44 Adenoma Paratiroide 44 Pancreas (cistoadenoma mucinoso) 44 60 + 36 32 Adenoma Paratiroide 22 Adenoma Paratiroide 33 Adenoma Ipofisi 25 Tumore endocrino Pancreas 31 29 15 41 41 Adenoma Paratiroide 36 Adenoma Paratiroide 40 Tumore endocrino Pancreas 36 Carcinoide Timo 40 + 19 + + - 38 Tumore endocrino Pancreas 30 32 10 2 - 13 3 1 + 26 Adenoma Paratiroide 13 Adenoma Paratiroide 24 45 Stomaco 40 Mammella (F) 80 Stomaco 75 Stomaco 92 SNC - 79 3 67 CMT Tiroide 60 0/2009 67 - ? - 45 42 38 Adenoma Paratiroide 30 Adenoma Paratiroide 30 27 46 58 - Polmone 3 3 76 7 5 Mammella (F) 68 Meninge 62 SNP (neurinoma dx) 63 71 CMT Tiroide 63 Adenoma Paratiroide 63 Tumore endocrino Pancreas 68 Adenoma Paratiroide 63 2 3 30 Feocromocitoma Midollare surrene 15 Paraganglioma Addome 20 Feocromocitoma Midollare surrene 28 Ganglioneuroblastoma (pelvi) 1 Mammella (F) 46 35 Melanoma cutaneo gamba sx 31 10 4 2 3 2 MEN1 – like MEN4
Scaricare