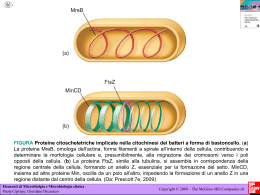
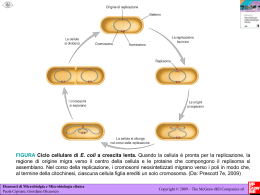
Valori di elettronegatività: H, 2,1; Li,1; Na, 0,9; Mg, 1,2; C, 2,5; O, 3,5; P, 2,1; N , 3; F, 4. He non assegnato Esercizi 1) Qual è la fonte di energia che mantiene la struttura ordinata e complessa di tutti gli esseri viventi? 2) Che cosa significa che gli esseri viventi sono dei sistemi omeostatici? 3) Esegui le seguenti equivalenze: 0,3 L = ml 48,5 cm3= ml 1ml= cm3 100 dl= ml 20ml= cm3 3,2 kg= µg 12 cm= mm 1 µm2 = m2 4) Se poteste ingrandire la cellula di 10000 volte (un ingrandimento che si può avere con un buon microscopio), quanto diventerebbe grande? (considerate una tipica cellula eucariotica con un diametro di 40 micron). 5)Calcolate i volumi medi di un mitocondrio (piccole sfere del diametro di 2 micrometri), del nucleo (diametro di circa 7 micrometri) e di una cellula eucariotica. Qual è il rapporto tra il diametro di una cellula e di un mitocondrio? Commentate. 5) Qual è la densità di un farmaco che pesa 0,9 grammi ed è contenuto in una siringa con una soluzione di 2ml? 6) Il mercurio ha una densità di 13,6 g/ml. Quanto pesano 57 ml di mercurio? 7) L’urina degli individui sani ha una densità che varia tra 1,003g/ml e 1,030 g/ml. Supponiamo che le analisi delle urine di due pazienti diano i seguenti valori di peso, per un volume di 10 ml: 10, 36 g e 10, 0002 g. Vi sembrano valori normali? Come potete commentare? 8) Quale dei seguenti processi sono un cambiamento fisico e quali un cambiamento di stato chimico: rompere il vetro, digerire, trasformazione della benzina nel motore a scoppio, preparazione della maionese, cottura di una torta. 9) Perchè quando un solido fonde la temperatura rimane costante? 10) Quale dei seguenti esempi di materia è un elemento, composto o miscela? ferro, zinco, benzina, aspirina (farmaco), liquido lacrimale, aria, liquido salivare, acido borico, varichina, soda caustica 11) Quanti protoni, neutroni ed elettroni sono presenti negli isotopi 14N e 31P? Temi della lezione L’energia di legame e l’energia di ionizzazione Le reazioni chimiche La mole e il numero di Avogadro Reazioni di ossido-riduzione Energia di ionizzazione ed energia di legame L’allontanamento di un elettrone dall’orbitale esterno di un atomo richiede una certa energia di ionizzazione, variabile secondo l’atomo che si considera. L’energia di legame è il tipo di energia che tiene uniti gli atomi legati da un legame covalente nella molecola di un composto o di un elemento. 1cal= 4,184 Joule Stato di ossidazione di un elemento in un composto è il numero di ossidazione, cioè la carica che si attribuirebbe ad un atomo presente nella molecola di un composto se, ipoteticamente, si spezzassero tutti i legami covalenti e si attribuissero gli elettroni all’atomo più elettronegativo. Es Mg O Reazioni chimiche Una reazione chimica viene formalmente rappresentata da una equazione chimica. Es H2+CL2 ___ HCl Bilanciamento di una reazione C6 H12 O6 + O2---CO2+ H2O Reazioni di ossidoriduzione: Es. Mg + O2 --MgO La mole • Una mole di sostanza è una quantità di espressa in grammi pari al numero espresso in uma che indica la massa atomica di quella sostanza. Una mole di una sostanza contiene un numero di molecole pari al numero di Avogadro, 6x 10 23 L’acqua, il legame idrogeno e le soluzioni acquose. Propietà colligative delle soluzioni acquose. Concentrazioni dei soluti. Acidi e basi, pH. Esempi di legami idrogeno Le soluzioni • Soluzioni acquose e sostanze solubili in acqua. • Concentrazione dei soluti in soluzione: • Molarità • Molalità • Percentuale Esercizi • • • In che volume di una soluzione 50 mM di NaCl sono contenuti 15 g di soluto? ( pm: vedere la tavola periodica) Qual è la concentrazione molare di una soluzione di glucoso al 10%? Quanti grammi di NaCl devo sciogliere in un litro di acqua sterile e distillata per preparare una soluzione fisiologica (cioè 150 mM)? Proprietà colligative delle soluzioni Sono quelle proprietà che dipendono dal numero di particelle di soluto disciolte in soluzione ma non dalla loro natura Un acido è un donatore di protoni Una base è un accettore di protoni La specie formata dalla ionizzazione di un acido è la sua base coniugata. Viceversa,la protonazione di una base dà il suo acido coniugato. In soluzione acquosa, un acido-base coniugati (come l’acido acetico e lo ione acetato) ha una importante proprietà: si oppone a piccoli cambiamenti di pH, cioè ha potere tamponante. PH di una soluzione • Il pH di una soluzione è il logaritmo negativo della concentrazione di ioni H+ • Anche le molecole di acqua sono debolmente dissociate in ioni H+ e OH-.La loro concentrazione è 10-7 .
Scarica