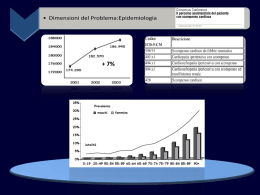
AMERICAN COLLEGE OF CARDIOLOGY American Heart Association Fighting Heart Disease and Stroke “Lo scompenso cardiaco è una sindrome clinica complessa che è il risultato di un disordine strutturale o funzionale del cuore che causa un ostacolo nel riempimento o nello svuotamento ventricolare”. ACC/AHA Guidelines. (2002) Scompenso cardiaco: incidenza, prevalenza e mortalità Incidenza annuale Prevalenza Mortalità annuale U.S.A. 400.000 5,0 milioni 250.000 Europa 580.000 6,5 milioni 300.000 Wilkerson Group Survey. (1998) Incidenza media annuale per 1.000 Incidenza dello scompenso cardiaco in rapporto all’età e al sesso: studio di Framingham 35 Donne 30 Uomini 25 20 15 10 5 0 45-54 55-64 65-74 75-84 85-94 Età (anni) Cowie MR, et al. (1998) Studio SEOSI: eziologia dello scompenso Cardiomiopatia Ipertrofica 0,9% Valvulopatia 14,7% Altro 4,9% Combinate 15,7% Ipertensione arteriosa 15,1% Cardiopatie congenite 0,4% Cardiomiopatia dilatativa 15,3% Cardiopatia ischemica 33% The SEOSI Investigators. (1997) Classificazione dello scompenso secondo la New York Heart Association (NYHA) Classe I Pazienti con cardiopatia ma senza limitazione dell’attività fisica. L’attività fisica ordinaria non causa affaticamento, dispnea, palpitazioni o dolori anginosi. Classe II Pazienti con cardiopatia condizionante una lieve limitazione dell’attività fisica. Asintomatici a riposo. L’attività fisica ordinaria provoca affaticamento, palpitazioni, dispnea o dolori anginosi. Classe III Pazienti con limitazione marcata dell’attività fisica. Asintomatici a riposo. Un’attività fisica minore dell’ordinaria provoca affaticamento, palpitazioni, dispnea o dolori anginosi. Classe IV Pazienti con cardiopatia condizionante un’incapacità a svolgere qualsiasi attività fisica senza sintomi. I sintomi di scompenso cardiaco o di sindrome anginosa possono essere presenti anche a riposo. Se viene intrapresa qualsiasi tipo di attività fisica aumentano i sintomi. Tappe evolutive dello scompenso cardiaco Danno miocardico primario Rimodellamento ventricolare Anomalia di funzione Sistolica Diastolica Risultato finale comune Localizzato (cardiopatia ischemica) + + Bassa portata Generalizzato (cardiomiopatia dilatativa) + – ± + Sovraccarico di pressione (ipertensione) Sindrome clinica dello scompenso cardiaco Alte pressioni di riempimento ventricolare Sovraccarico di volume (cardiopatie congenite e valvolari) + – Gorlin R. (1987) Principali cause di scompenso cardiaco Malattia coronarica (infarto miocardico, cardiomiopatia ischemica) Ipertensione arteriosa (cardiopatia ipertensiva) Patologie valvolari (cardiopatie valvolari congenite ed acquisite) Cardiomiopatie (patologie del muscolo cardiaco di origine sconosciuta) - Ipertrofica - Dilatativa (includente la cardiomiopatia periparto) - Restrittiva (fibrosi endomiocardica, sindrome di Loeffler) D’Aloia A, et al. (2001) Scompenso cardiaco: condizioni predisponenti Hazard ratio Condizione Uomini Donne Prevalenza (%) Popolazione a rischio (%) Uomini Donne Uomini Donne Ipertensione (>140/90 mmHg) 2,1 3,4 60 62 39 59 Infarto miocardico 6,3 6,0 10 3 34 13 Angina 1,4 1,7 11 19 5 5 Diabete 1,8 3,7 8 5 6 12 IVS all’ECG 2,2 2,9 4 3 4 5 Valvulopatia 2,5 2,1 5 8 7 8 Levy D, et al. (1996) Dall’ipertensione allo scompenso cardiaco Ipertensione Cardiopatia coronarica Ipertrofia VS Dilatazione VS Diastolica Fattori di rischio cardiovascolare Infarto miocardico Rimodellamento Disfunzione VS Danno VS Sistolica Scompenso cardiaco Sintomi Ridotta perfusione tissutale Aumento ospedalizzazioni Morte Controllo della pressione arteriosa e scompenso cardiaco Incidenza per anno (%) 2,5 2,30 Placebo Terapia 2,0 1,5 1,80 1,40 1,10 1,0 1,00 0,90 0,50 0,5 0,81 0,60 0,36 0 N. F.U. (mesi) Riduzione % EWPHE 848 56 17 p < ns STOP 1627 25 51 0,01 SHEP 4736 53 54 0,001 Syst-Eur 4695 24 29 ns UKPDS 1148 101 56 0,0043 Cleland JGF, et al. (2001) Una complessa cascata di eventi... Danno miocardico Disfunzione miocardica Ridotta perfusione sistemica Attivazione sistema Renina - Angiotensina - Aldosterone Attivazione sistema simpatico Alterata espressione genica Apoptosi Rimodellamento Modificazioni associate al rimodellamento (1) Alterazioni della biologia dei miocardiociti - Alterazioni dell’accoppiamento eccitazione-contrazione Ridotto ingresso di calcio in fase di depolarizzazione Ridotta ricaptazione di calcio dal reticolo sarcoplasmatico Riduzione dei depositi di calcio nel reticolo sarcoplasmatico Aumento del calcio libero intracellulare Deposito di calcio a livello mitocondriale - Alterazioni dell’apparato contrattile Ipertrofia con riduzione delle miofibrille Modificazione della sintesi di isoforme della miosina Alterazione delle proteine regolatorie Ridotta attività ATPasica miofibrillare - Alterazioni dello stato energetico Ridotto fabbisogno energetico Ridotta produzione di energia Ridotte riserve energetiche - Riduzione densità e desensibilizzazione dei recettori beta-1 Modificazioni associate al rimodellamento (2) Alterazioni del miocardio - Perdita di miociti Necrosi Apoptosi - Alterazioni della matrice extracellulare Degradazione della matrice Fibrosi sostitutiva Alterazioni della geometria della camera ventricolare - Forma sferica - Assottigliamento della parete - Insufficienza mitralica Rimodellamento cardiaco Rimodellamento cardiaco Infarto acuto (ore) Espansione infarto (ore - giorni) Rimodellamento (giorni - mesi) Attivazione adrenergica Attività simpatica SNC Attività simpatica cardiaca b1-recettori b2-recettori Attività simpatica rene e vasi a1-recettori Ipertrofia e morte dei miociti, dilatazione, ischemia e aritmie Vasocostrizione Ritenzione di sodio Packer M. (2000) Effetti sfavorevoli dell’iperattivazione simpatica - Riduzione densità e desensibilizzazione dei recettori b1 Riduzione della capacità funzionale - Attivazione secrezione di renina - Tachicardia Ischemia miocardica Riduzione del tempo di riempimento ventricolare - Induzione di ischemia miocardica Tachicardia Aumento del postcarico per vasocostrizione - Induzione di tachiaritmie (ventricolari e sopraventricolari) - Induzione di ipertrofia e fibrosi miocardica - Modificazioni del fenotipo delle cellule miocardiche Riduzione del rapporto tra catene pesanti della miosina di tipo a e b - Accelerazione dei processi di morte cellulare Necrosi (effetti tossici diretti, ischemia) Apoptosi Principali cause di attivazione del sistema renina-angiotensina Stimolazione simpatica Diminuita pressione di perfusione renale Diminuito apporto sodico tubulare nella macula densa Effetti dell’iperattività del sistema renina-angiotensina-aldosterone sulla progressione dello scompenso cardiaco Vasocostrizione periferica (diretta ed indiretta con aumento del rilascio di noradrenalina dalle terminazioni simpatiche) Stimolazione della secrezione di aldosterone e vasopressina a) ritenzione idrosalina/ aumentato precarico b) ipokaliemia/aritmie Attivazione simpatica Ipertrofia dei miociti e delle cellule muscolari lisce; iperplasia dei fibroblasti con aumento del turnover del deposito di tessuto connettivo collagene a) consumo di O2 e substrati energetici b) ischemia miocardica, degenerazione e fibrosi miocardica c) aumento delle resistenze periferiche Effetti tossici miocardici diretti a) necrosi cellulare, fibrosi reattiva Effetti dell’aldosterone nell’insufficienza cardiaca Ritenzione idrosalina Perdita di magnesio Aumento della pressione arteriosa ALDOSTERONE Attivazione simpatica Fibrosi miocardica Inibizione parasimpatica Disomogeneità elettrica del miocardio Aritmie, morte improvvisa Perdita di potassio Sintomi e segni dello scompenso cardiaco Sintomi Dispnea Dispnea da sforzo Ortopnea Dispnea parossistica notturna Respiro di Cheyne-Stokes e apnea Edema polmonare acuto Tosse Astenia Intolleranza allo sforzo Sintomi urinari Nicturia Oliguria Sintomi gastro-intestinali Sintomi neurologici Cianosi Segni Reperti cardiaci Polso alternante Toni cardiaci aggiunti Soffi cardiaci Reperti polmonari Rantoli polmonari Ipofonesi basale Ipertensione venosa sistemica Epatomegalia Versamento pleurico Edemi Dispnea di origine cardiaca e polmonare: diagnosi differenziale Pneumopatia cronica Asma bronchiale Cardiopatia Storia clinica di dispnea lunga lunga e ricorrente breve Storia di cardiopatia di solito assente di solito assente presente Modalità di insorgenza lenta e graduale periodica/acuta o subacuta acuta o subacuta Sudorazione modesta o assente modesta o assente presente Percussione torace iper-espanso/iperfonesi iper-espanso non iper-espanso Ascoltazione torace ronchi/sibili/gemití sibili espiratori/ronchi rantoli basali/ronchi Cianosi presente/marcata modesta assente Impegno muscoli respiratori presente marcato modesto Radiografia torace rinforzo trama polmonare enfisema edema interstiziale/ alveolare Efficacia broncodilatatori si si no Efficacia diuretici possibile no si Boccanelli A, et al. (2001) Sensibilità e specificità dei sintomi e dei segni fisici per la diagnosi di scompenso cardiaco Sensibilità (%) Specificità (%) Valore predittivo positivo* (%) Sintomi Dispnea Ortopnea Dispnea parossistica notturna Anamnesi di edema 66 21 33 23 52 81 76 80 23 2 26 22 7 13 10 31 10 99 91 93 95 97 6 27 3 61 2 Segni FC a riposo > 100/min Stasi polmonare Edemi Terzo tono Turgore giugulare *proporzione di pazienti in cui è stata posta correttamente la diagnosi di scompenso cardiaco Marantz PR, et al. (1988) Classificazione dello scompenso secondo la New York Heart Association (NYHA) Classe I Pazienti con cardiopatia ma senza limitazione dell’attività fisica. L’attività fisica ordinaria non causa affaticamento, dispnea, palpitazioni o dolori anginosi. Classe II Pazienti con cardiopatia condizionante una lieve limitazione dell’attività fisica. Asintomatici a riposo. L’attività fisica ordinaria provoca affaticamento, palpitazioni, dispnea o dolori anginosi. Classe III Pazienti con limitazione marcata dell’attività fisica. Asintomatici a riposo. Un’attività fisica minore dell’ordinaria provoca affaticamento, palpitazioni, dispnea o dolori anginosi. Classe IV Pazienti con cardiopatia condizionante un’incapacità a svolgere qualsiasi attività fisica senza sintomi. I sintomi di scompenso cardiaco o di sindrome anginosa possono essere presenti anche a riposo. Se viene intrapresa qualsiasi tipo di attività fisica aumentano i sintomi. Progressione dello scompenso cardiaco Classe NYHA Disfunzione ventricolare Scompenso cardiaco manifesto I Prevenzione Lieve II Moderato III Grave Terapia IV Scompenso cardiaco: indagini strumentali Indagini di terzo livello Tomografia computerizzata del cuore Risonanza magnetica del cuore Tomografia ad emissione di positroni Indagini di secondo livello Test da sforzo cardiopolmonare Cateterismo cardiaco e angiografia Biopsia endomiocardica Studio elettrofisiologico endocavitario ECG dinamico (Holter) Metodiche scintigrafiche Prove di funzionalità respiratoria Indagini di primo livello Elettrocardiogramma Rx torace Ecocardiografia Indici bioumorali e neurormonali Criteri di Boston per la diagnosi di scompenso cardiaco Categoria I: Anamnesi Dispnea a riposo Ortopnea Dispnea parossistica notturna Dispnea durante cammino in pianura alla velocità abituale Dispnea durante cammino in salita o attività fisica moderata Punteggio 4 4 3 2 1 Categoria II: Esame obiettivo Anomalie della frequenza cardiaca 1-2 se FC compresa tra 91 e 110 bpm (1 punto) se FC> 110 bpm (2 punti) Aumento della pressione venosa giugulare 2-3 se > 6 cm H20 (2 punti) se > 6 cm H20 più epatomegalia o edema agli arti inferiori (3 punti) Rantoli polmonari 1-2 se basali (1 punto) se estesi ai campi polmonari medi (2 punti) Broncospasmo 3 Terzo tono cardiaco 3 Categoria IIl: Radiografia del torace Edema polmonare alveolare Edema polmonare interstiziale Versamento pleurico bilaterale Rapporto cardiotoracico > = 0,50 (in proiezione posteroanteriore) Redistribuzione del flusso agli apici 4 3 3 3 2 Diagnosi di scompenso cardiaco: Punteggio: da 8 a 12 = definita da 5 a 7 = possibile ≤ 4 = improbabile Remes J, et al. (1992) Marker biochimici delle malattie d’organo Insufficienza renale creatinina Epatopatie enzimi epatici Necrosi miocardica troponine Scompenso cardiaco ? Peptidi natriuretici come marker dello scompenso cardiaco cronico Peptidi natriuretici ANP BNP Peptide natriuretico atriale Peptide natriuretico cerebrale ANP BNP Cuore normale ANP BNP Cuore scompensato Peptidi natriuretici: NT-proBNP propeptide Campioni di siero o plasma Volume richiesto 20 ml Peptide biologicamente attivo N-terminale (NT) propeptide Tempo valutazione 18 min NH2 1 98 ponte disulfidrilico COOH 126 BNP NT-proBNP Vantaggi del NT-proBNP: - Lunga emivita - Elevata stabilità Elecsys-proBNP NT-proBNP nello scompenso cardiaco NT-proBNP (mediana) (pmol/l) 1028 1000 800 600 340 400 217 200 0 n = 408 FE < 45% n = 16 controlli 101 12 Controlli I II III IV Classe NYHA Haass M, et al. (2001); Zugck C, et al. (2002) Prognosi dello scompenso cardiaco Hillingdon (n = 220) Framingham Donne (n = 321) Framingham Uomini (n = 331) 100 90 % 80 50% Sopravvivenza 70 60 50 40 0 1 3 Mesi 6 12 24 Eziologia e prognosi Sopravvivenza (%) 100 80 60 40 20 0 0 6 12 18 24 30 36 Sopravvivenza cumulativa (%) Durata del QRS e prognosi 100 QRS Durata (msec) < 90 90 90-120 80 120-170 170-220 70 > 220 60 0 120 240 360 Giorni del trial Gottpaky VK, et al. (1999) Noradrenalina plasmatica (PNE) e prognosi Mortalità cumulativa (%) 100 80 PNE >900 pg/ml 60 PNE 600–900 pg/ml 40 PNE <600 pg/ml 20 Due anni Totale p < 0,0001 p < 0,0001 0 0 6 12 18 24 30 36 42 48 54 60 Mesi Francis GS . (1993) Aldosterone e prognosi p < 0,0 02 Mortalità a 6 mesi (%) 60 p< 0,0 5 Placebo 50 Enalapril 40 30 20 10 0 Sotto la mediana Sopra la mediana Concentrazione aldosterone The CONSENSUS Trial Study Group. (1990) NT-BNP e prognosi Northern Glasgow MONICA: mortalità per tutte le cause dopo 4 anni 4,6 Log NT-BNP (95% CI) 4,4 4,2 4,0 3,8 3,6 p < 0,0001 ANOVA 3,4 3,2 3,0 2,8 Vivi Morti NT-BNP (mediana) (pg/ml) Vivi 22 (13,41) Morti 62 (31,119) p < 0,0001 Dargie HJ. (2002) NT-BNP e prognosi Sopravvivenza cumulativa (%) Northern Glasgow MONICA NT-BNP < 86 pg/ml 1,0 p < 0,00001 0,9 NT-BNP > 86 pg/ml 0,8 0 400 800 1.200 1.600 Tempo (giorni) Dargie HJ. (2002) Scompenso cardiaco cronico: predittori di mortalità ad 1 anno (8102 pazienti) Precedenti ricoveri per scompenso Età Pressione sistolica Tachicardia ventricolare Terzo tono Frequenza cardiaca Rischio relativo Intervallo di confidenza (95%) p< Classe NYHA III-IV 2,014 1,667-2,432 0,0001 1,733 1,410-2,129 0,0001 1,022 1,013-1,031 0,0001 0,985 0,980-0-989 0,0001 1,939 1,363-2,758 0,002 1,330 1,102-1,606 0,003 1,008 1,002-1,014 0,01 Scompenso cardiaco cronico: predittori di morbilità ad 1 anno (8102 pazienti) Rischio relativo Ricoveri per scompenso nell’anno precedente 1,774 Classe NYHA III-IV 1,667 Eziologia ischemica 1,427 Pressione sistolica 0,994 Frequenza cardiaca 1,007 Creatinina sierica > 2,5 mg/dl 2,370 Frazione d’eiezione < 30% 1,295 Intervallo di confidenza (95%) p< 1,486-2,119 0,0001 1,390-2,000 0,0001 1,190-1,702 0,0001 0,990-0,998 0,006 1,002-1,013 0,01 1,230-4,566 0,01 1,040-1,614 0,03 Boccanelli A, Mureddu GF. (2002) Obiettivi generali della terapia dello scompenso cardiaco Prevenire l’insorgenza e la progressione Eliminare la causa Migliorare i sintomi e la qualità di vita Migliorare la sopravvivenza Gavazzi A. (2002) I farmaci per lo scompenso cardiaco - Diuretici - ACE-inibitori - Beta-bloccanti - Glicosidi digitalici - Antagonisti recettoriali dell’angiotensina - Vasodilatatori - Agenti dopaminergici - Agenti beta-agonisti - Inibitori della fosfodiesterasi - Altri inotropi - Antiaritmici - Anticoagulanti e antiaggreganti Gavazzi A. (2002) Obiettivi specifici della terapia dello scompenso cardiaco Controllo volume Diuretici Rallentare la progressione della malattia b bloccanti ACE inibitori Digitale Trattare i sintomi residui Packer M. (2002) Sedi tubulari di azione dei diuretici Glomerulo Aldosterone-sensibile Tiazidici Metolazone Acetazolamide Corteccia Tubulo contorto prossimale Furosemide Acido etacrinico Bumetanide Torasemide Midollare esterna Midollare interna Spironolattone Triamterene Amiloride Dotto collettore Ansa di Henle Abraham WT, et al. (1994) Importanza dei diuretici nello scompenso cardiaco Effetti benefici della terapia con diuretici: Volume telediastolico (precarico) Resistenze vascolari periferiche Gittata cardiaca / stroke volume Sintomi congestizi Capacità all’esercizio Sono di aiuto nella fase di inizio e di titolazione degli ACE inibitori, b-bloccanti, vasodilatatori Diuretici dell’ansa Azione Som. Inizio Picco Durata Dosaggio Effetti collaterali Ac. etacrinico EV OS 5’ 30’ 15-30’ 2h 2h 6-8 h 50-100 mg 25-100 mg Ipokaliemia Ipomagniesemia Bumetanide EV OS 5’ 0,5-1 h 30-45’ 1-2 h 2h 4-6 h 0.5-1 mg (max 10 mg) 0.5-2 mg (max 10 mg) Iponatriemia Ipocalcemia Furosemide EV OS 5’ 30’ 30’ 1-2 h 2h 6h 20-120 mg (max 1 g) 20-160 mg (max 500 mg) Iperuricemia Ipokaliemia Intolleranza al glucosio Torasemide EV OS 5’ 30’ 1h 1h 6h 8-12 h 10-200 mg 10-40 mg Alcalosi ipocloremica Durata d’azione dei diuretici dell’ansa nei soggetti sani Bumetanide 2 ore Furosemide 2-2,5 ore Piretanide 2-2,5 ore Torasemide 6 ore 2 4 Durata (ore) 6 Brater DC. (1991) Durata d’azione della torasemide e della furosemide in pazienti con edema Torasemide 10-20 mg (n = 12) Furosemide 40 mg (n = 6) 5 10 12 Durata (ore) Herchuelz A, et al. (1988) Biodisponibilità della torasemide vs furosemide % Torasemide 100 80 Prodotti furosemide 60 40 20 0 Murray MD, et al. (1997) 3 Con cibo Senza cibo 2,5 2 1,5 1 0,5 0 0 4 8 Tempo (h) Kramer WG (1995) 12 Concentrazione plasmatica furosemide (mg/L) Effetto del cibo sulle concentrazioni plasmatiche della torasemide e della furosemide 3 Con cibo Senza cibo 2,5 2 1,5 1 0,5 0 0 4 8 Tempo (h) McCrindle YL, et al. (1996) 12 Studio TORIC: risultati sulla mortalità RR=51,5% * Tasso di mortalità (%) 5 Torasemide RR=59,7% * Furosemide 4 3 RR=65,8% RR=55,1% 2 RR=23,0% 1 0 Mortalità totale * p < 0,05 Mortalità cardiaca Mortalità per morte improvvisa Mortalità Mortalità per morte non cardiaca non improvvisa Diuretici tiazidici Azione Som. Inizio Picco Durata Dosaggio OS 2h 2-6 h 24-72 h 50-100 mg (max 200 mg) Ipokaliemia Idroclorotiazide OS 2h 4-6 h 6-12 he 25-50 mg (max 200 mg) Iponatriemia Ipokaliemia Clortalidone Effetti collaterali Indapamide OS 1-2 h 2h 36 h 2.5-5 mg (max 5 mg) Ipercalcemia Metolazone OS 1h 2h 12-24 h 5-10 mg (max 20 mg) Iperuricemia Intolleranza glucosio Alcalosi ipocloremica Ipercolesterolemia Gavazzi A. (2002) Diuretici risparmiatori K+ Azione Som. Inizio Picco Durata Dosaggio Amiloride OS 2h 3-4 h 24 h 5-10 mg (max 40 mg) Canrenoato OS 20’ 4h 2-3 giorni 25-100 mg (max 200 mg) Iponatriemia Spironolattone OS 1-2 h 2-5 h 2-3 giorni 25-100 mg (max 200 mg) Ginecomastia Triamterene OS 24 h 2-4 h 7-9 h 100-200 mg Effetti collaterali Iperkaliemia Irsutismo Acidosi metabolica ipercloremica Inibitori anidrasi carbonica Azione Acetazolamide Som. Inizio Picco Durata Dosaggio EV PO 2’ 1h 15’ 2-3 h 4-5 h 24 h 250-2000 mg 250-375 mg Effetti collaterali Acidosi metabolica ipercloremica Iperglicemia Gavazzi A. (2002) Escape dell’aldosterone 180 30 25 Angiotensina II 140 20 120 100 15 80 10 60 40 5 Aldosterone Aldosterone (pg/ml) Angiotensina II (pg/ml) 160 20 0 0 0 Captopril (mg/24 h) 200 1 2 3 mesi 6 9 200 400 400 500 600 12 600 Staessen JJ. (1981) Studio RALES Probabilità di sopravvivenza 1,00 0,90 0,80 0,70 Spironolattone 0,60 Placebo 0,50 0,40 0 3 6 9 12 15 18 21 24 27 30 33 36 Mesi Pitt B, et al. (1999) Modulazione della terapia diuretica Grado di ritenzione idrosalina Lieve • Diuretici tiazidici o dell’ansa a basso dosaggio • Riduzione moderata dell’apporto sodico (2-3 grammi di sodio/die) • Associazione con ACE-inibitore Moderata • Diuretici dell’ansa • Riduzione moderata dell’apporto sodico • Associazione con ACE-inibitore Severa • Diuretici dell’ansa a dose maggiore • Associazione diuretico dell’ansa - tiazidico • Restrizione moderata dell’apporto sodico • Associazione con ACE-inibitore, se non espressamente controindicata Refrattaria • Diuretici dell’ansa per via endovenosa (intermittenti o continui) • Terapia multifarmacologica • Terapia inotropa positiva • Ultrafiltrazione o dialisi Gavazzi A. (2002) I grandi trial con farmaci ACE-inibitori nello scompenso cardiaco NYHA (I-IV) FE (%) FUP Ricoveri SC (mesi) (RR,%) Mista IV nv 6 2569 Mista II-III 35 SOLVD-P (1992) Enalapril 4228 Mista I-II SAVE (1992) Captopril 2231 Ischemica AIRE (1993) Ramipril 2006 TRACE (1995) Trandolapril SMILE (1995) Zofenopril Trial (anno) Farmaco Paz. (n°) Eziologia CONSENSUS (1987) Enalapril 253 SOLVD-T (1991) Enalapril Legenda: Morti TOT (RR,%) Morti SC (RR,%) Morti IMP (RR,%) nv 27 p=0.003 50 p<0.001 — p=NS 41 26 p<0.0001 16 p=0.0036 22 p=0.0045 10 p=NS 35 37 44 p<0.001 8 p=NS 21 p=NS 7 p=NS I 40 42 22 p=0.019 19 p=0.019 36 p=0.032 — p=NS Ischemica II-III nv 15 nv 27 p=0.002 nv nv 1749 Ischemica I-IV 35 24 nv 22 p=0.001 25 p=NS 24 p=0.03 1556 Ischemica I-IV nv 12 nv 29 p=0.011 nv nv FE: frazione eiezione ventricolo sinistro; FUP: follow up medio; IMP: improvvise; nv: non valutato; NYHA: New York Heart Association; Paz.: pazienti; RR: rischio relativo; SC: scompenso cardiaco; TOT: totali; : diminuzione; — : invariato Sinagra G, et al. (2001) Studio CONSENSUS Mortalità (%) 80 70 60 Placebo 50 40 30 Enalapril 20 10 p = 0,002 0 0 2 4 6 Mesi 8 10 12 The CONSENSUS Trial Study Group. (1987) Gli studi SOLVD Trattamento Prevenzione Mortalità (%) Morte o ospedalizzazione per SC (%) 50 35 30 40 25 Placebo 30 Placebo 20 20 Enalapril 15 Enalapril 10 10 5 p = 0,0036 0 p = 0,001 0 0 6 12 18 24 30 Mesi 36 42 48 0 6 12 18 24 30 36 42 48 Mesi The SOLVD Investigators. (1991 e 1992) SOLVD prevention trial Pazienti asintomatici con disfunzione VS Sviluppo scompenso cardiaco (%) 25 20 Placebo (n=2117) Riduzione del rischio –32% 15 10 p < 0,001 vs placebo 5 Enalapril (n=2111) EF 0,35 NYHA class I–II 0 0 6 12 18 24 30 36 42 48 54 Mesi The SOLVD Investigators. (1992) Studio SAVE Morte per cause cardiovascolari (frequenza eventi) 0,3 Riduzione del rischio 0,2 Placebo –21% Captopril 0,1 p = 0,014 0 0 1 2 Anni 3 4 Pfeffer MA, et al. (1992) Studio AIRE Mortalità complessiva (%) 35 30 Placebo 25 Ramipril 20 15 10 Rischio relativo 0,73 (IC al 95% da 0,60 a 0,98) p = 0,002 5 0 0 6 12 18 24 30 Mesi The Acute Infarction Ramipril Efficacy Study Investigators. (1993) Studio AIREX Sopravvivenza cumulativa (%) 100 90 Ramipril 80 70 Placebo 60 p = 0,002 0 0 2 3 4 1 Tempo trascorso dalla randomizzazione (anni) 5 Halli As, et al. (1997) Studio V-HeFTII Mortalità cumulativa 0,75 0,50 Enalapril 0,25 Idralazina-isosorbide dinitrato p = 0,016 0 0 6 12 18 24 30 Mesi 36 42 48 54 60 Cohn JN, et al. (1991) Studio ATLAS Sopravvivenza (%) 100 90 80 70 60 50 Lisinopril bassa dose 40 30 Lisinopril alta dose 20 10 p = 0,002 0 0 6 12 18 24 30 36 42 48 Morte/ospedalizzazione (mesi) 54 60 Packer M, et al. (1999) Dosaggio dei farmaci ACE-inibitori nello scompenso cardiaco Farmaco Dose iniziale (mg/die) Dose “target” (mg/die) Captopril 6,25 x 3 25-50 x 3 Enalapril 2,5 x 1 10 x 2 Ramipril 1,25-2,5 x 1 2,5-5,0 x 2 Lisinopril 2,5 x 1 5-20 x 1 Quinapril 2,5-5,0 x 1 5-10 x 2 2x1 4x1 Perindopril Sinagra GF, et al. (2001) Controindicazioni assolute all’impiego degli ACE-inibitori - Stenosi bilaterale dell’arteria renale - Insufficienza renale grave - Gravidanza - Neutropenia persistente Gavazzi A. (2002) Studio Val-HeFT Mortalità-morbilità-ospedalizzazione (%) 100 95 90 Valsartan 85 80 Placebo 75 70 65 60 p = 0,009 55 0 3 6 9 18 15 12 Mesi dalla randomizzazione 21 24 27 Cohn JN, et al. (2001) Studio ELITE Probabilità di sopravvivenza 1,00 Losartan 0,95 Captopril 0,90 0,85 0,80 0,75 0 100 200 Follow-up (giorni) 300 400 Pitt B, et al. (1997) I grandi “trial” con farmaci beta-bloccanti nello scompenso cardiaco Trial (anno) Farmaco Paz. (n°) Eziologia NYHA (I-IV) FE (%) FUP (mesi) MDC (1993) Metoprololo 383 Idiopatica II-III 40 12-18 CIBIS-I (1994) Bisoprololo 641 Mista III 35 23 ANZ TRIAL (1995) Carvedilolo 415 Ischemica I-III 45 19 US TRIAL (1996) Carvedilolo 1094 Mista II-III 35 6 CIBIS-II (1999) Bisoprololo 2647 Mista III 35 16 MERIT-HF (1999) Metoprololo 3991 Mista II-III 40 12 COPERNICUS (2000) Carvedilolo 2289 Mista III-IV < 25 21 CAPRICORN (2001) Carvedilolo 1959 Ischemica (*) I-II 40 16 Ricoveri (RR,%) Morti TOT (RR,%) Morti SC (RR,%) Morti IMP (RR,%) 39 (†) 34 (#) — — p<0.04 p=0.058 p=NS p=NS 34 (‡) 20 — p<0.01 p=NS p=NS p=NS 23 (§) 24 — — p=0.05 p=NS p=NS p=NS 27 (†) 65 p<0.0036 p<0.001 20 (§) 34 26 44 p=0.0006 p<0.0001 p=NS p=0.0011 nv 35 49 41 p<0.0001 p=0.0023 p=0.0002 nv nv 24 (§+) 35 p<0.001 p=0.00014 14 (‡) 23 40 26 p=NS p=0.031 p=NS p=NS Legenda: FE: frazione eiezione ventricolo sinistro; FUP: follow up medio; IMP: improvvise; nv: non valutato; NYHA: New York Heart Association; Paz.: pazienti; RR: rischio relativo; SC: scompenso cardiaco; TOT: totali; (*): 3-21 giorni post-IMA; (†): per cause cardiovascolari; (‡): per scompenso cardiaco; (§): totali; (§+): totali+morti totali; (#): morti totali più trapianti cardiaci; : diminuzione; — : invariato. Sinagra GF, et al. (2001) MERIT-HF Mortalità % 20 Placebo 15 Metoprololo CR/XL 10 5 p = 0,0062 Riduzione del rischio = 34% 0 0 3 6 9 12 15 18 21 Follow-up (mesi) The MERIT-HF Study Group (1999) ANZ Trial Sopravvivenza 1,0 0,8 Carvedilolo (n=104) 0,6 0,4 Placebo (n=131) 0,2 0 12 6 18 Tempo (mesi) Australia/New Zealand Heart Failure Research Collaborative Group. (1997) US Carvedilol Heart Failure Study Mortalità Carvedilolo 1,0 (n=696) 0,9 Morte o ospedalizzazione per cause cardiovascolari 1,0 p < 0,001 0,9 Placebo 0,8 (n=398) (n=696) 0,8 0,7 0,7 0,6 0,6 Riduzione del rischio = 65% 0,5 Carvedilolo Placebo (n=398) p < 0,001 Riduzione del rischio = 38% 0,5 0 50 100 150 200 250 300 350 400 Giorni 0 50 100 200 250 300 350 400 Giorni Packer M, et al. (1996) CIBIS-II Sopravvivenza 1,0 Bisoprololo 0,8 p < 0,0001 Placebo 0,6 Riduzione del rischio = 34% 0 0 200 400 600 Tempo dopo l’inclusione (giorni) 800 CIBIS II Investigators and Committees. (1999) COPERNICUS Study 100 % sopravvivenza 90 80 Carvedilolo 70 p = 0,00013 Riduzione del rischio = 35% 60 0 0 4 8 12 16 20 Placebo 24 28 Mesi Packer M, et al. (2001) CAPRICORN Study Percentuale libera da eventi Morte da ogni causa e da infarto 1,00 0,95 0,9 Carvedilolo 0,85 0,8 Riduzione RR = 23% 0,75 Placebo p = 0,03 0,7 0 0,5 1 1,5 2 2,5 Anni The CAPRICORN Investigators. (2001) CAPRICORN Study Percentuale libera da eventi Morte improvvisa 1,00 0,98 0,96 Carvedilolo 0,94 0,92 Riduzione RR = 26% 0,90 Placebo p = 0,098 0,88 0 0,5 1 1,5 2 2,5 Anni The CAPRICORN Investigators. (2001) Variazione della FE in rapporto alla eziologia della cardiomiopatia LVEF (unità EF) 15 Ischemici 10 Non ischemici 5 0 Placebo 6,25 mg 12,5 mg 25 mg Carvedilolo (bid) Packer M. (2000) CARMEN Study: LVESVI dopo i differenti trattamenti LVESVI (biplane) [ml/m2] 0 Enalapril –1 ns –2 p < 0,002 Carvedilolo –3 –4 –5 C&E –6 –7 Basale 6 mesi 12 mesi LVESVI = indice volume telesistolico Vsx 18 mesi Ryden LE. (2002) Scompenso cardiaco: effetti sulla performance cardiaca del trattamento prolungato con carvedilolo o metoprololo 18 Variazione frazione eiezione VS (%) * Variazione pressione incun. polmonare (mmHg) Metoprololo (n = 75) 12 Carvedilolo (n = 75) 6 p = 0,002 0 –5 p < 0,05 –10 –15 –20 * Metra M, et al. (2000) Dosaggio dei farmaci beta-bloccanti nello scompenso cardiaco Dose iniziale (mg/die) Dose “target” (mg/die) Metoprololo 5 100-150 Bisoprololo 1,25 10 Carvedilolo 6,25 50 - 100* Farmaco *25 mg x 2 nei pazienti con peso < = 85 kg 50 mg x 2 nei pazienti con peso > 85 kg Peggioramento clinico Miglioramento clinico Effetti dei beta-bloccanti nel tempo 0 1–2 3–4 5–6 7–8 9–10 11–12 Mesi Packer M. (1998) Perché inizialmente i beta bloccanti possono peggiorare lo scompenso? b -blocco Gittata cardiaca Flusso renale Peggioramento dello scompenso Ritenzione di sodio Packer M. (1998) Un alfa-blocco può contrastare gli effetti negativi dei beta-bloccanti b-blocco Gittata cardiaca Flusso renale a-blocco Peggioramento dello scompenso a-blocco Ritenzione di sodio Packer M. (1998) Effetti farmacologici di alcuni beta-bloccanti Attivazione simpatica b1-recettori b2-recettori a1-recettori Bisoprololo Metoprololo Propranololo Carvedilolo CARDIOTOSSICITA’ Packer M. (2002) Controindicazioni assolute all’impiego dei beta-bloccanti - Broncospasmo - Arteriopatia periferica di grado severo - Bradicardia sintomatica - Blocco AV di II e III grado Studio BRING-UP: trattamento con b-bloccanti Basale n=3.091 Già in trattamento con b-bloccante Hanno iniziato il b-bloccante alla visita basale Non hanno iniziato il b-bloccante alla visita basale n=771 (24,9%) n=865 (28,0%) n=1.455 (47,1%) Dei quali hanno iniziato il b-bloccante durante il follow-up n=1.011 (32,7%) n=146 (4,7%) Dopo 1 anno di follow-up 2.636 pazienti vivi n=1.309 (49,7%) In trattamento b-bloccante n=1.307 (49,6%) Non in trattamento b-bloccante n=20 (0,7%) Non noti Maggioni AP, et al. (2003) Studio BRING-UP: trattamento con b-bloccanti (n = 3.091) Già in trattamento b-bloccante n = 771 (24,9%) Hanno iniziato b-bloccante al basale n = 865 (28,0%) Carvedilolo 562 (73%) Bisoprololo 8 (1%) Metoprololo 139 (18%) Altri 62 (8%) Carvedilolo 732 (85%) Bisoprololo 17 (2%) Metoprololo 116 (13%) Maggioni AP, et al. (2003) Studio BRING-UP: dosaggio giornaliero del carvedilolo (mg) Dose 40 media (mg) 33,5 34,0 6 mesi 12 mesi 30,7 30 23,9 20 10 0 8,5 Basale 1 mese 3 mesi Maggioni AP, et al. (2003) Studio BRING-UP: caratteristiche cliniche Età 70 anni NYHA III-IV Eziologia ischemica Fibrillazione atriale FE < 30% Uso ACE inibitori BB = b-bloccanti Già in terapia BB n = 771 (%) Iniziata terapia BB n = 865 (%) Non iniziata terapia BB n = 1.455 (%) 24 26 38 14 30 85 25 29 39 17 30 85 43 42 42 21 35 86 p 0,001 0,001 0,001 0,001 0,017 ns Maggioni AP, et al. (2003) Studio BRING-UP: motivi del mancato inizio del trattamento con b-bloccanti (n = 1.455) Controindicazioni: 540 (37,1%) (Grave BPCO, PVD, ipotensione, uso inotropi, bradicardia, blocco AV) Indicazioni incerte: 392 (26,9%) (Anziani, LVD asintomatica, NYHA IV) Motivi logistici 149 (10,2%) Altri motivi 470 (32,3%) Maggioni AP, et al. (2003) Studio BRING-UP: motivi dell’abbandono permanente della terapia con b-bloccanti (23,6%) Motivi (%) Peggioramento scompenso cardiaco 8,4 Ipotensione 3,1 Decisione del paziente 2,9 Peggioramento BPCO 1,9 Bradicardia, blocco AV 1,8 Altri 5,5 Maggioni AP, et al. (2003) Studio BRING-UP: mortalità a 12 mesi (341/2.843 = 12,0%) 17,1% Totale decessi a 12 mesi Morte improvvisa 11,8% 8,1% 7,6% 7,1% 3,2% Già in terapia b-bloccante 3,8% Hanno iniziato terapia b-bloccante Non hanno iniziato terapia b-bloccante 5,0% Totale Maggioni AP, et al. (2003) Effetti farmacodinamici della digitale Effetti emodinamici Aumento inotropismo cardiaco: aumento della gittata sistolica aumento della frazione di eiezione aumento della portata cardiaca riduzione delle pressioni di riempimento Effetti elettrofisiologici Effetto vagomimetico sul nodo del seno e sul nodo AV Effetti neuroormonali Aumento della sensibilità barorecettoriale Riduzione del tono adrenergico Riduzione delle concentrazioni plasmatiche di noradrenalina Morte-ospedalizzazione per aggravamento dello scompenso (%) Studio DIG 50 40 Placebo 30 Digossina 20 10 p < 0,001 0 0 4 8 12 16 20 24 28 Mesi 32 36 40 44 48 52 The Digitalis Investigation Group. (1997) Dosi giornaliere di digossina secondo lo studio DIG Clearance corretta della creatinina (ml/min/70 kg) 10 20 30 40 50 60 70 80 90 100 Peso corporeo (kg) 50 0,125 0,125 0,125 0,125 0,125 0,250 0,250 0,250 0,250 0,250 60 0,125 0,125 0,125 0,250 0,250 0,250 0,250 0,250 0,250 0,250 70 0,125 0,125 0,125 0,250 0,250 0,250 0,250 0,250 0,250 0,250 80 0,125 0,250 0,250 0,250 0,250 0,250 0,250 0,250 0,250 0,375 90 0,250 0,250 0,250 0,250 0,250 0,250 0,250 0,375 0,375 0,375 100 0,250 0,250 0,250 0,250 0,250 0,375 0,375 0,375 0,500 0,500 La clearance corretta della creatinina viene calcolata come 140 – (età: creatininemia sierica in mg per decilitro) per i maschi, e come 140 – (età: creatininemia sierica per decilitro) x 0,85 per le femmine Digitalis Investigation Group. (1997) Intossicazione digitalica Effetti tossici cardiaci Disturbi del ritmo: battiti ectopici ventricolari, blocco AV I grado, bradicardia sinusale, ecc. Effetti tossici psichiatrici Delirio, affaticamento, malessere, stato confusionale, vertigini, incubi Effetti tossici visivi Disturbi della visione dei colori, aloni Effetti tossici respiratori Aumento della risposta ventilatoria all’ipossia Linee guida ESC per il trattamento dello scompenso cardiaco: livelli di evidenza Livello A: almeno 2 trial randomizzati che supportano la raccomandazione Livello B: almeno 1 trial randomizzato o metanalisi che supporti la raccomandazione Livello C: opinione consensuale di esperti basata su studi clinici e su esperienza clinica ESC Task Force. (2001) ACE-inibitori: linee guida ESC Gli ACE-inibitori sono raccomandati come terapia iniziale nei pazienti con ridotta funzione sistolica del ventricolo sinistro (FE < 40-45%) (Livello A) In assenza di ritenzione di liquidi l’ ACE-inibitore dovrebbe essere somministrato come primo farmaco, in presenza di ritenzione di liquidi congiuntamente ad un diuretico (Livello B) Gli ACE-inibitori dovrebbero essere up-titolati fino a raggiungere le dosi che sono risultate efficaci nei grandi trial Essi non dovrebbero essere titolati sulla base del miglioramento dei sintomi ESC Task Force. (2001) Raccomandazioni per l’inizio della terapia con ACE-inibitori Rivedere il dosaggio dei diuretici Evitare un’eccessiva diuresi prima di iniziare il trattamento Iniziare con un basso dosaggio e raggiungere la dose di mantenimento Se la funzione renale si deteriora in modo evidente, sospendere il trattamento ESC Task Force. (2001) b-bloccanti: linee guida ESC I b-bloccanti sono raccomandati in tutti i pazienti con scompenso cardiaco lieve, moderato e grave, di origine ischemica e non ischemica … in trattamento standard con ACE-inibitori e diuretici (Livello A) I b-bloccanti sono raccomandati nei pazienti con disfunzione ventricolare sinistra post-infartuale con/senza scompenso cardiaco per migliorarne la sopravvivenza (Livello B) ESC Task Force. (2001) Spironolattone: linee guida ESC Gli antialdosteronici sono raccomandati nello scompenso in fase avanzata (classe NYHA III e IV) in aggiunta agli ACE-inibitori per migliorare la sopravvivenza e la morbilità (Livello B) ESC Task Force. (2001) Gli antagonisti dei recettori dell’angiotensina II (ARBs): linee guida ESC Gli ARBs possono essere presi in considerazione nei pazienti che non tollerano gli ACE-inibitori (Livello C) Non è stato provato che essi siano efficaci come gli ACE-inibitori nel ridurre la mortalità (Livello B) Associati agli ACE-inibitori gli ARBs migliorano i sintomi e riducono le ospedalizzazioni per scompenso cardiaco (Livello B) L’associazione degli ARBs agli ACE-inibitori e ai b-bloccanti al presente non può essere raccomandata-necessità di ulteriori indagini (Livello C) ESC Task Force. (2001) Digitale: linee guida ESC I glicosidi cardiaci sono raccomandati nella fibrillazione atriale e nello scompenso cardiaco sintomatico per migliorare la funzione cardiaca e i sintomi (Livello B) L’associazione digitale e b-bloccante sembra essere superiore al singolo farmaco da solo (Livello C) In corso di ritmo sinusale la digossina può migliorare lo stato clinico in presenza di sintomi clinici persistenti di scompenso cardiaco da disfunzione sistolica del ventricolo sinistro (Livello B) ESC Task Force. (2001) Trattamento dello scompenso cardiaco Stadio A Stadio B ALTO RISCHIO DI SCOMPENSO CARDIACO. PRESENZA DI ALTERAZIONI CARDIACHE STRUTTURALI. Assenza di alterazioni strutturali cardiache. Assenza di sintomi di scompenso. TERAPIA Trattare l’ipertensione Astensione dal fumo Trattare l’iperlipidemia Favorire l’esercizio fisico Sconsigliare l’uso di alcol e di droghe ACE-inibitori nei pazienti con appropriate indicazioni Assenza di sintomi di scompenso. TERAPIA Tutte le misure dello stadio A ACE-inibitori nei pazienti con appropriate indicazioni Beta-bloccanti nei pazienti con appropriate indicazioni ACC/AHA Guidelines. (2002) Trattamento dello scompenso cardiaco Stadio C Stadio D Presenza di alterazioni strutturali cardiache note. SCOMPENSO CARDIACO REFRATTARIO. SINTOMI DI SCOMPENSO CARDIACO precedenti o in corso. TERAPIA Tutte le misure dello stadio A Farmaci di routine: – Diuretici – ACE-inibitori – Beta-bloccanti – Digitale Restrizione apporto di sale Necessità di interventi specialistici. TERAPIA Tutte le misure degli stadi A, B e C Supporti meccanici di assistenza Trapianto cardiaco Infusione EV continua (non intermittente) di inotropi a scopo palliativo Ospedalizzazione ACC/AHA Guidelines. (2002) I farmaci per lo scompenso cardiaco nella pratica clinica Inotropi positivi Integratori di potassio 14,0% 5,0% Altri 12,9% Beta-bloccanti 9,9% ACE-inibitori 19,4% Diuretici 38,8% Physician Drug & Diagnosis Audit. (2002) Definizione - Molti pazienti presentano sintomi e segni indicativi di scompenso cardiaco pur non avendo una compromissione della funzione contrattile: in questi casi la condizione patologica è sostenuta da una disfunzione diastolica - La disfunzione diastolica può precedere la disfunzione sistolica e costituire un marker precoce del danno ventricolare Aspetti demografici dell’insufficienza diastolica Caratteristiche LVEF 0,39 LVEF 0,40 - 0,49 LVEF 0,50 (n = 741) (n = 238) (n = 312) 75 61 60 26 12 43 32 75 70 52 23 14 49 33 Età (anni) Sesso femminile (%) Storia di insuff. cardiaca Cardiopatia ischemica Cardiopatia ipertensiva Ipertensione Diabete 74 47 66 39 8 43 37 Philbin EF, et al. (2000) Aspetti demografici dell’insufficienza diastolica 186 pazienti ospedalizzati per insufficienza cardiaca Disfunzione Disfunzione sistolica diastolica Variabile Età Maschi (%) FE (%) Precedente IM (%) Diabete (%) Ipertensione (%) NYHA III IV (n = 150) (n = 36) p 73 63 29 65 30 25 19 60 77 36 56 33 30 42 8 70 < 0,05 < 0,005 ns < 0,001 ns 0,05 ns Jaarsma T, et al. (1999) Effetti dell’età sulla prevalenza e sulla prognosi dell’insufficienza diastolica Età (anni) < 50 50-70 > 70 Prevalenza (%) 15 33 50 Mortalità (%) 15 33 50 Morbilità (%) 25 50 50 Zile e Brutsaert. (2002) Quali possono essere i pazienti con insufficienza diastolica ? Pazienti con ipertensione (25%) particolarmente con ipertrofia VS (90%) Pazienti con cardiopatia ischemica senza precedente infarto miocardico Pazienti con diabete particolarmente quelli con complicanze (neuropatia, nefropatia) Pattern della disfunzione diastolica Normale Alterato rilasciamento Flusso mitralico Flusso vene polmonari Pseudonormale Restrittivo Criteri per la diagnosi di scompenso cardiaco da disfunzione diastolica Devono essere simultaneamente presenti: Segni e sintomi di scompenso cardiaco Funzione sistolica del ventricolo sinistro normale o solo moderatamente alterata Alterato rilasciamento, alterato riempimento, alterata distensibilità o rigidità diastolica del ventricolo sinistro Insufficienza diastolica: principali obiettivi del trattamento - Ridurre o eliminare i fattori responsabili della disfunzione diastolica - Eliminare le conseguenze cliniche della disfunzione diastolica, in particolare la congestione venosa Studio SWEDIC: effetti di 6 mesi di terapia sui parametri diastolici Placebo Basale 6 mesi Rapporto E:A 0,71 Carvedilolo Basale 6 mesi Valore p 0,76 0,72 0,83 0,046 IVRT (ms) 106 99 101 100 0,53 DT (ms) 215 223 224 234 0,71 pv S/D 1,55 1,62 1,56 1,52 0,87 IVRT = Tempo di rilasciamento isovolumetrico; DT = Tempo di decelerazione pv S/D = Rapporto sisto/diastolico della velocità del flusso venoso polmonare Bergström A, et al. (2001)
Scarica