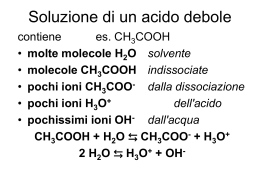
REAZIONI ACIDO-BASE Teoria Arrhenius (1887) “Acido è una specie chimica che in soluzione acquosa si dissocia per dare uno (monoprotico) o più (poliprotico) ioni idrogeno”. “Base è una specie chimica che in soluzione acquosa dà uno o più ioni ossidrile”. HNO3 NO3- + H+ NaOH Na+ + OH Teoria Brönsted-Lowry “Acido è un specie chimica in grado di donare uno ione idrogeno ad un’altra” – “Base è una specie chimica in grado di accettare uno ione idrogeno da un’altra”. Sistemi acido-base / coppie coniugate acido-base HNO3 + H2O H3O+ + NO3- Teoria Lewis (1923) “Acido è una specie chimica in grado di accettare una coppia di elettroni da un’altra” - “Base è una specie chimica in grado di donare una coppia di elettroni ad un’altra”. Mentre tutte le coppie acido-base secondo Brönsted-Lowry sono anche coppie acido-base secondo Lewis, non è vero il contrario. [Cu(H2O)6]2+ + NH3 [CuNH3(H2O)5]2+ + H2O HA + B BH+ + A- Keq = a(BH+) a(A-) / a(HA) a(B) a = attività o concentrazione attiva = f x c Se c 0 allora f 1 a = c f consente di operare su di una soluzione a concentrazione c NON IDEALE come se lo fosse Keq = [BH+] [A-] / [HA] [B] HA + H2O H3O+ + A- Keq = [H3O+] [A-] / [HA] [H2O] [H2O] Keq = Ka = [H3O+] [A-] / [HA] B + H2O BH+ + OH- Keq = [BH+] [OH-] / [B] [H2O] [H2O] Keq = Kb = [BH+] [OH-] / [B] HClO4 > HBr > H2SO4 > HCl SOSTANZE ANFIPROTICHE - AUTOPROTOLISI H2O + H2O H3O+ + OH- [H2O]2 Keq = Kw = [H3O+] [OH-] = 1 x 10-14 a 25 °C [H3O+] = [OH-] = 10-7 mol L-1 a 25 °C pH = - log [H+] = - log 10-7 = 7 soluzione neutra [H3O+] > 10-7 soluzione è acida e il pH < 7 [H3O+] < 10-7 soluzione è basica e il pH > 7 - log Kw = - log [H3O+] [OH-] pKw = - log [H3O+] - log [OH-] pKw = pH + pOH HA + H2O H3O+ + A- Ka = [H3O+] [A-] / [HA] A- + H2O HA + OH- Kb = [AH] [OH-] / [A-] Ka x Kb = ([H3O+] [A-] / [HA]) x ([AH] [OH-] / [A-]) Ka x Kb = Kw = [H3O+] [OH-] = costante a t° costante CALCOLO del pH per soluzioni acquose di ACIDI E BASI MONOPROTICI FORTI Se CHA > 10-6 allora [H+] = CHA Calcolare il pH di una soluzione 2.0 10-3 M di HCl [H3O+] = 2 10-3 pH = - log (2 10-3) = 3 –log 2 = 3-0,30 = 2,70 Calcolare il pH di una soluzione 10-8 M di HCl HA + H2O H3O+ + A- [H3O+] = [OH-] + [A-] EN H2O + H2O H3O+ + OH- [A-] = CHA BM Kw = [H3O+] [OH-] [A-] = CHA Kw / [H3O+] = [OH-] [H3O+]2 = CHA [H3O+] + Kw [H3O+] = Kw / [H3O+] + CHA [H3O+]2 - CHA [H3O+] – Kw = 0 ax2 + bx + c = 0 x = [-b ± (b2 – 4ac)1/2] / 2a x2 - 10-8 x - 10-14 = 0 pH = 6,98 Calcolare il pH di una soluzione 10-8 M di NaOH B + H2O H2O + H2O [OH-] = [H3O+] + [BH+] EN BH+ + OH- [BH+] = CB BM H3O+ + OH- Kw = [H3O+] [OH-] [BH+] = CB Kw / [H3O+] = [OH-] Kw = [H3O+]2 + CB [H3O+] Kw / [H3O+] = [H3O+] + CB [H3O+]2 + CB [H3O+] – Kw = 0 x2 + 10-8 x - 10-14 = 0 pH = 7,02 TITOLAZIONE ACIDO FORTE con BASE FORTE Equivalenti titolante = Equivalenti analita nel campione 50,00 mL HCl 1M titolati con NaOH 1M Prima che inizi la titolazione [H3O+] = 1 pH = 0 Dopo l’aggiunta di 10,00mL [H3O+] = (50x1)–(10x1)/60 = 40/60 = 0,666 = 6,66 10-1 pH = 1-log 6,66 = 0,177 = 0,18 Dopo l’aggiunta di 20,00mL [H3O+] = (50x1)–(20x1)/70 = 30/70 = 0,4286 = 4,29 10-1 pH = 1-log 4,29 = 0,37 Dopo l’aggiunta di 30,00mL [H3O+] = (50x1)–(30x1)/80 = 20/80 = 0,25 = 2,50 10-1 pH = 1-log 2,50 = 0,6 Dopo l’aggiunta di 40,00mL [H3O+] = (50x1)–(40x1)/90 = 10/90 = 0,111 = 1,11 10-1 pH = 1-log 1,11 = 0,955 Dopo l’aggiunta di 49,90mL [H3O+] = (50x1)–(49,9x1)/99,9 = 0,1/99,9 = 1 10-3 pH = 3 Al punto equivalente NaCl [H3O+] = [OH-] = 10-7 pH = 7 Dopo il p.e. 0,10 mL di NaOH in eccesso [OH-] = (0,1x1)/100,1 = 1 10-3 pOH = 3 pH = 11 Prima punto equivalente [H3O+] = [(VxN)A–(VxN)B]/Vtot Al punto equivalente [H3O+] = [OH-] soluzione del sale Dopo il punto equivalente [OH-] = (VxN)B in eccesso /Vtot CALCOLO del pH per soluzioni acquose di ACIDI E BASI MONOPROTICI DEBOLI HA + H2O H3O+ + A- [H3O+] = [OH-] + [A-] EN H2O + H2O H3O+ + OH- [A-] + [HA] = CHA BM Kw = [H3O+] [OH-] [HA] = CHA – [A-] Ka = [H3O+] [A-] / [HA] [A-] = [H3O+] – [OH-] [OH-] = Kw / [H3O+] Ka = [H3O+] [A-] / [HA] Ka = [H3O+] ([H3O+] - Kw/[H3O+]) CHA - [H3O+] + Kw/[H3O+] Se [H3O+] = x Ka = x (x - Kw/x) CHA - x + Kw/x X3 + Ka X2 – (Kw+CHAKa) X - KaKw = 0 1° approssimazione HA è comunque un acido quindi [H3O+] >>> [OH-] [H3O+] = [OH-] + [A-] = [A-] [A-] + [HA] = CHA Kw = [H3 O+] [OH-] [HA] = CHA – [H3O+] Ka = [H3O+] [A-] / [HA] Ka = [H3O+] [H3O+] CHA - [H3O+] Se [H3O+] = x Ka = X2 CHA - X X2 = Ka (CHA – X) 2° approssimazione HA + H2O H3O+ + A- CHA-x x x X2 + KaX - KaCHA = 0 (fattore KaX trascurabile rispetto a KaCHA) HA è un acido debole quindi poco dissociato [H3O+] <<< CHA [H3O+] = [A-] CHA > 10-3 e Ka < 10-3 [HA] = CHA – [H3O+] = CHA Kw = [H3 Ka = [H3 O+] [OH-] O+] [A-] Se [H3O+] = x Ka = / [HA] X2 = Ka CHA X = Ka CHA X2 CHA X = (Ka CHA)1/2 - log [H3O+] = - log (Ka CHA)1/2 = - ½ log (KaCHA) pH = - ½ log Ka + (– ½ log CHA) = ½ pKa – ½ log CHA Calcolare il pH di una soluzione 0,2 N di Acido Formico Ka = 1,8 10-4 HCOOH + H2O [H3O+] = Ka CHA = = 6 10-3 H3O+ + HCOO- 1,8 10-4 x 0,2 = pH = 2,22 3,6 10-5 1° approssimazione 2° approssimazione [H3O+] >>> [OH-] [H3O+] <<< CHA [OH-] circa 10-12 <<<< 6 10-3 6 10-3 << 2 10-1 B + H2O BH+ + OH- H2O + H2O H3O+ + OH- [OH-] = [H3O+] + +] [BH [BH+] + [B] = CB Kw = [H3O+] [OH-] [B] = CB – Kb = [BH+] [OH-] / [B] [BH+] [BH+] = [H3O+] – [OH-] [H3O+] = Kw / [OH-] Kb = [BH+] [OH-] / [B] Kb = [OH-] ([Kw/[OH-] – [OH-]) CB – Kw/[OH-] + [OH-] Se [OH-] = x Kb = x (Kw/x - x) CB - Kw/x + x X3 + Kb X2 – (Kw+CBKb) X - KbKw = 0 1° approssimazione B è comunque una base quindi [OH-] >>> [H3O+] [OH-] = [H3O+] + [BH+] = [HB+] [BH+] + [B] = CB Kw = [H3 O+] [B] = CB – [OH-] [OH-] Kb = [BH+] [OH-] / [B] B + H2O CHA-x BH+ + OHx x Kb = [OH-] [OH-] CB - [OH-] Se [OH-] = x Kb = X2 = Kb (CB – X) 2° approssimazione X2 CB - X X2 + KbX - KbCB = 0 (fattore KbX trascurabile rispetto a KbCB) B è una base debole quindi poco dissociata [OH-] <<< CB [OH-] = [HB+] CB > 10-3 e Kb < 10-3 [B] = CB – [OH-] = CB Kw = [H3 O+] [OH-] Se [OH-] = x Kb = Kb = [BH+] [OH-] / [B] X2 = Kb CB X = Kb CB X2 CB X = (Kb CB)1/2 - log [OH-] = - log (Kb CB)1/2 = - ½ log (KbCB) pOH = - ½ log Kb + (– ½ log CB) = ½ pKb – ½ log CB pOH = pKw - pH e Kb = Kw / Ka - pH + pKw = ½ p(Kw/Ka) – ½ log CB pH = pKw - ½ p(Kw/Ka) + ½ log CB pH = pKw - ½ pKw – ½ p(1/Ka) + ½ log CB pH = + ½ pKw + ½ pKa + ½ log CB Calcolare il pH di una soluzione 0,1 N di Ammoniaca pKa = 9,244 NH3 + H2O NH4+ + OH- Ka = 10-9,244 Kb = Kw/Ka = 10-14/10-9,244 = 1,75 10-5 pH = + ½ pKw + ½ pKa + ½ log CB [OH-] = [H3O+] = Kb CB Kw [OH-] = 1,75 10-5 x 0,1 = pH = 11,12 1,75 10-6 FRAZIONE MOLARE di UNA SPECIE CHIMICA Computo delle masse in funzione di un parametro variabile Frazione di HA = aHA [HA] = CHA Frazione di A- = aA- = [A-] CHA = = aHA + aA- = 1 [HA] [HA] + [A-] [A-] [HA] + [A-] [A-] = Ka Dividendo numeratore e denominatore per [HA] [HA] [H+] aHA = aA- = 1 1 + Ka/[H+] Ka/[H+] 1 + Ka/[H+] = = [H+] [H+] + Ka Ka [H+] + Ka CALCOLO del pH per soluzioni acquose di ACIDI E BASI POLIPROTICI ACIDI FORTI alla 1° dissociazione e 2° dissociazione Acidi del tipo H2SO4 H2SO4 + H2O H3O+ + HSO4- Ka1 >> 1 HSO4- + H2O SO42- + H3O+ Ka2 =2,1 10-2 CAc = c [H3O+] = 2c Calcolare il pH di una soluzione 0,05M di acido solforico [H3O+] = 2c = 0,1M pH = 1 ACIDI FORTI alla 1° dissociazione e deboli alla seconda Acidi con Ka1 >>> Ka2 si comportano come acidi monoprotici ACIDI / BASI DEBOLI ANCHE alla 1° dissociazione Ka1 >> Ka2, Ka2 >> Ka3 H2S, H2SO3, H2CO3, H3PO4, H3BO3, H2C2O4 [H3O+] = (Ka1 CAc)1/2 [OH-] = (Kb1 CBase)1/2 pH = ½ pKa1 – ½ log CAc pH = + ½ pKw + ½ pKa + ½ log CB CALCOLO DEL pH di una soluzione contenente un sale del tipo NaHA o Na2HA HS-, HSO3-, HCO3-, H2PO4-, HPO42-, H2BO3-, HC2O4HA- + H2O HA- + H2O H2A + OHA2- + H3O+ Kb2 = Ka2 = [H2A] [OH-] [HA-] [H3O+] [A2-] 2[A2-] + [HA-] + [OH-] = [H3O+] + [Na+] [A2-] + [HA-] + [H2A] = Csale Kw = [H3O+] [OH-] [A2-] = Ka2 [HA-]/[H3O+] [H2A] = Kb2 [HA-]/[OH-] [OH-] = Kw/[H3O+] [HA-] [Na+] = Csale 2[A2-] + [HA-] + [OH-] = [H3O+] + [A2-] + [HA-] + [H2A] [A2-] + [OH-] = [H3O+] + [H2A] [H3O+] = [OH-] + [A2-] - [H2A] [H3O+] = Kw/[H3O+] + Ka2 [HA-]/[H3O+] - Kb2 [HA-]/[OH-] [H3O+] = Kw/[H3O+] + Ka2 [HA-]/[H3O+] - Kw/Ka1 ([HA-] [H3O+]/Kw) [H3O+]2 = Ka2 [HA-] + Kw 1 + [HA-]/Ka1 [H3O+]2 = Ka2 [HA-] + Kw 1 + [HA-]/Ka1 1° approssimazione Ka2 >>> Kw [H3O+]2 = Ka2 [HA-] 1 + [HA-]/Ka1 2° approssimazione Ka1 <<< [HA-] [H3O+]2 = Ka2 [HA-] [HA-]/Ka1 = Ka1 Ka2 [HA-]/Ka1 >>> 1 [H3O+] = Ka1 Ka2 - log [H3O+] = - log (Ka1 Ka2)1/2 = - ½ log (Ka1 Ka2) pH = + ½ (pKa1 + pKa2) Il valore del pH di una soluzione è in modo approssimato indipendente dalla concentrazione del sale NaHA FRAZIONE MOLARE di UNA SPECIE CHIMICA per un acido poliprotico pI = + ½ (pKa1 + pKa2) SOLUZIONI TAMPONE HA + NaA CH3COOH/CH3COONa – NaH2PO4/Na2HPO4 – NaHCO3/Na2CO3 HA + H2O A- + H2O A- + H3O+ Ka = [H3O+] [A-] / [HA] HA + OH- Kb = [AH] [OH-] / [A-] x y [A-] = Csale – y + x [H3O+] = x [HA] = CAc – x + y [OH-] = y Kw = [H3O+] [OH-] 1° approssimazione Ka > Kb y trascurabile [A-] = Csale + x [HA] = CAc – x Equazione di 3° grado Ka = x (Csale + x) / CAc - x Ka CAc – Ka x = x Csale + x2 X2 + X (Csale + Ka) - Ka CAc = 0 2° approssimazione anche x è trascurabile per il principio di Le Chatelier [A-] = Csale [HA] = CAc [H3O+] = Ka [HA] [A-] pH = pKa + log [H3O+] = Ka [HA] [A-] = Ka CAc Csale Csale CAc - log [H3O+] = - log Ka + log [A-]/[HA] pH = pKa + log [A-]/[HA] Equazione di Henderson-Hasselbalch SOLUZIONI TAMPONE B + BHCl B + H2O BH+ + OH- Kb = [BH+] [OH-] / [B] B + H3O+ Ka = [H3O+] [B] / [BH+] BH+ + H2O [BH+] = Csale – y + x [B] = Cbase – x + y [H3O+] = [OH-] [B] = Cbase Kw = [H3O+] [OH-] Kw [BH+] = Csale Kw [B] Ka [BH+] [H3O+] = = Kb [B] [BH+] Ka [BH+] [B] - log [H3O+] = - log Ka + log [B]/[BH+] pH = pKa + log [B]/[BH+] pH = pKa + log Cbase Csale Calcolare il pH di una soluzione 1,5 10-3 M di Acido Acetico e 0,50 10-3 M di Acetato di Sodio Ka = 1,75 10-5 X2 + X (Csale + Ka) - Ka CAc = 0 X2 + X (0,50 10-3 + 1,75 10-5) – (0,50 10-3) (1,75 10-5) = 0 X = [H3O+] = 4,65 10-5 pH = 4,33 [H3O+] = 5,25 10-5 pH = 4,28 2,0 10-3 M di Acido Acetico pH = 3,75 2,0 10-3 M di Sodio Acetato pH = 8.03 3,75 < pH = 4,33 < 8.03 TITOLAZIONE ACIDO DEBOLE con BASE FORTE Titolazione di un acido HA con NaOH pH iniziale pH = ½ pKa – ½ log CHA pH prima punto equivalente HA + OH- Ka CHA HA + NaA soluz tampone H2O + A- [OH-] = [A-] = b pH = pKa + log [H3O+] = [HA] = Cac - b Csale [H3O+] = Ka CAc pH punto equivalente CAc Csale NaA idrolisi pH = + ½ pKw + ½ pKa + ½ log CB X = Kb CB pH dopo punto equivalente [OH-] = (VxN)B in eccesso /Vtot 50,00 mL di Acido Acetico 1M titolati con NaOH 1M Ka = 10-5 pH iniziale pH = ½ pKa – ½ log CHA = ½ (5) – ½ log 1 = 2,5 Dopo l’aggiunta di 10,00mL Cac - b CAc = Ka [H3O+] = Ka Csale b [(50x1)-(10x1)]/60 = Ka (10x1)/60 = 10-5x(40/10) = 4 10-5 pH = 5 – log 4 = 4,4 Dopo l’aggiunta di 20,00mL pH = 4,82 Dopo l’aggiunta di 30,00mL pH = 5,18 Dopo l’aggiunta di 40,00mL pH = 5,6 Dopo l’aggiunta di 49,90mL pH = 7,7 pH al punto equivalente idrolisi acetato pH = + ½ pKw + ½ pKa + ½ log CB pH = + ½ (14) + ½ (5) + ½ log [(1x50)/(50+50)] pH = 7 + 2,5 + ½ log 0,5 = 9,35 pH dopo punto equivalente [OH-] = [(1x0,1)/100,1] = 1 10-3 pOH = 3 pH = 11 TITOLAZIONE ACIDI POLIPROTICI con BASE FORTE 1) Ka1 e Ka2 molto vicine Ka1/Ka2 < 104 L’aggiunta della base neutralizza entrambi i protoni e in soluzione è come se fosse presente un acido monoprotico in concentrazione doppia. H2A 2HA 2) Ka1 e Ka2 diverse Ka1/Ka2 > 104 pH iniziale è dato dalla 1° dissociazione pH = ½ pKa1 – ½ log CH2A pH prima 1° punto equivalente pH = pKa1 + log Csale CAc 1° punto equivalente H2A+NaHA soluz tampone NaHA idrolisi pH = + ½ (pKa1 + pKa2) pH prima 2° punto equivalente pH = pKa2 + log Csale CAc 2° punto equivalente [OH-] = Kb1 CB NaHA+Na2A soluz tampone CAc = CHA- - b’ e Csale = b’ Na2A idrolisi pH = + ½ pKw + ½ pKa2 + ½ log CB Ka1 = 3,3 10-7 Ka2 = 4,8 10-11 Fenolftaleina Kb2 = 3,03 10-8 giallo Kb1 = 2,8 10-4 Rosso di metile rosso 1° punto equivalente pH = + ½ (pKa1 + pKa2)= 8,4 Metilarancio CO32- + H3O+ HCO3- + H2O H3 2° punto equivalente pH = 2,98 H2CO3 + H2O D CO2 + H2O pH = ½ pKa1 – ½ log CHA 20 mL 1M O+ 20 mL 0,1M pH = 3,48 Acido Ossalico Ka1 = 5,6 10-2 Ka2 = 5,4 10-5 2° punto equivalente C2O42- pH = + ½ pKw + ½ pKa2 + ½ log CB Titolazione di 20,00 mL di Acido ossalico 0,1000M con NaOH 0,1000M 20 mL 0,1M pH = 8.39 20 mL 1M pH = 8,89 Acido Fosforico Ka1 = 7,11 10-3 Ka2 = 6,32 10-8 Ka3 = 4,5 10-13 1° punto equivalente H2PO4- pH = + ½ (pKa1 + pKa2) = 3,67 2° punto equivalente 3° punto equivalente PO43- pH = + ½ pKw + ½ pKa3 + ½ log CB HPO42- pH = + ½ (pKa2 + pKa3) = 8.77 Ambiente non acquoso o per via argentometrica Determinazione alcalinità dell’acqua (CO32- + HCO3-) Campione di 25,00 mL di acqua viene titolato con HCl 0.0150M 1° punto equivalente 2,52 mL HCl 2° punto equivalente 11,35 mL HCl CO32- + H3O+ HCO3- + H2O [CO32-] e [HCO3-] ? 2,52 mL 2,52 x 0.0150 x PE (=PM sodio carbonato) = 4.01 mg/25,00 mL 2,52 x 0.0150 = 0.0378 mmol (Ξ ½ mequivalenti carbonato) 0.0378mmol/25,00mL = 0.00151M = 1.51 10-3M HCO3- + H3O+ 0.0378mmol + HCO3 - H2CO3 11,35 mL 11,35 - 2,52 = 8,83 mL 8,83 x 0.0150 = 0.1324 mmol (0.0378mmol+HCO3-) 0.1324 – 0.0378 = 0.0946mmol/25,00mL = 3.78 10-3M 11.35 x 0.0150 = 0.1702 mmol 0.1702 – (0.0378 x 2) = 0.0946mmol HCO3- (Ξ mequivaleni bicarbonato) 0.0946mmol/25,00mL = 3.78 10-3M 0.0946 x PE (=PM sodio bicarbonato) = 7.95 mg NaHCO3 Determinazione quantità di CO2 (mg) nel sangue Tampone fisiologico H2CO3/HCO3- a 37 °C pH = 7,40 Ka1 = 7,94 10-7 pH = pKa + log log [HCO3-] [H2CO3] Csale CAc = 1.30 [HCO3-] = 26 10-3 mol/L 7,40 = 7 - 0.90 + log [HCO3-] [H2CO3] [HCO3-] [H2CO3] = 19.95 [H2CO3] = [CO2] = 26 10-3 / 19.95 = 1.30 10-3 mol/L = 1.30 mmol/L 1.30 mmol/L x 44,01 (PM) = 57,2 mg/L INDICATORI ACIDO-BASE InH + H2O Kaind = [In-] [H3O+] / [InH] In- + H3O+ [H3O+] = Kaind [InH] / [In-] -Log [H3O+] = -log Kaind + (-log [InH]/[In-]) pH = pKaind + log [In-]/[InH] Ammettendo che In- Giallo e InH Rosso Se [InH] >>>>[In-] soluzione nettamente rossa Se [In-] >>>>[InH] soluzione nettamente gialla [InH] = [In-] allora [In-]/[InH] = 1 pH = pKaind punto di viraggio colorazione rosa pH = pKaind ± 1 Fenolftaleina HO OH HO OH HO OH OH OH O COOH COO- Forme incolori O pH = 8,2 OH- O O -O OH -H2O OHOH O- OH COO- COO- Forme rosso-viola pH = 9,6 COO- Blu bromotimolo Rosso fenolo iPr iPr HO O OH Br Br OH Me OH Giallo pH = 6,4 SO3 H Rosa SO3H Rosso Giallo pH = 8,0 pH = 6,0 Metil arancio N N Giallo Blu verde pH = 7,6 Me HO3S Me HO 3S Me H+ N N N Me H N H+ Me pH = 4,0 HO 3S H N Me N Rosso pH = 2,0 N Me TITOLAZIONI acido-base In ambiente NON ACQUOSO Solubilità in acqua delle specie coinvolte (prevalenza della componente organica in molti farmaci). Stabilità chimica in acqua Caratteristiche acido-base dell’analita rispetto al solvente acqua (farmaci spesso hanno deboli caratteristiche acide o basiche). Un processo acido-base può essere visto come un processo di competizione tra l’analita (soluto) e il solvente per il titolante. Quando soluto e solvente presentano caratteristiche acido-base comparabili la reazione di titolazione avviene per entrambe le specie, la Keq con l’analita non è sufficientemente favorevole e il punto finale non è distinto. Natura anfiprotica dell’acqua e suo effetto livellante Esempi di Farmaci a natura basica OH HO O H N NH * . HCl . H2O N R HO Lidocaina Adrenalina Alcaloidi O N N O O N N Caffeina N O N H N N Teofillina O N HN O N N Teobromina CH=CH 2 H8 N HO 9 9-(R)-8-(S) cinconidina N H H MeO R R= CH=CH 2 HO N H H 9 R R= 9-(R)-8-(S) chinina N 9-(S)-8-(R) cinconina R= N H MeO R= 9-(S)-8-(R) chinidina N Esempi di Farmaci a natura acida Acidi organici, solfonammidi, fenoli, barbiturici OH R O R R' HO O Olivetolo NH N R" R=R’=-CH2CH3 O R' O O NH N R" S Barbitale R=-CH2CH3 R’=-C6H5 Fenobarbitale R=R’=-CH2-CH=CH2 Allobarbitale R=-CH2CH3 e R’=-CH(CH3)-(CH2)2-CH3 Pentobarbitale SH + SH SH + H2O H2S+ + S- H3O+ + S- Ka = [H3O+] [S-] / [SH] ione "lionio" SH + H2O H2S+ + OH- Kb = [H2S+] [OH-] / [SH] ione "liato" KaSH x KbSH = KautSH = [H2S+] [S-] Acido debole HA nel solvente SH SH2+ + A- AH + SH [H+] [A-] [SH2+] [AH] [SH] [H+] KAHSH = [SH2+] [A-] = KAH KbSH [AH] [SH] Base debole B nel solvente SH B + SH BH+ + S- [BH2+] [H+] [S-] [H+] [B] [SH] KBSH = [BH+] [S-] = KB KaSH [B] [SH] [SH2+ A-] AH + SH dissociazione ionizzazione B + SH SH2+ + A- [BH+S-] BH+ + S- - Alto valore della costante dielettrica: facilita il processo di dissociazione e la separazione delle cariche. - Basso valore della Kaut. CLASSIFICAZIONE SOLVENTI Caratteristiche acido-base A. Anfiprotici Solventi Protogeni (caratteristiche acide > dell’acqua), es. CH3COOH, HCOOH, H2SO4. Solventi Protofili (caratteristiche basiche > acqua), es. NH3, H2NCH2CH2NH2, H2N(CH2)4NH2. Solventi Ossidrilati (caratteristiche CH3OH, CH3CH2OH, alcooli in generale. intermedie), es. B. Aprotici Costanti di autoprotolisi talmente basse da non poter essere determinate, es. CHCl3, CCl4, n-esano. C.Basici ma NON acidi Classe di composti aventi doppietti elettronici non condivisi (basi secondo Lewis), es. esteri, eteri, chetoni, nitrili [(CH3)2SO, piridina, dimetilformammide o DMF]. Rivelazione punto finale - Strumentale (preferito) - Chimico: indicatori cromatici DETERMINAZIONE DI SOSTANZE BASICHE - Analita: B - Solvente: acido acetico glaciale - Titolante: Ac Perclorico in acido acetico glaciale. Solvente d’elezione CH3COOH a) Elevato grado di purezza b) Possibilità di eliminare anche tracce di acqua (anidride) c) Spiccate caratteristiche acide (titolazioni di B molto deboli) d) Specie titolante CH3COOH2+ e) Correzione del volume in funzione della temperatura t° B (l’analita) può essere: a) Base libera B B + CH3COOH2+ BH+ + CH3COOH b) Sale della base con un acido debole [B.HA] [B.HA] + CH3COOH2+ BH+ + CH3COOH + HA c) Sale della base con un acido forte [B.HX] [B.HX] + CH3COOH2+ BH+ + CH3COOH + HX d) Sale metallico di acidi organici MeA MeA + CH3COOH2+ (CH3COO)2Hg + 2HX Me+ + CH3COOH + HA HgX2 indissociato + 2 CH3COOH Titolante: HClO4 in CH3COOH glaciale Acido perclorico si trova in commercio o al 60% o al massimo al 70% in soluzione acquosa (non è uno standard primario). Causa di errore: standardizzazione variazione della soluzione di t° titolante determinazione vera e propria. Vc = V [0,0011(t1-t2)+1] T1 = temperatura Standardizzazione T2 = temperatura Determinazione tra la e la Preparazione e Standardizzazione di una soluzione 0,1 N di Acido perclorico PM 100,46 / d = 1,53 (60%) / d = 1,67 (70%) 100,46 (g/mol) x 0,1 = 10,046g di ac perclorico 10,046/0,60 = 16,74g di soluzione 16,74/1,53 = 10,94 mL da prelevare e portare ad 1L In un matraccio tarato da 1L contenente circa 850mL di acido acetico glaciale, raffreddato a 10-15 °C, si introducono, agitando bene e continuamente, circa 11mL di acido perclorico e circa 30mL di anidride acetica, evitando che l’anidride venga in diretto contatto con l’acido perclorico (formazione di prodotti esplosivi). Si porta a volume con acido acetico glaciale e si lascia riposare 24 h. Titolante: ftalato acido di potassio. Indicatore: cristal violetto COOK COOH + CH3COOH2+ COOH + CH3COOH + K + COOH O NH PM = 288,8 . HCl . H2O N Lidocaina Calcolare il volume di KOH 2,0N che occorre per spostare la lidocaina base da 5,0g del suo sale cloroidrato monoidrato, sapendo che 0,5776g hanno richiesto 19,85 mL di HClO4/CH3COOH 0,1007N 19,85 x 0,1007 = 1,998 meq di lidocaina in 0,5776g (1,998 x 5,0)/0,5776 = 17,30 meq di lidocaina base contenuti in 5,0g 17,30 = V(KOH) x N(KOH) 17,30/2 = 8.65 mL di KOH 2,0N 2[B . HCl] + Hg(AcO)2 2CH3COO- + 2CH3COOH2+ 2BH+ + HgCl2 + 2CH3COO4CH3COOH Adrenalina e adrenalina tartrato, mepiramina maleato, potassio sorbato, ecc… DETERMINAZIONE DI SOSTANZE ACIDE - Analita: HA - Solvente: Py, DMF, Etilendiammina, chetoni, idrocarburi - Titolante: CH3ONa in benzene anidro. HA + N CHO HN CHO + A - Impurezze acide e possibili tracce di acqua nella DMF (prova in bianco). - Standardizzazione della soluzione di CH3ONa con acido benzoico. Preparazione e Standardizzazione di una soluzione 0,1 N di Sodio Metossido PM (Na) 22,9898 In una beuta da 1L, raffreddata in bagno di ghiaccio, protetta dall’aria, e contenente circa 150 mL di alcool metilico, si aggiungono cautamente a piccole porzioni 2,5g circa di sodio metallico appena tagliato. A solubilizzazione ultimata si porta a volume con benzene e si agita accuratamente la soluzione; questa deve essere conservata al riparo dall’umidità e dall’anidride carbonica. Titolante: Acido benzoico in DMF. Indicatore: Azzurro timolo 1% (DMF). Determinazione di: sulfamidici, barbiturici, fenoli, ecc….
Scaricare