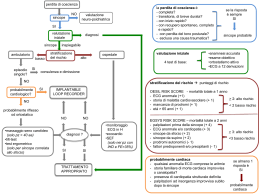
Corso integrato di FISIOPATOLOGIA, SEMEIOTICA E METODOLOGIA CLINICA anno 2006/07 Prof.Claudio Borghi Dip.Medicina clinica e Biotecnologia Applicata “D.Campanacci” Fisiopatologia delle valvulopatie cardiache Apparato valvolare del cuore Apparato valvolare del cuore in diastole in sistole Il circolo cardiaco Mitrale Tricuspide Aortica Valvulopatie: caratteristiche generali 1. Tipo: – – – stenòsi: restringimento o riduzione delle superfici di apertura insufficienza: incompleta chiusura od incontinenza steno-insufficienza: combinazione di queste due condizioni 2. Modalità di insorgenza: – – graduale o cronica: consente un adattatamento all’aumento del carico di lavoro (grazie all’ incremento della massa miocardica o ipertrofia) acuta: nessun adattamento emodinamico (insufficienza cardiaca acuta) Valvulopatie: caratteristiche generali 3. Effetti a livello delle camere cardiache: – sovraccarico di volume o diastolico: aumento del precarico o quantità di sangue che giunge ai ventricoli durante la diastole, determina ipertrofia eccentrica (aumento dimensioni dei sarcomeri e dilatazione cavità ventricolari) – sovraccarico di pressione o sistolico: aumento delle resistenze alla eiezione durante la sistole, determina ipertrofia concentrica (aumento numero dei sarcomeri e riduzione delle cavità ventricolari poi dilatazione) Sovraccarico sistolico Sovraccarico diastolico Valvulopatie: caratteristiche generali 4. Disturbi funzionali: – aumento delle pressioni a monte della valvola/e interessate con trasmissione retrograda al distretto venoso sistemico o polmonare – caduta della gittata cardiaca (= gittata sistolica x FC) o insufficiente adeguamento di quest’ultima alle richieste dell’organsimo Conseguenze emodinamiche delle valvulopatie Valvulopatie: caratteristiche generali 5. Progressione: – – fase di compenso: viene mantenuta la portata cardiaca e la funzione sistolica (fase che può anche essere asintomatica o paucisintomatica) fase di scompenso: insufficienza cardiaca (sintomatica) Principali valvulopatie • • • • • Stenosi mitralica Insufficienza mitralica Stenosi aortica Insufficienza aortica Valvulopatie tricuspidaliche Mitrale Tricuspide Aortica Stenòsi mitralica • Anatomia: – – 2 lembi valvolari, corde tendinee, anulus Superficie: 4-6 cm2 (limite critico:1-1,5 cm2) • Eziologia: – malattia reumatica, calcificazione (anziani) malattie autoimmuni • Fisiopatologia: – – – – ostacolo al passaggio di sangue attraverso la valvola AV e, quindi, al riempimento ventricolare sn durante la diastole ↑pressione atrio sn, ↑gradiente pressorio AV ⇒ riempimento ventricolare mantenuto, portata cardiaca mantenuta (a riposo) ↑ pressione atrio sn si trasmette in senso retrogrado alle vene e capillari polmonari ⇒ ipertensione polmonare cronica congestione polmonare cronica ⇒ sindrome funzionale ventilatoria restrittiva • Conseguenze cliniche: – – dispnea da sforzo, fibrillazione atriale, emoftoe, edema polmonare acuto Ipotensione, astenia e ridotta tolleranza allo sforzo, scompenso cardiaco congestizio • Esame obiettivo: – – – – rinforzo del I tono schiocco di apertura della mitrale soffio o rullio diastolico reperti ausculatatori della ipertensione arteriosa polmonare: accentuazione componente polmonare del II tono, soffio sistolico e soffio diastolico della valvola polmonare (o soffio di Graham Steel) Insufficienza mitralica • Anatomia: – – 3 lembi valvolari, corde tendinee, anulus Superficie: 4-6 cm2 (limite critico:1-1,5 cm2) • Eziologia: – Reumatica, degenerativa, infettiva, ischemica,dilatazione ventricolo sn • Fisiopatologia: – – – reflusso di sangue dal ventricolo all’atrio sn durante la sistole (cioè da una cavità ad alta pressione verso una cavità a bassa pressione) insuff. cronica: • Ridotta gittata cardiaca, ridotta pressione arteriosa, ipertrofia e dilatazione del vent. sin (ipertrofia eccentrica), ↑distensibilità atrio sn. insuff. acuta: • assenti meccanismi di adattamento: ↑massivo pressione sisto-diastolica in atrio sn e circolo polmonare e riduzione gittata anterograda • Conseguenze cliniche: – – insuf. cronica: astenia, ridotta tolleranza allo sforzo, dispnea, scompenso cardiaco insuf. acuta: edema polmonare acuto, sindrome da bassa portata • Esame obiettivo: – – – soffio pansistolico alla punta, irradiato verso la base o verso la ascella III tono protodiastolico accentuazione dello sdoppiamento del II tono Principali valvulopatie • • • • • Stenosi mitralica Insufficienza mitralica Stenosi aortica Insufficienza aortica Valvulopatie tricuspidaliche Mitrale Tricuspide Aortica Stenòsi aortica • Anatomia: – Restringimento della via di efflusso del ventr. sn a livello: • • • • Eziologia: – – • sottovalvolare valvolare od orifiziale sopravalvolare congenita, degenerativa, post-reumatica Infettiva Fisiopatologia: – ostacolo all’eiezione ventr. sn durante la sistole 1. ↑pressione sistolica del ventr. sn e del gradiente di pressione tra ventr. sn ed aorta, 2. sovraccarico di pressione V.sn, incremento massa miocardica (ipertrofia concentrica)e mantenimento portata; 3. Alterazione funzione diastolica V.sn (↑rigidità parietale o ridotta distensibilità V.sin) 4. Progressivo deterioramento del compenso e della funzione sistolica, insuff. cardiaca, scompenso cardiaco globale • Conseguenze cliniche: – – • sincope, angina durante sforzo fisico, dispnea, morte improvvisa fase avanzate: dispnea a riposo, edema polmonare acuto Esame obiettivo: – – Soffio sistolico aortico irradiato alle carotidi Polso arterioso piccolo e lento Insufficienza aortica • Anatomia: – 3 lembi valvolari, chiusura della valvola garantita anche da aorta ascendente • Eziologia: – degenerativa, post-reumatica, congenita (bicuspide), lue, ipertensione arteriosa • Fisiopatologia: – – – reflusso di sangue dall’aorta nel ventricolo sn durante la diastole insuf. cronica: • aumenta il volume diastolico del vent. sn e, per la legge di F. Starling, il volume sistolico è in grado di mantenere adeguata la gittata anterograda; • ipertrofia e dilatazione del ventr. sn (ipertrofia eccentrica), insufficienza ventr. sn, scompenso cardiaco globale insuf. acuta: • ↑ della pressione di riempimento ventricolare e, a monte, del circolo polmonare, • Conseguenze cliniche: – – insuf. cronica: abnorme pulsatilità arteriosa e aumento PA differenziale, dispnea da sforzo, angina insuf. acuta: dispnea, ortopnea, edema polmonare acuto, sindrome da bassa portata, tachicardia • Esame obiettivo: – – Soffio diastolico da rigurgito e soffio sistolico da eiezione aortico II tono aortico indebolito,↑PAS, ↓PAD, polso arterioso ampio e celere Legge di Frank-Starling Relazione V/P, in condizioni di isometria nel cuore isolato, fu dimostrata da Otto Frank nel 1884 e successivamente enunciata da Starling nel 1918: la forza di contrazione sviluppata dalle fibre cardiache durante la sistole, e quindi la quantità di sangue espulsa dal ventricolo, dipendono dalla lunghezza iniziale delle fibre, cioè dal volume telediastolico. Il volume telediastolico, che dipende dal ritorno venoso, determina la gittata sistolica. Principali valvulopatie • • • • • Stenosi mitralica Insufficienza mitralica Stenosi aortica Insufficienza aortica Valvulopatie tricuspidaliche Mitrale Tricuspide Aortica Valvulopatie tricuspidaliche • Anatomia: – – 3 lembi valvolari, corde tendinee, anulus Comuni le alterazioni della anatomia di tipo funzionale (da dilatazione del ventr dx e dell’anello tricuspidalico secondarie a cardiopatie) • Eziologia: – Infettiva, reumatica, carcinoide, endocardiofibrosi, traumi toracici, congenite • Fisiopatologia: – ↑ pressione venosa sistemica, a monte della valvola alterata – congestione venosa a livello epatico, splancnico, renale e degli arti inferiori – Insuffcienza funzionale degli organi relativi • Conseguenze cliniche: – – – epatomegalia pulsante con epatalgia da sforzo, tensione addominale, turbe dispeptiche scompenso cardiaco congestizio: oliguria, edemi declivi, versamenti sierosi fase avanzate: dispnea a riposo, edema polmonare acuto • Esame obiettivo: – – – segni fisici analoghi a quelli delle corrispondenti valvulopatie anche se attenuati per il regime pressorio meno elevato nelle sezioni dx rumori e toni a genesi tricuspidalica si evidenziano od accentuano nella fase inspiratoria (ritorno venoso alle sezioni cardiache di dx) turgore venoso a livello delle giugulari Fisiopatologia delle aritmie cardiache Josè Perez “A day in hospital”, 1929 Sistema di conduzione del cuore Destra Sinistra Sistema di conduzione del cuore Aritmie • aritmie ipercinetiche • aritmie ipocinetiche Meccanismi di formazione delle aritmie ipercinetiche 1. Aumento della frequenza propria del nodo del seno; 2. Acquisizione del ritmo dominante da parte di un pacemaker (latente o patologico) che scarica ad una frequenza superiore a quella del nodo del seno; 3. Fenomeno del “rientro”; 4. La cosiddetta “triggered activity” Meccanismi di formazione delle aritmie ipocinetiche 1. Diminuzione della frequenza del nodo del seno, che conserva il governo del ritmo cardiaco; 2. Assunzione, per carenza di attività del nodo del seno, del governo del ritmo da parte di un pacemaker latente che agisce mantenendo invariato il proprio automatismo; 3. Disturbi della conduzione A-V Cause principali di aritmie • Funzionali • Organiche – Cardiache primitive: • • • • Cardiopatia ischemica Cardiopatie valvolari Cardiomiopatie primitive Miocarditi – Cardiache secondarie a: • tireotossicosi • feocromocitoma • squilibri elettrolitici Classificazione delle aritmie ipercinetiche • Extrasistoli (o battiti ectopici o battiti prematuri) – Atriali – Giunzionali – Ventricolari • Tachicardie sopraventricolari – Sinusale – Tachicardia atriale ectopica (con blocco) – Ritmo giunzionale accelerato – Sindromi da preeccitazione – Tachicardia parossistica sopraventricolare • Tachiaritmie sopraventricolari – Flutter atriale – Fibrillazione atriale • Tachicardie ventricolari – Ritmo ventricolare accelerato – Tachicardia parossistica ventricolare – Torsione di punta – Fibrillazione ventricolare Classificazione delle artimie ipocinetiche • • • • Bradicardia sinusale Malattia del nodo del seno Ritmo giunzionale Blocchi atrio-ventricolare – di I grado – di II grado • Mobiz 1 (fenomeno di Luciani- Wenckebach) • Mobiz 2 – di III grado • Blocchi di branca Fisiopatologia delle aritmie Le aritmie interferiscono con la corretta funzione del cuore attraverso numerosi meccanismi i cui effetti possono essere così sintetizzati: 1. Effetti legati alla modificazione della frequenza cardiaca 1. Effetti legati alla perdita della contrazione atriale (es.F.atriale) 1. Effetti legati al consumo di O2 aumentato da parte del miocardio 2. Effetti legati alla riduzione del flusso coronarico 1. Effetti sul sincronismo della contrazione ventricolare Rapporti tra profilo fisiopatologico delle aritmie e quadro sintomatologico • In generale non è possibile abbinare i vari disturbi del ritmo con sintomi e segni specifici. • La comparsa di sintomi è determinata sia dalla presenza della aritmia che da altre numerose variabili: 1. 2. 3. 4. • condizioni contrattili del miocardio stato del circolo coronarico stato del circolo arterioso periferico durata della aritmia Questi fattori tendono a fare del sintomo un parametro spesso personale, che deve essere tuttavia indagato. Rapporti tra profilo fisiopatologico delle aritmie e quadro sintomatologico-2 In linea generale si può dire che i sintomi soggettivi determinati dalla presenza di una aritmia possono derivare da 4 meccanismi principali: 1. percezione del battito cardiaco irregolare (?) 2. interferenza col riempimento coronarico (?) 3. Interferenza con il riempimento diastolico (?) 4. Influenza della aritmia sulla funzione di pompa del cuore – A. Ipercinetiche (?) – A. ipocinetiche (?) Rapporto tra profilo fisiopatologico delle aritmie e quadro sintomatologico-3 1. Il sintomo più comune è la percezione del cuore che batte velocemente o in maniera irregolare e cioè il cardiopalmo – “ritmico” – “aritmico” 2. Se il circolo coronarico è compromesso possono comparire sintomi legati alla ipoperfusione coronarica (angina) perché si riduce il tempo di riempimento diastolico delle coronarie; 3. Nelle aritmie caratterizzate da riduzione dealla portata cardiaca su base ipercinetica sono presenti segni e sintomi di scompenso retrogrado (dispnea) e anterogrado (pallore, confusione mentale, sudorazione) e turbe della coscienza. 4. Nelle aritmie caratterizzate da riduzione dealla portata cardiaca su base ipocinetica sono presenti segni e sintomi di ipoperfusione del periferica e soprattutto cerebrale quali: vertigini, lipotimie e sincopi Corso integrato di FISIOPATOLOGIA, SEMEIOTICA E METODOLOGIA CLINICA anno 2006/07 Prof.Claudio Borghi Dip.Medicina clinica e Biotecnologia Applicata “D.Campanacci” Cardiovascular pathophysiological continuum Myocardial infarction Coronary thrombosis Neurohormonal activation Myocardial ischemia Arrhythmias and Sudden loss of muscle death Remodeling CAD Atherosclerosis LVH† Ventricular enlargement CHF Fattori di rischio Ipertensione Iperlipidemia Diabete Fumo, ecc. Death Dzau and Braunwald. Am Heart J 1991;121:1244 Cardiovascular and renal pathophysiological continuum Tissue injury (MI, stroke, renal insufficiency, PAD Atherothrombosis and Progressive CV disease Early tissue dysfunction Pathological remodelling Target organ damage Oxidative and mechanical stress Inflammation Risk factors End-organ failure (CHF, ESRD) Death Dzau VJ et al, Circulation 2007 Ipertensione arteriosa This illustration depicts one of William Harvey's experiments in his De Sanguinis Cordis or On the Circulation of the Blood (1628). Venal valves had already been discovered, but here Harvey shows that venal blood flows only toward the heart. He ligatured an arm to make obvious the veins and their valves, then pressed blood away from the heart and showed that the vein would remain empty because it was blocked by the valve. The first direct blood pressure measurement is attributed to the Reverend Stephen Hales in 1733. Definizione Valori di PAS (massima) ≥ 140 mmHg e/o PA diastolica (minima) ≥ 90 mmHg in pazienti che non stanno assumendo alcun farmaco antipertensivo • Organizzazione Mondiale della Sanità (OMS) • Società Internazionale dell’Ipertensione (ISH) • Società Europea della Ipertensione (ESH) • Joint National Committee (USA) Prevalenza Corrisponde al numero totale di pazienti con ipertensione arteriosa in una popolazione La ipertensione arteriosa colpisce: circa il 38% della popolazione adulta Italiana circa il 45% della popolazione adulta Europea In Italia più di 15 milioni di individui sono affetti da ipertensione arteriosa Complessità della ipertensione arteriosa •Eziologia e patogenesi complesse e multifattoriali •Forme primarie e secondarie •Profilo fisiopatologico complesso e composito •Significato aspecifico dell’incremento dei valori di PA. •Valori di PA = paz. con profili fisiopatologici •Valori di PA paz. con profili fisiopatologici = •Coinvolgimento ed esaltazione di sistemi fisiologici •SNS, SRAA •Transitorietà di alcuni meccanismi fisiopatologici •Variabilità del soggetto nel tempo Ipertensione arteriosa Aspetti fisiopatologici essenziali Pressione arteriosa = Portata cardiaca x Resistenze vascolari periferiche . Volume sistole x Frequenza cardiaca . 80% piccole arterie precapillari 20% arterie di grossomedio calibro Modificazioni di PC e RVP ed età Ipertensione arteriosa Aspetti fisiopatologici essenziali Pressione arteriosa = portata cardiaca x resistenze periferiche totali I meccanismi ipertensivi possono agire mediante: Aumento della portata cardiaca Aumento delle resistenze periferiche Classificazione della ipertensione in base alla eziologia Forma primitiva (essenziale o idiopatica) Forme secondarie ad eziologia nota * * comprendono il 5-10% dei casi che conseguono ad una causa diagnosticabile e, spesso, correggibile Fisiopatologia della ipertensione arteriosa primitiva: Aspetti prevalenti •Aspetti genetici •Iperattività del sistema nervoso simpatico •Alterazioni dei sistemi neuro-umorali •Sodio-sensibilità •Alterazioni dei meccanismi endoteliali (es. NO, ET1) •Attività del sistema RAA •Altri fattori neuro-ormonali (es. AVP) •Diabete ed insulino-resistenza Aspetti genetici: forme monogeniche (rare) Lifton et al, Nat Gen 1992 Aspetti genetici: forme combinate La ipertensione è più spesso la risultante della interazione tra le influenze genetiche ed i condizionamenti ambientali (stress, livello di sedentarietà, obesità e tipo di dieta) che possono favorire l'aumento dei valori pressori ed influenzare il decorso e la prognosi della malattia Pressione arteriosa (mmHg) Effetto additivo dei fattori genetici ed ambientali sui valori di pressione arteriosa sistolica e diastolica 190 Componente ambientale 170 Componente genetica 150 140 mmHg 130 110 90 mmHg 90 70 50 SBP DBP SBP Normali DBP SBP DBP SBP DBP Ipertesi “ambientalI” SBP DBP SBP DBP Ipertesi “genetici” Carrettero O & Oparil S, Circulation 2000 Fisiopatologia della ipertensione arteriosa primitiva: Aspetti prevalenti •Aspetti genetici •Iperattività del sistema nervoso simpatico •Alterazioni dei sistemi neuro-umorali •Sodio-sensibilità •Alterazioni dei meccanismi endoteliali (es. NO, ET1) •Attività del sistema RAA •Altri fattori neuro-ormonali (es. AVP) •Diabete ed insulino-resistenza Sistema nervoso simpatico e controllo P.A. SYMPATHETIC NERVOUS SYSTEM Frequenza cadiaca Cardiac output X Total systemic vascular resistance Na+ retention Volume Expansion Renin Angiotensin II Aldosterone Aspetti di iperattività del sistema nervoso simpatico nella ipertensione • Aumento dei livelli plasmatici di catecolamine • Aumento dei livelli tissutali di catecolamine • Aumento del traffico nervoso a livello muscolare Fisiopatologia della ipertensione arteriosa primitiva: Aspetti prevalenti •Aspetti genetici •Iperattività del sistema nervoso simpatico •Alterazioni dei sistemi neuro-umorali •Sodio-sensibilità •Alterazioni dei meccanismi endoteliali (es. NO, ET1) •Attività del sistema RAA •Altri fattori neuro-ormonali (es.AVP) •Diabete ed insulino-resistenza Condizioni associate con esagerata sodio-sensibilità • • • • • • Età anziana Razza nera Diabete Presenza di ridotta funzionalità renale Iperattività del sistema nervoso simpatico Iperattività del sistema renina-angiotensina 10-YEAR INCIDENCE OF STABLE HYPERTENSION IN BHT PATIENTS AND CONTROL AND RESPONSE TO I.V. NaCl LOADING 0,6 Na-sensitive Na-resistant Control Event rate 0,5 0,4 43% RR= 1.7 (1.2-3.8) 0,3 25% 0,2 5% 0,1 0 0 2 5 7 10 Years of follow-up Borghi C et al, J Hypertens 1997 Modificazioni della risposta vasodilatatoria alla Bradichinina nell’avambraccio di pazienti ipertesi e normotesi 600 * p<0.05 Ipertesi Normotesi * 400 FBF D% * 200 0 BRADYKININ 0.005 0.015 0.05 µg/100 ml/min SNP 1 2 4 µg/100 ml/min Taddei S et al, 2001 (in press) Cardiovascular event-free survival curves in hypertensive patients according to Ach-stimulated forearm blood flow (FBF) Event-free survival 1 0,8 3rd terzile 0,6 2nd terzile 0,4 p=0.0012 (Log-rank test) 0,2 1st terzile 1st terzile= 30-184 % increase FBF from baseline 2nd terzile= 185-333% increase FBF from baseline 3rd terzile= 334-760% increase FBF from baseline 0 0 12 24 36 48 Follow-up, months 60 72 84 Perticone F et Al, Circulation 2001 Distribuzione del sistema RAA • Sistema plasmatico circolante – Apparato juxtaglomerulare • PA arteriola afferente e Na tubulare • Sistema tissutale – Cuore e vasi • Endotelio vascolare Sistema Renina-angiotensina-aldosterone Angiotensinogen Endopeptidase Renin Non-ACE Catepsin G Chymase Angiotensin III, IV (fragments) AT1 receptors Prorenin Angiotensin I ACE Angiotensin II AT2 Other receptors receptors -Aldosterone release -Vasocostriction -Thrist -Tubular Na+reabsorption -ADH secretion -Cell hypertrophy -Ca++-transport -Vasodilatation - Cell growth -Antioxidant action -Apoptosis? VIP Sost-P Enkefalin Bradikinin Inactive fragments RAA overactivity in secondary form of hypertension • Renovascular hypertension • Malignant hypertension • Renin-secreting tumor • Aldosterone-secreting adenoma (Conn disease) • Adrenal hyperplasia Fisiopatologia della ipertensione arteriosa primitiva: Aspetti prevalenti •Aspetti genetici •Iperattività del sistema nervoso simpatico •Alterazioni dei sistemi neuro-umorali •Sodio-sensibilità •Alterazioni dei meccanismi endoteliali (es. NO, ET1) •Attività del sistema RAA •Altri fattori neuro-ormonali (es.AVP) •Diabete ed insulino-resistenza Definition of insulin resistance “Uno stato di disregolazione della omeostasi insulina-glucosio nel quale la capacità della insulina di stimolare la captazione ed utilizzazione del glucosio da parte dei tessuti periferici (muscoli e tessuto adiposo) risulta ridotto.” % Glucose utilization What is Insulin Resistance? 120 100 Normal IR (mild) IR (severe) 80 60 40 20 0 0 0,1 1 10 100 Insulin concentration (ng/ml) Adapted from Olefsky MJ et al. In: Rifkin H, Porte D Jr. Diabetes Mellitus Theory and Practice, 4th Edition: Insulin Resistance in Man: p125. Prevalence of insulin resistance according to metabolic disorders IGT Diabetes Hypercholesterolemia Low HDL-C Hypertriglyceridemia Hyperuricemia Hypertension Metabolic syndrome 0 Bonora E et al, Diabetes 1998 20 40 60 Prevalence (%) 80 100 Correlazione tra resistenza insulinica, ipertensione e complicanze CV Resistenza insulinica Iperinsulinemia SNS RAA Ritenzione di Na Ipertensione Cardiopatia ischemica Ictus e AIT Arteriopatia periferica Cardiopatia ischemica Ischemia miocardica Coronary heart disease Left coronary artery with anterior descending and circumflex branches. Normal findings. Coronary angiogram of right coronary artery. Initial findings: Severe stenosis in a long segment near the origin from the aorta and a complicated, long-segment double stenosis with associated ulceration below. Determinanti della perfusione miocardica Resistenze vascolari coronariche Flusso coronarico Apporto O2 Frequenza cardiaca Consumo O2 Contrattilità Tensione parietale sistolica Capacità di trasporto di O2 Source: Eugene Braunwald Fattori che intervengono nella genesi dell’ischemia miocardica • Riduzione miocardio dell’apporto • Aumento del consumo ossigeno (MVO2) di Ossigeno al miocardico di Determinanti della perfusione miocardica Autoregolazione Forze compressive extravascolari Controllo metabolico Resistenze Vascolari coronariche Fattori umorali Controllo nervoso Flusso coronarico Apporto O2 Rilassamento diastolico V.sin Pressione arteriosa Consumo O2 Source: Eugene Braunwald Schema di sviluppo e progressione dell’aterosclerosi Cellule Schiumose Strie Lipidiche Lesione Intermedia Ateroma Crescita dovuta principalmente all’accumulo di lipidi Prima decade Dalla terza decade Adattato da Stary HC et al. Circulation. 1995;92:1355-1374. Placca Lesione/rottura Fibrosa complicata Muscolo liscio e collagene Trombosi, ematoma Dalla quarta decade Effetti dell’ischemia a livello miocardico • Gli effetti indotti dall’ischemia a livello miocardico sono di tre tipi: – alterazioni metaboliche – alterazioni elettriche – alterazioni meccaniche Alterazioni metaboliche nel miocardio ischemico • In condizioni di normale ossigenazione, il miocardio ha un metabolismo strettamento aerobio e catabolizza gli acidi grassi ed il glucosio a CO2 e H2O. • In presenza di ischemia gli acidi grassi non possono essere ossidati ed il glucosio viene metabolizzato a lattato: – diminuzione il pH intracellulare – Riduzione delle riserve di fosfati ad alta energia (ATP e creatinin-fosfato) • La riduzione delle riserve di ATP interferisce con lo scambio ionico a livello del sarcolemma: – aumento Na+ i.c. – riduzione K+ i.c. • L’aumento del Na+ i.c. promuove un incremento del Ca++ i.c. (per un aumento scambio Na+/Ca++) mentre la ridotta disponibilità di ATP riduce l’estrusione di Ca++ dalla cellula • L’aumento del Ca++ i.c. produce un sovraccarico di Ca++ mitocondriale e ciò deprime ulteriormente il metabolismo e la funzione miocardica • Inoltre la produzione, a livello del tessuto ischemico, di radicali liberi derivati dall’ossigeno per fenomeni di perossidazione, possono danneggiare la membrana cellulare e quindi contribuire al danno ischemico Alterazioni elettriche nel miocardio ischemico • Secondariamente alle alterazioni metaboliche, l’anossia altera le proprietà elettriche delle cellule miocardiche modificando l’equilibrio elettrolitico intra/extracellulare e queste modificazioni possono essere rilevate all’ECG • I segni ECG caratteristici sono quelli di – “ischemia” – “lesione” – “necrosi” • NB. Questi termini sono utilizzati in elettrocardiografia clinica per definire degli aspetti morfologici dell’ECG ma corrispondono ad alterazioni strutturali ben identificabili “Ischemia” “Lesione” “Necrosi” Progressione dell’ECG nell’infarto miocardico Alterazioni meccaniche nel miocardio ischemico • Generalità – • Le alterazioni meccaniche conseguenti all’ischemia possono essere permanenti o transitorie, ma protrarsi anche a lungo dopo la risoluzione dell’ischemia stessa (“miocardio stordito” o stunned myocardium). Effetti sulla funzione contrattile (sistolica): – Se l’area interessata è piccola (<3-5%) si ha riduzione segmentaria della funzione contrattile del miocardio – se l’area ischemica è sufficientemente ampia (<20%), si ha depressione della funzione globale del ventricolo sinistro con: • • • • ↓ della gettata sistolica ↓ della portata cardiaca ↓ della frazione di eiezione. – Se l’ischemia interessa il 20-25% della massa ventricolare sinistra: scompenso – Se l’ischemia interessa i muscoli papillari o altri segmenti del miocardio responsabili del funzionamento dell’apparto mitralico: insufficienza mitralica Effetti sulla funzione diastolica: – riduzione del rilasciamento ventricolare, e prolungamento del periodo di rilasciamento isovolumetrico – ostacolo al normale riempimento del ventricolo, aumento della pressione diastolica, congestione venosa a monte Manifestazioni cliniche della ischemia miocardica •Angina pectoris: •squilibrio transitorio tra domanda e apporto di O2 al miocardio •la ischemia è reversibile e non provoca danno anatomico permanente •nel caso in cui non si associ a sintomi, si parla di ischemia silente •Infarto miocardico: •consegue a un’ischemia miocardica protratta •porta a danno cellulare irreversibile o necrosi miocardica •Scompenso cardiaco: •può manifestarsi come complicanza di un infarto acuto o pregresso •può essere precipitato da ischemia miocardica transitoria o aritmie •Aritmie: •possono essere l’unico segno di una cardiopatia ischemica •Arresto cardiaco: • evolve rapidamente verso la morte, in assenza rianimatorie o quando la rianimazione è inefficace di manovre Corso integrato di FISIOPATOLOGIA, SEMEIOTICA E METODOLOGIA CLINICA anno 2006/07 Prof.Claudio Borghi Dip.Medicina clinica e Biotecnologia Applicata “D.Campanacci” Insufficienza cardiaca Historical perspective of CHF Progress of understanding HF is a dropsical syndrome HF is a central cardiac pump problem HF is caused by decompensated ventricular hypertrophy HF is a circulatory dysfunction HF is a disorder of renal function HF is an endocrinopathy HF is a fever HF is a complicated milieu of pump dysfunction, remodeling, humoral perturbation and subsequent circulatory insufficiency Heart Failure: A Major Public Health Problem Affects >6 million persons worldwide >1 million new cases per year (worldwide) Number of hospitalizations quadrupled in last 15 ys Five year survival 50% Sudden death most common mode of death Risk of sudden death - 5 times the general population La catena di eventi delle malattie CV Infarto Miocardico Trombosi coronarica Rimodellamento ventricolare Angina pectoris Morte improvvisa Attivazione Neuro-ormonale Ischemia miocardica Dilatazione & Disfunzione Aterosclerosi ventricolare sinistra Ipertrofia VS Ipertensione Fattori di rischio Iperlipidemia Diabete Fumo, ecc. Insufficienza cardiaca Morte Insufficienza Cardiaca: Cause Cardiopatia ischemica (IMA) Ipertensione arteriosa Cardiomiopatia primitive (dilatativa) Valvulopatie, Aritmie Eziologia della insufficienza cardiaca Fisiopatologia insufficienza cardiaca Definizione fisiopatologica di Insufficienza cardiaca (I.C.) Anomalia della funzione cardiaca tale che il cuore non è in grado di pompare sangue in maniera adeguata alle richieste metaboliche o di farlo solo a spese di un aumento della pressione di riempimento ventricolare e/o di un’attivazione dei sistemi neuroendocrini. E. Braunwald La regolazione della funzione cardiaca I tre fattori fondamentali coinvolti nella regolazione della funzione cardiaca sono: il precarico il postcarico la contrattilità (o stato inotropo) Svuotamento Ventricolare Post-carico Riempimento Ventricolare Pre-carico . . Contrattilità Ventricolare Pre-carico Tensione passiva esercitata dal volume sanguigno sulla parete ventricolare al termine della diastole. Un aumento del precarico permette l'espulsione di un maggior volume di sangue nella circolazione polmonare e sistemica. Post-carico E’ indice della resistenza che si oppone al ventricolo in aorta e nell’albero arterioso e che il ventricolo deve superare per poter pompare il sangue in circolo. Dipende dal gradiente di pressione ventricolo/aorta e soprattutto dai valori di pressione aortica e sistemica. Contrattilità •Proprietà peculiare del muscolo cardiaco che e' in grado intrinsecamente di contrarsi in modo più o meno efficace condizionando la gitatta cardiaca. •La contrattilità è influenzata dal pre- e post carico (legge di Frank-Starling). La regolazione intrinseca (Legge di Frank-Starling) Il cuore si può adattare autonomamente ai cambiamenti del volume di sangue che riceve. Quanto più un fascio muscolare cardiaco è disteso durante la diastole (fase di riempimento ventricolare), tanto più energica sarà la sua contrazione durante la sistole (fase di espulsione del sangue) Meccanismo di Frank-Starling Fattori emodinamici che condizionano la funzione cardiaca e insufficienza cardiaca La alterazione della funzione cardiaca può quindi conseguire a condizioni che modificano: Il pre-carico ventricolare: modalità di riempimento VS (es.aritmie) Il post-carico ventricolare: resistenza alla eiezione VS (es.HBP) La contrattilita’ intrinseca: proprietà del miocardio (es.IMA, CMP) Meccanismi di attivazione neuro-ormonale Fisiopatologia della insufficienza cardiaca In termini fisiopatologici la comparsa di insufficienza cardiaca può conseguire a: (1) Ridotta gittata cardiaca (disfunzione sistolica) (2) Ridotto riempimento ventricolare sinistro (disfunzione diastolica) (3) Attivazione del sistema neuroormonale (SNS, SRAA,Peptidi atriali e AVP?) che condizionano il quadro clinico e la comparsa di sintomi. Disfunzione sistolica Consiste nell’incapacità da parte del cuore di espellere una adeguata quantità di sangue ad ogni sistole. Cause: Perdita di miociti IMA Depressione contrattilità Cardiomiopatie generalizzata della Disfunzione diastolica Consiste nell’alterato riempimento delle cavità ventricolari che impedisce al cuore di disporre di una adeguata quantità di sangue da espellere. Cause: Ipertrofia Ventricolare sinistra (I.A.) Fibrosi miocardica (Card.Ischemica) Alterazione del pericardio Systolic and diastolic heart failure Diastolic heart failure Systolic heart failure Attivazione neuro-ormonale Consiste nell’attivazione di sistemi neuro-endocrini che rappresnetano iniziali meccanismi di compenso e successivamente accelerano la progressione dello scompenso. Sono: Sistema nervoso simpatico (SNS) Sistema Renina-angiotensina-aldosterone (SRAA) Sistema dei peptidi “natriuretici” Fisiopatologia del S.Nervoso Simpatico e I.C Nello scompenso cardiaco esiste sempre un variabile grado di attivazione del sistema nervoso simpatico Tale attivazione ha, inizialmente, un significato compensatorio finalizzato al mantenimento di una perfusione adeguata degli organi vitali La stessa attivazione, nel lungo periodo, condiziona negativamente la performance dell’intero sistema cardiovascolare Fisiopatologia del S.Nervoso Simpatico e I.C Nel cuore scompensato diminuisce progressivamente la densità dei recettori adrenergici sulle miocellule per "protezione” nei confronti dell’aumento delle catecolamine circolanti La diminuzione dei recettori sulle miocellule riduce la riserva contrattile e favorisce lo sviluppo di scompenso cardiaco Attivazione simpatica e prognosi della I.C. Fisiopatologia del RAS e I.C. Cardiac dysfunction Renin Angiotensin I Angiotensinogen Other paths ANGIOTENSIN II AT1 Vasoconstriction Post-loading ACE RECEPTORS AT2 Na+-retention Vasodilatation Pre-loading Antiproliferative Action Conseguenze dell’attivazione del sistema RAS Sodio-ritenzione Perdita di potassio a livello renale Fibrosi miocardica e vascolare Danno vascolare diretto Disfunzione dei barocettori Inibizione della captazione della noradrenalina Natriuretic Peptides: Origin and Physiologic Effects Peptide Primary origin Atrial natriuretic peptide Cardiac atria Brain natriuretic peptide Ventricular myocardium C-type natriuretic peptide Physiologic effects Vasodilation Sodium excretion Decreased aldosterone levels Vascular endothelium, kidney, lung, heart, brain Inhibition of the RAAS Inhibition of sympathetic nervous activity Vasodilation Decreased aldosterone levels Decreased vascular smooth muscle growth Modified from Burnett et al. J Hypertens 1999;17:S3 SURVIVAL AND CARDIAC EVENT-FREE PLOTS FOR PTS WITH CHF SUBDIVIDED ACCORDING TO PLASMA LEVELS OF BNP Maeda K et al, JACC 2000 Interazione tra attivazione neuro-ormonale, ridotta performance ventricolare e sviluppo di I.C. Performance ventricolare Resistenze all’efflusso Resistenze vascolari Malattia cardiaca Disfunzione sistolica Disfunzione diastolica Gittata cardiaca Attivazione neurormonale Ritenzione di Na+ e H2O Catecolamine RAS ANP BNP AVP Dopamina Sintomi/funzione cardiaca/sopravvivenza EFFETTO DEI FARMACI SULLA FUNZIONE CARDIACA E SULLA STORIA NATURALE DELLO SCOMPENSO CARDIACO storia naturale ACE-inibitori Sartani ß-bloccanti Inotropi Diuretici Tempo Cumulative survival (%) Plasma ANP and prognosis in CHF 100 80 ANP < 125 pg/ml 60 P<0.01 40 ANP > 125 pg/ml 20 0 0 3 6 9 12 15 18 21 24 Months of follow-up Gottlieb S et al JACC 1989 Treatment of heart failure guided by plasma brain natriuretic peptide (N-BNP) concentrations Cardiovascular event Heart failure or death Pts remaining event-free (%) Pts remaining event-free (%) BNP group Clinical group 100 90 80 p=0.049 70 p=0.034 60 50 0 0 30 60 90 120 150 180 0 30 60 90 120 150 180 Time after randomisation (weeks) Troughton RW et al, Lancet 2000 INSUFFICIENZA CARDIACA: fisiopatologia Corso integrato di FISIOPATOLOGIA, SEMEIOTICA E METODOLOGIA CLINICA anno 2006/07 Prof.Claudio Borghi Dip.Medicina clinica e Biotecnologia Vertigini, lipotimia sincope e coma Vertigine, lipotimia, sincope e coma Vertigine Lipotimia Stato di coscienza 100% Sincope Transitorie perdite di Coscienza TPC Coma 0% Vertigine, lipotimia sincope e coma Vertigine: Definizione • Il termine vertigine definisce qualsiasi condizione di disorientamento soggettivo ed obiettivo nello spazio circostante senza deficit di coscienza ma con frequenti sintomi di accompagnamento (nausea, vomito, sudorazione, ipotensione, ecc.). Vertigine, lipotimia sincope e coma Vertigine: Classificazione generale • Vertigine soggettiva (90%): il paziente percepisce che lo spazio che lo circonda si sta muovendo intorno a lui che resta relativamente immobile. • Vertigine obiettiva (10%): il paziente percepisce che è lui che si muove rispetto allo spazio che lo circonda e che resta relativamente immobile. Vertigine, lipotimia sincope e coma Vertigine: Classificazione soggettiva • Vertigine rotatoria: il paziente percepisce che lo spazio si muove intorno in maniera piò o meno vorticosa. E’ la forma più comune e diffusa. • Vertigine ondulatoria: il paziente percepisce che lo spazio si muove secondo un senso di oscillazione sull’asse longitodinale o trasversale • Vertigine sussultoria: il paziente percepisce un senso di trascinamento in alto o in basso (es.come accade in ascensore, pavimento che sprofonda) Vertigine, lipotimia sincope e coma Vertigine, lipotimia sincope e coma Vertigine: Classificazione fisiopatologica • Vertigine centrali: a partenza dal tronco encefalico. • Vertigini periferiche: labirintica. a partenza oto- • Vertigini psicogene: non correlate ad un meccanismo organico a significato fisiopatologico Vertigine, lipotimia sincope e coma Aspetti anamnestico/semeiologici delle vertigini Caratteristiche V.Periferiche V.Centrali Improvviso Parossistico Insidioso Continuo Massima iniziale Lieve Minuti/ore Giorni/settimane Nistagmo verticale Assente Comune Influenza movimenti Notevole Lieve o nulla Tinniti, sordità Comuni Assenti Test di Romberg Altri n,cranici Negativo Rari Positivo Comuni Inizio Quadro clinico Intensità Durata Vertigine, lipotimia sincope e coma Vertigine: Cause principali • Vertigine centrali: – – – – Insufficienza verterbo-basilare Neoplasie cerebrali, Sclerosi multipla Sindrome post-commotiva Epilessia temporale, Emicrania con aura, cause oculari • Vertigini periferiche: – Malattie o malfunzioni oto-labirintiche. – M.di Menière (vertigine, acufeni, sordità progressiva) • Vertigini psicogene: – Stati di tensione emotiva, ansia – Nevrosi (claustrofobia, agorafobia) – S.da Iperventilazione Vertigine, lipotimia sincope e coma Sincope: Definizione • Il termine sincope definisce una sindrome clinica drammatica caratterizzata da improvvisa e transitoria perdita di coscienza associata ad incapacità a mantenere il tono posturale. Vertigine, lipotimia sincope e coma Lipotimia: Definizione • Il termine lipotimia definisce una sindrome clinica caratterizzata da progressivo sviluppo di ipostenia associata spesso ad incapacità a mantenere il tono posturale e preceduta da sintomi vegetativi (pallore, sudorazione, senso di mancamento, cardiopalmo….) Vertigine, lipotimia sincope e coma Pre-lipotimia: Definizione • Il termine pre-lipotimia definisce una sindrome clinica caratterizzata dalla comparsa di sintomi combinati di probabile ipoperfusione cerebrale senza perdita di coscienza. Può rappresentare una forma parziale di lipotimia vera riconoscendo le stesse cause o la conseguenza di un episodio pseudo-lipotimico. Vertigine, lipotimia sincope e coma Disturbo transitorio della coscienza Perdita transitoria di coscienza Lipotimia Sincope No perdita transitoria di coscienza Pre-lipotimia Anamnesi Es.obiettivo Anamnesi Es.obiettivo Indagini strumentali Indagini strumentali Approccio al paziente Dottore, stavo camminando verso casa e mi sono risvegliato con un sacco di gente intorno...... Approccio al paziente Dottore, stavo camminando verso casa e mi sono sentito debole ed ho cominciato a sudare e mi sono risvegliato con un sacco di gente intorno...... Approccio al paziente Dottore, stavo camminando verso casa e mi sono sentito debole ed ho cominciato a sudare e mi sono dovuto sedere a terra ed in pochi minuti mi sono ritrovato con un sacco di gente intorno...... Vertigine, lipotimia sincope e coma Sincope/lipotimia (TPC): Classificazione fisiopatologica • TPC Neurogena o neuro-mediata (“vasodepressiva”) • TPC da Ipotensione ortostatica • TPC da causa elettrica cardiaca (aritmie) • TPC da cardiopatia organica • TPC da cause cerebrovascolari Vertigine, lipotimia sincope e coma TPC: TPC Neurogena o neuro-mediata (“vasodepressiva”) 1. Situazionale 2. Vaso-vagale 3. Carotidea 4. Nevralgia glosso-faringea Vertigine, lipotimia sincope e coma TPC neurogena Frequenza cardiaca Flusso di perfusione cerebrale = Pressione arteriosa Tono vascolare Vertigine, lipotimia sincope e coma TPC: TPC da Ipotensione ortostatica (I.O.) • Si verifica quando la assunzione delle stazione eretta causa una riduzione eccessiva della pressione arteriosa • Consegue (1) alla incapacità del S.N. autonomo di attivare i riflessi che adattano il circolo alla postura o (2) alla riduzione del volume intravascolare (“deplezione di volume”). • Rappresenta una entità diversa dalla sincope vasovagale da ortostasi Vertigine, lipotimia sincope e coma TPC da ipotensione ortostatica Frequenza cardiaca Flusso di perfusione cerebrale = Pressione arteriosa Tono vascolare Vertigine, lipotimia sincope e coma TPC: TPC da cause elettriche cardiache • Si verifica quando la comparsa di alterazioni del ritmo cardiaco causa una riduzione della gittata cardiaca che non permette di mantenere una adeguata perfusione cerebrale. • Può assumere l’aspetto si manifestazione lipotimica o sincopale. • Può conseguire ad alterazioni del battito cardiaco di tipo ipercinetico (frequenza troppo elevata) o ipocinetico (frequenza troppo bassa) Vertigine, lipotimia sincope e coma TPC da cause elettriche cardiache Frequenza cardiaca Flusso di perfusione cerebrale = Pressione arteriosa Tono vascolare Vertigine, lipotimia sincope e coma TPC: TPC da cardiopatia organica • Si verifica quando la presenza di una malattia cardiaca non permette di mantenere una portata cardiaca • • • adeguata alle esigenze di perfusione cerebrale. Può conseguire ad alterazioni della pressione arteriosa, del tono vascolare periferico e del ritorno venoso centrale. Può assumere l’aspetto si manifestazione lipotimica o sincopale. Vertigine, lipotimia sincope e coma TPC da cardiopatia organica Frequenza cardiaca Flusso di perfusione cerebrale = Pressione arteriosa Tono vascolare Ritorno venoso Vertigine, lipotimia sincope e coma TPC: TPC da cause cerebrovascolari • • • • Si verifica quando la presenza di una malattia vascolare cerebrale o aortica riduce il flusso a livelli inadeguati alle esigenze di perfusione cerebrale. Può conseguire ad alterazioni della pressione arteriosa, e della perfusione del circolo cerebrale. Può assumere l’aspetto si manifestazione lipotimica o sincopale associate a sintomi neurologici. Vertigine, lipotimia sincope e coma TPC da cause cerebrovascolare Frequenza cardiaca Flusso di perfusione cerebrale = Pressione arteriosa Tono vascolare Compromissione cerebrovascolare Vertigine, lipotimia sincope e coma Cause di TPC apparente (“pseudo-lipotimie) – Cadute accidentali – Crisi catatoniche – “Sincopi” neuropsichiatriche – Epilessia – Intossicazioni – Malattie metaboliche • • • diabete, ipoO2, iperventilazione con ipoCO2 Vertigine, lipotimia sincope e coma Coma: Definizione • Il termine coma definisce uno stato di sopore profondo con perdita totale o quasi (stato semicomatoso) della coscienza, della motilità volontaria e della sensibilità con persistenza più o meno compromessa delle funzioni vegetative Vertigine, lipotimia sincope e coma Coma: Classificazione fisiopatologica • Coma senza segni neurologici focali o rigidità nucale – Metabolico (es.diabetico, epatico, endocrino) – Tossico (es.Alcool, oppio e derivati, psicofarmaci, CO) – Misto (es.ipoventilazione polmonare CO2) • Coma con segni neurologici focali – Accidente cerebrovascolare – Trauma cranico – Cause infettive (ascessi) o vascolari (aneurisma) cerebrali • Come con rigidità nucale – Emorraggia subaracnoidea – Meningite o encefalite – Varie (forme neoplastiche o meningismo secondario) Vertigine, lipotimia sincope e coma Coma: Classificazione clinica e stadi • Stadio 1 (precoma): Coincide con la fase di profondo torpore in cui il paziente non agisce spontaneamente, ma agisce in risposta a stimoli (es.nome) e percepisce e reagisce al dolore. Sfinteri -, deglutizione + • Stadio 2 (coma propriamente detto): Turbe della coscienza più profonde e perdita sensibilità al dolore. Soppressa deglutizione. Conservato riflesso pupillare. Funzioni vegetative e respiro + • Stadio 3 (come profondo): Perdita completa della coscienza. Aboliti i riflessi. Ipotonia muscolare ed areflessia. Perturbate funzioni vegetative quali respiro e, pressione, temperatura • Stadio 4 (come depassè): Assenza di coscienza e funzioni vegetative il paziente sopravvive grazie alla strumentazione
Scarica