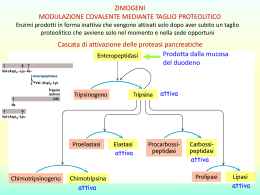
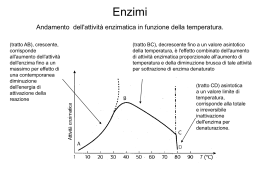
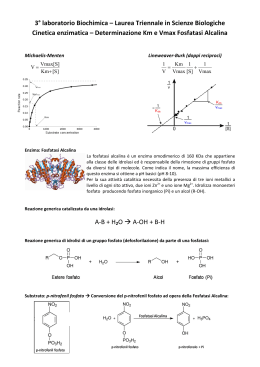
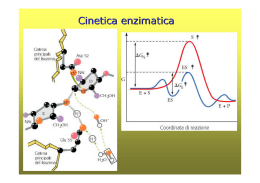
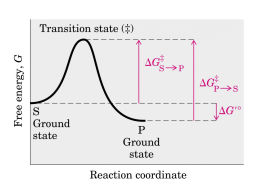
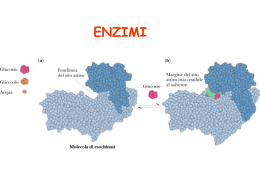
LE PROTEINE POSSONO ESSERE BERSAGLIO DEI FARMACI FARMACI controllano l’attività delle proteine PROTEINE svolgono molteplici attività STRUTTURALI mantenimento della forma della cellula (microtubuli, microfilamenti) organizzazione strutturale del DNA (impalcatura del cromosomi) … FUNZIONALI enzimi, implicati nel metabolismo proteine recettoriali, informano la cellula degli eventi esterni e sono essenziali per l’attivazione della risposta intracellulare fattori di trascrizione … LIVELLI DI ORGANIZZAZIONE STRUTTURALE DEGLI ENZIMI primaria sequenza amminoacidica secondaria terziaria quaternaria la struttura tridimensionale (3D)di una singola catena ripiegata.E' composta da elementi di struttura secondaria regolare ed irregolare la conformazione lungo la catena, in particolare per quanto riguarda segmenti con conformazione regolare (alfa-elica, beta-struttura ecc.) aggregazione di due o più subunità (catene) proteiche identiche (omo) o diverse (etero) Energia di attivazione La conversione X --> Y è termodinamicamente favorevole (Y si trova ad uno stato energetico inferiore rispetto a X), ma la reazione non può avvenire se X non acquisisce sufficiente energia per superare la barriera dell’energia di attivazione Distribuzione di energia in una popolazione di molecole • Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso • Solo una piccola frazione di esse possiede sufficiente energia per superare la barriera dell’energia di attivazione Enzimi: catalizzatori biologici Reazione non catalizzata DG* Reazione catalizzata DG* X DG Y • Gli enzimi si combinano transientemente col substrato e ne abbassano l’energia di attivazione • Non spostano l’equilibrio della reazione, ma aumentano la velocità con cui l’equilibrio viene raggiunto • Non subiscono modificazioni permanenti durante la reazione e sono subito disponibili per catalizzare una nuovo ciclo di reazione Struttura generale degli enzimi ione metallico coenzima (vitamina) gruppo prostetico (legato covalentemente) OLOENZIMA APOENZIMA (Parte proteica) V=K3 x [ES] Vmax=K3 x [Etot] M K2 + K3 = Ks + K3 K1 + K1 K1 Misura efficienza catalitica V0 = K3 x [Et] = Vmax Kcat = Vmax = numero di turnover processi nell’unità di tempo Et M M M M M M M M M M M M M M M M M M M la Km aumenta se l'affinità di E per l'inibitore è maggiore di quella di ES (a > 1), la Km diminuisce se l'affinità di E per l'inibitore è minore di quella di ES (a < 1). M M M M M M M M Reazioni a due substrati S1 + S2 P1 + P2 Bi—Bi Uni-Bi Uni-Ter Meccanismi Sequenziali Le reazioni sequenziali sono quelle in cui tutti i reagenti si legano all'enzima prima che venga rilasciato il prodotto e possono venire suddivise in due sottoclassi, reazioni ordinate e reazioni casuali. Nel primo caso i reagenti si legano e i prodotti sono rilasciati secondo una sequenza obbligatoria, mentre nel secondo caso non esiste una sequenza di legame obbligatoria. Meccanismi a Ping-pong Le reazioni a ping-pong sono quelle in cui almeno un prodotto viene rilasciato prima che tutti i substrati si siano legati Grafici di Lineweaver-Burk Si consideri un grafico per un enzima che usa un meccanismo sequenziale: Qui A agisce da substrato variabile. Sono usati cinque valori di concentrazione di fisso, B, e ognuna dà cinque intercette con gli assi 1/v e 1/[A]. Questi rappresentano differenti valori apparenti di 1/Vmax and 1/KA. I valori veri sarebbero quelli ottenuti saturando la concentrazione di B, oppure a concentrazione infinita di B. Questi non possono essere misurati direttamente. La stima più vicina sarebbe la misura ottenuta alla più alta concentrazione di B.. Una proteina allosterica Una proteina allosterica è una proteina che contiene due o più siti di legame topologicamente distinti che interagiscono in modo funzionale l'un con l'altro. Il che significa che ci sono almeno due siti in due differenti posizioni che sono capaci di legare dei leganti (substrati, inibitori...). La formazione di un legame di un legante ad un sito altera le proprietà dell'altro sito. La maggioranza delle proteine allosteriche sono degli enzimi per il fatto che sono capaci di catalizzare delle reazioni, però alcune, come l'emoglobina, sono semplicemente delle proteine di legame o di trasporto. La cinetica sigmoidale Allo stato attuale il grafico iperbolico, della velocità contro la concentrazione del substrato vale per gli enzimi che seguono la legge di Michaelis-Menten,. Un simile grafico per un enzima allosterico dà un tipo di curva differente chiamato sigmoide, o curva ad S. Cooperatività Per cooperatività si intende il cambiamento della costante di legame della proteina nei confronti di piccole molecole a causa di una precedente formazione di legami di un'altra piccola molecola. Se la modificazione aumenta la capacità di legame (o affinità) si parla di cooperatività positiva. Se questa capacità di legame viene diminuita si parla di cooperatività negativa. Gli inibitori e attivatori allosterici, a cui ci riferiremo come effettori allosterici, sono una delle ragioni principali per l'importanza di detti enzimi. L'alterazione della velocità di catalisi enzimatiche per inibizione o attivazione è la chiave dei metodi di controllo metabolici. Il grafico seguente mostra il modo in cui gli effettori cambiano il grafico cinetico di un tipico enzima che mostra una coopeatività positiva. Dalle curve è chiaro che tutte tendano al valore di Vmax. Questo vuol dire che gli effettori hanno operato sulla capacità di legare il substrato e di conseguenza sulla Km. Questo sistema è detto Sistema K. Alcuni effettori lavorano cambiando la V max e si parla di Sistemi V. Risposta bifasica a inibitori competitivi Oltre all'inibizione allosterica, gli enzimi allosterici possono subire l'influenza di normali inibitori competitivi come qualsiasi enzima. Gli inibitori classici competitivi funzionano perchè sono chimicamente simili al substrato. In un enzima allosterico con cooperatività positiva da substrato un inibitore competitivo potrebbe essere molto simile al substrato in struttura da avere le stesse proprietà cooperative del substrato. Perciò a basse concentrazioni di substrato un inibitore competitivo aumenta la capacità dell'enzima di legare il substrato e quindi la sua velocità di reazione. Ad alte concentrazioni l'inibitore bloccherà il substrato legandosi al solito modo e rallentando di conseguenza la reazione. L'inibitore ha perciò un effetto bifasico. A basse concentrazioni sembra attivare, mentre ad alte concentrazioni disattiva come al solito. Ipotesi concertata Questa ipotesi di Monod, Wyman e Changeaux è una spiegazione semplice ed elegante per la cooperatività positiva da substrato e l'influenza degli effettori allosterici che sono comportamenti comuni per gli enzimi allosterici. Si basa sull'idea che un enzima allosterico sia costituito da un certo numero di subunità che possono esistere in due differenti conformazioni. Ci si riferisce alla conformazione Rilasciata, o stato R, e alla forma Tesa, o stato T. Le subunità di un particolare enzima interagiscono in modo tale che devono avere tutte la stessa conformazione. In altre parole l'enzima deve essere costituito o da soli R o da soli T, non sono ammesse miscele delle due. In soluzione le due forme si interconvertono l'una nell'altra secondo un equilibrio. Dal momento che non si possono avere miscele delle due forme, sarà un equilibrio molto semplice tra due forme consistenti di subunità o di solo R o di solo T. No Ipotesi sequenziale L'ipotesi concertata si basava sull'assunzione che una molecola di enzima potesse contenere un solo tipo di subunità, R o T. L'ipotesi sequenziale accetta la possibilità che possano trovarsi enzimi misti, contenenti cioè entrambe le subunità. Ancora si avrebbe un equilibrio di cui le forme pure R e T rappresentano gli estremi di questo equilibrio. Inibitori e attivatori Si può spiegare facilmente l'influenza degli effettori allosterici. Un attivatore lavorerebbe allo stesso modo del substrato, anche se si lega ad un sito differente della subunità, mentre un inibitore avrebbe l'effetto di rendere l'enzima più rigido rendendogli più difficile sottostare al cambio dell'adattamento indotto da R a T. Metodo spettrofotometrico DA=(p-s). Dc x l DA=(p-s). Dc x l Dt Dt Micromoli di substrato trasformate al minuti per litro di miscuglio di incubazione nel saggio Dc = 1 Dt nxl x 106 x DA p-s Dt U = 1 L nxl x 106 p-s x n=1 DA x Dt V v Concentrazione attività enzimatica Attività specifica purificazione (inibitori) METODO END POINT Se la conversione del substrato è completa S P A DA t Acido urico + O2 + H2O 293=12600 Allantoina + H2O + CO2 293=nullo Metodo a dosaggio accoppiato Modello di reazione accoppiata semplice a singolo substrato S P Enzima principale P1 Enzima indicatore Modello di reazione accoppiata ausiliaria a singolo substrato S Enzima principale P P1 Enzima ausiliario P2 Enzima indicatore Reazioni a due Substrati Sequenziali Ping-pong Seguire le variazioni spettrofotometriche di un substrato mantenendo la concentrazione saturante dell’altro Sampling method (metodo dell’accumulo) Si procede alla reazione per un tempo t poi si aggiunge un reattivo che denatura l’enzima e di colorare al tempo stesso sia il substrato che il prodotto Metodi cromatografici Si differenzia dal precedente solo per la misurazione al posto di uno spettrofotometro viene utilizzato un cromatografo Metodi radiometrici In questa maniera si fa in modo di incamerare nel prodotto uno o più radioisotopi
Scarica