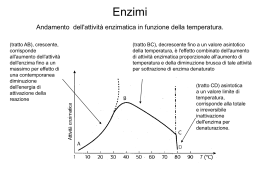
ENZIMI Importanza degli enzimi in Medicina 1. 2. 3. 4. 5. 6. Chiave per capire errori del metabolismo Importanti nelle reazioni di detossificazione Targets di chemioterapia Essenziali per formulare il razionale di un farmaco Punto di riferimento nella diagnosi e nel monitoraggio terapeutico Il ruolo primario delle vitamine è svolto come cofattori di enzimi Tutti gli enzimi sono proteine**** -hanno un peso molecolare tra 15 kDa – 1000 kDa -mostrano le stesse proprietà fisiche e chimiche delle proteine: 1. denaturazione 2. precipitazione 3. sensibilità alle proteasi **** alcuni RNA catalitici o ribozimi possono essere classificati come enzimi Gli enzimi sono caratterizzati da tre proprietà distintive: 1. CAPACITA’ CATALITICA 2. SPECIFICITA’ DI SUBSTRATO 3. REGOLAZIONE I residui amminoacidici che formano il sito di legame sono disposti in modo tale da reagire specificamente con il substrato mediante forze attrattive Molti enzimi necessitano di componenti chimici addizionali detti cofattori ioni inorganici (Fe2+, Mg2+, Zn2+) I cofattori possono essere coenzimi (molecole organiche o metallo-organiche) I coenzimi legati covalentemente all’enzima sono chiamati gruppi prostetici GRUPPO PROSTETICO + APOENZIMA = OLOENZIMA Esempi di enzimi che contengono come cofattori ioni inorganici Fe2+ o Fe3+ Catalasi Perossidasi Cu2+ Citocromo ossidasi Zn2+ Anidrasi carbonica Alcol deidrogenasi Mg2+ Glucosio-6-fosfatasi Piruvato chinasi Mn2+ Ribonucleotide reduttasi Ni2+ Ureasi Mo Dinitrogenasi Se Glutatione perossidasi Esempi di enzimi e coenzimi che trasferiscono gruppi chimici coenzima gruppi trasferiti enzimi FAD NAD atomi di idrogeno ione idruro deidrogenasi coenzima A gruppi acilici acil-transferasi tiamina pirofosfato gruppi idrossialchil. decarbossilasi piridossalfosfato gruppo amminico amminotransferasi biotina CO2 carbossilasi tetraidrofolato formil, metilen, metil transferasi C1 Studio della velocità delle reazioni enzimatiche P A (spontanea) v= [A] t = K[A] La velocità è proporzionale alla concentrazione di A e K è la costante di proporzionalità o costante di velocità Poiché v è proporzionale ad A (unico reagente), la reazione A è detta reazione di primo ordine (reaz. unimolecolare) P Invece nella reazione: A+B C+D v= K[A] [B] Poiché v è proporzionale al prodotto di due concentrazioni, la reazione è di secondo ordine. Energia libera media (stato iniziale) (Energia richiesta per aumentare l’E media di una mole di reagenti) C + D si verifica perché ad ogni istante dato La reazione A + B sia A che B hanno l’energia necessaria per raggiungere una condizione reattiva nota come stato di transizione. Ci sono due modi per accelerare una reazione chimica: A P P aumento della temperatura: aumenterà l’energia media dei reagenti diminuendo così l’energia necessaria a raggiungere lo stato di transizione. aggiunta di un catalizzatore: il catalizzatore abbassa il DG combinandosi temporaneamente con i reagenti in modo da promuovere il loro ingresso nella condizione reattiva dello stato di transizione CINETICA DELLE REAZIONI ENZIMATICHE Il cambiamento nella velocità di reazione in funzione della variazione della concentrazione del reagente è una delle misure principali dell’analisi cinetica Curva di saturazione del substrato per una reazione enzimatica (A) A bassa [S], v è proporzionale a [S] (reazione di primo ordine) Ad alta [S], v diviene indipendente da [S] e si avvicina ad un limite massimo. Il valore di v a questo limite è indicato come Vmax. La reazione enzimatica obbedisce ora ad una cinetica di ordine zero, cioè la velocità è indipendente dalla [reagente] e dipende direttamente dall’enzima. Quando v non aumenta anche se [S] aumenta, il sistema è saturato dal substrato Teoria generale di azione degli enzimi proposta da Michaelis e Menten: l’enzima E ed il suo substrato S si associano reversibilmente per formare un complesso ES. Il prodotto si forma in un secondo stadio quando ES si rompe per dare E+P lo stadio precoce della reazione è mostrato in scala maggiore E + S K1 K-1 ES K2 K-2 E+P L’equazione di Michaelis-Menten v 0 v K max m S S Km = costante di Michaelis-Menten Vo = velocità iniziale Vmax = velocità allo stato stazionario La velocità di una reazione enzimatica v in qualsiasi istante è determinata dal rapporto fra due costanti Km e Vmax e la concentrazione del substrato in quell’istante. Il valore di Km è definito dalla concentrazione di substrato che dà una velocità pari alla metà della velocità massima: quando [S]= Km, v= Vmax/2 Significato della costante di Michaelis L’equazione di Michaelis-Menten descrive una curva chiamata iperbole rettangolare Km è anche una misura dell’affinità dell’enzima per il suo substrato: se un enzima ha un piccolo valore di Km, vuol dire che raggiunge la massima efficienza catalitica a basse concentrazioni di substrato (bassa Km = alta affinità) La Commissione Internazionale sugli Enzimi definisce l’Unità Internazionale di Enzima come la quantità che catalizza la formazione di una micromole di prodotto in un minuto. Il numero di turnover di un enzima, Kcat, è una misura della sua massima attività catalitica. Kcat = numero di molecole di substrato convertite in prodotto per molecola di enzima per unità di tempo quando l’enzima è saturato con il substrato Il riconoscimento enzima-substrato e gli eventi catalitici che seguono sono fortemente dipendenti dal pH L’optimum di pH può non coincidere con l’ambiente naturale in cui l’enzima si trova: risposta al pH = regolazione intracellulare dell’attività enzimatica Effetti della temperatura sull’attività enzimatica La diminuzione dell’attività a temperature superiori a 50° è dovuta alla denaturazione termica. L’equazione di Michaelis-Menten descrive una curva chiamata iperbole rettangolare v 0 v K max m S S A causa della forma iperbolica del grafico di v in funzione di [S] la determinazione precisa del valore di Vmax non è possibile. La maniera migliore per ottenere i valori di Vmax è rimaneggiare l’equazione di MM per ottenere un grafico lineare. Dall’equazione di Michaelis-Menten si possono ottenere grafici lineari: prendendo i reciproci di entrambi i membri dell’equazione di M-M v 0 v K max m S S 1 V = Km + [S] Vmax [S] = 1 V = Km Vmax [S] + Km Vmax [S] 1 Vmax + [S] Vmax [S] Grafico dei doppi reciproci di Lineweaver-Burk questa equazione descrive una linea retta y= x= Inibizione enzimatica inibizione reversibile competitiva non competitiva l’inibitore interagisce con l’enzima attraverso reazioni non covalenti di associazione/dissociazione inibizione irreversibile l’inibitore causa alterazioni covalenti stabili dell’enzima I due tipi di inibizione si possono distinguere dal particolare tipo di andamento che si ottiene quando i dati cinetici sono analizzati in diagrammi lineari di Lineweaver-Burk INIBIZIONE REVERSIBILE La Succinato deidrogenasi – un esempio classico di inibizione competitiva INIBIZIONE REVERSIBILE inibizione competitiva Il substrato e l’inibitore competono per lo stesso sito di legame sull’enzima (sito attivo) L’aumento della [S] aumenta la probabilità che sia S a legarsi all’enzima invece dell’inibitore. Alti valori di [S] possono annullare l’effetto di I. La caratteristica di questo tipo di inibizione è che Vmax non è influenzata da I (tutte le rette mostrano la stessa intercetta sull’asse y) Km aumenta Vmax è invariata INIBIZIONE REVERSIBILE inibizione non competitiva L’inibitore ed il substrato si legano a siti diversi dell’enzima e il legame di I non influenza il legame di S Km invariata L’inibizione non può essere superata aumentando la [S] Vmax diminuisce (diminuzione dell’enzima attivo) INIBIZIONE IRREVERSIBILE - l’inibitore si lega irreversibilmente all’enzima (per es. con un legame covalente) . -tipo di cinetica osservata: simile all’inibizione non competitiva - differenza: la diluizione non è efficace a dissociare il complesso E-I e non ripristina l’attività enzimatica Substrati suicidi: sono inibitori analoghi del substrato che si legano covalentemente all’enzima con specificità ed alta affinità. la penicillina è un inibitore irreversibile dell’enzima glicoproteina transpeptidasi che crea i legami crociati nelle catene di peptidoglicano durante la sintesi della parete cellulare batterica. La specificità è il risultato del riconoscimento molecolare Il sito attivo dell’enzima comprende solo una parte della sua struttura, una speciale tasca complementare alla struttura del substrato Adattamento indotto il complesso cataliticamente attivo enzima-substrato è una struttura interattiva: -la forma del sito attivo dell’enzima si modifica in seguito al legame di S -l’enzima induce il substrato ad adottare una forma che mimi lo stato di transizione della reazione processo di riconoscimento dinamico fra E e S Controllo dell’attività enzimatica 1. 2. 3. 4. accumulo del prodotto (dimin. velocità di sintesi di P) disponibilità del substrato controllo genetico modifica covalente reversibile irreversibile 5. isozimi 6. proteine modulatrici 7. enzimi allosterici 4. Modificazioni covalenti reversibili: Fosforilazione Adenilazione Uridililazione ADP-Ribosilazione Metilazione Fosforilazione Gli enzimi regolati mediante modifiche covalenti sono chiamati enzimi interconvertibili Modificazioni covalenti irreversibili: Proteolisi (zimogeni) enzimi proteolitici del tratto digestivo L’attivazione proteolitica del chimotripsinogeno’ coagulazione del sangue Controllo dell’attività enzimatica 1. 2. 3. 4. accumulo del prodotto disponibilità del substrato controllo genetico modifica covalente reversibile irreversibile 5. isozimi 6. proteine modulatrici 7. enzimi allosterici Gli isozimi della lattato deidrogenasi 5. Isozimi (M4) Numerosi enzimi esistono in più strutture quaternarie che differiscono nelle proporzioni di associazione di due subunità A e B. (H4) Enzimi di interesse clinico che si presentano in forme multiple Enzima Lattico deidrogenasi (infarto del miocardio, epatite virale) Isocitrico deidrogenasi (epatiti virali) Glucosio-6-fosfato deidrogenasi (anemia) Glutammico deidrogenasi (affezioni epatiche) Aspartico transaminasi (infarto del miocardio) Creatina chinasi (indice di infarto e distrofia muscolare) Acetilcolinesterasi (anestesia) Colinesterasi (indice di funzionalità epatica) Fosfatasi alcalina (affezioni epatiche e dell’app. scheletrico) Controllo dell’attività enzimatica 1. 2. 3. 4. accumulo del prodotto disponibilità del substrato controllo genetico modifica covalente reversibile irreversibile 5. isozimi 6. proteine modulatrici 7. enzimi allosterici 6. Proteine modulatrici La proteina chinasi AMP ciclico dipendente (PKA) Controllo dell’attività enzimatica 1. 2. 3. 4. accumulo del prodotto disponibilità del substrato controllo genetico modifica covalente reversibile irreversibile 5. isozimi 6. proteine modulatrici 7. enzimi allosterici 7. Enzimi allosterici la loro cinetica non obbedisce all’equazione di Michaelis-Menten Grafico sigmoide di V in funzione di [S] Il modello della regolazione enzimatica: la glicogeno fosforilasi 1. In condizioni normali, l’attività di questo enzima nel muscolo è regolata allostericamente da metaboliti che riflettono lo stato energetico cellulare (AMP, ATP, glucosio 6 fosfato) 2. In caso di stress l’adrenalina stimola una cascata di reazioni che culminano nella fosforilazione (attivazione) dell’enzima STRUTTURA DEL MONOMERO DELLA GLICOGENO FOSFORILASI DIMERO DELLA GLICOGENO FOSFORILASI Curve di v in funzione di [S] per la glicogeno fosforilasi b) L’ATP è un inibitore a feed-back che influenza l’attività dell’enzima per il substrato c) L’AMP è effettore eterotropico positivo; si lega allo stesso sito dell’ATP (in competizione) ed influenza l’affinità dell’enzima per il substrato Livelli significativi di AMP indicano che lo stato di energia della cellula è basso e che dovrebbe essere prodotta più energia (ATP). I cambiamenti nelle concentrazioni cellulari di ATP e AMP e la loro competizione per il legame allo stesso sito con effetti opposti assicura che la produzione di energia sia proporzionata alle esigenze cellulari 1. Meccanismo della modifica covalente e della regolazione allosterica della glicogeno fosforilasi 2. La fosforilazione causa nella fosforilasi un drastico cambiamento conformazionale La glicogeno fosforilasi è regolata da cascate enzimatiche L’attivazione ormonale dell’adenilato ciclasi MECCANISMI DI AZIONE DEGLI ENZIMI I tipi di meccanismi catalitici utilizzati dagli enzimi sono stati classificati come: catalisi acido-basica catalisi covalente catalisi favorita da ioni metallici catalisi favorita da effetti di prossimità e di orientamento catalisi acido-basica (presente in quasi tutte le reazioni enzimatiche): la velocità aumenta se cambia il pH. Esistono di 2 tipi di catalisi acido-basica: catalisi acido-base specifica: gli ioni H+ o OH- accelerano la reazione (la concentrazione del tampone non ha alcun effetto sulla reazione) catalisi acido-base generale un acido o una base, diversi da H+ o OHaccelerano una reazione (il tampone può donare o accettare protoni, influenzando così la velocità di reazione) Catalisi covalente: alcune reazioni enzimatiche devono gran parte dell’aumento della loro velocità alla formazione di legami covalenti fra E ed S X= centro nucleofilo che attacca un centro elettrofilo catalisi favorita da ioni metallici: alcuni enzimi richiedono ioni metallici per svolgere la loro massima attività catalitica l’alcol deidrogenasi epatica uno ione zinco del sito attivo dell’enzima alcol deidrogenasi stabilizza la formazione di una carica negativa sull’atomo di ossigeno dell’acetaldeide, portando alla comparsa di una parziale carica positiva indotta sull’atomo di carbonio carbonilico catalisi favorita da effetti di prossimità e di orientamento le reazioni chimiche avvengono più velocemente quando i reagenti si trovano in prossimità, cioè vicini gli uni agli altri. Gli enzimi non solo mantengono i substrati e i gruppi catalitici vicini gli uni agli altri, ma li orientano in modo tale da favorire la catalisi MECCANISMI ENZIMATICI Serina proteasi Aspartato proteasi Serina proteasi classe di enzimi proteolitici il cui meccanismo catalitico è basato sulla presenza di un residuo di serina nel sito attivo. -tripsina enzimi digestivi sintetizzati nel pancreas e secreti -chimotripsina nell’apparato digerente come proenzimi inattivi o zimogeni -elastasi -trombina -plasmina -attivatore tissutale del plasminogeno -acetil colinesterasi= non è una proteasi ma una serina esterasi il cui meccanismo d’azione è correlabile a quello delle serina proteasi. Essa idrolizza il neurotrasmettitore acetilcolina nello spazio sinaptico interneuronico. Tripsina, chimotripsina ed elastasi catalizzano tutti la stessa reazione: la scissione di una catena polipeptidica. Tripsina: agisce su aa basici (arginina, lisina) Chimotripsina: agisce su aa aromatici Elastasi: agisce su piccoli residui di aa neutri Tre residui polari (His 57, Asp102, Ser195) formano la cosiddetta triade catalitica in corrispondenza del sito attivo il quale è costituito da una depressione sulla superficie dell’enzima. Le proteasi a serina sono sensibili alla inibizione da parte di fluorofosfati organici complesso covalente enzima-inibitore Il diisopropilfluorofosfato reagisce con i residui di serina del sito attivo delle serina proteasi e delle serina esterasi (come l’acetilcolinesterasi) causando una inattivazione. Acetilcolinesterasi: serina esterasi che degrada il neurotrasmettitore acetilcolina nei neuroni. DIFP: altamente tossico perché inibisce le acetilcolinesterasi. Sarin: molecola simile al DIFP (1995, metropolitana di Tokyo) Gas mortale VX: 10 volte più tossico del Sarin (Inghilterra) Aspartato proteasi classe di enzimi proteolitici il cui meccanismo catalitico è basato sulla presenza di due residui di acido aspartico nel sito attivo. Alcune aspartato proteasi rappresentative Nome Sorgente Funzione Pepsina Stomaco Digestione proteine della dieta Catepsina D Milza, Fegato Digestione lisosomiale proteine Renina Rene Regolazione pressione arteriosa Proteasi HIV-1 Virus AIDS Maturazione delle proteine del virus dell’AIDS A differenza delle serina proteasi, le aspartato proteasi non formano legami covalenti con i loro substrati peptidici. La proteasi del virus HIV-1 dell’AIDS è una aspartato proteasi La proteasi HIV-1 scinde la poliproteina originando proteine diverse necessarie alla crescita virale e all’infezione cellulare Gli inibitori delle proteasi prolungano la vita dei pazienti affetti da AIDS Terapia: inibitori proteasi + AZT Farmaci progettati con un disegno strategico basato sulla struttura: la parte della struttura contenente il gruppo -OH si inserisce fra i due gruppi carbossilici del sito attivo della proteasi Struttura dell’AZT inibitore della trascrittasi inversa CARATTERISTICHE DI UN FARMACO Biodisponibilità: capacità di raggiungere nell’organismo il luogo di azione desiderato Specificità: per la proteasi dell’HIV nei linfociti e non per le altre proteasi Novità: per contrastare i ceppi mutanti dell’HIV resistenti agli inibitori delle proteasi (ricerche ancora in corso)
Scarica