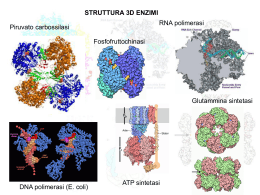
Cinetica Enzimatica • Fattori che influenzano le velocità • Substrato, prodotto, inibitore, attivatore, pH, forza ionica, temperatura • Analisi al variare dei fattori • Meccanismo cinetico di catalisi • Ipotesi sul complesso e sull’intermedio • Costanti cinetiche – concentraz. fisiologiche • Regolazione • Gruppi coinvolti • Modello per la reazione ENZIMI SONO PROTEINE CON PESO MOLECOLARE CHE VARIA DA 12.000 FINO A OLTRE UN MILIONE UNICA ECCEZIONE ALCUNI RNA CATALITICI ALCUNI HANNO BISOGNO DI COFATTORI – GRUPPO PROSTETICO : -IONI INORGANICI Fe2+ , Mg2+ , Mn2+ , Zn2+ , . . . . -MOLECOLE ORGANICHE - COENZIMI Alcuni enzimi che contengono come cofattori elementi inorganici Fe2+ o Fe3+ Citocromo ossidasi Catalasi Perossidasi Cu2+ Citocromo ossidasi Zn2+ Anidrasi carbonica Alcol deidrogenasi Mg2+ Esochinasi Glucosio-6-fosfatasi Piruvato chinasi Mn2+ Arginasi Ribonucleotide reduttasi K+ Piruvato kinasi Ni2+ Ureasi Mo Dinitrogenasi Se Glutatione perossidasi Alcuni coenzimi servono come trasportatori temporanei di specifici atomi o gruppi funzionali Coenzima Esempi di gruppi chimici trasferiti Precursore nella dieta dei mammiferi Tiamina pirofospato Aldeidi Tiamina (vitamina B1) Flavin adenin dinucleotide Elettroni Riboflavina (vitamina B2) Nicotinamide adenina dinucleotide Ione idruro (:H-) Acido nicotinico (niacina) Coenzima A Gruppi acilici Acido pantotenico e altre molecole Piridossal fosfato Gruppi amminici Piridossina (vitamina B6) 5’-deossiadenosilcobalamina (coenzima B12) Atomi di H e gruppi alchilici Vitamina B12 Biocitina CO2 Biotina Tetraidrofolato Gruppi a un atomo di carbonio Folato Acido lipoico Elettroni e gruppi alcilici Non necessario nella dieta • Un enzima cataliticamente attivo con tutti i suoi coenzimi o ioni metallici va sotto il nome di OLOENZIMA • La parte proteica di un enzima viene detta APOENZIMA o APOPROTEINA Classificazione internazionale degli enzimi N. Classe Tipo di reazione catalizzata 1 - Ossidoreduttasi Trasferimento di elettroni 2 - Trasferasi Reazioni di trasferimento di gruppi 3 - Idrolasi Reazioni di idrolisi (trasferimento di gruppi funzionali all’acqua) 4 - Liasi Addizione di gruppi a legami doppi o formazione di doppi legami mediante la rimozione di gruppi 5 - Isomerasi Trasferimento di gruppi all’interno di molecole formando isomeri 6 - Ligasi Formazione di legami C-C, C-S, C-O, C-N mediante reazioni di condensazione accoppiata alla scissione di ATP Legame di un substrato al sito attivo di un enzima Substrato Residui importanti Del sito catalitico Diagramma della coordinata di reazione per una reazione chimica Energia libera, G Stato di transizione (‡) DG‡ S P DGP‡ S Stato basale S DG°’ P Stato basale Coordinata della reazione N.B.:Nei sistemi biologici la variazione di energia libera standard è calcolata a pH 7,0 La relazione tra K’eq e DG°’ DG°’ = - RT ln(K’eq) K’eq DG°’ (kJ/mole) 10-6 34,2 10-5 28,5 10-4 22,8 10-3 17,1 10-2 11,4 10-1 5,7 1 0 101 -5,7 102 -11,4 103 -17,1 Diagramma della coordinata di reazione della reazione S P non catalizzata e catalizzata da un enzima Energia libera, G Stato di transizione (‡) ‡ DGnon cat. ‡ ‡ DGcat. S ES EP P Coordinata della reazione E+S ES EP E+P L’aumento della velocità prodotto da alcuni enzimi Anidrasi carbonica 107 Fosfoglucomutasi 1012 Succinil-CoA-trasferasi 1013 Ureasi 1014 Energia di legame, che si libera dalle interazioni enzima-substrato Gruppi catalitici specifici contribuiscono alla catalisi • Catalisi acido-basica generale • Catalisi covalente • Catalisi da ioni metallici Prima tappa della razione catalizzata dalla Chimitripsina, tappa di acilazione Cinetica Enzimatica • Fattori che influenzano le velocità • Substrato, prodotto, inibitore, attivatore, pH, forza ionica, temperatura • Analisi al variare dei fattori • Meccanismo cinetico di catalisi • Ipotesi sul complesso e sull’intermedio • Costanti cinetiche – concentraz. fisiologiche • Regolazione • Gruppi coinvolti • Modello per la reazione Reazioni catalizzate da enzimi v = velocità iniziali di reazione v v senza enzima (catalizzatore) con enzima (catalizzatore) [S] [S] S k1 k -1 P v d [P] k 1[S] dt v f ([S ]) ? [P] 4[E] 3[E] 2[E] v=[P]/t1 Reazioni catalizzate da enzimi [E] t1 t2 [E] Tempo di saggio S k1 k -1 P Formazione del complesso enzima substrato S S P S S ER S S S S ER P ER S S S k1 E+S k2 ES k-1 k3 EP k-2 E+P k-3 ER Approccio del rapido equilibrio in un sistema ad un substrato k1 E+S k2 ES k-1 k3 EP k-2 k1 E+S k-3 k2 ES E+P k-1 k-2 k1 k2 E+S ES k-1 E+P E+P k1 E+S k2 ES E+P [ES] [E] [S] KS k-1 [E] [S] v Ks [ET ] [E] [E] [S] Ks k2 v k 2 [ES] [ET ] [E] [ES] KS k 1 [E] [S] k1 [ES] [S] v Ks k 2 [ET ] 1 [S] Ks Equazione di Henri-Michaelis-Menten v k 2 [ES] [ET ] [E] [ES] v [S] V max Ks [S] APROCCIO DELLO STATO STAZIONARIO k1 E+S k2 ES E+P [S] v Km k 2[ET ] 1 [S] Km v [S] V max Km [S] k-1 Vmax v k 2 [ES] v [ET ] [E] [ES] 1.0 \\ 0.8 0.6 v k 2 [ES] [ET ] [E] [ES] 0.5 Vmax 0.4 0.2 d [ES] k 1 [E][S] k 1[ES] k 2[ES] 0 dt [ES] k 1[S] [E] ( k 1 k 2) Km [ES] k 1 k2 k1 [S] [E] v K m [ET ] [E] [S] [E] Km k2 [S] [E] Km \\ 0.0 0 2 4 6 8 10 100 [S] Km 1 Km 1 1 v V max [S] V max Grafico dei doppi reciproci 8 1/v 7 6 5 4 1/Vmax 3 2 1 0 -2 0 2 4 6 -1/Km 1/[S] 8 Enzimi multisubstrato E+A + B EA + B EP + Q EB + A EAB EPQ EA A + E + Q P+E + Q P + EQ EQ Meccanismo sequenziale A E B EA E P + E* + B E*B EAB EPQ Q EQ E Meccanismo PING PONG A E*P P P EA B E* Q EQ E INIBIZIONE ENZIMATICA Inibitore competitivo k1 k2 E+S +I ES Inibitore incompetitivo E+P E+S k-1 k1 k-1 KI ES k2 +I KI EI ESI Inibitore non competitivo E+S +I k1 k-1 ES +I KI KI EI + S k2 k1 k-1 ESI E+P E+P Formazione del complesso enzima inibitore competitivo I S P S I ER S S I S I ER S ER P ER ER Formazione del complesso enzima inibitore non competitivo I S P S I ER S S ER S ER S I S ER I I P ER ER Formazione del complesso enzima inibitore incompetitivo I S P S I S ER S ER S ER S I S I P ER ER INIBIZIONE ENZIMATICA Inibitore competitivo k1 k2 E+S ES Inibitore non competitivo E+P k-1 +I k1 E+S k-1 +I KI ES EI+S E+P E+S k1 k1 k-1 +I KI EI k2 Inibitore incompetitivo k2 ES E+P +I KI KI ESI ESI k-1 1/v I =KI 8 I aumenta I aumenta 1/v I =0 6 8 1/v I =0 6 1/Vmaxapp 4 8 I =0 6 1/Vmaxapp 4 4 1/Vmax 2 -2 2 0 2 -1/Km app. 1/[S] 4 6 8 -2 2 0 -1/Km 2 1/[S] 4 6 8 -2 -1/Km app. 0 2 1/[S] 4 6 Regolazione dell’attività enzimatica - Enzimi allosterici k1 ET S k2 E + nS ET E(S)n E + nP k-1 S ER v [ S ]n V max K '[ S ] n ET 1.0 0.8 0.6 0.4 0.2 0.0 0 S ER ER S S ER ER S 2 4 6 8 10 ER ET EETT ER EET T ER ER ET ER ET S EETT S EET T ER ER ER ET ER ET S E ETT EET T S S ER ER S ER ET ET S E ETT ER EET T S S ER ER ET S S S ER S S S ET ER E ETT EET T ET S S S ER ER S ER S Aspartato transcarbamilasi (ATCasi) Effetto del pH sulle attività enzimatiche e sulla stabilità 1 v 0.5 pKa1 pKa2 0 3 4 5 6 7 pH 8 Effetto della temperatura sulle attività enzimatiche e sulla stabilità v V max k 2 [ET ] k Ae Ea RT 10 20 30 40 50 60 Temp. (°C) Effetto della temperatura Equazione di Arrhenius - energia di attivazione logk pendenza k Ae Ea RT log k Ea 1 log A 2.3 R T Ea 2.3 R 1 T
Scarica