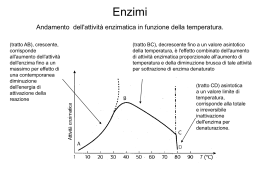
Enzimi (“nel lievito”): un po’ di storia... • Il primo nome ad essi assegnato fu fermenti • 1835: prima teoria della catalisi chimica (Jöns Jacob Berzelius, chimico svedese) • 1860: fermentazione causata da sostanze termolabili (Louis Pasteur, microbilogo francese) • 1877: primo uso del termine enzima • 1897: estrazione dal lievito degli enzimi che catalizzano la fermentazione alcoolica; dimostrazione che la fermentazione può avvenire in assenza di cellule integre (Eduard Buchner, tedesco, premio Nobel per la chimica) • 1926: cristallizzazione dell’ureasi (James Sumner, chimico americano) • 1930: cristallizzazione di pepsina, tripsina e chimotripsina: tutti gli enzimi sono proteine (John Howard Northrop, americano, premio Nobel per la chimica) • 1960: teoria dell’allosterismo (François Jacob, Jacques Monod, francesi, premio Nobel per la Medicina , Jan Pierre Changeaux, genetista francese) Sono proteine con il compito di catalizzare le reazioni chimiche che avvengono negli organismi viventi. Essi si sono evoluti con la funzione di portare all’equilibrio le reazioni dell’organismo in tempi brevissimi. La loro regolazione permette all’organismo di selezionare quali reazioni devono essere accelerate, e quali invece rallentate o anche bloccate. Gli enzimi sono i più potenti, efficienti e specifici catalizzatori che si conoscono. Gli enzimi sono catalizzatori delle reazioni biochimiche. Un catalizzatore è una sostanza che non partecipa direttamente alla reazione chimica (si trova nella stessa quantità prima e dopo la reazione stessa), ma la accelera o la rende possibile in condizioni ambientali più favorevoli. Ad esempio la scissione del glucosio richiede una temperatura di 100° e tempi lunghissimi, mentre gli enzimi permettono una rapida reazione all’interno del corpo umano. I catalizzatori sono anche il cardine della moderna chimica industriale, e gran parte della ricerca si concentra sul ritrovamento di nuovi catalizzatori che rendano i processi più economici. Nell’organismo gli enzimi sono indispensabili alla vita: per capire la loro importanza basta pensare che le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. Alcune caratteristiche degli enzimi • OTTIMIZZARE LA RESA: – Svolgere solo le reazioni necessarie – Impedire reazioni indesiderate (specificità di substrato) – Portare a termine le reazioni in tempi brevi – Indipendenza dall’ambiente (temperatura, pressione) – Riutilizzo della stessa “macchina” per molte volte • MINIMIZZARE GLI SPRECHI: – Non produrre sottoprodotti (specificità di reazione) – Minimizzare il dispendio energetico Energia di attivazione La conversione X --> Y è termodinamicamente favorevole (Y si trova ad uno stato energetico inferiore rispetto a X), ma la reazione non può avvenire se X non acquisisce sufficiente energia per superare la barriera dell’energia di attivazione Distribuzione di energia in una popolazione di molecole • Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso • Solo una piccola frazione di esse possiede sufficiente energia per superare la barriera dell’energia di attivazione Enzimi: catalizzatori biologici Reazione non catalizzata DG* Reazione catalizzata DG* X DG • • • Y Gli enzimi si combinano transientemente col substrato e ne abbassano l’energia di attivazione Non spostano l’equilibrio della reazione, ma aumentano la velocità con cui l’equilibrio viene raggiunto Non subiscono modificazioni permanenti durante la reazione e sono subito disponibili per catalizzare una nuovo ciclo di reazione La catalisi enzimatica Gli enzimi: • abbassano la barriera dell’energia di attivazione inserendo stati di transizione più bassi • stabilizzano lo stato di transizione Classificazione internazionale degli enzimi • gli oltre 1500 enzimi noti sono riuniti in sei classi funzionali: – – – – – – Ossidoreduttasi Trasferasi Idrolasi Liasi Isomerasi Ligasi Classificazione internazionale degli enzimi • • • • • • 1 - ossidoreduttasi 2 - transferasi 3 - idrolasi 4 - liasi 5 - isomerasi 6 - ligasi: reazioni di formazione di nuovi legami con rottura di ATP in AMP e pirofosfato o ADP e Pi – – – – 6.1 6.2 6.3 6.4 legami legami legami legami C-O C-S C-N C-C Reversibilità delle reazioni enzimatiche • L’enzima favorisce il raggiungimento dell’equilibrio, quindi catalizza anche la reazione inversa A <====> B • Ma, se B è substrato di una reazione successiva, la prima reazione diventa praticamente irreversibile A -----> B <====> C • Ciò vale per catene anche molto lunghe di reazioni (catene enzimatiche) Struttura generale degli enzimi ione metallico coenzima (vitamina) gruppo prostetico (legato covalentemente) OLOENZIMA APOENZIMA (Parte proteica) Il sito attivo La maggior parte delle reazioni enzimatiche utilizza substrati che sono di piccole dimensioni se comparati alla molecola enzimatica. Di conseguenza solo una piccola parte della proteina enzimatica si trova a diretto contatto con la molecola del substrato a formare il COMPLESSO ENZIMA-SUBSTRATO (ES). Le porzioni di enzima a contatto con il substrato che giocano un ruolo diretto nel processo catalitico costituiscono il cosiddetto SITO ATTIVO (o CATALITICO). Il resto della proteina enzimatica fornisce una specie di scheletro strutturale che garantisce il mantenimento dei componenti del sito attivo nella conformazione tridimensionale necessaria ad una efficiente e specifica catalisi. L’elaborazione matematica mirata a correlare la velocità di una reazione enzimatica con la quantità di enzima presente è chiamata derivazione di Michaelis-Menten Questa relazione fornisce la descrizione analitica delle interazioni esistenti tra Vmax, v e [S] Come variano le concentrazioni dei vari componenti durante la reazione Con queste assunzioni si ricava l'equazione di Michaelis-Menten. Cinetica enzimatica • 1913: Michaelis e Menten • approccio cinetico basato su: assunzione del “quasi equilibrio” (“equilibrio rapido”) assunzione della velocità iniziale GRAFICO DI MICHAELIS MENTEN L'equazione di Michalis Menten è un‘ IPERBOLE EQUILATERA e l'enzima viene caratterizzato da due costanti: Km, cioè la concentrazione del substrato per cui v è metà della Vmax. Vmax, la velocità massimale della reazione che si ha quando [S]>>Km L’equazione di Michaelis-Menten descrive un’ iperbole rettangolare avente come asintoti Vmax e -Ks ( o -Km). KM é ... [S] alla quale v = Vmax/2 [S] alla quale metà dei siti attivi dell’enzima sono occupati KM = legame >, affinità > Il valore della Km è importante perché: a) è una costante specifica per ogni enzima b) è una stima della concentrazione intracellulare del substrato. c) lo studio dell' effetto di diversi composti sulla Km permette di identificare eventuali inibitori. d) conoscendo il valore della Km di un enzima, è possibile misurarne la Vmax ( [S]>>Km ) che è una misura indiretta di [Etot]. Inibizione enzimatica In molti casi, piccole molecole specifiche o ioni possono competere con le molecole di substrato nel legarsi con l’enzima ed inibire l’attività dell’enzima. Quando ciò si verifica, le molecole di enzima, costrette a impegnarsi anche con gli inibitori, solo in parte si legano alle molecole di substrato. Questo fenomeno, automaticamente, riduce la velocità di reazione ed abbassa il turnover dell’enzima. L’inibizione viene sfruttata da molti farmaci quando si vuole curare una malattia in modo molto selettivo. L’inibizione può essere irreversibile e reversibile. E’ irreversibile quando l’inibitore e l’enzima si legano con legame molto forte per formare il complesso EI e la reazione di ritorno risulta molto lenta o non avviene per niente in quanto l’enzima è inattivato e non è più in grado di legare il substrato normale. Un esempio di inibizione irreversibile è dato dall’azione dei gas nervini che bloccano l’azione dell’enzima acetilcolinesterasi, un enzima che ha un ruolo importantissimo nella trasmissione degli impulsi nervosi. L’inibizione reversibile può essere competitiva, quando gli inibitori sono, da un punto di vista chimico, molto simili alle molecole di substrato e si legano agli stessi siti attivi, e non competitiva, quando gli inibitori si legano a siti dell’enzima diversi da quelli che legano il substrato e, pertanto, possono legarsi sia all’enzima che al complesso ES. Possono, però, anche instaurare con l’enzima un legame che deforma spazialmente i siti di legame del substrato e impedire la formazione del complesso ES. Inibizione enzimatica Ogni sostanza che riduca la velocità di una reazione enzimatica è da considerarsi un INIBITORE. L’inibizione può essere IRREVERSIBILE o REVERSIBILE; un inibitore reversibile forma legami non covalenti e transitori con l’enzima. La formazione reversibile di un legame non covalente con una molecola diversa dal substrato porta alla formazione di complessi anomali, non produttivi, che non fanno parte del normale processo catalitico. Ci sono 3 tipi principali di inibizione reversibile: Competitiva, Non Competitiva, Acompetitiva. • Reversibile – Competitiva – Non competitiva • Nella trattazione cinetica della inibizione enzimatica si applicano le assunzioni di Michaelis-Menten anche all'inibitore – Acompetitiva KI • Irreversibile E+I EI A) Inibizione competitiva. Un inibitore competitivo è una sostanza che si lega all'enzima libero, impedendo così la formazione del complesso enzima-substrato (ES). Esso può essere un analogo non metabolizzabile del substrato, un substrato alternativo per l'enzima o un prodotto di reazione. B) Inibizione non-competitiva. In un tipico sistema di inibizione non-competitiva l'inibitore non ha alcun effetto sul legame del substrato con l'enzima, ed il substrato non ha alcun effetto sulla formazione del legame tra inibitore ed enzima, in quanto entrambi si legano reversibilmente all' enzima in siti differenti C) Inibizione acompetitiva. Il tipico.inibitore acompetitivo è una sostanza che si lega reversibilmente al complesso ES dando origine al complesso non produttivo ESI. Enzimi con siti catalitici multipli cooperativi: enzimi allosterici. Se il legame di una molecola di substrato (o di altro legante) con l' enzima induce cambiamenti strutturali tali da alterare le affinità dei siti vacanti, la curva di v / [S] non seguirà più la cinetica di MichaelisMenten e l'enzima sarà classificato come allosterico. Generalmente, ma non sempre, gli enzimi allosterici hanno delle curve v/[S] di tipo sigmoidale. Se il legame di una molecola di substrato (o di altro legante) facilita il legarsi di ulteriori molecole di substrato come conseguenza di una aumentata affinità dei siti vacanti si parla di EFFETTO COOPERATIVO POSITIVO. I vantaggi potenziali di una risposta sigmoidale si possono constatare comparando tra loro una una iperbolica con una sigmoidale. REGOLAZIONE ALLOSTERICA La regolazione allosterica è un esempio di modulazione delle vie metaboliche in modo tale da adattare le velocità di reazione alle esigenze funzionali della cellula. Nel metabolismo cellulare vi sono gruppi di enzimi che lavorano insieme in vie sequenziali per condurre un certo processo metabolico. La velocità complessiva di tutta la reazione è determinata da un enzima "chiave" che regola la tappa più lenta dell’intero processo. Questi enzimi regolatori presentano un'attività catalitica aumentata o diminuita in risposta a certi segnali che sono in genere costituiti da piccole molecole o cofattori. Mediante l'azione di tali enzimi, la velocità di ogni sequenza metabolica si adegua costantemente alla domanda cellulare di energia e di biomolecole necessarie per il mantenimento della cellula. Gli enzimi allosterici agiscono mediante il legame reversibile non-covalente di un metabolita regolatore, detto effettore (inibitore o attivatore), e sono in grado di acquisire nuove conformazioni. Gli effettori allosterici non agiscono direttamente sul sito catalitico, ma indirettamente ne modificano la struttura fissandosi su un altro sito ad essi destinato (sito allosterico). Il legame di un attivatore/inibitore al sito allosterico determina una modificazione conformazionale dell'enzima tale da condizionare l'attività catalitica dell'enzima stesso. Entrambi i processi di inibizione ed attivazione sono reversibili in quanto il distacco dell'effettore allosterico (inibitore o attivatore) determina il ritorno dell'enzima alla conformazione iniziale, attiva o inattiva. La regolazione nell'attivare/inibire con legame proteine covalente specifiche consiste mediante il trasferimento di gruppi funzionali. Un classico esempio di processo biologico con regolazione covalente è il legame tra un ormone peptidico o un fattore di crescita e un recettore di membrana che determina una serie di reazioni a cascata. Il cambiamento conformazionale del recettore attiva il trasduttore (T) il quale a sua volta acquista la capacità di attivare un amplificatore (A). Quest'ultimo converte uno specifico precursore (X) nel "secondo messaggero" il quale attiva un effettore che determina la risposta funzionale della cellula bersaglio allo stimolo iniziale. La glicogeno fosforilasi è un enzima omodimerico che esiste in due stati conformazionali T (meno attiva) ed R (più attiva): il glicogeno si lega preferenzialmente all'enzima nella forma R La glicogeno fosforilasi fosforilata è quella più attiva (fosforilasi a); nel fegato è inibita allostericamente dal glucosio che si lega alla forma T) La fosforilasi b (non fosforilata) è comunque sufficientemente attiva per produrre glucosio-1-fosfato utilizzato nella glicolisi per generare l'ATP necessario per l'attività basale delle cellule sia epatiche che muscolari. Nel muscolo la fosforilasi b è attivata da AMP (attivatore allosterico che si lega alla forma R) ed inibita da ATP e glucosio-6-fosfato (inibitori allosterici che si legano alla forma T) Modificazioni covalenti Un'altra modalità di regolazione dell'attività enzimatica è quella che si realizza attraverso modificazioni covalenti della proteina enzimatica. La più comune di esse consiste in reazioni fosforilazione/defosforilazione della catena polipeptidica. di I residui amminoacidici coinvolti sono la serina, la tirosina o la treonina, ai quali si lega, mediante un legame estere, un gruppo fosforico. Le modificazioni di questo tipo sono reversibili e sono catalizzate da enzimi specifici: le proteina-cinasi, che provocano la fosforilazione dell'enzima; le proteina-fosfatasi, che ne provocano la defosforilazione. La fosforilazione può avere sia l'effetto di attivare, sia quello di inattivare un enzima. Generalmente, questo tipo di regolazione è diretto su un enzima-chiave di una via metabolica ed è chiaramente finalizzato a regolare l'intera via, in maniera razionale e funzionale.
Scarica