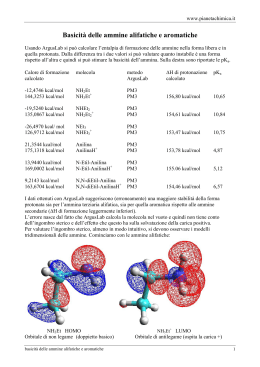
EQUILIBRI TAUTOMERICI RAZIONALIZZAZIONE DEGLI EQUILIBRI TAUTOMERICI E possibile sulla base di considerazioni riguardanti: 1) i corrispondenti equilibri nei composti aliciclici 2) le energie di legame e l’aromaticità 1) Composti aliciclici i CHETONI esistono come tali piuttosto che nella forma enolica O OH 106 : 1 ∆G = 8 Kcal 2) Composti aromatici O OH cicloesadienone fenolo 1 : 1010 ∆Garomaticità = 36 Kcal In questi casi, in genere prevale la forma enolica stabilizzata dall’aromaticità 2) Composti aromatici O O O O O OH O Negli idrossifurani l’aromaticità non è sufficiente a stabilizzare la forma enolica: prevale la struttura furanonica (chetonica) O OH O ∆Garomaticità = 16 Kcal 2) Composti aromatici La situazione è borderline per gli idrossitiofeni S OH ∆Garomaticità = 24 Kcal Consideriamo le Energie di legame … O H OH C C C C H H C O -179 C O -86 C C -83 C C -146 C H -99 O H -111 -361 Kcal/mol -343 Kcal/mol Il chetone è più stabile di ∆E = -18 Kcal/mol N.B. calcoli molto grossolani: 1) valori medi dell’Energia di legame 2) si riferiscono alla fase gassosa 3) ± 5 Kcal/mol Consideriamo le Energie di legame … O OH H H H -361 -343 ER≈ -5 ER≈ -36 -366 Kcal/mol -379 Kcal/mol Il chetone è meno stabile di ∆E = +13 Kcal/mol N.B. calcoli molto grossolani: 1) valori medi dell’Energia di legame 2) si riferiscono alla fase gassosa 3) ± 5 Kcal/mol Se sono presenti più gruppi enolici, l’energia di risonanza può essere insufficiente a contro-bilanciare il ∆E di legame O OH Resorcina: è enolica ma mostra maggiore reattività chetonica del fenolo O OH OH O Fluoroglucina: comportamento intermedio tra chetone e fenolo HO OH O O L’equilibrio tautomerico nelle AMMIDI semplici è ancora più spostato verso la forma “OSSO” che nei chetoni OH O R R NH2 NH Nell’idrossipiridina c’è la possibilità che l’idrogeno si sposti sull’azoto dell’anello. Tale struttura mantiene gran parte dell’aromaticità, quindi la sua formazione è favorita O OH O N N N H non si forma (∆Garomaticità = 4 Kcal) stabile in fase gassosa (∆Garomaticità = 28 Kcal) stabile in fase solida e liquida (∆Garomaticità = 16 Kcal) Importanza degli Equilibri tautomerici Gli elettrofili possono così attaccare l’azoto eterociclico Gli elettrofili possono attacare l’azoto esociclico Reazioni della 2-amminopiridina Più stabile In tutti i casi l’elettrofilo attacca prima l’azoto eterociclico! Anche se esistono esempi in letteratura a riguardo, non è corretto usare metodi chimici per determinare la preponderanza di un tautomero rispetto ad un altro Es.: Acidi barbiturici Relazione tra acidità e tautomeria Questa relazione può essere sfruttata per studiare gli equilibri tautomerici (metodo della basicità). Entrambi i tautomeri hanno l’anione in comune. Studio della tautomeria tramite NMR Il limite della spettrometria NMR non è però solo determinata dalla scala dei tempi, ma anche dalla sua sensibilità. Infatti anche con i migliori spettrometri non è possibile identificare i tautomeri se il rapporto è maggiore di 50:1. In questi casi si ricorre alla spettroscopia Uv-Vis, sfruttando anche il metodo dei derivati fissi Concetto dei “derivati fissi” tautomeri specie non tautomeriche, fisse Lo spettro della 3metanensulfonammidopiridina (C) mostra la prevalenza della specie neutra su quella zwitterionica (9:1) B C A C A B La medesima tecnica è stata applicata al 4-piridinetione (A). Lo spettro di A non fornisce chiare indicazioni quantitative. In questo caso si ricorre al metodo della basicità. A B C Se Kt = K1/K2 catione comune ai due tautomeri allora: Kt ≈ K’1/K’2 p Kt = pK’1 - pK’2 Tautomeria delle piridine NH2 N 4-amminopiridina p Kt = +8.7 OH NH O α- e γ-piridoni N N p Kt = -3.3 H H SH 3-idrossipiridina OH N p Kt = 0 N α- e γ-tiopiridoni S O N N p Kt = -4.6 H Gli equilibri tautomerici di piridine sostituite in soluzione acquosa sono influenzati dal bilancio fra energia di legame e aromaticità N H Gli equilibri tautomerici sono importanti anche in ambito biologico, quando si studiano le interazioni che le biomolecole possono dare in un dato ambiente di reazione. La tautomeria può influenzare gli studi che riguardano le interazioni con le basi azotate presenti negli acidi nucleici, che nella forma idrossi- o chetopossono dare diversi legami a ponte a idrogeno.
Scarica