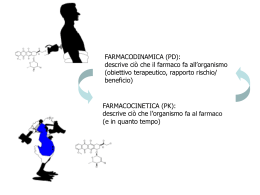
FARMACODINAMICA (PD): descrive ciò che il farmaco fa all’organismo (obiettivo terapeutico, rapporto rischio/ beneficio) FARMACOCINETICA (PK): descrive ciò che l’organismo fa al farmaco (e in quanto tempo) ADME Assorbimento Distribuzione Metabolismo Escrezione ADME : definizioni ASSORBIMENTO Velocità: dipende da diversi fattori; per un dato farmaco è proporzionale alla sua concentrazione a livello del sito di assorbimento Entità: è definita dalla competizione tra velocità di assorbimento e velocità con cui il farmaco viene perso (p.e per degradazione chimico-fisica, metabolizzazione o passaggio attraverso il tratto GI) VALUTAZIONE DELL’ ASSORBIMENTO INTESTINALE FATTORI CHE INFLUENZANO L’ ASSORBIMENTO INTESTINALE ESPRESSIONE DI ENZIMI FARMACO-METABOLIZZANTI NEI DIVERSI SEGMENTI DEL TRATTO INTESTINALE MODELLI PER LO STUDIO DELL’ASSORBIMENTO INTESTINALE Modelli in vivo Modelli in situ Modelli in vitro Modelli organotipici Sacco intestinale rovesciato (everted drug sac) Segmenti intestinali isolati e perfusi Camere di Ussing Modelli cellulari Parallel artificial membrane permeability assay (PAMPA) Test di permeabilità MODELLI CELLULARI PER LO STUDIO DELL’ASSORBIMENTO INTESTINALE Sistemi non intestinali: MDCK (Madin Darby canine kidney cells) Linee cellulari di ratto derivate da intestino tenue fetale o neonatale Caco-2 amount transported Papp (cm sec−1) = Area * time 1 * initial concentration CARATTERISTICHE DELLA LINEA CELLULARE Caco-2 Origine Adenocarcinoma colorettale umano cellule epiteliali in monostrato Crescita cellule epiteliali in monostrato Differenziamento 14-21 dopo la confluenza morfologia Cellule polarizzate, con giunzioni serrate e orletto a spazzola apicale Parametri elettrici Resistenza elettrica elevata Enzimi digestivi Peptidasi e disaccaridasi specifiche dell’intestino tenue Trasporto attivo Aminoacidi, zuccheri, vitamine, ormoni…. Trasporto ionico di membrana Na+,K+ ATPasi, H+,K+ ATPasi, scambiatore Na+,H+, cotrasportatore Na+,K+, Cl-, canali apicali per Cl- Trasportatori non ionici di membrana P-glicoproteina, MRPs, LRP Recettori Vitamina B12, vitamina D3, EGF, trasportatori per il glucosio (GLUT1,3,5 e SGLT1) CONDIZIONI DI COLTURA PER L’USO DELLA LINEA CELLULARE Caco-2 Siero inattivato nel terreno sul versante apicale 20% Siero inattivato nel terreno sul versante basolaterale 20% rivestimento Collagene di tipo I (non richiesto con filtri dal 0.4 μm) Additivi Aminoacidi non essenziali (1%) Glucosio (25 mM) Glutamina (2 mM) Antibiotici (streptomicina 100 μg/l; penicillina (100mU/ml) CO2 10 o 5% pH Generalmente 7.4 su entrambi i versanti, o 7.4 sul versante basolaterale e 6.4 su quello apicale Densità cellulare alla semina 2.5 x 103 – 4 x 103 Numero di passaggi 25 – 100 PRINCIPALI CONTROLLI DA EFFETTUARE SU CELLULE IN MONOSTRATO Resistenza elettrica transepiteliale (TEER) 260 – 420 Ω/cm2 Può indicare tossicità o perdita ddi funzionalità delle tight junctions Markers di differenziamento Attività enzimatiche: saccarosio isomaltasi, aminopeptidasi, fosfatasi alcalina Differenziamento morfologico Microscopia elettronica Espressione della Pgp Immunoistochimica, Western blot o misura dell’attività della Pgp Assenza di contaminazione da micoplasmi Metodi microbiologici standard Integrità del monostrato cellulare mediante misura della permeabilità a composti standard Mannitolo, PEG Meccanismo Ruolo della P-gp Ruolo delle MRP Ruolo della LRP Agenti Inibitori Verapamil Chinidina Ciclosporina A 0.5 mM sul versante apicale (A) e basolaterale (B) 0.5-1 mM in A e B 50 μM in A e B Substrati Rodamina 123 1 mM Inibitori Come i substrati Substrati Leucotriene C4 S2,4-dinitrofenilglutation e PAH Doxorubicina Etoposide Vinblastina Metotrexate Aumento del trasposrto dal versante A al B (se il farmaco è posto sul versante A) Inibitori Substrati Trasporto paracellulare Effetti EGTA citocalasina Antracicline Aumento del trasporto, se è paracellulare PASSAGGIO ATTRAVERSO LA BARRIERA EMATOENCEFALICA PASSAGGIO ATTRAVERSO LA BARRIERA EMATOENCEFALICA BCEC (brain capillary endothelial cells) immortalizzate condizionali ottenute da animali transgenici PASSAGGIO ATTRAVERSO LA BARRIERA EMATOENCEFALICA PASSAGGIO ATTRAVERSO LA BARRIERA EMATOENCEFALICA PASSAGGIO ATTRAVERSO LA BARRIERA EMATOENCEFALICA PASSAGGIO ATTRAVERSO LA BARRIERA SANGUE-CSF PASSAGGIO ATTRAVERSO LA BARRIERA PLACENTARE VALUTAZIONE DEL LEGAME ALLE PROTEINE PLASMATICHE ALBUMINA >>> altre proteine (p.e. α-glicoproteina acida) Spiazzamento di farmaci che legano specifici siti Ibuprofene Warfarin ADME : definizioni ELIMINAZIONE: perdita irreversibile di farmaco dall’organismo Velocità: proporzionale alla concentrazione del farmaco Entità: dipende dalla competizione tra vie di eliminazione diverse ADME : definizioni METABOLISMO: Perdita irreversibile di farmaco dovuta alla formazione di nuove specie chimiche Detossificazione/attivazione Fase I:ossidazione (CYP-dipendente) riduzione, idrolisi Fase II:coniugazione ADME : definizioni METABOLISMO (cont.) Principalmente a livello epatico (ma anche intestinale, polmonare e cutaneo) Complessità: Induzione Inibizione Polimorfismi INTERAZIONI CON ALTRI FARMACI VARIABILITÀ ADME : definizioni ESCREZIONE: perdita irreversibile del composto originale Renale: dipende dalla struttura chimica (carattere idrofilo) e dal peso molecolare Biliare: dipende dalla struttura chimica (è necessaria la presenza di un gruppo non polare) e dal peso molecolare Altre vie, generalmente meno importanti PRIINCIPALI ENZIMI IMPLICATI NEL METABOLISMO DEI FARMACI NELL’UOMO Fase I: enzimi citocromo P450-dipendenti (CYP) CYP1A2, CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1 CYP3A4 Fase II: UDP-dependent glucuronosyl transferase (UGT), phenol sulfotranferase (PST) estrogen sulfotransferase (EST) glutathione-S-transferase (GST). STUDI METABOLICI IN VITRO FRAZIONE EPATICA S9 MICROSOMI in sospensione EPATOCITI in coltura SUPERSOMI % parent compound = disappearance parent compound concentration (after incubation) 1− parent compound concentration (before incubation) . 100 X 100 Sperimentazione clinica (Fasi I e II) Tossicità acuta (somministrazione singola a dosi elevate) Molecola candidata per lo sviluppo Tossicità per somministrazioni ripetute (da 1 a 6 mesi) Mutagenesi in vitro Tossicità dello sviluppo (fertilità, sviluppo peri- e post-natale, teratogenicità) Mutagenesi in vivo Cancerogenesi (studio per due anni nel topo e nel ratto) Tossicità speciali TEST DI TOSSICITÀ ACUTA valutano effetti avversi che si verificano entro un tempo breve dalla somministrazione di una dose singola della sostanza in esame devono essere effettuati almeno su due specie animali, di cui una non roditrice; il farmaco deve essere somministrato secondo almeno due vie di somministrazione gli animali vengono osservati per 14 gg DL50 Dose singola, derivata statisticamente, di una sostanza, per la quale ci si attende una mortalità pari al 50% degli animali trattati TEST DI TOSSICITÀ PER SOMMINISTRAZIONI RIPETUTE SCOPI ottenere informazioni sulla tossicità di un prodotto medicinale prevedibilmente destinato ad essere somministrato ripetutamente valutare i rischi connessi con l’impiego terapeutico del prodotto stesso, tenendo anche conto dei suoi prodotti di biotrasformazione TEST DI TOSSICITÀ PER SOMMINISTRAZIONI RIPETUTE Durata proposta per il trattamento nell’uomo Durata suggerita per gli studi di tossicità Una o più dosi nell’arco di 24h 2 settimane (studi di tossicità acuta) Fino a 7 gg 4 settimane (studi di tossicità subacuta) Fino a 30 gg 3 mesi (studi di tossicità subcronica) Oltre 30 gg 6 mesi (studi di tossicità cronica) Test di tossicità dello sviluppo i. ii. iii. iv. v. vi. vii. viii. ix. Modifiche della fertilità o procreazione anormale Interferenza con le fasi del pre-impianto e dell’impianto dello sviluppo fetale Effetti tossici sull’embrione Effetti tossici sul feto Modifiche della fisiologia materna con conseguenti effetti tossici secondari sull’embrione o sul feto Effetti sulla crescita e sullo sviluppo dell’utero o della placenta Interferenza con il parto Effetti sullo sviluppo post-natale, sull’allattamento e sulla capacità di prendere il latte da parte dei nati Effetti tardivi sulla discendenza Test di tossicità dello sviluppo Segmento Segmento Segmento Segmento I - Test di performance riproduttiva e fertilità generale II – Teratogenesi III – Tossicità peri- e post-natale IV – Studi multigenerazionali Test di cancerogenesi Sono di norma indispensabili a) Quando appare possibile che un farmaco sia somministrato con regolarità per un periodo di tempo abbastanza lungo b) Quando la struttura chimica del farmaco fa sospettare un potenziale effetto cancerogeno c) Quando il farmaco può suscitare dubbi a causa di i. Aspetti specifici della sua azione biologica ii. Quadro di tossicità o ritenzione a lungotermine rilevati da studi precedenti iii. Positività in prove di mutagenesi e/o di cancerogenesi a breve termine Good Laboratory Practice (GLP) Quality system concerned with the organisational process and the conditions under which non-clinical health and environmental safety studies are planned, performed, monitored, recorded, archived and reported. 1. SVILUPPO CHIMICO Sintesi chimica: come produrre il farmaco in modo efficiente “Commercial manufacturing”: come produrre il farmaco in modo economico Formulazione: come preparare il farmaco in una forma adatta per la somministrazione
Scaricare