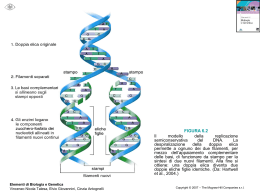
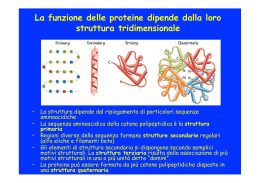
Come misurare la concentrazione di glucosio Nei laboratori, la [c] ematica del glucosio è di solito misurata utilizzando una miscela di enzimi, la glucosio ossidasi e la perossidasi. Il primo E è altamente specifico per il glucosio e ossida il 64% dello zucchero in soluzione. Riconosce solo l’anomero b, per cui, alla miscela viene aggiunta la mutarotasi, un E che trasforma tutte le altre forme anomeriche del glucosio in forma b. La H2O2 che si forma in queste reazioni di ossidazione, viene ridotta dalla perossidasi ad acqua. Contemporaneamente alla reazione catalizzata dalla perossidasi, un cromoforo incolore presente nella soluzione, si colorerà e l’intensità del colore sarà direttamente proporzionale alla [c] di glucosio. REGOLAZIONE DELLA GLICOLISI La fosfofruttochinasi è detto anche "enzima tandem", infatti forma un complesso con un secondo enzima, l’enzima 2,6 bifosfatasi 2. L'attivazione di una delle due unità enzimatiche è regolata dalla fosforilazione di un residuo di serina. Quando il residuo è defosforilato, la fosfofruttochinasi è attiva, viceversa, la bifosfatasi 2 è attiva. La sua regolazione è fondamentale nella glicolisi, dove catalizza la fosforilazione del fruttosio 6 fosfato a fruttosio 1,6 bisfosfato. REGOLAZIONE DELLA GLICOLISI L’attività della fosfofruttochinasi è favorita dalla presenza di AMP, di fruttosio-6-fosfato, di fosfato inorganico e dallo ione ammonio. Questi rimuovono l'inibizione allosterica operata dall’ ATP, dal fruttosio2,6-bifosfato e dal citrato. enzima induttore repressore La struttura secondaria presenta 13 α-eliche e 11 filamenti β disposti in due gruppi di 4 e 7 filamenti. Il gruppo di 4 filamenti β compone un foglietto β aperto ed è riconoscibile il motivo supersecondario β-α-β filamenti β paralleli intercalati da α-eliche. Il gruppo di 7 filamenti β presenta un gruppo centrale di 5 filamenti che compongono un foglietto β aperto torsionale, sempre con motivo β-α-β, aperto e chiuso da due filamenti antiparalleli congiunti al foglietto da α-eliche con funzione di ansa di raccordo. Tra i due motivi strutturali è presente un’ampia fessura caratterizzata dalla presenza di due loop che presentano una discreta flessibilità, che suggerisce la presenza di un sito di legame. 319 residui aminoacidici, forma allungata. loop gruppo di 7 filamenti β gruppo di 4 filamenti β
Scaricare