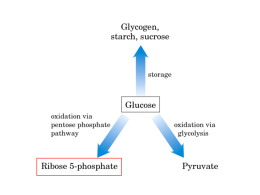
CICLO DEI PENTOSI Molti i nomi alternativi… Via dei pentosi fosfati Via del Fosfogluconato Shunt dei pentosi Shunt dell’esosomonofosfato Ciclo di Horecker Via del catabolismo di G6-P alternativa alla glicolisi, dove si ha ossidazione del glucosio senza produzione di ATP; quindi il ciclo dei pentosi non ha funzione energetica. La sua funzione è quella di rappresentare la principale via di formazione dei pentosi fosfati necessari alla sintesi di DNA e RNA. Altra importante funzione è quella di fornire NADPH, potere riducente usato per le biosintesi riduttive. Avviene nel citosol di tutte le cellule. Questa via si dirama dalla glicolisi a livello del G6-P ed è perciò anche nota come shunt dell’esoso monofosfato; il termine shunt, letteralmente “deviazione”, è usato perché nel caso la cellula non necessiti di pentosi per le biosintesi, i suoi intermedi sono trasformati in fruttosio-6-P e gliceraldeide-3-P e ricondotti nel flusso principale della glicolisi. Funzioni della via del pentoso fosfato 1. Principale produzione di NADPH, potere riducente per le biosintesi riduttive di acidi grassi, steroidi e sali biliari. Inoltre il NADPH è il substrato di glutatione reduttasi, enzima che è in grado di rigenerare glutatione ridotto che funge da antiossidante, specialmente negli eritrociti dove scherma l’ossidazione del Fe2+ a Fe3+. 2. Produzione di pentosi tra cui riboso-5-P utilizzato per la sintesi di nucleotidi e acidi nucleici 3. Degradazione ossidativa dei pentosi (di origine alimentare) in esosi che entrano nella glicolisi o nella gluconeogenesi Nei globuli rossi la via del pentoso fosfato è l’unica fonte di NADPH che serve per mantenere Fe2+ ed impedire l’ossidazione dei doppi legami dei lipidi di membrana. Chi usa la via del pentoso fosfato… Circa la metà del glucosio mobilizzato nel fegato entra nella via del pentoso fosfato. E’ una via metabolica importante nei tessuti in grado di effettuare biosintesi riduttive, utilizzando NADPH, ovvero: Tessuto adiposo (molto attivo ciclo dei pentosi per avere NADPH usato nella biosintesi riduttiva degli acidi grassi) Fegato Invece nel Muscolo è Rene pressochè assente mentre Eritrociti dominante glicolisi perché Ghiandola mammaria prevalgono processi Corteccia surrenale energetici (contrazione). Tiroide Testicoli Tessuto nervoso (oligodendrociti) NADP+ NADPH Glucosio-6-P Gluconolattone G-6-P Deidrogenasi Lattonasi Transaldolasi, Transchetolasi e zuccheri a 3, 5 e 7 C 6-Fosfogluconato NADP+ 6-fosfogluconato Deidrogenasi Biosintesi acidi nucleici NADPH Ribosio-5-P Ribulosio-5-P Isomerasi Questa via metabolica può essere suddivisa in 2 fasi: La prima, detta OSSIDATIVA, è costituita da reazioni irreversibili e in essa il glucosio-6-P viene ossidato in pentoso fosfato. Fornisce NADPH e FOSFOPENTOSI La seconda, detta “DELLE INTERCONVERSIONI”, è costituita da reazioni reversibili e trasforma un certo numero di carboidrati tra loro, attraverso reazioni di isomerizzazione. In essa i fosfopentosi in eccesso sono trasformati in intermedi della glicolisi e si ha la risintesi del glucosio-6-P in pentoso fosfato. La via dei Fosfopentosi (fase redox) La via dei Fosfopentosi (fase delle interconversioni) Prima fase : Ossidativa Ossidazione del glucosio-6-P. Per azione della glucosio-6-P-deidrogenasi il glucosio-6-P viene ossidato in 6fosfogluconolattone (estere intramolecolare fra il gruppo carbossilico in C-1 e il gruppo ossidrilico in C-5) con la concomitante riduzione di una equivalente quantità di NADP+ a NADPH + H+. In questa deidrogenazione vengono eliminati 2 H+ dal C1 del G-6-P e trasferiti al NADP +, con formazione di doppio legame C=O sul C1 del 6fosfogluconolattone e di NADPH + H+. L'attività della glucosio-6-P deidrogenasi è regolata dal rapporto NADPH+(H+)/NADP+ (più questo è elevato, cioè più NADPH c’è, e più l'enzima è inibito) e dagli acidi grassi liberi (un eccesso dei quali ha azione inibitrice). In particolare, la glucosio-6-P deidrogenasi è soggetta a inibizione allosterica da parte del NADPH, e quindi in virtù di questo semplice meccanismo, la produzione di NADPH nel ciclo è autolimitante. Questa reazione limita la velocità del ciclo. Formazione del 6-fosfogluconato. La idrolisi del 6-fosfogluconolattone in 6fosfogluconato è catalizzata dalla 6fosfogluconato lattonasi: la stessa idrolisi può avvenire anche spontaneamente ma con molta maggiore lentezza. In questa reazione di idrolisi, grazie all’entrata di una molecola di H2O, l’OH dell’ H2O si va a legare sul C1 ( e poi l’H+ se ne va), mentre l’altro H dell’ H2O va a legarsi sull’Ossigeno del C5. Questa reazione è irreversibile, quindi nonostante la reversibilità della reazione precedente, nel complesso, l’ossidazione del glucosio6-P in 6-fosfogluconolattone risulta un processo irreversibile. Decarbossilazione ossidativa del 6fosfogluconato. La trasformazione del 6fosfogluconato in ribulosio-5-P è un processo di decarbossilazione ossidativa, catalizzato dalla 6-fosfogluconato deidrogenasi e una seconda molecola di NADP+ viene ridotta a NADPH + H+. Il C1, che fa parte della molecola di CO2 se ne va, mentre a livello del C3 se ne vanno 2 H (che ritroviamo nel NADPH + H+) con la contemporanea formazione del doppio legame C=O. Al termine della FASE OSSIDATIVA che comprende queste prime tre reazioni, il glucosio-6-P viene ossidato a ribulosio-5-P mentre si generano 2 equivalenti di NADPH(H+). Seconda fase : “Delle Interconversioni” Isomerizzazione del ribulosio-5-P. Il ribulosio-5-P viene in parte isomerizzato in ribosio-5-P per azione della fosfopentoso isomerasi, in parte il ribulosio-5-P viene epimerizzato in xilulosio-5-P ad opera della fosfopentoso epimerasi. Il ribosio-5-P è usato per la sintesi di nucleotidi, ma in realtà solo una piccola parte di esso viene sottratta al ciclo per questo scopo. In ogni caso, per la formazione di questi due composti, la rimozione di un protone porta alla formazione di un intermedio, l’ENEDIOLO. La riprotonazione forma il chetoso xilulosio-5-P o l’aldoso ribosio 5-P. E’ implicito che se in un determinato momento, o in un particolare tessuto, il ribulosio5-P venisse impiegato solo per la sintesi dei nucleotidi, verrebbe trasformato completamente in ribosio-5-P e l'ulteriore processo di interconversione, mediante Transchetolasi e Transaldoasi, non avrebbe luogo. Viceversa se il tessuto non richiedesse sintesi di nucleotidi, ma solo di equivalenti riducenti [NADPH(H+)], allora i pentosi fostati verrebbero riciclati completamente nel processo seguente. Le seguenti reazioni di Transchetolasi e Transaldoasi implicano un "rimescolamento" degli atomi di C dei pentosi fosfati, che vengono così trasformati in fruttosio-6-P e gliceraldeide-3-P. Questi due enzimi creano un collegamento reversibile tra la via dei pentosi fosfati e la glicolisi, catalizzando queste tre reazioni: Transchetolasi C5 + C5 C3 + C 7 Transaldolasi C7 + C 3 C4 + C6 Transchetolasi C5 + C 4 C3 + C6 La TRANSCHETOLASI trasferisce una unità a due atomi di carbonio La TRANSALDOLASI trasferisce una unità a tre atomi di carbonio Lo zucchero che dona le unità bi- o tri-carboniose è sempre un CHETOSO, mentre l’accettore è sempre un ALDOSO. H2C—OH Unità trasferita dalla transchetolasi C=O Unità trasferita dalla transaldolasi H2C—OH C=O HO—C—H CHETOSO ALDOSO Ia Transchetolazione. Questa reazione, è catalizzata dalla transchetolasi, enzima difosfotiamina (TPP) dipendente. In generale, la reazione consiste nel trasporto di un frammento a 2 atomi di carbonio (chetolo) da un chetoso, fosforilato sull'ultimo atomo di C ad un aldoso, pure fosforilato, con formazione di una nuova coppia di chetoso ed aldoso fosforilati, suscettibili di transchetolazione. In particolare, in questa di transchetolazione, si ha il trasferimento di due atomi di carbonio dallo xilulosio-5-P (C5) al ribosio5-P (C5), formando sedoeptulosio-7-P (C7)ed gliceraldeide-3-fosfato (C3). L’enzima richiede che il chetoso abbia configurazione sterica sull’OH del C3 come quella del fruttosio. Transchetolasi C5 + C 5 C3 + C7 Meccanismo d’azione della transchetolasi, dove si evidenzia il ruolo essenziale della Tiamina Pirofosfato (TPP). E’ mostrato solo l’anello tiazolico della TPP. Transaldolazione. Questa reazione è catalizzata dalla Transaldolasi ed è caratterizzata dal trasferimento di un frammento a 3 C (diossiacetone) da un chetoso fosforilato sull'ultimo atomo di carbonio e con la stessa configurazione sterica vista per le transchetolazione, ad un aldoso pure fosforilato. In particolare, in questa di transaldolazione, si ha il trasferimento di tre atomi di carbonio dal sedoeptulosio-7-P (C7) alla gliceraldeide-3fosfato (C3), formando eritrosio-4-P (C4) e fruttosio-6-P (C6). L’enzima richiede che il chetoso abbia configurazione sterica sull’OH del C3 come quella del fruttosio. Transaldolasi C7 + C 3 C4 + C 6 Meccanismo d’azione della transaldolasi IIa Transchetolazione. Ancora per azione della transchetolasi un chetolo, cioè un frammento a due atomi di carbonio viene trasferito da una seconda molecola di xilulosio-5-P (C5) sull'eritrosio-4-P (C4), formando gliceraldeide-3-P (C3) e fruttosio6-P (C6). Transchetolasi C5 + C 4 C3 + C6 Riepilogo della IIa fase Questa fase “delle interconversioni” è controllata dalla disponibilità dei substrati. In totale: 2 xilulosio-5-P + 1 ribosio-5-P↔2 fruttosio-6-P + 1 gliceraldeide-3-P Considerando quindi i prodotti di partenza e di arrivo del ciclo dei pentosi fosfati, il G-6-P viene per gran parte trasformato in F6-P (da qui il nome di shunt dell’esoso-fosfato, perché alternativo alla glicolisi). Relazione tra la glicolisi e la via dei pentosi fosfati L’eccesso di Ribosio-5-P viene convertito in intermedi glicolitici Bilancio e regolazione Reazione totale: G6-P + 12NADP+ → 6CO2 + 12NADPH + 12H+ + Pi Potere riducente funzione primaria In adipociti 60% del glucosio viene utilizzato Flusso metabolico varia secondo necessità del momento Disponibilità di NAD e NADP che regola Glucosio-6PDH aumenta da aumentata ingestione di glucidi, inibita da aumento rapporto NADPH/NADP, stimolata da Glutatione ossidatoAnossia aumenta via dei pentosi Il metabolismo del glucosio-6-P fra glicolisi e ciclo dei pentosi Il glucosio-6-fosfato viene metabolizzato sia attraverso la glicolisi che il ciclo dei pentosi fosfato; dipende dalla concentrazione citoplasmatica di NADP+, Ribosio-5-P e ATP Metabolismo del G-6-P in quattro diverse situazioni: (1) Richiesta maggiore di ribosio-5-P rispetto al NADPH: es. cellule in rapida divisione che necessitano di R-5-P per sintesi nucleici 5 glucosio-6-P + ATP → 6 ribosio-5-P + ADP + H+ (2) Le necessità di NADPH e ribosio-5-P sono bilanciate: glucosio-6-P + 2 NADP+ + H2O → ribosio-5-P + 2 NADPH + 2H+ + CO2 (3) Richiesto più NADPH che ribosio-5-P: es. il tessuto adiposo per produrre acidi grassi glucosio-6-P + 12 NADP+ + 7 H2O → 6 CO2 + 12 NADPH + 12 H+ + Pi (4) Sono richiesti NADPH e ATP: 3 glucosio-6-P + 6 NADP+ + 5 NAD+ + 5Pi + 8 ADP → 5 piruvato + 3 CO2 + 6 NADPH + 5 NADH + 8 ATP + 2 H2O + 8 H+ Bilancio e regolazione del ciclo dei pentosi fostati La trasformazione di 6 molecole di glucosio-6-P nel ciclo dei pentosi fosfati implica il seguente bilancio: 1) 6 glucosio-6-P + 12 NADP+ + 6 H2O → 4 fruttosio-6-P + 2 aldeide 3-P-glicerica + 6 CO2 + 12 NADPH(H+) Considerando che il fruttosio-6-P è in equilibrio con il glucosio-6P e che 2 molecole di aldeide 3-P-glicerica possono formare 1 molecola di fruttosio-6-P e quindi di glucosio-6-P (gluconeogenesi), la precedente reazione è omologabile alla seguente: 2) 6 glucosio-6-P + 12 NADP+ + 7 H20 → 5 glucosio-6-P + 6 CO2 + 12 NADPH(H+) + Pi Sopprimendo i termini comuni si ottiene: 3) glucosio-6-P + 12 NADP+ + 7 H2O → 6 CO2 + 12 NADPH(H+) + Pi Trascurando i metaboliti intermedi, suscettibili di utilizzazione metabolica particolare, nei ciclo dei pentosi fosfati 1 mole di glucosio-6-P viene dunque ossidata in 6 moli di CO2 con concomitante riduzione di 12 moli di NADP+ in NADPH(H+). E’ proprio la produzione del “potere riducente” in forma di NADPH(H+) la funzione primaria del ciclo. Il NADPH(H+) è necessario per sostenere gran parte dei processi di biosintesi riduttiva (es. sintesi degli acidi grassi, sintesi del colesterolo, sintesi dell'acido tetraidrofolico, etc.). Infatti, come si è detto, il ciclo dei pentosi fosfati è particolarmente attivo nei tessuti lipogenici (ghiandola mammaria funzionante, ghiandola cortico-surrenale, tessuto adiposo), caratterizzati da un rimarchevole ritmo dì sintesi degli acidi grassi o degli steroidi. Nel tessuto adiposo, ad esempio, il 60% del glucosio viene metabolizzato nel ciclo dei pentosi fosfati, mentre nel muscolo scheletrico, nel quale predomina la glicolisi, il flusso metabolico nel ciclo dei pentosi fosfati è pressoché irrilevante. Il flusso metabolico del glucosio nella glicolisi o nel ciclo dei pentosi fosfati varia in funzione delle necessità metaboliche del momento. Quando c'è maggior bisogno di energia si accentua il metabolismo del glucosio nella glicolisi e nel ciclo di Krebs, quando c'è maggior necessità di biosintetizzare nuove molecole si accentua l'immissione del glucosio nel ciclo dei pentosi fosfati. E’ la disponibilità nel citoplasma di NAD+ e rispettivamente di NADP+ che stimola il flusso del glucosio-6-P nella glicolisi e, rispettivamente, nel ciclo dei pentosi fosfati. E’ infatti l'attività della glucosio-6-P deidrogenasi che impone il ritmo all'intera via dei pentosi fosfati. L'attività di questo enzima, che aumenta considerevolmente in seguito ad aumentata ingestione di glucidi con la dieta, viene inibita da un aumentato rapporto NADPH(H+)/NADP+ e specificamente disinibita dal glutatione ossidato. Nell'ambito dello stesso tessuto l'utilizzazione del glucosio nel ciclo dei pentosi fosfati viene accentuata da uno stato di anossia. La mancanza di ossigeno impedisce l'utilizzazione ossidativa del piruvato e secondariamente induce un accumulo degli intermedi glicolitici. Il glucosio-6-P viene così forzato nella via dei pentoso-fosfati e l'accumulo conseguente di NADPH(H+) accentua la biosintesi degli acidi grassi. Si spiegherebbe così, almeno in parte, la steatosi che si verifica nei tessuti anossici. Altra funzione del ciclo dei pentosi fosfati è la produzione dei pentosi fosfati necessari per la sintesi dei nucleotidi, degli acidi nucleici e di numerosi coenzimi. A questo riguardo va osservato che la formazione di ribosio-5-P, precursore di tutti i nucteotidi, può attuarsi, utilizzando intermedi della glicolisi, attraverso semplici reazioni di transchetolazione e isomerizzazione (xilulosio-5-P → ribulosio-5-P → ribosio-5-P). In questo modo il flusso biosintetico dei nucleotidi può decorrere anche indipendentemente dalla riossidazione del NADPH(H+). Deficienza eritrocitaria della glucoso-6-P deìdrogenasi Negli eritrociti umani si sono finora individuate più di 50 varianti genetiche della glucosio-6-P deidrogenasi (l’enzima che catalizza la prima reazione della fase ossidativa), ciascuna risultante da una mutazione genica che causa la sintesi di un enzima con struttura primaria non ortodossa. Nei casi più noti tale anomalia risulta dalla sostituzione di un amminoacido con un altro. La variante più diffusa, specie in alcune regioni dei Mediterraneo, è quella nota come FAVISMO, in quanto i globuli rossi degli individui che ne sono affetti vanno incontro ad estesa emolisi dopo ingestione di fave o di farmaci antimalarici (es. promachina, aceitilfenilidirazone). Si tratta di un difetto dell'attività della glucosio-6-P deidrogenasi eritrocitaria derivante da un aumentato ritmo di degradazione dell'enzima. Si è constatato infatti che la vita media dell'enzima geneticamente alterato è di 14 giorni contro i 60 dell'enzima normale. Inoltre nel favismo la G-6-P deidrogenasi presenta una minore affinità per il NADP+ rispetto alla deidrogenasi dei normali. Nella deficienza di glucosio-6-P deidrogenasi la diminuita produzione di NADPH(H+) facilita la trasformazione dell'emoglobina (Fe2+) in metaemoglobina (Fe3+) e si traduce in una deficienza di glutatione ridotto (G-SH). Il G-SH si forma infatti a spese del NADPH(H+) nella seguente reazione catalizzata dalla glutatione riduttasi: NADPH(H+) + GS-SG → NADP+ + 2 G-SH Una deficienza di G-SH consente ai processi perossidativi una più intensa azione deleteria, per cui i costituenti dei globulo rosso e la stessa membrana eritrocitaria si alterano, provocando lisi della cellula. Gli agenti antimalarici e le fave scatenano la crisi emolitica in quanto concorrono ad ossidare il già scarso G-SH, aggravandone drammaticamente la deficienza. La deficienza ereditaria della G-6-P deidrogenasi si riscontra frequentemente nelle popolazioni esposte da secoli alla malaria. Poiché l'agente della malaria richiede per la sua crescita ottimale glutatione ridotto e prodotti del ciclo dei pentosi, la deficienza della G-6-P deidrogenasi e quindi di G-SH parrebbe costituire un adattamento di difesa contro il parassita, e quindi contro l’insorgenza della malaria. Nella deficienza di G-6-P deidrogenasi gli eritrociti sono le uniche cellule colpite; mancano infatti del ciclo di Krebs e dei mitocondri e l'unico processo ossidativo è in essi la prima fase del ciclo dei pentosi fosfati. Il Glutatione Il glutatione è un tripeptide (γ-glutamil-cisteinil-glicina), presente nella cellula in forma ridotta tiolica, ed è un coenzima essenziale per la protezione della cellula contro il danno ossidativo. La forma ridotta del glutatione (GSH), un tripeptide con un gruppo sulfidrilico libero, ha la funzione di tampone sulfidrilico per mantenere i residui di cisteina dell’emoglobina (Hb) e delle altre proteine allo stato ridotto. In condizioni normali, quando le proteine sono esposte all’ossigeno, i loro gruppi SH liberi vengono gradualmente ossidati a formare ponti disolfuro intramolecolari o con altre proteine; in particolare nei globuli rossi, il glutatione ridotto mantiene i gruppi SH dell’Hb allo stato ridotto, inibendo la formazione di legami crociati nella proteina stessa. La forma ridotta del glutatione partecipa anche ad alcune reazioni di detossificazione dell’acqua ossigenata (perossido d’idrogeno) e di altri perossidi organici nel citosol e nelle membrane cellulari. Il Glutatione Attività antiossidanti del Glutatione Meccanismo d’azione del glutatione negli eritrociti Il glutatione è mantenuto allo stato ridotto GSH, dall’enzima glutatione reduttasi che nei globuli rossi utilizza il NADPH formato dal ciclo dei pentosi. Durante la sua funzione come coenzima antiossidante, il GSH è ossidato alla forma disolfuro GSSG, ed è poi rigenerato dall’azione della glutatione reduttasi. Meta Hb NADPH FAD 2 GSH Fe 3+ NADP+ FADH2 GSSG Fe 2+ Glutatione Metaemoglobina reduttasi Hb reduttasi Via dei pentosi Durante la rigenerazione del GSH, gli elettroni non sono trasferiti dal NADPH direttamente al ponte disolfuro del GSSG, ma sono invece trasferiti prima dal NADPH al FAD, poi al ponte disolfuro e infine al glutatione ossidato. Meta Hb NADPH FAD 2 GSH Fe 3+ NADP+ FADH2 GSSG Fe 2+ Glutatione Metaemoglobina reduttasi Hb reduttasi Le monoossigenasi catalizzano reazioni ove solamente uno dei due atomi della molecola di ossigeno viene incorporato nel substrato; l’altro e’ ridotto ad acqua. Questi enzimi vengono spesso chiamati idrossilasi (per evidenziare il fatto che il substrato principale viene in genere ossidrilato) oppure ossigenasi a funzione mista, per indicare che ossidano contemporaneamente due substrati diversi. Il termine ossidasi a funzione mista che spesso viene usato e’ improprio: nelle ossidasi propriamente dette l’ossigeno molecolare e’ l’accettore di elettroni, ma gli atomi di ossigeno non compaiono nei prodotti ossidati. Una tipica reazione catalizzata dal citocromo P450 può essere così schematizzata: RH + O2 + 2H+ + 2e- ROH + H2O Come donatore di elettroni il citocromo P450 può utilizzare indifferentemente NADH o NADPH; i due elettroni devono essere trasferiti al citocromo attraverso una proteina trasportatrice (nel caso dei citocromi microsomiali di una flavoproteina).
Scaricare