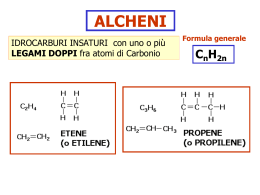
INORGANICI vs ORGANICI COMPOSTI INORGANICI Esistenti già prima degli organismi viventi Max 1 atomo di Carbonio nella molecola NaCl CO2 HCO3 CaCO3 COMPOSTI ORGANICI Esistenti con gli organismi viventi Più atomi di Carbonio nella molecola Alcune eccezioni: sono organici CH4 (metano); CH3OH (metanolo) CH2O (formaldeide) H-COOH (acido formico) CONFIGURAZIONE ELETTRONICA DEL CARBONIO Allo stato fondamentale C 6 6 p+ 6 e- Numero atomico Configurazione 1s2 2s2 2p2 Completo 1s2 2s2 Completo 4 enel livello più esterno Incompleti 2p2 Vuoto ORBITALI IBRIDI 1s2 2s2 2p2 Fusione di tutti e 4 4 orbitali ibridi sp3 2sp3 Carbonio può formare 4 legami uguali!!! ORBITALI IBRIDI 1s2 2s 2p Fusione di s con soli due p 3 orbitali ibridi sp2 2sp2 Così il Carbonio può formare 2 legami semplici e uno doppio! 2p ORBITALI IBRIDI 1s2 2s 2p Fusione di s con un solo p 2 orbitali ibridi sp 2sp Così il Carbonio può formare 1 legame semplice e uno triplo! 2p Idrocarburi alifatici saturi ALCANI Alifatico termine derivato dal greco “aleifar” (unguento). Idrocarburi con catene lunghe, infatti, hanno caratteristiche tipiche di olii e grassi. Attualmente con il termine vengono indicati gli idrocarburi a catena aperta (lineare o ramificata) TOGLIENDO UN ATOMO DI IDROGENO H RADICALE (o sostituente). METANO CH4 Saturotermine indicante per il C tutti e 4 i legami semplici. Metile –CH3 Qualsiasi altro gruppo di atomi Il nome cambia: si sostituisce –ano con -ile SE DUE GRUPPI METILE SI UNISCONO… + TOGLIENDO UN ATOMO DI IDROGENO Etile -C2H5 Radicale (o sostituente) Etano C2H6 Met- 1 C Et- 2 C ETILE + METILE + TOGLIENDO UN ATOMO DI IDROGENO Propano C3H8 Propile -C3H7 Prop- 3 C PROPILE + METILE BUTANO C4H10 Pentano C5H12 Esano C6H14 Eptano C7H16 Ottano C8H18 … … But- 4 C Nomenclatura IUPAC (razionale) delle catene lineari 1) Contare i C prefisso (met-, et-, prop-, but-, pent-, es-, ett-, ott-, enn-, dec-, undec-….) 2) Aggiungere la desinenza -ano FORMULA GREZZA GENERALE DEGLI IDROCARBURI ALIFATICI CnH2n+2 Dal nome alla formula IUPAC PENTANO 1. Pent- 5 C Costruire lo scheletro di atomi di Carbonio 2. Saturare ogni C con gli atomi di H Formula condensata oppure Formula geometrica piana ISOMERI COMPOSTI CHE HANNO UGUALE FORMULA GREZZA MA DIVERSA FORMULA DI STRUTTURA proprietà chimiche e fisiche leggermente differenti Metano, etano e propano esistono in un’unica formula (sia grezza, sia di struttura) non hanno isomeri, ma dal butano in poi… C4H10 Stessa formula grezza C4H10 Sostituente o Radicale Catena lineare n-butano (n= normal) Catena principale Catena ramificata iso-butano ISOMERI E FORMULE CONDENSATE n-butano iso-butano Nomenclatura IUPAC (razionale) - Regole 1. Individuare la catena principale (quella più lunga) 2. Ricavare il nome corrispondente Eptano 3. numerare (anche solo mentalmente) gli atomi di C partendo dall’estremità che ha il primo sostituente (radicale) più vicino. Continua… Individuare i sostituenti (radicali) e le relative posizioni, anteponendo al nome di ognuno di, tri, tetra, penta ecc in caso ce ne fossero di uguali : Ci sono 2 gruppi metile (-CH3) in posizione 2 e 4 2,4 dimetil … C’è un gruppo etile (-C2H5) in posizione 4 4 etil … Comporre il nome seguendo l’ordine alfabetico dei radicali, separondoli da un trattino, e aggiungere alla fine il nome della catena principale. 4 etil- 2,4 dimetil- eptano 1. Assegnare il nome IUPAC ai seguenti composti a b c d 2. Assegnare il nome IUPAC (attenzione alla catena principale e alla relativa numerazione dei carboni) b. a. c. d. 3. Assegnare il nome IUPAC e. f. g. j. m. h. i. l. k. n. o. Strutture più complesse 4 propil-eptano 4 (propan-2-il)-eptano Nome alternativo: 4 –sec-propile-eptano Nomenclatura dei radicali Prendono nome come gli alcani sostituendo la desinenza -ano con –ile. In generale, quindi, si parla di radicali (o semplicemente gruppi) alchili (o alchilici). Le caratteristiche delle sostanze organiche cambiano anche in base alla posizione dell’H mancante (o sostituito). Entrambi questi radicali sono propili, ma non hanno lo stesso comportamento chimico. 1. Il primo viene indicato come propile primario, o npropile. 2. Il secondo viene indicato come propile secondario (abbreviato: sec-propile) o iso-propile. Butile primario (n-butile) Regola generale: Se il carbonio legato alla catena Butile secondario (sec-butile) principale (X) è legato 1. Ad un altro solo C primario 2. Ad altri 2 C secondario 3. Ad altri 3 C terziario Butile terziario (terz-butile) Alcani ciclici o cicloalcani o nafteni Si tratta di idrocarburi saturi (ogni carbonio ha 4 legami semplici) la cui catena non è aperta, ma chiusa a formare strutture indicate come «cicliche». Vengono rappresentate con formule di struttura piana poligonale, in realtà si tratta di forme molecolare tridimensionali complesse. Il nome segue le regole degli alcani lineari con l’aggiunta del termine finale «ciclico» o del prefisso «Ciclo» ciclopropano o propano ciclico ciclobutano o butano cicl. ciclopentano o butano cicl. La formula generale grezza è cicloesano o esano cicl. CnH2n - Nel caso della presenza di un radicale: la nomenclatura segue le stesse regole viste per gli alcani lineari. La numerazione dei carboni comincia da quello presentante il radicale. - Nel caso di più radicali: si comincia da quello avente l’iniziale più bassa (in ordine alfabetico) e si prosegue (in senso orario o antiorario) verso l’altro radicale più vicino e così via (in modo che ai carboni presentanti i radicali sia assegnata la numerazione più bassa possibile). Metile Etile 2 1 In molti casi è preferibile «trattare» i gruppi ciclici come radicali e non come catene principali: il nome risulta più semplice. 1 1 2,2 dicicloesil-propano 2 1 È più semplice di: 1,1 prop-2,2 diil-dicicloesano Indica che il gruppo prop è radicale di due catene principali
Scaricare