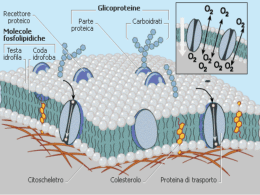
Elementare8 acqua salata congelamento pressione osmotica Opportuno schermo completo-cliccare se serve Perché l’acqua di mare,salata, congela sotto 0°C mentre l’acqua dolce, di fiumi,laghi.rubinetto, congela a 0°C ? Perché l’acqua salata quando inizia a congelare non congela sempre in tutta la sua massa,volume ? Osservazioni sperimentali:acqua dolce congela a 0°C Acqua liquida Temperatura >0°C Acqua solida:ghiaccio Temperatura =< 0 °C Osservazioni sperimentali:acqua salata congela a temperature inferiori allo 0°C in proporzione alla concentrazione di Sali presenti (valori approssimati per motivi didattici…) C=1 C=2 -2°C -4°C C=3 C=4 -6°C -8°C C=5 -10°C temperatura -2C concentrazione -10C 1 5 ghiaccio ghiaccio Acqua salata con C=16 congela a -2°C Congela a -4°C ghiaccio Congela a -6°C A –2°C l’acqua salata comincia a congelare:il sale rimane nell’acqua non congelata e la concentrazione quindi aumenta:il congelamento non procede finchè la temperatura non si abbassa ulteriormente (es.-4°C):allora altra acqua congela aumentando ancora la concentrazione salina nel residuo che non può congelare se la temperatura non scende ancora (es. a -6°C) e così fino ad eventuale completo congelamento Circuito di raffreddamento motore motore Acqua di raffreddamento nel circuito del motore,tergicristallo: potrebbe congelare se la temperatura ambientale dovesse scendere sotto lo °C (inverno…): per evitare tale inconveniente si prepara una miscela contenente acqua e sostanze di vario tipo che con la loro concentrazione abbassano il punto di congelamento della miscela tanto più quanto più risulta concentrata la soluzione Perché bere acqua salata non disseta, anzi produce disidratazione? Perché certe piante e animali possono vivere in acqua salata(mare) e altri morirebbero? Soluzione di acqua e soluto (es.zucchero,sale..) Livello uguale nei due vasi Membrana di separazione permeabile alle molecole di acqua e di soluto Passaggio reversibile attraverso la membrana e mantenimento omogeneità e livello Soluzione di acqua e soluto (es.zucchero,sale..) uguale concentrazione nei due ambienti Livello uguale nei due vasi Membrana di separazione semipermeabile:permeabile solo alle molecole di acqua nei due sensi Passaggio reversibile dell’acqua attraverso la membrana e mantenimento omogeneità e livello Situazione iniziale:vasi contenenti solo acqua separati da membrana semipermeabile,che permette solo il passaggio bidirezionale del solvente (acqua) ma impedisce il passaggio del soluto Introducendo un soluto in un ramo dello strumento si osserva una variazione di livello nei due rami: si innalza nel ramo contenente acqua e soluto e si abbassa nel ramo contenente solo acqua: il dislivello aumenta con l’aumentare della concentrazione del soluto…come mai ? dislivello soluto Ipotesi:la pressione esercitata sulla membrana da entrambe le parti risulta equilibrata se esiste un passaggio bidirezionale contemporaneo di molecole di solvente e di soluto:i livelli delle colonne non cambiano: se il passaggio avviene solo da solvente a soluzione,si crea un accumulo di solvente nel ramo contenente il soluto e la colonna aumenta di livello: la nuova pressione idrostatica esercitata sulla faccia della membrana rivolta verso la soluzione deve essere equilibrata da una nuova pressione che integra quella del solo solvente la cui colonna è diminuita:la nuova pressione si definisce Pressione osmotica:si verifica che tale pressione varia con la natura del solvente e con la concentrazione del soluto (apparentemente non dipende dalla natura del soluto) Pressione = K*c dislivello soluto Praticamente se esiste una separazione semipermeabile tra due diversi ambienti con diversa concentrazione (esempio liquido extracellulare e liquido intracellulare separati da membrana cellulare semipermeabile) si verifica un flusso di solo solvente (acqua) dall’ambiente con soluzione più concentrata a quello con soluzione meno concentrata:la elasticità della membrana può influire sul fenomeno… Liquido intracellulare più concentrato solvente entra e rigonfia la cellula (anche fino a farla scoppiare):esempio emolisi e iniezioni non fisiologiche… Liquido extracellulare (acqua salata bevuta) più concentrato di quello intracellulare:richiama acqua dall’interno della cellula, disidratandola Concentrazione maggiore esterna Concentrazione maggiore interna Concentrazioni uguali:equilibrio osmotico Bere quindi acqua salata non disseta perché non può essere assorbita dalle cellule che hanno una concentrazione inferiore Così solo le piante e gli animali che riescono a mantenere una concentrazione intracellulare superiore a quella dell’acqua marina possono vivere nel mare o in luoghi salmastri (come le spiagge): altre piante o animali morirebbero (e quindi non li troviamo nel mare) Bassa concentrazione acqua simileconcentrazione nel pesce può vivere in equilibrio con ambiente Alta concentrazione acqua bassa concentrazione nel pesce non può essere in equilibrio:migra… Esempio migrazione salmoni per cambiamento osmotico durante la vita Torrente e fiume con concentrazione crescente da sorgente a foce Salmone appena nato presso sorgente:organismo con bassa concentrazione in equilibrio con ambiente Crescendo, aumenta la concentrazione interna e quindi scende verso zone più concentrate finchè giunge al mare ove rimane per alcuni anni in equilibrio con concentrazione ambiente Cambiamento di concentrazione interna stimola il salmone adulto a cercare ambienti sempre meno concentrati, più adatti al suo ambiente interno:risale il fiume,il torrente ,fino alla sorgente: depone le uova…finsice il suo ciclo vitale Mare con elevata concentrazione Un animale marino può cambiare zona se non compatibile con proprio interno una pianta non può farlo:se seme cade in zona inospitale, muore Pianta con elevata concentrazione in equilibrio con ambiente:prolifera La pianta produce semi che cadono nel terreno e producono altra pianta Pianta con bassa concentrazione in equilibrio con ambiente:prolifera La pianta produce semi che cadono nel terreno e producono altra pianta ma se cadono in zona salmastra muoiono:selezione Terreno normale Zona salmastra
Scaricare