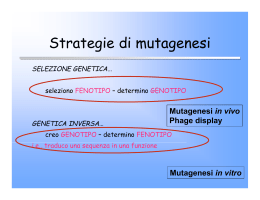
Biologia Molecolare Prodotti da geni clonati nativi e manipolati Fattori che influiscono sull’espressione dei geni clonati Nella fusione traduzionale la proteina clonata avrà un frammento iniziale non presente nella proteina originaria Fattori che influiscono sull’espressione dei geni clonati Se non è possibile inserire il frammento “in frame”: -Cambiare la scelta del vettore -Modificare il vettore e/o l’inserto (utilizzando dei linker) -Generare il frammento dai inserire utilizzando la PCR per ineririre un sito di restrizione appropriato Espressione in cellule eucariotiche Sistemi di espressione in Lievito: -Crescono rapidamente -Terreni di coltura semplici -Facili da manipolare e contare (unicellulari) -Saccharomyces cerevisiae, Pichia pastoris Saccharomices: •Per molti aspetti l’approccio è molto simile a quelli visti per i batteri •E’ possibile utilizzare vettori episomici •Si possono usare vettori che possiedono l’origine di replicazione episomica (alto numero di copie) o vettori dotati di centromero (di solito una copia per cellula) •Utilizzo di vettori Shuttle •Promotore regolabile (di solito promotore ed enhacer del gene GAL1) Espressione in cellule eucariotiche Pichia pastoris: -Può utilizzare metanolo come fonte di carbonio -Gene AOX1 (alcol ossidasi) -Gene finemente regolato e promotore altamente efficiente -Vettori non episomici -Contengono origine di replicazione per E. coli Espressione in cellule di insetto: -Sistema Baculovirus Il baculovirus AcMNPV (Autographa californica Multicapsid Nucleopolyhedrovirus) Infetta cellule di insetto. Durante l’infezione produce una grande quantità della proteina virale Poliedrina. I virus si riproduce anche senza poliedrina ma la progenie generata è distinguibile da quella prodotta dal virus naturale. Il vettore è troppo grande (> 100kb) per essere manipolato direttamente, quindi viene utilizzato un vettore di trasferimento (shuttle). Sistema Baculovirus Vettore di trasferimento DNA virale si Progenie virale “non aggregata” Ricombinazione no Progenie virale “aggregata” Sistema Baculovirus È possibile aggiungere anche un gene betagalattosidasi (per il facile riconoscimento delle placche ricombinanti) -Modificazioni post traduzionali più complesse (non ottenibili con lievito) -Meno efficiente (e semplice) dei sistemi di lievito -Elevati livelli di proteina ottenuti subito prima della lisi cellulare Espressione in cellule di mammifero Esistono numerosi sistemi di espressione in mammifero -Vettori basati su Citomegalovirus umano (CMV) -SV40 -Herpes Simplex Anche in questo caso è auspicabile il controllo dell’espressione: È possibile interporre tra il promotore e il gene clonato la sequenza dell’operatore dell’operone batterico per la resistenza alla tetraciclina. Trasfettando le cellule con un plasmide contenente il gene repressore per la tetraciclina (tetR) questo impedisce la attivazione del gene clonato. La tetraciclina stacca tetR dall’operatore permettendo l’inizio della espressione del gene clonato. Si può utilizzare anche il RE per l’ecdisone (elemento di insetto) -Probabilità più elevata di ottenere proteine di mammifero funzionanti -Versatilità del targeting proteico utilizzando peptidi segnale -Costi elevati e produzione quantitativamente non paragonabile ai sistemi batterici o di lievito. Aggiunta di marcatori e segnali -Epitopi -Estremità di poliistidina (affinità per il nickel) -Poliistidina-nickel come epitopo marcatore -Possibilità di aggiunegere siti per peptidasi specifiche Aggiunta di marcatori e segnali Segnali di secrezione E. coli non secerne molte proteine -> secrezione nello spazio tra membrana e parete Bacillus subtilis (e grampositivi) possono secernere nel terreno di coltura. - Segnale N-terminale contenente diversi sottodomini, tra cui una parte centrale idrofobia, che permette il riconoscimento da parte di un sistema di traslocazione Il processo non dipende solo dal segnale ma anche dalla struttura generale della proteina! Mutagenesi in vitro Mutagenesi generalizzata indotta da agenti mutageni Beadle & Tatum -Produzione di mutanti di Neurospora crassa utilizzando raggi X -Selezione di mutanti auxotrofi per l’arginina -Identificazione di 3 diversi tipi di mutanti: -Mutanti ARG1: crescono in presenza di arginina, ornitina o citrullina -Mutanti ARG2: crescono in presenza di arginina o citrullina -Mutanti ARG3: crescono solo in presenza di arginina Mutagenesi in vitro Mutagenesi in vitro Mutagenesi sito-specifica Alterazione specifica (singola base o corta sequenza di basi) a livello di un sito specifico della sequenza bersaglio Mutagenesi in vitro Mutagenesi sito-specifica Produzione del 50% dei cloni mutanti Inferiore al 50% per riparazione del DNA non metilato (è possibile l’utilizzo di ceppi mutanti) Mutagenesi in vitro Applicazioni di ingegneria proteica I vaccini I vaccini sono costituiti da proteine capaci di attivare risposta immunitaria specifica. Sono quindi molecole con la stessa attività antigenica dell’agente eziologico verso il quale si vuole fornire immunità. Vaccino tradizionale->agente eziologico naturale inattivato Vaccino ingegnerizzato->viene usata solo la parte antigenica e non la parte funzionalmente attiva Vaccini da Subunità Espresso in: E. coli -> non funziona S. cerevisiae -> funziona Altro esempio: tossina del colera. Subunità A -> effetto tossico Subunità B-> non tossica (trasporto) Vaccini a DNA
Scarica