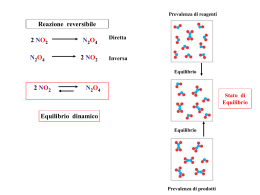
PRINCIPIO DI LE CHATELIER Se viene modificata una delle condizioni che influenzano l’ equilibrio, L’ equilibrio si sposta in modo da minimizzare la modificazione eso 2 NO2 endo [ N2O4 ] N2O4 Keq= Fattori che influenzano l’ equilibrio [ N2O4 ] Aumenta Temperatura T Aumenta Pressione (volume) P Concentrazione Diminuisce [ NO2 ]2 L’equilibrio si sposta da destra verso sinistra Si aggiunge reagente • • • • K non cambia i reagenti diminuiscono i prodotti aumentano l'equilibrio si sposta verso destra Si aggiunge prodotto • • • • K non cambia i prodotti diminuiscono i reagenti aumentano l'equilibrio si sposta verso sinistra Aumento della pressione • importante solo per i gas • nei gas, la pressione aumenta col numero di molecole • l'aumento di pressione sposta l'equilibrio verso dove ci sono meno molecole Aumento della pressione • • • • • • • I2(g) ⇆ 2 I(g) il n. di molecole aumenta l'equilibrio si sposta verso sinistra se invece il n. di molecole diminuisse, l'equilibrio si sposterebbe verso destra e se il n. di molecole non cambia, la pressione non sposta l'equilibrio Equilibrio Non equilibrio Nuovo equilibrio Illustrazione del Principio di Le Chatelier ΔP 18 molecole 10 H2 5 N2 3 NH3 18 molecole 14 molecole 10 H2 5 N2 3 NH3 N2 + 3 H 2 eso 4 H2 3 N2 7 NH3 2 NH3 Aumento della temperatura • • • • K cambia reazione esotermica → K diminuisce reazione endotermica → K aumenta l'equilibrio si sposta nel senso in cui consuma calore • se T diminuisce, l'equilibrio si sposta per produrre calore Temperatura, °C Pressione totale , Atm Influenza della temperatura e della pressione sulla resa di ammoniaca
Scaricare