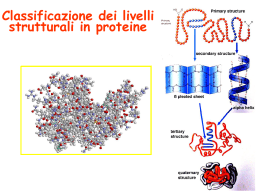
Caratterizzazione strutturale delle proteine 1. X-ray 2. NMR 1)Cristallografia a raggi X 2) NMR (Nuclear Magnetic Resonance) LA STORIA 1864 1895 Viene cristallizzata l’ emoglobina. Röngten osserva che quando i raggi catodici (elettroni) colpiscono un bersaglio metallico si origina una nuova forma di radiazione penetrante, che egli chiamò raggi X. 1912 Facendo attraversare dai raggi X un cristallo di solfuro di zinco Von Laue ottiene i primi diffrattogrammi. W.L. Bragg e W.H. Bragg propongono una correlazione semplice tra la figura di diffrazione ottenuta con i raggi X e la disposizione degli atomi nel cristallo che ha generato la figura (legge di Bragg). Anni ‘30 Bernal, Crowfoot, Bragg, ottengono i primi diffrattogrammi da cristalli di proteine (insulina, emoglobina, mioglobina). 1941 Atsbury ottiene il primo diffrattogramma ai raggi X del DNA. 1951 Pauling e Corey propongono i concetti di struttura a-elica e foglietto b in base a considerazioni teoriche. 1953 Watson e Crick propongono la struttura a doppia elica del DNA sulla base delle analisi diffrattometriche ai raggi X di Franklin e Wilkins. 1954 Perutz e coll. elaborano i metodi basati sull’ impiego dei metalli pesanti per risolvere il problema delle fasi nella cristallografia ai raggi X. 1960 Kendrew descrive la struttura della mioglobina a una risoluzione di 2 Å. Perutz propone la struttura della emoglobina, piu’ grande, ad una risoluzione inferiore. Anni ‘80 Hartmut Michel risolve la struttura (3 Å) della prima proteina di membrana (centro di reazione fotosintetico). The paper The model Maurice Wilkins M.H.F. Wilkins, A.R. Stokes, H.R. Wilson: Molecular Structure of Deoxypentose Nucleic Acids. Nature 171, 738 (1953) Rosalind Franklin R.E. Franklin and R.G. Gosling Molecular Configuration in Sodium Thymonucleate, Nature 171, 740 (1953) Nobel laureates 1962 Wilkins, Perutz, Crick, Steinbeck, Watson, Kendrew Cristallografia a raggi X • Attualmente tecnica di elezione per la determinazione di strutture 3D a risoluzione atomica • Tecnica indiretta: l’immagine va ricostruita • Non ci sono limitazioni nelle dimensioni delle macromolecole • Svantaggi: – cristalli singoli – altamente ordinati – ragionevolmente grandi (80-100 μM) Cristallografia a raggi X Precisa determinazione della posizione atomica Cristalli della proteina – 0.3-1.0 mm – Le singole molecole sono ordinate in modo periodico, ripetitivo Salting out non è sufficiente La solubilità della proteina è determinata dalle interazioni soluto solvente dovute alle cariche superficiali della proteina Lys, Arg, Asp, Glu L’aumento della forza ionica della soluzione favorisce la interazione tra le cariche superficiali della proteina ed il solvente polare Un eccesso di forza ionica della soluzione favorisce le solvatazione degli ioni stessi a scapito della solvatazione della proteina. Il sale compete con la proteina e la solvatazione diminuisce all’aumentare della forza ionica Polietilenglicole: proteina precipita, ma rimane in contatto con l’acqua. Struttura ordinata con indice di rifrazione diverso rispetto a quello del mezzo in cui si trova Perchè i raggi X? Per poter visualizzare due oggetti come entità separate, la lunghezza d’onda della radiazione elettromagnetica deve essere dello stesso ordine di grandezza della distanza tra gli oggetti: distanza interatomica ≈1Å (10 nm) λraggiX= 0.1 ÷ 2 Å con i raggi X “vedo” gli atomi Visione d’insieme del processo RX Cristallizzazione FFT Diffrazione Risoluzione della struttura e affinamento …perché un cristallo? L’immagine di diffrazione da una singola molecola si forma per interazione dei raggi X con gli elettroni degli atomi della molecola MA: - è troppo debole - impossibile separarla dalla radiazione di fondo (soluzione) Impossibile ricostruire la molecola In un cristallo, miliardi di molecole sono disposte in modo ripetuto e ordinato nelle tre dimensioni Cristallo è amplificatore del segnale 100 mg!! buone immagini di diffrazione si può ricostruire la molecola Schmid, M. Trends in Microbiology, 10:s27-s31. Instrumentation or synchrotron X-rays Instrumentation ESRF - Grenoble Instrumentation Elettra - Trieste The Bragg law Facendo incidere un'opportuna onda elettromagnetica su di un cristallo si osservano fenomeni di interferenza, causate dalla riflessione di onde riflesse da piani cristallini diversi, ma paralleli. l = 2 d sinq sinq/l = 1/(2 d) d = l / (2 sinq) Dove: - θ è l'angolo che il fascio incidente forma con il piano cristallino - λ è la lunghezza d’onda della radiazione - d è la distanza tra due piani adiacenti. Acqua Agente precipitante Soluzione cristallizzante acqua/acetone cloroformio o cloruro di metilene/etere di petrolio o esano Crystal growth Crystal growth Abbiamo ottenuto le MAPPE … e poi? + Densità iniziale = Interpretazione Struttura 3D • La qualitá delle MAPPE dipende dalla risoluzione. • La risoluzione dipende dalla qualitá dei cristalli. Risoluzione Esempio: la proteasi del virus HIV La cavità centrale è ampia e può legare un polipeptide in conformazione estesa KNI577 • La tasca è stata “riempita” con analoghi non idrolizzabili del substrato: inibitori competitivi altamente specifici e selettivi • Nuova generazione di farmaci “intelligenti” con pochi effetti collaterali inibitori non competitivi altamente specifici e selettivi MODULATION OF HEME AND MYRISTATE BINDING TO HUMAN SERUM ALBUMIN BY ANTI-HIV DRUGS. AN OPTICAL AND NMR SPECTROSCOPIC STUDY (FEBS J. 274 (2007) 4491-4502) Superimposition of myristate and abacavir (panel A), nevirapine (panel B), and atazanavir (panel C) in binding site FA6. Ligands are colored as follows: myristate: green; abacavir: blue; nevirapine: orange; atazanavir: cyan. Atomic coordinates were taken from the PDB entry 1O9X (Zunszain et al., 2003). Heme Binding to Albuminoid Proteins is the Result of Recent Evolution, IUBMB Life 59, 436-440 (2007). 2) NMR • Tecnica spettroscopica per lo studio della struttura di macromolecole a risoluzione atomica • È basata sull’interazione dei singoli nuclei atomici magneticamente attivi - 1H, 15N, 13C e 31P - con il campo magnetico esterno e con i campi magnetici dei nuclei adiacenti Informazioni di: – dinamica – conformazione – folding – interazioni intermolecolari Campo magnetico NOE (Nuclear Overhauser Effect) Il campo magnetico Magnete a 900 MHz Magnete a 400 MHz Costo commerciale di uno spettrometro a 900 MHz: ca. 5 M € n. di spettrometri 900 MHz operativi al mondo < 10 Magnetic Resonance Center - Firenze The Magnet History First magnets were built using ferromagnetic material= permanent magnet Then Electromagnets: i.e. field was generated by wiring of conducting material Now: cyomagnets: i.e. electromagnets made of superconducting wire. A “cutted” magnet La rotazione dei nuclei atomici su sé stessi è capace di procurare un momento magnetico μ se i nuclei sono carichi. Solo nuclei con numero atomico dispari mostrano proprietà magnetiche: si dice che il loro numero quantico di spin è ±1/2. Solo particelle dotate di spin sono in grado di disporsi in diversi livelli energetici se immerse in un campo magnetico. Orbita di precessione B0 Dipolo magnetico Momento magnetico μN Nucleo Frequenza di Larmor L’energia della transizione NMR Si applica un campo magnetico B0: il momento magnetico del protone tenderà ad allinearsi con il campo esterno. Si creano due livelli energetici: uno, ad energia più alta, in cui il suo momento magnetico si oppone al campo esterno; uno, ad energia più bassa, in cui è allineato. m=-1/2 E= -m•B0 DE=h0 DE=g(h/2p)B0 E m=+1/2 B0 Larmor Frequency Il campo magnetico B0 serve per creare la separazione di energia tra i 2 livelli L’energia della E= -m•B0 transizione NMR DE=g(h/2p)B0 Devo applicare una E radiofrequenza = alla frequenza DE=h0 Per stimolare la transizione! m=-1/2 DE=h0 m=+1/2 B0 Il campo di radiofrequenza utilizzato per eccitare la transizione si chiama anche B1 Larmor Frequency B1 deve emettere una radiofrequenza in corrispondenza della frequenza di Larmor Some paradigmatic examples Why? NMR is a unique method to obtain information in solution AT THE ATOMIC LEVEL. Each individual atom has a peculiar resonance frequency. Because the resonance frequency depends on the environment of the atom, EACH atom has a different resonance frequency and can, therefore be identified CH3-CH2-OH equivalent NMR Spectrum to 3D Structure H H Interactions Spectrum H H H H H H H H H Structure Challenges For Determining Protein Structures Using NMR • Proteins have thousands of signals • Assign the specific signal for each atom • Thousands of interactions between atomsalso need to be assigned • Need to transform from NMR spectrum through interpretation of scalar and dipolar interactions to generate 3D coordinates Resonance Assignment CH3-CH2-OH OH CH2 CH3 Which signal from which H atoms? The key attribute: use the scalar and dipolar couplings to match the set of signals with the molecular structure Proteins Have Many Signals 1H NMR Spectrum of Ubiquitin ~500 resonances A large number of signals are overlapped A Critical Feature of Protein NMR Spectra • Only some nuclei are coupled Each amino acid gives rise to an independent NMR sub-spectrum, which is much simpler than the complete protein spectrum Methods have been developed to extract each sub-spectrum from the whole Critical Features of Protein NMR Spectra • The nuclei are not all mutually coupled • Regions of the spectrum correspond to different parts of the amino acid • Tertiary structure leads to increased dispersion of resonances Regions of the 1H NMR Spectrum are Further Dispersed by the 3D Fold What would the unfolded protein look like? Proteins Have Overlapped Signals 1H NMR Spectrum of Ubiquitin Spettri monodimensionali presentano differenze di c.s. < potere risolutore Resolve resonances by multi-dimensional experiments Resolve Peaks By Multi-D NMR A BONUSregions in 2D spectra provide protein fingerprints If 2D cross peaks overlap go to 3D or 4D ….. Solution to the Protein Challenge 1. Increase dimensionality of spectra to better resolve signals: 1234 2. Detect signals from heteronuclei (13C,15N) t2 t1 t3 NMR Structure Calculations • Objective is to determine all conformations consistent with the experimental observables • NMR data is not perfect: noise, incomplete Multiple solutions: caused by uncertainties in the experimental constraints Conformational Ensemble Representing an NMR Structure C N Risonanza Magnetica Nucleare (NMR) • • • • • • Proteine in soluzione Limite di dimensione ~ 40 kDa Proteine stabili a lungo Marcatura con 15N, 13C, 2H. Strumentazione molto costosa Tempo per assegnare le risonanze Pro e contro X-ray NMR • Richiede cristalli, problematico • Possibile in soluzione, più semplice • Non ha limiti (teorici) di grandezza • Limitato a proteine fino a circa 300 residui • Piú preciso • Meno preciso • Risoluzione • Numero di vincoli • Struttura può essere deformata dai cristalli, rigida • Struttura nativa in soluzione, flessibile • Una “soluzione“ • Molti modelli X-ray NMR
Scaricare