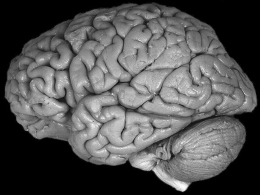
SISTEMI TRANSDERMICI Per sistema transdermico si intende un dispositivo che consente un'azione sistemica di un dato principio attivo, mediante assorbimento di quest'ultimo attraverso la pelle. Vantaggi: •No metabolismo di primo passaggio; •Si evita l’ambiente acido dello stomaco; •No irritazioni a livello gastrico; •Minore variabilità della concentrazione plasmatica; •Maggiore compliance dei pazienti; •No problemi da sovradosaggio e riduzione effetti collaterali. Svantaggi: •Il ristretto numero di attivi con caratteristiche idonee alla somministrazione transdermica. •Variabilità tra i soggetti legata sia alle caratteristiche peculiari della pelle che ad eventuali stati patologici della stessa. •Possibile irritazione nel sito di applicazione Transdermici- 2 Pelle La pelle rappresenta l’organo più esteso del corpo umano, costituendo circa il 10% della massa totale. Ha funzione : •protettiva; •omeostatica; •sensoriale. La pelle è un organo multistrato piuttosto complesso. Macroscopicamente si distinguono tre strati: •epidermide (più esterno, rappresenta circa l’1% dello spessore), •derma (intermedio circa l’85%) •tessuti subcutanei (più interno circa il 14%). Il derma contiene vasi sanguigni, linfatici e terminazioni nervose, provvedendo al supporto fisiologico dell'epidermide. Dal momento che i vasi sanguigni arrivano fino all'interfaccia tra epidermide e derma, quest'ultima non può essere quindi considerata una barriera da dover oltrepassare. A: Epidermide; B:Derma; C; Tessuti subcutanei L'epidermide è a sua volta costituita da due strati: uno più interno e vitale detto germinativo ed uno esterno detto corneo. Lo strato germinativo potrebbe essere inteso come una specie di gel acquoso e non rappresenta pertanto una significativa barriera alla penetrazione delle varie sostanze. Il compito delle cellule in esso contenute (keratinociti) è quello di rigenerare lo strato corneo. Lo strato corneo è costituito da strati (15-25) di corneociti, ossia keratinociti definitivamente differenziati, intrappolati in una matrice lipidica a doppio strato. Il tutto forma uno strato continuo, interrotto soltanto dai dotti delle ghiandole sudoripare e sebacee, nonché dai follicoli piliferi, che, dal derma, raggiungono la superficie esterna della pelle. Lo spessore varia dai 10 ai 20 µm a seconda delle varie parti del corpo. Se esaminato al microscopio, lo strato corneo risulta costituito da cellule individuali di forma grossolanamente esagonale e piatta, che si sovrappongono le une con le altre a formare tante pile parallele incastonate le une con le altre. La posizione di ciascuna cellula nella pila varia col tempo. In circa due settimane, il corneocita passa dalla posizione basale a quella più esterna, per essere poi definitivamente espulso (desquamazione). Contemporaneamente, nuove cellule si differenziano e dallo strato germinativo e passano alla base di quello corneo. Strato corneo Corneociti Strato corneo Matrice lipidica intercellulare Strato germinativo Transdermici- 4 Il componente principale dello strato corneo è la keratina, o meglio le keratine, visto che ne esistono di diversi tipi, con peso molecolare variabile tra i 40.000 ed i 70.000. Sono dei polipeptidi relativamente poveri in cistina e ricchi in serina e glicina. L'aminoacido che termina la catena è sempre l'N-acetilserina. Le keratine sono fortemente cross-linkate attraverso ponti disolfuro intermolecolari Le keratine iniziano a formarsi nel citoplasma dei keratinociti, quando questi si trovano, ancora in forma indifferenziata, nello strato germinativo. Man mano che i filamenti di keratina aumentano, essi tendono a formare uno strato calloso, partendo dalla superficie interna della membrana cellulare e procedendo poi verso l'interno del citoplasma stesso, fino a provocare la rottura dei vari organelli cellulari e del nucleo. Una volta consumata la rottura del nucleo, siamo passati dal keratinocita al corneocita. Quella che una volta era la membrana cellulare risulta ora costituita da idrossiacil sfingosine esterificate (idrossiceramidi) il cui compito è quello di ancorare i corneociti alle lamelle lipidiche extracellulari. Queste lamelle lipidiche a doppio strato si formerebbero dalla fusione bordo a bordo di vescicole lipidiche appiattite, che si formano contemporaneamente alla cheratina all'interno dei keratinociti. Al momento della definitiva differenziazione dei keratinociti, tali vescicole vengono espulse all'esterno. Le lamelle lipidiche, a differenza di tutte le membrane biologiche, non contengono fosfolipidi bensì ceramidi, colesterolo e derivati, acidi grassi. Lipidi contenuti nello spazio intercellulare dello strato corneo Transdermici- 5 Lo strato corneo costituisce la vera barriera alla penetrazione o permeazione di corpi o molecole estranee di qualsiasi tipo, grazie alla sua elevata densità (1,4 g/cm3 allo stato secco), alla bassa idratazione (15-20% contro una media del 70% per gli altri tessuti) ed all’assenza di vascolarizzazione. È quindi inverosimile pensare che la via di somministrazione transdermica possa essere con successo applicata a qualsiasi tipo di principio attivo. E' possibile comunque valutare a priori se una molecola può essere un buon candidato per la formulazione di un sistema transdermico, considerando una serie di parametri. I primi parametri da considerare sono la dose ed il tempo di emivita. Considerando che un sistema di rilascio opportuno non dovrebbe coprire una superficie corporea superiore a 50 cm2 (un disco da 8 cm di diametro), onde evitare o non aggravare eventuali fenomeni di irritazione o sensibilizzazione, è molto difficile riuscire a far passare nella circolazione ematica, in 24 ore, più di 15-20 mg di principio attivo. E' chiaro pertanto che solo i principi attivi che agiscono a basse concentrazioni sono dei buoni candidati alla somministrazione transdermica. Per quanto riguarda il tempo di emivita, più esso è breve, più sarà difficile riuscire a raggiungere livelli ematici efficaci, considerando il basso quantitativo di principio attivo che riesce a penetrare la pelle nell'unità di tempo. Dosaggio: < 15-20 mg al giorno Valutazione a priori Emivita Transdermici- 6 Il trasporto attraverso lo strato corneo è un processo di tipo passivo, saranno quindi le proprietà chimico-fisiche dei candidati alla somministrazione a determinare la possibilità di diffondere e penetrare lo strato corneo. Possono essere identificate tre rotte attraverso cui una molecole può attraversare lo strato corneo: •Intercellulare (attraverso la matrice lipidica dello strato corneo); •Transcellulare (diffusione e ripartizione attraverso i corneociti ed i lipidi dello strato corneo); •Attraverso le varie appendici. Analisi di tipo diffusivo e morfometriche suggeriscono che la rotta intercellulare sia quella principalmente coinvolta nella diffusione transdermica Attraversata l’epidermide un composto può poi perseguire attraverso i vasi sanguinei del derma o penetrare fino ai tessuti più profondi. Transdermici- 7 le principali caratteristiche chimico-fisiche del principio attivo che ne influenzano l’assorbimento attraverso la via transdermica sono: •Solubilità •Diffusività La solubilità di una sostanza in due fasi immiscibili dipende dal coefficiente di ripartizione ottanoloacqua. Questo parametro determina se la sostanza è idonea ad essere assorbita dallo strato corneo e desorbita dallo strato corneo verso i tessuti sottostanti. Il coefficiente di ripartizione ottanolo-acqua (KOW) per un soluto A è calcolato nel seguente modo: KOW=[A]ottanolo/[A]water Dove [A] è la molarità del soluto A nei due solventi immiscibili tra loro quando questi sono entrambi presenti (imbuto separatore). Il coefficiente di ripartizione è un indice dell’idrofilicità o lipofilicità di una sostanza. Normalmente è espresso nella forma logaritimica indicata logP. La diffusività indica invece la velocità con cui un soluto attraversa una data barriera, dipenderà quindi dalle possibili interazioni soluto-strato corneo, dalla viscosità dello strato corneo (o dei sui componenti, come la matrice lipidica) e dalla tortuosità del percorso. Altri fattori in grado di influenzare l’assorbimento transdermico di una molecola sono : •Peso molecolare •Stato di dissociazione Transdermici- 8 Tenendo presente lo schema a fianco, vediamo come il principio attivo, dal punto in cui è contenuto (drug reservoir), per giungere alla circolazione ematica (dermis and capillaries), deve attraversare una serie di ostacoli. Partendo dal sistema di rilascio ed ipotizzando che sia un dispositivo a membrana (polimerica), il principio attivo deve inizialmente ripartirsi all'interno della membrana per poi iniziare a diffondere attraverso di essa. Il coefficiente di diffusione in questo caso, oltre che dalle caratteristiche chimicofisiche del principio attivo, dipenderà anche dalla natura del polimero scelto per costituire la membrana polimerica. Subito dopo incontra lo strato adesivo dove, ancora una volta, dapprima si ripartisce e poi diffonde. In questo caso però, la velocità di diffusione è ben più elevata di quella che si ha attraverso la membrana, per cui, in effetti, lo strato adesivo non rappresenta un reale ostacolo. Transdermici- 9 A questo punto il principio attivo deve ripartirsi e diffondere attraverso lo strato corneo. Esso rappresenta di solito l'ostacolo maggiore. Qui c'è poca acqua e l'unica via di diffusione possibile è attraverso il materiale lipidico che circonda i corneociti. E' ovvio che più il coefficiente di ripartizione ottanolo-acqua è elevato, più la molecola si ripartirà facilmente in questo strato. Molecole molto polari o addirittura cariche penetrano questo strato molto difficilmente. La molecola troppo lipofila incontrerà però serie difficoltà a ripartirsi e oltrepassare il successivo strato e cioè quello germinativo, in quanto questo è molto ricco d'acqua. Rimarrà pertanto trattenuta dallo strato corneo. Una molecola decisamente idrofila vi diffonderebbe rapidamente, ma lo strato corneo gli impedisce di arrivarci. Sono infatti le molecole che possiedono un coefficiente di ripartizione di circa 1 o leggermente più basso (polarità intermedia) che riescono ad oltrepassare meglio la barriera della pelle, riuscendo a ripartirsi ugualmente bene sia nel materiale lipofilo dello strato corneo che in quello acquoso dello strato germinativo. Comunque, in definitiva, una regola fissa e schematica non esiste. Per verificare la fattibilità della formulazione di un sistema transdermico, è necessario paragonare la curva dei livelli ematici ottenuta tramite somministrazione transdermica con quella ottenuta per via orale. Transdermici- 10 Valutazione dell’assorbimento transdermico Naturalmente, non è ammissibile da un punto di vista etico ne possibile dal punto di vista economico valutare la fattibilità di un sistemica transdermico direttamente attraverso studi in vivo. Questi motivi, uniti alla crescente necessità di ottenere informazioni utili riguardanti i rischi tossicologici dovuti al contatto con una vastissima quantità di entità chimiche varie (cosmetici, detergenti, disinfettanti, concini ecc.) hanno spinto vari enti a sviluppare protocolli e test in vitro volti alla valutazione dell’assorbimento transdermico. I test in vitro permettono di ottenere dati in condizioni altamente controllate, dove le uniche variabili sono rappresentate dalla pelle e dal materiale testato. I test in vitro valutano solamente l’attraversamento dell’epidermide mentre i test in vivo valutano la concentrazione sistemica (non si hanno informazioni sulla concentrazione locale). Anche se la farmacopea riporta un test in vitro per i sistemi transdermici, è preferibile seguire quello messo a punto e suggerito dalla FDA, che prevede l'utilizzo delle cosiddette celle di Franz, dal nome dello studioso che le ha proposte per primo. Con questo test non si verifica solo come il P.A. si libera dalla forma farmaceutica, ma si può avere anche un'idea più precisa di quello che è il comportamento in vivo e ottenere anche informazioni sulle cinetiche di diffusione. Transdermici- 11 La membrana ideale da utilizzare dovrebbe essere epidermide umana tagliata non più spessa di 0,5 mm. Inoltre, l'età, la razza e il sesso del donatore nonché la zona del prelievo dovrebbero altresì essere specificati. In realtà, molto spesso i test vengono eseguiti utilizzando pelle animale (topo, ratto, coniglio), sebbene la composizione dell'epidermide animale non è esattamente la stessa di quella umana. Un'ulteriore alternativa è rappresentata dalle membrane artificiali, appositamente sviluppate per mimare le proprietà della pelle. Queste devono avere una porosità di 0,45 µm ed uno spessore di 150 µm. Possono essere in cellulosa acetato o nitrato, eventualmente imbevuti di una fase lipofila (isopropil miristato) nel caso in cui il test debba essere eseguito su unguenti, o per meglio avvicinarsi alla struttura della pelle. Il solvente che deve “mimare” il flusso sanguigno è in genere tampone fosfato a pH 7,4 alla temperatura di 32°C. La cella ne contiene 7 ml, sotto agitazione, ma un certo flusso garantisce le condizioni "sink". Un anello in Teflon di 2 mm x 17 mm, con un foro di 15 mm di diametro, viene posto sopra alla membrana. L'interno dell'anello è riempito col materiale da testare, che occuperà dunque un volume di 2 mm di altezza x 15 mm di diametro. Il tutto viene chiuso dal tappo superiore. La superficie di contatto tra la forma farmaceutica e la membrana è dunque una circonferenza di 15 mm di diametro. Transdermici- 12 La correlazione vivo-vitro per i sistemi transdermici è stato un argomento profondante studiato. I risultati hanno mostrato come i dati in vitro sembrano accurati nella previsione di quelli in vivo, eccetto che nei casi in cui il composto è soggetto ad estensive trasformazioni metaboliche a livello del derma. Transdermici- 13 Metodi per il miglioramento dell’assorbimento transdermico Per aumentare la quantità di attivo che penetra attraverso la pelle nell'unità di tempo, è possibile ricorrere all'uso di determinate sostanze dette "promotori di assorbimento“. Tali sostanze dovrebbero avere caratteristiche ben determinate quali : •non possedere azione farmacologica •essere specifiche nella loro azione •agire immediatamente e per una durata prestabilita •possedere un'azione reversibile •essere chimicamente e fisicamente stabili •essere compatibili con il principio attivo e gli altri componenti della formulazione •essere incolore, inodore, insapore •essere non tossiche, non allergeniche, non irritanti Ovviamente nessun promotore in uso possiede contemporaneamente queste qualità e bisogna accettare dei compromessi. E' altrettanto ovvio che non tutti i promotori di assorbimento funzionano indistintamente bene per qualsiasi tipo di principio attivo. In qualche caso possono anche addirittura ridurne l'assorbimento. Tra essi i più noti sono: Etanolo e metanolo l'effetto promotore dipenderebbe dalla loro capacità di estrarre alcuni lipidi dello strato corneo, soprattutto se si affianca ad essi anche un cosolvente idrofobico come il n-esano. DMSO (dimetil solfossido) ed omologhi come il C10MSO (decil metil solfossido) Agirebbero estraendo diversi componenti dello strato corneo, dai lipidi alle lipoproteine, alle nucleoproteine. Transdermici- 14 DMA (dimetil acetamide) e DMF (dimetil formamide) Agiscono con un meccanismo simile al DMSO Solventi vari (acetone, tetraidrofurfuril alcol, glicol propilenico) Alcoli ed acidi grassi Pirrolidoni Agirebbero aumentando l'idratazione dello strato corneo Azone (laurocaprame) E' uno dei promotori più efficaci, sintetizzato appositamente per questo scopo. Riesce ad aumentare l'assorbimento sia di principi attivi idrofili che lipofili. Generalmente il quantitativo opportuno da utilizzare è tra l'1 e il 5%. Questo è un ottimo vantaggio rispetto ai solventi precedentemente nominati che per essere attivi vanno utilizzati in percentuale ben più elevata (in qualche caso bisogna arrivare al 70%, con possibili complicazioni di tipo tossicologico). L'effetto promotore è potenziato dall'uso di glicol propilenico come cosolvente, mentre è inibito dai PEG liquidi. Il meccanismo con cui l'azone agisce non è ancora del tutto chiaro ( in realtà sembra incorporarsi nel doppio strato lipidico alterandone la microviscosità), ma, se una singola dose di azone riesce a cambiare la permeabilità di una molecola per i 5 giorni successivi alla somministrazione, è chiaro che tende a rimanere all'interno dell'epidermide. Effetto dell’azone sulla penetrazione di metrodinazolo in esperimenti condotti con pelle umana Transdermici- 15 SEPA Sepa è l’acronimo di ‘‘soft enhancement of percutaneous absorption” e rappresenta una classe di composti chimicamente correlati. Il termine soft è stato scelto per indicare la modesta tossicità (perlomeno se confrontata a quella degli altri promotori). Anche per i sepa il meccanismo d’azione non è ben chiaro, anche se i dati a disposizione fanno pensare ad un meccanismo simile a quello proposto per l’azone. Studi comparativi hanno mostrato una maggiore efficacia dei sepa rispetto all’azone. Transdermici- 16 Tensioattivi (anionici, cationici, non ionici) Il loro effetto è concentrazione dipendente. Al di sotto della concentrazione micellare critica, essi aumentano l'assorbimento delle sostanze, grazie al loro effetto destabilizzante sulle membrane cellulari. Quando invece la concentrazione supera quella micellare critica e si formano le micelle, la permeabilità diminuisce se il principio attivo è trattenuto dalle micelle stesse. Si possono verificare i seguenti casi: A: Il tensioattivo aumenta la permeabilità ma il P. A. interagisce con le micelle al di sopra della concentrazione micellare critica. B: Il tensioattivo aumenta la permeabilità ed il P. A. interagisce debolmente con le micelle al di sopra della concentrazione micellare critica. C: Il tensioattivo aumenta la permeabilità ed il P. A. non interagisce con le micelle al di sopra della concentrazione micellare critica. D: Il tensioattivo non aumenta la permeabilità ed il P. A. interagisce con le micelle al di sopra della concentrazione micellare critica. Velocità di permeazione E: Il tensioattivo non aumenta la permeabilità ed il P. A. non interagisce con le micelle al di sopra della concentrazione micellare critica. Concentrazione di tensioattivo Transdermici- 17 Dispositivi transdermici La somministrazione di attivi destinati alla pelle avviene in genere tramite formulazioni semisolide tipo unguenti, gel o creme. Queste forme farmaceutiche, pur rappresentando un via possibile, in realtà non costituiscono sistemi particolarmente idonei alla somministrazione transdermica. Questi sistemi non permettono di avere un controllo riproducibile del quantitativo di principio attivo assorbito in quanto la quantità di pomata usata e la superficie su cui viene sparsa non è mai la stessa. I dispositivi transdermici attualmente utilizzati sono i cosiddetti “cerotti transdermici”. Tutti i cerotti attualmente disponibili ricadono in tre tipologie principali: Drug in adhesive Il principio attivo è contenuto direttamente nello strato dell’adesivo cha ancorerà il cerotto all’epidermide. Drug in matrix (sitemi monolitici) L’attivo è inglobato in uno strato di matrice monolitica polimerica (semisolida o liquida), posizionato tra la copertura posteriore (backing layer) e l’adesivo. La matrice polimerica oltre a contenere il farmaco ne controlla anche la velocità di rilascio. Drug in reservoir Sono costituiti, partendo dall'esterno verso la pelle, dallo strato posteriore di chiusura, dallo strato che funge da serbatoio (liquido o semisolido) contenente il P.A., da una membrana polimerica e dallo strato adesivo. Il compito della membrana è quello di controllare la velocità di rilascio del principio attivo verso la pelle . Transdermici- 18 I componenti dello strato che contiene il P.A. possono essere i più disparati, purché farmaceuticamente accettabili almeno per uso esterno. La stessa cosa dicasi per la membrana che dovrebbe controllare la cinetica di rilascio. Il tipo di polimero e lo spessore usati possono essere moltissimi, purché, anche in questo caso farmaceuticamente accettabili. Anche il materiale costituente lo strato adesivo deve essere scelto con giudizio. Intanto bisogna verificare quanto P.A. migra nello strato adesivo prima ancora che il cerotto venga somministrato e se interagisce con i suoi componenti. Tale materiale deve garantire un'ottima adesione alla pelle del cerotto per un periodo di tempo anche lungo, ma deve anche far sì che la rimozione non sia dolorosa. Infine, il materiale adesivo non deve irritare la pelle. I materiali più usati sono quelli costituiti da resine acriliche, siliconiche o da poliisobutilene. Cominciano ad essere usati anche vari tipi di idrogeli. Lo strato posteriore di chiusura è invece molto spesso costituito da lamine ottenute per estrusione di poliesteri, polietilene, miscele dei due, oppure da lamine metalliche (di solito alluminio). Questi materiali devono essere “impermeabili” ed inerti sia nei confronti dell’attivo che degli eccipienti. Devono essere impermeabili in maniera da ridurre la perdita sia dell’acqua eventualmente contenuta nella formulazione (sistemi reservoir) che di generata dalla sudorazione transepidermiale (favorendo in questo modo una maggiore idratazione dello strato corneo). Transdermici- 19 Formulazione transdermiche attualmente presenti sul mercato SCOPOLAMINA Primo sistema transdermico (TTS) introdotto nel mercato nel 1981. La scopolamina (trattamento di nausea e vomito da movimento), sostanza oleosa insolubile in acqua, è rapidamente assorbita nel tratto GI e metabolizzata nel fegato. Gli effetti collaterali, dopo somministrazione orale o parenterale e la breve durata di azione (per via orale viene somministrata ogni 6 h) ne giustificano la somministrazione per via transdermica. Il TTS contenente scopolamina ha una struttura multistrato di tipo reservoir di cui fa parte una membrana porosa che regola la velocità di rilascio del farmaco. Rilascia 0.5 mg di farmaco per 3 giorni e si applica dietro l’orecchio. La somministrazione transdermica elimina gli effetti collaterali (disorientamento, disturbi della memoria, irrequietezza, vertigini, allucinazioni,confusione mentale). Prodotto commercializzato in Italia: Transcop (Recordati ) NITROGLICERINA Farmaco utilizzato nel trattamento dell’angina pectoris, con una scarsa biodisponibilità orale (1%), un’ elevata potenza ( 50-500 ng / ml ), ed una breve emivita (1-4 minuti). Le formulazioni orali hanno un effetto molto rapido ( inferiore a 2 minuti ) ma una breve durata d’azione (30 minuti nel caso delle compresse sottolinguali e 3 – 5 h per quelle buccali). In commercio ci sono sistemi transdermici di diverso tipo che comunque forniscono concentrazioni plasmatiche costanti ed equilvalenti nell’arco di 24h. Transdermici- 20 Prodotti commercializzati in Italia Adesitrin 5 / 10 / 15 Deponit 5 / 10 / 15 Minitran 5 / 10 / 15 Nitroderm TTS 5 / 10 / 15 Nitrodur 5 / 7.5 / 10 / 15 Nitrosylon 5 / 10 / 15 Top Nitro 5 / 7.5 / 10 / 15 Triniplas 5 / 10 / 15 Venitrin T 5 / 10 / 15 Pharmacia & Upjohn Schwarz Pharma 3M Italia Novartis Pharma Sigma – Tau Tau Knoll Farmaceutici Schering – Plough Novartis Farma AstraZeneca SISTEMA NITRO-DUR ® Questo dispositivo transdermico e’ preparato scaldando una soluzione acquosa di un polimero idrosolubile, glicerolo e alcool polivinilico e poi abbassando la temperatura della miscela per formare un gel. Un triturato lattosio/nitroglicerina e’ disperso nel gel e la miscela e’ solidificata a temperatura ambiente. Il disco medicato ottenuto e’ assemblato su una lamina impermeabile e munito di un bordo adesivo; si ottiene cosi’ un dispositivo transdermico da 20 cm2 che libera 10 mg di nitroglicerina al giorno per la prevenzione dell’angina pectoris. Transdermici- 21 ESTRADIOLO Farmaco di elevata potenza (20-100 100 pg/ml), con breve emivita (0.05 h) e rapida clearance (600--800 L/ h). I sistemi transdermici, di tipo multistrato, forniscono livelli plasmatici, costanti per un periodo di 3.5 giorni. Sono realizzati in dosaggi diversi e possono contenere associazioni con progestinici. CLONIDINA Farmaco di sintesi, antipertensivo, viene assorbito (95%) nel tratto GI , e presenta una emivita di 6 a 20 h. Gli effetti collaterali e la scarsa compliance da parte del paziente nei confronti del regime di dosaggio orale ne giustificano l’impiego per via per via transdermica. Il sistema transdermico contenente clonidina è di tipo multistrato con una membrana che controlla la velocità di rilascio del farmaco. Il sistema rilascia clonidina per 7 giorni. La somministrazione transdermica evita i picchi di concentrazione ematica che si osservano dopo somministrazione orale. FENTANIL Farmaco analgesico con elevata potenza (10 µg/Kg), breve emivita (3.7 h), elevato metabolismo epatico, scarsa biodisponibilità orale (30%). I sistemi transdermici, disponibili in quattro dimensioni (10, 20, 30, 40 cm2) rilasciano, rispettivamente, 25, 50, 75 e 100 µg/ h fentanil per 3 giorni. Sono sistemi a “reservoir” multistrato con una membrana che controlla la velocità di rilascio del farmaco. La somministrazione per via transdermica incrementa il tempo di emivita (17 h) rispetto a quella endovenosa (6 h). Transdermici- 22
Scaricare