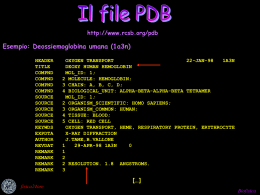
Di che cosa trattiamo? Alcuni cenni sulla struttura delle PROTEINE L’analisi informatica per la comprensione della struttura e funzione delle proteine: le SIMULAZIONI AL CALCOLATORE Biofisica La struttura delle biomolecole è un argomento di grande interesse per molti settori della ricerca di base e applicativa Funzione STRUTTURA Meccanismo Origine/Evoluzione Biofisica La FISICA fornisce metodi computazionali e approcci sperimentali molto potenti per indagare la struttura delle macromolecole biologiche. Biofisica Le più importanti tecniche sperimentali e teoriche per l’analisi delle strutture di macromolecole Difrattometria ai raggi X Microscopie Spettroscopie Modellistica molecolare Simulazioni al computer di dinamiche molecolare e interazioni molecolari Biofisica Le proteine e gli acidi nucleici sono polimeri Le macromolecole sono costruite collegando insieme unità strutturali definite MONOMERI Proteine 20 amminoacidi 4 basi nucleotidiche Acidi nucleici Biofisica LE PROTEINE (dal greco protos: principale) SONO LE MACROMOLECOLE PIU’ ABBONDANTI E SVOLGONO SVARIATE FUNZIONI, ad es.: La luce prodotta dalle lucciole coinvolge la proteina luciferina; Gli eritrociti contengono la proteina emoglobina che trasporta l’ossigeno; La proteina cheratina è il componente strutturale dei capelli, squame, corna, lana, unghie etc. Biofisica Contengono 20 amminoacidi uniti tramite un legame “peptidico”covalente Amminoacido Il legame peptidico Biofisica La sequenza degli amminoacidi costituisce la struttura primaria Ogni pallina corrisponde ad un amminoacido Ribonucleasi: Mr 17000 da, 124 aa., secreta dal pancreas. Catalizza l’idrolisi di acidi nucleici ingeriti con la dieta Biofisica Le proteine hanno diversi livelli di struttura Biofisica Molte malattie sono dovute al difettoso ripiegamento di una proteina Alcune patologie derivano da proteine che non sono in grado di raggiungere la loro struttura funzionale e che tendono a formare grossi aggregati (fibrille o forme amiloidi): Alzheimer, Parkinson, encefalopatia spongiforme, diabete di tipo II. In altri casi mutazioni puntiformi generano proteine che non raggiungono la loro locazione finale o che non sono più in grado di svolgere la loro funzione perché incapaci di legare i loro substrati. Fibrosi cistica: difetto nella proteina transmembrana che agisce come un canale degli ioni cloro nelle cellule epiteliali (CFTR: 1480 amminoacidi). La mutazione più comune è la delezione di un amminoacido (Phe 508) e la proteina mutata non si avvolge correttamente. Biofisica Il problema del “folding”: che cosa determina la struttura tridimensionale delle proteine? In genere la sequenza amminoacidica contiene la informazione completa per il raggiungimento della struttura funzionale Biofisica DETERMINAZIONE DELLA STRUTTURA TRIDIMENSIONALE DELLE MACROMOLECOLE BIOLOGICHE A LIVELLO ATOMICO = determinare le coordinate spaziali xyz per ogni singolo atomo, ovvero le posizioni reciproche degli atomi nello spazio Biofisica TECNICHE SPERIMENTALI X-ray crystallography (Kendrew and Perutz - 1961) NMR spectroscopy (Ernst and Wuthrich - 1983) Diffrazione di raggi X incidenti su cristalli di biomolecole -> dipende dalla spaziatura tra gli atomi Assorbimento di radio frequenze da parte di biomolecole (solo certi tipi di nuclei) IN SOLUZIONE e immerse in un campo magnetico -> dipende dall’intorno del nucleo Biofisica Confronto NMR - diffrazione ai raggi X NMR Raggi X Mioglobina Con NMR si ottengono delle famiglie di strutture: si hanno informazioni sulla mobilità delle porzioni di macromolecola, ma in molti casi il risultato finale è molto simile Biofisica TECNICHE COMPUTAZIONALI L’utilizzo COMPLEMENTARE di tecniche di tipo sperimentale e di tipo computazionale è l’approccio ottimale per lo studio dei sistemi e dei processi biologici. I limiti dell’una sono infatti superati dall’altra Biofisica Limiti delle tecniche sperimentali risoluzione SPAZIALE misure ad alta risoluzione di strutture molecolari sono possibili solo per sistemi relativamente rigidi risoluzione ENERGETICA analisi delle energie di interazione atomica difficoltosa risoluzione TEMPORALE i primissimi eventi dei processi biologici sono di difficile misurazione Biofisica Limiti delle tecniche computazionali Sistemi biomolecolari troppo complessi utilizzare approssimazioni si devono Simulazione del comportamento nel tempo di un sistema molecolare su un computer solo un numero limitato (<NA) atomi o di gradi di libertà (di solito 102-105 atomi), per un limitato periodo di tempo (103-104 picosecondi) può essere simulato piccoli sistemi, con tempi di rilassamento brevi e/o utilizzo dei dati sperimentali per restringere il numero di conformazioni possibili Biofisica Alcune Applicazioni MODELLIZZARE la struttura risoluzione atomica della molecola tridimensionale a Biofisica Effettuare MUTAZIONI puntiformi, che possono fornire indicazioni utili per il riconoscimento del sito attivo o di strutture indispensabili all'attività della molecola o dirette ad una certa funzione. Biofisica Studiare le VARIAZIONI CONFORMAZIONALI provocate dall’interazione della proteina con uno o più LIGANDI, la quale fornisce l’attivazione (o inattivazione) necessaria per compiere la propria funzione biologica (o per impedirla). Biofisica Monitorare i CAMBIAMENTI STRUTTURALI indotti su peptidi o proteine da parte di MEMBRANE BIOLOGICHE, i quali sembrano essere fondamentali per il riconoscimento con il recettore o per oltrepassare la fase lipidica e raggiungere zone altrimenti inaccessibili. Biofisica Comprendere il processo di FOLDING delle proteine, ovvero il meccanismo di ripiegamento con cui raggiungono la confomazione biologicamente attiva. Biofisica Applicazioni FARMACOLOGICHE: viene fornita un’indicazione specifica, o quanto meno restrittiva, della struttura opportuna in funzione del bersaglio del farmaco. In questo campo, la costruzione di strutture calibrate permette di ridurre la ricerca ad un ristretto raggio d’azione. Biofisica Biofisica Ipotesi termodinamica di Anfinsen (per proteine a singolo dominio) L’informazione codificata nella amminoacidica di una proteina completamente la sua struttura nativa sequenza determina Lo stato nativo è il minimo assoluto dell’energia libera della proteina Biofisica Permette di costruire la struttura tridimensionale di una proteina sulla base della SIMILARITÀ DI SEQUENZA con un’altra proteina di struttura NOTA che viene usata come STAMPO. Biofisica Si basa sulle seguenti osservazioni: le proteine appartengono ad un numero limitato di famiglie strutturali proteine della stessa famiglia tridimensionali molto simili hanno strutture Biofisica E’ molto importante l’allineamento di sequenza con la proteina “stampo” * aa identici . aa simili 4mdh.aa 11BMD 1 1 SEPIRVLVTG AAGQIAYSLL YSIGNGSVFG KDQPIILVLL DITPMMGVLD KAPVRVAVTG AAGQIGYSLL FRIAAGEMLG KDQPVILQLL EIPQAMKALE *.** *** *****.**** . *. * ..* ****.** ** .* * *. 4mdh.aa 11BMD 51 51 GVLMELQDCA LPLLKDVIAT DKEEIAFKDL DVAILVGSMP RRDGMERKDL GVVMELEDCA FPLLAGLEAT DDPDVAFKDA DYALLVGAAP RKAGMERRDL **.***.*** .*** . ** * ..**** * *.***. * *. ****.** 4mdh.aa 11BMD 101 101 LKANVKIFKC QGAALDKYAK KSVKVIVVGN PANTNCLTAS KSAPSIPKEN LQVNGKIFTE QGRALAEVAK KDVKVLVVGN PANTNALIAY KNAPGLNPRN * * *** ** ** ** * ***.**** ***** * * *.**.. * 4mdh.aa 11BMD 151 151 FSCLTRLDHN RAKAQIALKL GVTSDDVKNV IIWGNHSSTQ YPDVNHAKVK FTAMTRLDHN RAKAQLAKKT GTGVDRIRRM TVWGNHSSTM FPDLFHAEVD *. .****** *****.* * * * .. . .******* .**. ** * 4mdh.aa 11BMD 201 201 LQAKEVGVYE AVKDDSWLKG EFITTVQQRG AAVIKARKLS SAMSAAKAIC GRP----ALE LVDME-WYEK VFIPTVAQRG AAIIQARGAS SAASAANAAI .. * * . * ** ** *** **.* ** * ** ***.* 4mdh.aa 11BMD 251 246 DHVRDIWFGT PEGEFVSMGI ISDGNSYGVP DDLLYSFPVT IKDKTWKIVE EHIRDWALGT PEGDWVSMAV PSQGE-YGIP EGIVYSFPVT AKDGAYRVVE .*.** .** ***. ***.. *.*. **.* . ..****** ** . ..** 4mdh.aa 11BMD 301 295 GLPINDFSRE KMDLTAKELA EEKETAFEFL SSA GLEINEFARK RMEITAQELL DEMEQVKALG LI ** **.*.* .*..** ** .*.* . Biofisica Dopodichè si procede con… …la costruzione dello scheletro… …l’inserimento delle catene laterali… …l’inserimento dei loop corrispondenti a “buchi” nell’allineamento… Biofisica …per concludere con… …l’ottimizzazione del modello.. …e il controllo della sua qualità Biofisica http://www.rcsb.org/pdb Esempio: Deossiemoglobina umana (1a3n) HEADER TITLE COMPND COMPND COMPND COMPND SOURCE SOURCE SOURCE SOURCE SOURCE KEYWDS EXPDTA AUTHOR REVDAT REMARK REMARK REMARK REMARK OXYGEN TRANSPORT 22-JAN-98 1A3N DEOXY HUMAN HEMOGLOBIN MOL_ID: 1; 2 MOLECULE: HEMOGLOBIN; 3 CHAIN: A, B, C, D; 4 BIOLOGICAL_UNIT: ALPHA-BETA-ALPHA-BETA TETRAMER MOL_ID: 1; 2 ORGANISM_SCIENTIFIC: HOMO SAPIENS; 3 ORGANISM_COMMON: HUMAN; 4 TISSUE: BLOOD; 5 CELL: RED CELL OXYGEN TRANSPORT, HEME, RESPIRATORY PROTEIN, ERYTHROCYTE X-RAY DIFFRACTION J.TAME,B.VALLONE 1 29-APR-98 1A3N 0 1 2 2 RESOLUTION. 1.8 ANGSTROMS. 3 […] Biofisica tipo di atomo ATOM ATOM ATOM ATOM ATOM ATOM ATOM ATOM ATOM ATOM ATOM ATOM ATOM ATOM ATOM ATOM ATOM ATOM ATOM ATOM ATOM 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 tipo di amminoacido N CA C O CB CG1 CG2 N CA C O CB CG CD1 CD2 N CA C O CB OG VAL VAL VAL VAL VAL VAL VAL LEU LEU LEU LEU LEU LEU LEU LEU SER SER SER SER SER SER A A A A A A A A A A A A A A A A A A A A A 1 1 1 1 1 1 1 2 2 2 2 2 2 2 2 3 3 3 3 3 3 coordinate X Y Z 10.720 10.228 8.705 8.164 10.602 10.307 12.065 8.091 6.624 6.176 6.567 6.020 6.386 5.998 5.730 5.380 4.831 3.725 3.095 4.308 3.076 19.523 20.761 20.714 20.005 22.000 23.296 21.951 21.453 21.451 22.578 23.730 21.707 20.649 21.119 19.337 22.237 23.237 24.027 23.717 22.429 21.786 6.163 6.807 6.878 6.015 5.966 6.700 5.544 7.775 7.763 6.821 7.022 9.129 10.198 11.577 9.795 5.852 4.928 5.568 6.591 3.727 3.991 1.00 1.00 1.00 1.00 1.00 1.00 1.00 1.00 1.00 1.00 1.00 1.00 1.00 1.00 1.00 1.00 1.00 1.00 1.00 1.00 1.00 21.36 24.26 18.62 19.87 27.19 31.86 31.74 16.19 17.31 18.55 18.72 18.34 17.39 17.99 16.96 15.02 16.59 14.84 14.40 16.47 14.91 N C C O C C C N C C O C C C C N C C O C O … Biofisica 1a3n Deossiemoglobina catena A C O N S EME Fe Biofisica RASMOL v 2.7 http://www.umass.edu/microbio/rasmol/index2.htm Biofisica Comprende tecniche come: la DINAMICA MOLECOLARE, la RICERCA DEL MINIMO DELL’ENERGIA CONFORMAZIONALE, e il RICONOSCIMENTO MOLECOLARE (DOCKING). Biofisica Ad ogni conformazione molecolare è associata una ENERGIA POTENZIALE Biofisica La forma più semplice DELL’ENERGIA POTENZIALE di una molecola è : ENERGIA pot = bending Energia di ALLUNGAMENTO dei legami + Energia di PIEGAMENTO degli angoli di legame stretching + Energia di TORSIONE degli angoli diedri + Energia delle interazioni di NONLEGAME: repulsioni steriche, interazioni di Van der Waals, interazioni elettrostatiche torsion Biofisica Ipotesi termodinamica di Anfinsen (per proteine a singolo dominio) L’informazione codificata nella amminoacidica di una proteina completamente la sua struttura nativa sequenza determina Lo stato nativo è il minimo assoluto dell’energia libera della proteina Biofisica Termodinamica del folding imbuto di energia libera visto come Si raggiunge il minimo energetico assoluto percorrendo anche strade diverse Ogni minimo relativo corrisponde a stati intermedi metastabili Le interazioni idrofobiche di residui non polari provocano il “collasso idrofobico” Scendendo verso il basso si ha una diminuzione delle specie Biofisica Strategie di ricerca del minimo assoluto Esistono metodi computazionali di ricerca del minimo assoluto che implicano il campionamento dello spazio conformazionale: -il campionamento energetico sistematico -l’annealing simulato -la ricerca casuale enorme onere computazionale utilizzabili solo per peptidi corti Biofisica Permette lo studio di processi dinamici complessi che avvengono nei sistemi biologici. Studia sia transizioni conformazionali che vibrazioni locali, ad esempio: stabilità delle proteine variazioni conformazionali folding proteico trasporto ionico Biofisica Calcola la TRAIETTORIA di un sistema molecolare = la configurazione molecolare in funzione del tempo, ovvero come variano nel tempo le posizioni, le velocità e le accelerazioni degli atomi della molecola. La traiettoria è generata da integrazioni simultanee dell’ equazione del moto di Newton Fi = mi ai per tutti gli atomi del sistema molecolare Biofisica Per calcolare una traiettoria c'è bisogno: 1. delle posizioni inziali ri : si ricavano da strutture sperimentali (cristallografia raggi X, NMR ecc.) o ottenute con modeling; 2. delle velocità iniziali vi : si ottengono dalla distribuzione delle velocità alla temperatura assegnata; 3. delle accelerazioni : sono determinate da una relazione che lega la forza che agisce su un atomo all'energia potenziale. Biofisica Protocollo di simulazione Struttura iniziale Minimizzazione dell’ energia rimuove interazioni di Van der Waals forti che porterebbero a distorsioni locali Solvatazione della proteina nel caso si usi un solvente esplicito, aggiungere le molecole d’acqua Minimizzazione dell’ energia in presenza del solvente Fase di riscaldamento Fase di equilibrazione per equilibrarlo con la struttura si lancia la MD con velocità iniziali a bassa temperatura nuove velocità riassegnate periodicamente a T leggermente più alta e così via fino al raggiungimento della T di simulazione desiderata. la simulazione prosegue finchè sono stabili nel tempo la struttura, la pressione, la temperatura (si riscalano le velocità), l'energia Fase di simulazione vera e propria Biofisica Analisi dei risultati Campionamento periodico di coordinate (e velocità) Calcolo dell’energia potenziale media in funzione del tempo Calcolo della differenza con la struttura di partenza in funzione del tempo Energia potenziale (Kcal/mol) 200 100 0 -100 -200 -300 -400 -500 -600 -700 -800 -900 0 500 1000 1500 2000 tempo (ps) media 1700ps 1600ps 1500ps 1400ps 1300ps 1200ps 1100ps Calcolo della superficie accessibile al solvente e del raggio di girazione, in funzione del tempo 1000ps 900ps 800ps 700ps 600ps 500ps 400ps 300ps 200ps S1 Calcolo della struttura media H1 H2 S2 S3 S4 S5 S6 S7 S8 S9 S10 100ps 10 20 30 40 50 60 70 80 90 100 110 120 130 Residue number Biofisica Riconoscimento molecolare E’ il punto di partenza per quasi tutti i processi biologici. Le molecole interagiscono in una maniera altamente specifica: modello CHIAVE-SERRATURA (Fisher e Ehrilch) Biofisica La complementarità geometrica e chimica fra piccole molecole biologiche (LIGANDI) e le strutture dei loro bersagli macromolecolari (RECETTORI) gioca un ruolo molto importante all’interno dei processi biologici. Biofisica La capacità di un recettore di agganciarsi al suo ligando selettivamente e con alta affinità è dovuta alla formazione di una serie di legami deboli (legami H, ionici, interazioni di Van der Waals) sommati ad interazioni favorevoli (es. idrofobiche). Gli atomi del sito di legame forniscono l’impalcatura necessaria per conferire alla superficie un dato contorno e particolari proprietà chimiche Variazioni anche piccole di tali amminoacidi spesso compromettono la funzionalità del recettore Biofisica docking Metodi computazionali per la predizione della struttura 3D di complessi proteina-ligando. Insieme di tecniche che consentono di simulare interazioni tra vari sistemi (sito attivo di un enzima e una nuova molecola di inibitore) e di valutare approssimativamente le nuove interazioni che si creano. Biofisica In quest’ultimo caso, viene trovato il corretto modo di legame di un composto tramite il campionamento dello spazio conformazionale nel sito di legame, attraverso la valutazione di funzioni che stimano l’energia di ogni combinazione confomazionale ligando-recettore. Tali funzioni valutano fattori quali: •Complementarità fra superficie •Interazioni elettrostatiche e idrofobiche •Energia libera di solvatazione Biofisica algoritmi AUTODOCK, DOCK, FlexX, GOLD, GRID… Algoritmi di docking. Posizionano ligandi - rigidi o flessibili - in siti di binding proteici generalmente rigidi. Il ligando durante il binding cambia la sua struttura tridimensionale in termini di angoli di torsione per trovare il miglior adattamento spaziale ed energetico nel sito di binding della proteina. Questa assunzione segue il modello “chiave-serratura” citato in precedenza. Prendendo in considerazione anche la flessibilità del recettore allora andrebbero considerati centinaia o anche migliaia di gradi di libertà. Biofisica farmaci Elemento chiave: scoperta di composti guida nuovi e innovativi Composto guida = composto che mostra affinità per un dato recettore, che ha attività biologica e che può essere strutturalmente modificato per migliorare la bioattività Biofisica tempi per lo sviluppo di un nuovo farmaco 1. 2. 3. 4. 5. 6. Ricerca del composto guida (1-2 anni) Ottimizzazione del composto guida (1-2 anni) Saggi di attività in vitro e in vivo (1-2 anni) Test tossicologici (1-3 anni) Test per la sicurezza sull’uomo (1 anno) Test per l’efficacia sull’uomo (1-2 anni) Tempo totale per lo sviluppo di un nuovo farmaco: 6-12 anni Costo totale: circa $ 500 000 000 è di grande importanza l’identificazione RAPIDA E AFFIDABILE di ligandi ad alta affinità Biofisica Screening sperimentale: test in vitro di grandi librerie di composti. Ignora, in genere, le proprietà strutturali del recettore Metodi computazionali detti Rational Design: si basano su informazioni strutturali del recettore e/o del ligando Biofisica Metodi computazionali Struttura 3D del recettore NON nota QSAR (Quantitaive Structure-Activity Relationship) Stabilisce una relazione tra la struttura molecolare e l’attività biologica di una serie di composti attivi. Predice la attività e la affinità di composti non noti dall’analisi delle similitudini e differenze strutturali con composti noti, fornendo anche informazioni sui requisiti strutturali del recettore. Struttura 3D del recettore nota Structure Based Drug Design De Novo Design I nuovi composti vengono generati nel sito di legame a partire da atomi o frammenti preposizionati nel sito e che successivamente vengono trasformati in molecole intere da softwares specifici. Screening Virtuale Librerie di molecole (esistenti o ipotetiche) vengono analizzate cercando ligandi con caratteristiche in accordo con i requisiti del sito di legame Docking Biofisica Biofisica Biofisica Le tecniche computazionali rappresentano uno strumento molto utile per: •la modellazione di sistemi proteici •la comprensione dei processi biologici •la comprensione della relazione struttura-attività •la scoperta e ottimizzazione dei composti guida farmacologici Vantaggio dal punto di vista biologico, chimico e farmaceutico, riducendo i tempi e completando e indirizzando le conoscenze sperimentali Biofisica
Scaricare