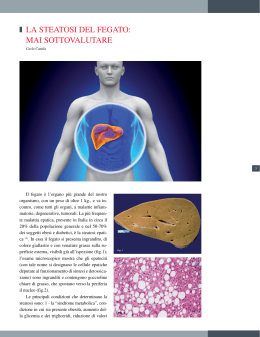
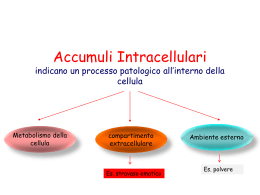
STEATOSI STEATOSI La steatosi è una patologia cellulare legata all'accumulo intracellulare di lipidi generalmente trigliceridi che comporta una serie di danni fino alla necrosi della cellula. Gli organi più colpiti sono la corticale renale, il muscolo striato e soprattutto il cuore (o meglio le fibre muscolari miocardiche) e il fegato. Quest'ultimo organo è particolarmente sensibile ai processi steatosici per tre ragioni: è un organo chiave nel metabolismo dei lipidi è un organo responsabile dell'inattivazione di numerose sostanze tossiche è un organo la cui circolazione è prevalentemente venosa (quindi costantemente vicino ad una situazione di ipossia) STEATOSI Quasi tutte le steatosi sono provocate da uno squilibrio fra la quantità di trigliceridi che le cellule hanno a disposizione e la loro effettiva capacita’ di metabolizzarli. STEATOSI Caratteristiche delle steatosi Le caratteristiche macroscopiche delle steatosi sono l'organomegalia ed il tipico colore giallastro causato dall'eccesso di grasso. Le caratteristiche microscopiche sono riconducibili all'organizzazione che l'accumulo di lipidi può assumere; si distinguono infatti: Steatosi microvescicolari: caratterizzate dalla presenza di numerose e piccole vescicole. Si tratta di steatosi irreversibili, che progrediscono come steatoepatiti e terminano come cirrosi. Sono tipiche steatosi da ipossia o da avvelenamento (per esempio da CCl4) Steatosi macrovescicolari: caratterizzate dalla presenza di un'unica grossa vescicola. Si tratta di una steatosi reversibile, che se non curata può comunque progredire come steatoepatite e infine come cirrosi. Tipica steatosi da etilista. STEATOSI TIPOLOGIE Per quanto riguarda le steatosi epatiche possiamo classificarle in base alla loro eziologia in steatosi: da aumentato apporto di grassi da ridotto smaltimento di grassi da aumentata sintesi endogena di grassi. STEATOSI STEATOSI DA AUMENTATO APPORTO DI GRASSI: steatosi la cui causa risiede in una dieta iperlipidica o in un'aumentata mobilizzazione dei NEFA (acidi grassi liberi non esterificati). Frazione lipidica che dai depositi periferici (tessuto adiposo) viene convogliata al fegato o ai muscoli per essere metabolizzata e fornire all'organismo energia di pronto impiego; i NEFA hanno infatti un turnover rapidissimo (emivita di circa 2 minuti); essi rappresentano l'1-3% dei lipidi plasmatici. Quest'ultima a sua volta può essere causata da molteplici fattori tra cui stress, ormoni (tiroidei, ACTH), o di farmaci (teofillina, caffeina) e digiuno prolungato (in questo caso avremo un quadro reversibile) o da altre patologie come diabete mellito e glicogenosi di tipo I (entrambe le patologie sono caratterizzate da un deficit insulinico con conseguente aumento della lipolisi e quindi dei NEFA circolanti) si tratta di un quadro irreversibile. STEATOSI STEATOSI DA RIDOTTO SMALTIMENTO DI GRASSI: Steatosi la cui causa può essere una dieta ipoproteica, una diminuita sintesi di apolipoproteine necessarie a smaltire i trigliceridi . Deficit di colina, essenziale per la sintesi di fosfolipidi necessari per la formazione di lipoproteine (trigliceridi+proteine). Deficit di vitamina B12, eccesso di vitamina PP o ipossia. L’avvelenamento da aflotossina B1 o Amanita phalloides inibiscono la RNA polimerasi che sintetizzano gli RNA messaggeri per le apolipoproteine con conseguente accumulo di trigliceridi STEATOSI STEATOSI DA AUMENTATA SINTESI ENDOGENA DI GRASSI: Steatosi dovute ad un accumulo di lipidi di sintesi endogena a partire da acetato. Esempi clinicamente importanti sono le steatosi provocate da barbiturici (in grado di stimolare la sintesi di acidi grassi a partire da acetil-CoA) e quelle da abuso di alcool (l'etanolo viene infatti metabolizzato ad acetaldeide prima e ad acetato poi). Ciclo di Krebs STEATOSI EPATICA ALCOLICA METABOLISMO DELL'ALCOOL L'alcool ingerito viene metabolizzato a livello del fegato da un enzima, l'alcool deidrogenasi (ADH) che lo trasforma in acetaldeide. In questa reazione è implicato come coenzima il sistema NAD (nicotinaammide - adenin - dinucleotide) che viene ridotto a NADH. L'acetaldeide viene trasformata successivamente in acetato attraverso l'uso dello stesso coenzima; l'acetato, insieme al coenzima A (Co-A) viene inserito poi nel ciclo di Krebs dove trova il suo destino metabolico. La conseguenza di questa reazione con la formazione di una grande quantita di NADH (forma ridotta) con consumo del NAD (forma ossidata). STEATOSI EPATICA ALCOLICA Nel fegato l'etanolo viene metabolizzato ad acetaldeide seguendo tre possibili vie: Nei perossisomi viene metabolizzato dalle catalasi con produzione di una molecola di acqua. Si tratta di una reazione dannosa in quanto comporta la produzione di specie reattive dell'ossigeno (radicali liberi). Nel citoplasma viene metabolizzato dall'enzima alcool deidrogenasi (ADH). Si tratta di una reazione di ossidazione che comporta la riduzione di una molecola di NAD+ a NADH In misura maggiore l'etanolo viene metabolizzato dal MEOS (microsomial ethanol oxidizing system) a livello microsomiale del reticolo endoplasmatico liscio: il citocromo P450 catalizza la reazione di ossidazione dell'etanolo riducendo il proprio ione di ferro STEATOSI EPATICA ALCOLICA DANNI DA ACETALDEIDE Qualunque sia il sistema enzimatico di metabolizzazione dell’etanolo il risultato è la produzione di acetaldeide, composto altamente reattivo, che, comportando un rischio per l’epatocita, tende ad essere rapidamente metabolizzato per il 90% ad acetato in sede mitocondriale ad opera dell’aldeide deidrogenasi L'acetaldeide non metabolizzata favorisce la lipoperossidazione, una reazione molto pericolosa in quanto può provocare danni a livello di vari organelli cellulari (come mitocondri e RER) e alla membrana cellulare (tra le cui componenti principali troviamo i fosfolipidi) . Inibisce le ossidazioni mitocondriali e qundi anche l’ossidaizone degli acidi grassi con aumento di questi nell’epatocita Inibisce la sintesi proteica delle lipoproteine a livello delle frazioni dei ribosomi legati al RE. Causa la deplezione di glutatione e SAM (S-adenosil-metionina) con conseguente minore difesa verso i radicali liberi e quindi un maggior rischio di danno cellulare, di mutazione e indirettamente di insorgenza di un tumore.
Scaricare