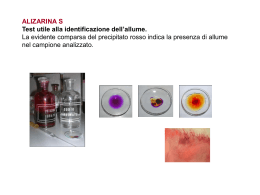
Corso di Laurea in Chimica e Tecnologie Farmaceutiche Insegnamento di Patologia Generale e Terminologia Medica Caludio Paoli UO Neurologia Azienda USL 6 di Livorno BUONO CATTIVO RAPIDO/LENTO “Noi siamo il nostro cervello” Il Neurone 2 settimane 7 anni !!!!!!!!!! La Malattia di Alzheimer La Malattia di Parkinson Ictus ischemico Malattia di Alzheimer Principale malattia neurodegenerativa 13% sopra 65 anni 50% sopra 85 anni Mild Cognitive Impairment → Dementia Esame post-mortem: A. grovigli neurofibrillari e B: β-amiloide sotto forma di placche. Malattia di Alzheimer Esordio: - AD INSORGENZA PRECOCE (<65 anni), più rara - AD INSORGENZA TARDIVA, più diffusa Eziologia: A) fattori genetici B) sporadica, multifattoriale A) Mutazioni in: presenilin 1, amyloid precursor protein, presenilin 2 → early-onset familial AD B) Polimorfismi in Apolipoproteina E → associati alla forma idiopatica L’ eziologia non è conosciuta Aspetti Neuropatologici Alterazioni morfologiche quantitative: - riduzione di peso e di volume dell’organo - dilatazione cavità ventricolari - ampliamento dei solchi e delle scissure a livello della corteccia - maggiore atrofia “anche lui può essere CLINICAMENTE Alzheimer Patologia della malattia di Alzheimer PLACCHE DI AMILOIDE: Proteina precursore dell’ amiloide APP depositi amorfi extracellulari di proteina β-amiloide (Aβ) sotto forma di placche Buona Cattiva GROVIGLI NEUROFIBRILLARI: intreccio intracellulare di neurofibrille formate da proteina TAU anomala Placche senili 1. CLASSICHE: sono accumuli extracellulari, costituiti da un nucleo centrale di β-amiloide, circondato da un anello di neuroni distrofici, microglia e astrociti (“neuritiche”) 2. DIFFUSE (assenza di reazione neuritica periplacca): sono una forma preliminare rispetto alle classiche e localizzate in aree cerebrali non sintomatiche dell’AD Placche di amiloide Sono ammassi di sottili filamenti (7-10 nm) che si formano nello spazio extracellulare nel cervello dei malati di AD. Sono costituiti da una forma insolubile del peptide che deriva dalla proteina precursore del β-amiloide (APP) e queste placche possono avere un nucleo denso centrale. PROTEINA PRECURSORE DELL’AMILOIDE Colorazione rosso congo Ruolo dell’amiloide nei neuroni L’amiloide agisce attraverso recettori sulla membrana cellulare, stimolando cambiamenti all’interno della cellula: 1. anormale fosforilazione di tau 2. aumento dello stress ossidativo 3. aumentata suscettibilità all’ eccitotossicità 4. Danno diretto alle membrane, alla neurotrasmissione. 5. Azione proinfiammatoria L’amiloide stessa è in grado di generare radicali liberi, che provocano danni alle membrane, con conseguente degenerazione; L’amiloide può causare danni al DNA e/o dare origine ad apoptosi; Causa dell’accumulo delle Placche Due cause principali dell’accumulo delle placche: 1. Forme dominanti della malattia associate alla disfunzione dei geni che controllano il metabolismo della proteina amiloide: α-, β-, and γsecretasi e preseniline 1 e 2 2. Forme non dominanti della malattia (incluse le forme sporadiche) che coinvolgono i meccanismi della rimozione della Aβ. Il precursore dell’amiloide Recettore ? Blu → PS1 Verde → APP Rosso → Mutazioni La proteina precursore dell’amiloide viene normalmente degradata per l’azione di una serie di proteasi, chiamate secretasi: α-, β-, e γ-secretasi che tagliano la proteina in sequenze specifiche (vedi forbici) Queste proteasi sono sotto il controllo di due altre proteasi: le preseniline 1 e 2 Mutazioni nelle preseniline, α-, β-, e γ-secretasi o nella APP stessa determinano l’ accumulo extracellulare di Aβ (vedi aa rossi) sono causa di malattia. Preseniline e neurotossicità La PS1 e la PS2 ( funzionalità meccanismi trasduzione del segnale) fanno parte di un complesso enzimatico la γ-secretasi; (Aβ42/Aβ40) Mutazioni in queste proteine aumentano la produzione di Aβ, fornendo un legame per la deposizione di amiloide; APP processing and Aß accumulation Mature APP (center, inside dashed box) is metabolized by 2 competing pathways: A) the α-secretase pathway that generates sAPP α and C83 (also known as CTF α; left) B) and the ß-secretase pathway that generates sAPPß and C99 (right). Some ß-secretase cleavage is displaced by 10 amino acid residues and generates sAPPß' and C89. All carboxyterminal fragments (C83, C99, and C89) are substrates for γ-secretase, generating the APP intracellular domain (AICD) and, respectively, the secreted peptides p3 (not shown), Aß (right), and Glu11 Aß (see Figure 4). Aß aggregates into small multimers (dimers, trimers, etc.) known as oligomers. Oligomers appear to be the most potent neurotoxins, while the end stage senile plaque is relatively inert. Rimozione dell’amiloide Ruolo dell’ApolipoproteinaE (ApoE) Proteina plasmatica implicata nel trasporto del colesterolo Nel SNC e’ prodotta dagli astrociti e interviene nei meccanismi di crescita e riparazione dopo un danno e nel trasporto del colesterolo nei neuroni Nell’AD la ApoE è legata alle placche di Aβ e ai grovigli neurofibrillari ApoE inibisce la formazione di fibrille di Aβ I peptidi amiloidi interagiscono direttamente con ApoE legandovisi Nei cervelli di soggetti sani ApoE si lega e sequestra Aβ in modo più efficiente che in quelli dei malati di AD ApoE ε4 Patologia neurofibrillare Sono anormali strutture filamentose che includono filamenti a doppia elica e filamenti lineari che contribuiscono alla formazione di matasse nei corpi cellulari . Questi filamenti sono altamente insolubili e permangono nello spazio extracellulare anche dopo la morte del neurone. Grovigli neurofibrillari Colorazione con Sali d’ argento Mutazioni nel MAPT demenze frontotemporali I grovigli neufibrillari sono dovuti a fasci di filamenti insolubili che derivano da alterata fosforilazione delle proteine TAU, associate al citoscheletro dei neuroni, che si accumulano nel corpo neuronale L’iperfosforilazione riduce l’affinità delle TAU per i microtubuli causando una perdita di stabilità nel neurone e può portare alla modificazione del metabolismo dell’ APP Queste masse neurofibrillari si trovano principalmente: A. nelle cellule piramidali dell’ippocampo e B. nei piccoli neuroni piramidali della corteccia fronto-temporale Correlati, anche quantitativamente, alla perdita della memoria recente All’inizio le matasse neurofibrillari sono intracellulari e non c’è un’ apprezzabile perdita di neuroni; quando si sviluppano le placche e i grovigli si diffondono alla neocorteccia, i neuroni degenerano e lasciano grovigli extracellulari. Individui non dementi, con depositi di β-amiloide nella neocorteccia possono avere deficit cognitivi quindi Stadio precoce di AD Forse fase preclinica, prevista dalla cascata patologica dell’AD Lo sviluppo delle placche nelle aree neocorticali precede la patologia neurofibrillare e la demenza clinica eccitotossicità IPOTESI COLINERGICA Inibitori acetil colinesterasi AChI • Rivastigmina • Donepezil • Galantamina (ATTRAVERSANO LA BARRIERA EMATOENCEFALICA) ( REVERSIBILI ) Rivastigmina • Più alta selettività per forma molecolare G1 ( meno ubiquitaria ) dell ACh esterasi -minore incidenza di effetti collaterali periferici ( ?) DONEPEZIL • Il Donezepil è metabolizzato dall’isoenzima CYP2D6, coinvolto nel metabolismo della maggior parte dei farmaci. Il locus CYP2D6 è altamente polimorfico, con più di 100 differenti alleli identificati che dividono la popolazione dei pazienti che assume il donepezil in metabolizzatori normali, poveri ed ultrarapidi GALANTAMINA • INIBITORE COMPETITIVO REVERSIBILE • Nonostante i meccanismi d’azione dei tre inibitori differiscano parzialmente, il loro effetto terapeutico è pressochè equivalente ed in caso di cattiva tollerabilità od inefficacia del farmaco originariamente prescritto è possibile sostituirlo con uno degli altri due Cerotto ! IPOTESI GLUTAMMATERGICA • Il principale neurotrasmettitore del Sistema Nervoso Centrale (SNC) è risultato essere il glutammato, responsabile del 70% delle risposte eccitatorie a livello del SNC. Si ipotizza come un’eccessiva stimolazione dei recettori per il glutammato possa contribuire alla perdita dei neuroni nel SNC con conseguente formazione di placche amiloidee o determinare un danno di tipo eccitotossico a carico dei neuroni resi più vulnerabili dopo l’esposizione all’ amiloide MEMANTINA Soluzione orale Processi di apprendimento e memoria ( LTP) Antagonizza l’ eccitotossicità glutammatergica tonica TAU • Tra i composti che hanno come target la proteina tau, vengono annoverati, per esempio, gli inibitori GSK-3, il blu di metilene e la taslaclidina. • L’ipotesi dell’ inibizione della glicogeno sintetasi-chinasi 3 (GSK3) ritiene che tale chinasi sia implicata nello sviluppo di tutti gli hallmarkers della patologia poiché media l’iper-fosforilazione della proteina tau, l’ aumento della produzione di αβ da APP (proteina precursore di αβ), i processi che causano la compromissione mnesica e il potenziamento delle risposte infiammatorie in prossimità delle placche amiloidee • La Talsaclidina (altro composto che ha come target la proteina tau), • non sono ad oggi disponibili dati significativi su outcome clinici rilevanti nell’AD. • Un altro farmaco che ha come bersaglio la proteina tau è il blu di metilene (Rember), un colorante chimico, che diminuisce l’aggregazione della suddetta proteina ed aumenta l’attività mitocondriale (13). !!! • trattando pazienti con diagnosi di MCI, con acido acetilsalicilico (ASA) associato ad antiossidanti, dopo 6 mesi, questi mostravano dopo trattamento una stabilità del quadro cognitivo (74,5%) mentre l’80% dei soggetti, trattati con AchEI (rivastigmina 25%, Donepezil 20%, altri 5%) progrediva verso il deficit cognitivo. È stata utilizzata l’ASA in quanto potrebbe essere considerato un trattamento farmacologico in grado di intervenire nella patogenesi dell’ AD, poiché sarebbe in grado di prevenire o, addirittura, invertire la formazione di β-amiloide, riducendo, inoltre, la fosforilazione a proteina TAU della serina 422 e sopprimendo la secrezione della proteina precursore dell’amiloide. VACCINO • Lo scopo dell’ immunoterapia è stimolare il sistema immune a riconoscere ed eliminare Aβ o introdurre anticorpi preformati per prevenire la deposizione in placche di Aβ o aumentare l’ eliminazione delle placche. La vaccinazione attiva è in grado di indurre un’eccessiva risposta autoimmune proinfiammatoria TH1-mediata, compromettendo gli eventuali benefici derivanti dalla rimozione delle placche. Nell’immunoterapia passiva la somministrazione passiva di anticorpi può aggirare la risposta T-cellulare indesiderata associata alla vaccinazione attiva, mantenendo le importanti attività biologiche correlate all’ efficacia (16). ! Malattia di Parkinson • Parkina (att proteasica fisiologica) • Alfa sinucleina (turnover vescicole) dopamina Hornykiewicz Guggenheim Il miracolo La Dopamina non attraversa la BEE L-DOPA ( O. Sacks) Elevati dosaggi (10 gr / die!!) ( molti effetti collaterali per azione periferica della dopamina, soprattutto nausea e vomito subcontinui) DOPA Dopamina dopa decarbossilasi Paradosso dell inibitore delle decarbossilasi ( Carbidopa / Benserazide) Passa BEE Inibitore DOPA decarbossilasi ! Non passa BEE Non passa la BEE Parkinsonismi dopamina dopamina ICTUS ISCHEMICO • 15% della gittata • 20% del consumo di ossigeno • Glucosio Autoregolazione miogena, P Co2/O2, Metabolica Ischemia • globale • Focale: - lacune - aree piu’ o meno estese ( fino a infarto devastante) Strategie terapeutiche per lo stroke acuto RIPERFUSIONE (approccio vascolare) ( Flusso ematico) • Edema tissutale • Trombolisi • Angioplastica • Endarterectomia NEUROPROTEZIONE (approccio parenchimale ( vulnerabilità del tessuto) • • • • Eccitotossicità ([Ca2+]i, Radicali liberi Infiammazione Apoptosi Dinamiche spazio-temporali dello sviluppo e dell’evoluzione del danno ischemico cerebrale Molti vecchi TIA!! 3h 72 h I° Parte Meccanismo e Strategie della Riperfusione Riperfusione •E’ dimostrato che il rapido ripristino del flusso ematico cerebrale in caso di occlusione vascolare acuta può determinare il completo recupero della funzionalità del tessuto cerebrale • La riperfusione del tessuto ischemico può avvenire attraverso 3 meccanismi: • • • Ricanalizzazione spontanea Trombolisi farmacologica e/o meccanica Collaterali leptomeningei A 15 anni dall’avvento delle prime terapie trombolitiche, numerosi studi e la pratica clinica hanno confermato il beneficio della riperfusione precoce Trombolisi • Sistemica, endovenosa: rtPA 0.9 mg/kg entro 3 ore dall’esordio. • Endovascolare, intrarteriosa rtPA, urokinasi Meccanica Fibrinolisi farmacologica Urokinasi • Prodotto da tutte le cellule nucleate • Non ha recettori sulla fibrina tPA • • • Prodotto dalle cellule endoteliali Ha recettori sulla fibrina Si lega alla annessina II sulla superficie endoteliale Alcuni studi clinici di trombolisi endovenosa nello stroke NINDS I e II ECASS I 1995 rt-PA <3 h migliora outcome 3 mesi, aumenta rischio ICH 1995 rt-PA <6h ± outcome, aumenta rischio ICH ECASS II 1998 rt-PA <6h ± outcome aumenta rischio ICH ECASS III 2008 rt-PA 3-4,5 h migliora outcome 3 mesi, aumenta rischio ICH ATLANTIS A ATLANTIS B 1999 rt-PA 3-5 h NON migliora outcome 3 mesi, aumenta rischio ICH 2002 rt-PA <3 h migliora outcome 3 mesi, aumenta rischio ICH DEFUSE EPITHET 2006 rt-PA 3-6 h DWI/PWI mismatch 2008 rt-PA 3-6 h DWI/PWI mismatch SITS-MOST 2007 rt-PA <3h migliora outcome 3 mesi, aumenta rischio ICH DIAS I DEDAS DIAS II (fase 2) (fase 2) (fase 3) 2005 desmotelpase 2006 desmotelpase 2009 desmotelpase migliora outcome se DWI<80% PWI (41% casi) NON riduce volumi infartuali, > % riperfusione 3-9 h DWI/PWI mismatch>1.2 migliora outcome e riperfusione 3-9 h DWI/PWI mismatch>1.2 migliora outcome e riperfusione 3-9 h NON migliora outcome Ogni 1000 pz che ricevono rt-PA entro 3 ore 140 evitano la morte o dipendenza a 3 mesi Ogni 1000 pz che ricevono rt-PA entro 6 ore 57 evitano la morte o dipendenza a 3 mesi Agenti trombolitici studiati nella riperfusione in seguito a stroke ischemico rt-PA (alteplase) Duteplase Reteplase u-PA (urokinase) SK (streptokinase) TNK (tenecteplase) DS-PA (desmoteplase) Plasmin Microplasmin …in associazione ad antiaggreganti …in associazione ad anticoagulanti ! …in associazione a ultrasuoni (sonotrombolisi) rt-PA (alteplase) + 2-MHz Doppler Transcranico (studio CLOTBUST) Trombolisi combinata (Sistemica+ Locoregionale) 1. Nella terapia dell’ ictus grave da occlusione di grossi vasi prossimali • Razionale: associare la rapidità di inizio trattamento della trombolisi SISTEMICA alla maggiore efficacia di ricanalizzazione sui grossi vasi prosssimali della INTRA-ARTERIOSA. 2. Come intervento di salvataggio in caso di insuccesso della trombolisi ev Controllo a 24 ore: ricanalizzazione completa II° parte DANNO DA RIPERFUSIONE Definizione Si parla di danno da riperfusione quando la circolazione sanguigna torna al tessuto dopo un periodo di ischemia causando danno al tessuto stesso invece della ripresa della normale funzionalità. A livello cerebrale….. Gli effetti della riperfusione non sono solo e sempre positivi. La riperfusione tissutale che segue la trombolisi o l’embolectomia innesca una cascata di eventi molecolari che risultano lesivi per il parenchima cerebrale. Parte del tessuto ischemico cerebrale, soprattutto quello a livello della “penombra ischemica” è ancora vitale al momento della trombolisi ma, paradossalmente, muore durante la riperfusione DANNO DA RIPERFUSIONE: IL COSIDDETTO “OXYGEN PARADOX” In seguito alla trombolisi, la riperfusione ematica riporta i livelli di ossigeno tissutale a livelli fisiologici ma in un tessuto sofferente a causa del precedente insulto ischemico. Ne risulta una marcata formazione di radicali liberi dell’ossigeno, ROS, attraverso vari meccanismi. I principali sono: 1 – In tutte le cellule: diretta riduzione dell’ossigeno molecolare 2 – Endotelio: reazioni enzimatiche catalizzate da xantina ossidasi, ciclossigenasi, nitrossido sintetasi. 3 – Leucociti (soprattutto neutrofili attivati): mediante la NADPH-ossidasi (produzione di superossido nella fase tardiva della riperfusione) 4 - Cellule neuronali e gliali: a livello del complesso I e III della catena respiratoria mitocondriale (diretta formazione di superossido), ossidazione di metaboliti endogeni quali catecolamine e lipidi di membrana Effetto dei ROS prodotti a causa della riperfusione ione superossido: O2perossido d’idrogeno: H2O2 ossigeno singoletto O° perossinitrito ONOOGlutammato/eccitotossicità NOS i NOS n NOS e NMDA/AMPA GLUr Ca++ Na+ acidosi cell Perossidazione dei lipidi di membrana, con conseguente: aumento permeabilità: disionie, depolarizzazione danno reticolo sarcoplasmatico: blocco sintesi proteica, trafficking cellulare blocco della respirazione mitocondriale: crisi energetica, aumentata produzione di ROS (circolo vizioso) blocco scavengers Ossidazione delle proteine, con conseguente : alterazione dei canali ionici e pompe ioniche (Na+/K+ ATPasi, Ca++ ATPasi, scambiatore Na+/Ca++): disionie, depolarizzazione Danni agli acidi nucleici, con conseguente : blocco trascrizionale e innesco della cascata apoptotica PARP1 caspasi indipendente NO Danno da riperfusione e funzionalità endoteliale ROS endotelio alterata permeabilità endoteliale ed aumento della pressione intracapillare determinano un aumento della filtrazione di fluidi nell’interstizio = edema tissutale. Basale 5’ Riperfusione 30’ Riperfusione B.E.E: Principale molecola citoscheletrica per conservazione dell’ integrità dell’ endotelio Danno da riperfusione e Barriera Ematoencefalica Early blood-brain barrier disruption in human focal brain ischemia 77. Ann Neurol. 2004 Oct;56(4):468- In 144 ictus ischemici la perdita della barriera ematoencefalica (BBB) avviene nel 45% dei riperfusi e 18% dei non riperfusi Una prognosi infausta si verifica nel 63% nei pazienti con perdita di BBB e 25% nei pazienti con mantenimento della BBB La perdita di BBB è un forte predittore di trasformazione emorragica Evidence of reperfusion injury, exacerbated by thrombolytic therapy, in human focal brain ischemia using a novel imaging marker of early blood-brain barrier disruption. Stroke, 2004, 35:2659-61 La distruzuione della BBB si può evidenziare alla MRI come: HARM: “Hyperintense Acute Reperfusion Marker” Dopo circa 3 h dalla riperfusione è presente nel 33% dei pazienti ischemici e si associa a trasformazione emorragica e cattiva prognosi. La riperfusione è il principale predittore di distruzione della BBB. Danno da Riperfusione e Granulociti Neutrofili • I Neutrofili sono la maggiore componente cellulare della risposta infiammatoria che contribuisce al danno da riperfusione • Nel parenchima cerebrale post-ischemico sono i primi ad attivarsi e migrano nei tessuti), quindi si attiva la componente macrofagica e linfocitaria • Sono richiamati nel parenchima cerebrale post ischemico da componenti del complemento e da mediatori rilasciati dall’ endotelio • Sono una importante fonte di: 1 - ROS che, innescando un circolo vizioso, aumentano l’adesione dei neutrofili stessi all’endotelio 2 - Enzimi proteolitici 3 - Citochine pro-infiammatorie, leucotrieni, prostanoidi Aumento permeabilità vascolare, edema, trombosi, morte neuronale Conclusioni Il danno da riperfusione: Si associa frequentemente alla riperfusione cerebrale E’ tanto maggiore quanto più tardiva è la riperfusione Time is brain E’ causato da disfunzione endoteliale, formazione di radicali liberi e infiltrazione granulocitaria Può essere visualizzato con MRI nell’uomo A livello preclinico può essere ridotto con opportune tecniche capaci di bloccare i fenomeni patogenetici che ne stanno alla base (ROS, infiammazione) Tali strategie non hanno dato risultati analoghi nell’uomo Il suo contenimento è un obiettivo principale nell’ambito della terapia farmacologica dell’ictus ischemico, soprattutto alla luce di un possibile prolungamento oltre le 3 ore dell’attuale finestra di riperfusione I Patogenesi del danno ischemico cerebrale INSULTO ISCHEMICO • NEURONE DEGENERA (vacuolizzazione /rottura) • Macrofagi / angiogenesi infiammatoria / Gliosi reattiva • Poroencefalia 10 ml / 100gr/min INSULTO ISCHEMICO • Si riduce ATP ( non si mantiene potenz membrana / si ha depolarizzazione , disfunzione mitocondriale) • Incremento Glutammato / eccessiva eccitotossicità • Incremento ingresso calcio/sodio • Cascata di segnali • Infiammazione / Radicali liberi / Danno mitocondriale • Penombra/ Apoptosi /Necrosi Chronological sequence of mechanisms in postischemic neuronal death Zaleska et al., Neuropharmacology 56: 329, 2009 Eventi molecolari alla base della progressione del danno ischemico cerebrale: II – vie di morte tissutale Morte neuronale ischemica “Excyting, Radical, Suicidal” DEPOLARIZZAZIONE PERIINFARTUALE • Diffusione attività elettrochimica (CSD) • Incremento eccitotossicità • Promozione per interleuchina 1 β e TNF-α Aumento del calcio intracellulare Danno mitocondriale/stress ossidativo ROS Danno al DNA Attivazione PARP ( caspasi indip) Citocromo C nel citosol TNF Caspasi iniziatrici Caspasi effettrici ( azione su proteine citoplasmatiche e nucleari) Nel corso dell’apoptosi: il DNA si frammenta il citoscheletro collassa la cromatina si condensa la cellula si contrae formando una serie di bolle (BLEBS) che, separandosi dalla cellula, formano i corpi apoptoci, i quali vengono fagocitati da circolanti professionali o da cellule epiteliali contigue (fagociti occasionali) opsonizzazione rapidità Le possibilità di una modulazione farmacologica della neurodegenerazione ischemica ECCITOTOSSICITA’ “If glutamate or another compound stimulating excitatory amino acid receptors, is present in synaptic clefts for a prolonged period of time it can kill cells on which it normally acts as a neurotransmitter” (Bruyn & Stoot) [Glu]o Morte neuronale eccitotossica Glutamate receptors Besancon et al., TIPS. 29: 268, 2008 Kalia et al., Lancet Neurol. 7: 742, 2008 NMDA-R: potential sites for drug action Kalia et al., Lancet Neurol. 7: 742, 2008 Target farmacologici per la neuroprotezione ischemica I – ECCITOTOSSICITA’ Esempi di passati trial clinici falliti con strategie anti-eccitotossiche Lee et al., Nature 399 (supp): A7, 1999 Target farmacologici per la neuroprotezione ischemica II – STRESS OSSIDATIVO Ischemia cerebrale Attivazione dei reccettori glutammatercgici Disfunzione mitocondriale Ativazione della NADPH ossidasi Attivazione della nNOS Attivazione delle cellule infiammatorioe Radicali Superossido Idrossile Perossido d’idrogeno Ossigeno singoletto Malondialdeide Ossido nitrico Perossinitrito Disufenton sodium NXY-059 for acute stroke therapy: clinical trials Danno tissutale Morte neuronale CHANT (Cerebral Hemorrhage And NXY Treatment) A double-blind, randomized, placebo-controlled, parallel-group, multicenter, Phase IIb study to assess the safety and tolerability of 72 hours intravenous infusion of NXY 059 in adult patients with acute intracerebral hemorrhage (ICH). SAINT I (Stroke – Acute Ischemic – NXY Treatment) A Double Blind, Randomized, Placebo Controlled, Parallel Group, Multicenter, Phase IIb/III Study to Assess the Efficacy and Safety of Intravenous NXY-059 in Acute Ischemic Stroke. SAINT II (Stroke – Acute Ischemic – NXY Treatment) A Double Blind, Randomized, Placebo Controlled, Parallel Group, Multicenter, Phase IIb/III Study to Assess the Efficacy and Safety of Intravenous NXY-059 in Acute Ischemic Stroke. 26 October 2006: AstraZeneca Announces SAINT II Trial Results Showed No Efficacy in Acute Ischaemic Stroke NXY-059 (disufenton sodium) was discontinued from development following the results from the SAINT II (Stroke Acute Ischemic NXY-059 Treatment) trial, which showed that the investigational drug NXY-059 did not meet its primary outcome of a statistically significant reduction in stroke-related disability, as assessed by the Modified Rankin Scale (mRS) (p=0.33, odds ratio 0.94) compared to placebo. There was no evidence of NXY-059 lowering the incidence of symptomatic intracranial haemorrhage when administered with rt-PA (p=0.56). Mortality and the incidence and profile of adverse events in patients receiving NXY-059 were similar to placebo. Target farmacologici per la neuroprotezione ischemica III- INFIAMMAZIONE Infiammazione e stroke Infiammazione placca ateromasica Stroke pegg ioram ento Attivazione astrociti/microglia Infiltrazione leucocitaria infiammazione CLINICAL TRIALS WITH ANTIINFLAMMATORY DRUGS AS STROKE NEUROPROTECTANTS - Leukocyte adhesion inhibition Anti-ICAM-1 antibody (enlimonab) (EAST) Adverse Effect HU23F2G – leukocyte adhesion inhibitor (HALT) No benefit - Inhibition of cytokines IL-1 R antagonist Per ora nessun risultato Target farmacologici per la neuroprotezione ischemica IV - APOPTOSI VARI INIBITORI DELLE CASPASI CON DIFFERENTI STRUTTURE MOLECOLARI SPERIMENTALI NELL’ANIMALE Non sono mai stati compiuti clinical trials con inibitori delle caspasi L’entusiasmo si è notevolemente ridotto Neuroprotezione Selected ongoing trials of neuroprotection Sacco et al., Lancet 369: 331, 2007 Recenti studi clinici per la neuroprotezione ischemica I – Citicolina Cytidine-5’-diphosphocholine (Citicoline) Intermediate in the synthesis on phosphatidylcholine. Essential for the biosynthesis of membrane phospholipids Inhibits the activity of some phospholipases, Restores some enzymatic activities bound to neuronal membranes Elevates brain levels of some catecholamines. Membrane stabilization fallito Recenti studi clinici per la neuroprotezione ischemica II – Albumina umana (in fase di reclutamento) fallito ALBUMIN: Enhances red cell oxygen transport capacity, Reduces leukocyte adhesion within the brain micorcirculation Endowed with antioxidant effects La minociclina: una tetraciclina neuroprotettiva Possibili meccanismi neuroprotettivi Antiossidante Antinfiammatoria Inibisce le metalloproteinasi Promuove l’espressione di Bcl-2 Inibisce la poli (ADP-ribosio) polimerasi ? Recenti studi clinici per la neuroprotezione ischemica IV – Statine (in corso) STATINS 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors Pleiotropic effects in addition to cholesterol lowering properties Reduce ishemic volumes in several preclinical experimental models Figure 1. The pleiotropic effects of statins in stroke A schematic of the cholesterol biosynthesis pathway showing the effects of inhibition of 3-hydroxy-3-methylglutaryl-coenzyme A reductase by statins. Decreased isoprenylation of signaling molecules leads to modulation of various signaling pathways. Neurology 2013. Cappellari et al Azione antiinfiammatoria , promozione sinaptogenesi protezione endoteliale, incremento di VEGF ?! Il concetto di “unita neurovascolare” dalla neuroprotezione alla protezione neurovascolare control ischemia Edward Jenner 1796 ( apprendista farmacista) PRIONE
Scaricare