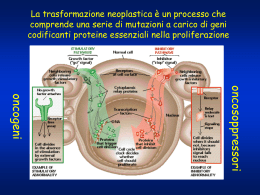
CARCINOMA DEL COLON-RETTO: EGFR E K-RAS MARTINA PUGLISI CRISTINA RUSSO JESSICA RUSSO FEDERICA SAMPUGNA Insieme molto complesso ed eterogeneo di malattie Indipendenza da segnali di crescita esterna Invadere tessuti CANCRO Insensibilita’ a segnali antiproliferativi esterni Angiogenesi e vascolarizzazione Capacita’ di evitare l’apoptosi Perdita di controllo proliferativo Carcinoma colon-retto MASCHI FEMMINE Polmone 27% Mammella 16% Colon-retto 11% Colon-retto 12% Prostata 8% Polmone 11% Fegato 7% Pancreas 7% Stomaco 7% Stomaco 6% Incidenza di 950.000 casi e 500.000 decessi l’anno Più del 95% dei pazienti affetti da cancro colorettale hanno un’età superiore ai 45 anni al momento della diagnosi Almeno il 50% della popolazione occidentale sviluppa un adenoma a partire dall’età di 70 anni e nel 10% dei casi degenera in cancro 10% dei cancri sono di origine ereditaria (es: Familial Adenomatous Polyposis (FAP) in 1 caso ogni 7000 individui; Hereditary Non Polyposis Colorectal Cancer (HNPCC) nel 2-4% totale dei casi) • La maggior parte dei casi è di origine sporadica • Il tasso di sopravvivenza a 5 anni e’ inferiore al 10% • Paesi con maggiore incidenza della malattia Sedi piu’ colpite dal carcinoma FATTORI DI RISCHIO • Fattori nutrizionali Calorie Calorie Grassi animali Grassi animali Fibre Fibre Maggiore rischio Minore rischio • Fumo e inquinamento ambientale Fattori genetici: - storia familiare della malattia - sindromi trasmesse ereditariamante (adenomatosi poliposa familiare o FAP; sindrome di Lynch..) • Altri fattori: - eta’ - presenza di polipi nel colon - processi infiammatori cronici dell’intestino • Storia naturale del cancro colon - rettale Presenta un ampio spettro di neoplasie che vanno da escrescenze benigne al cancro invasivo e sono essenzialmente di natura epiteliale. Distinguiamo 3 gruppi: 2.Polipi neoplastici polipi adenomatosi (adenomi) t.benigni, ma precursori del cancro 1.Polipi non neoplastici iperplastici, giovanili, infiammatori, amartomatosi, non precursori del cancro 3.Cancri Classificazione istologica dei polipi Classificazione dei polipi STADIAZIONE Il sistema TNM si basa sulla valutazione di tre elementi: •T : estensione del tumore primitivo •N : assenza o presenza ed estensione di metastasi ai linfonodi regionali •M : assenza o presenza di metastasi a distanza L’aggiunta di numeri a queste 3 componenti indica l’estensione del tumore: T0,T1,T2,T3,T4 N0,N1,N2,N3 M0,M1 Esami diagnostici • • • • • • • Ricerca sangue occulto nelle feci. Colon scopia – colonscopia virtuale. Clisma opaco. Tc RMN. Ecografia – CL. Esami ematochimici. Il cancro è una malattia dei geni Perché delle cellule inizino a dividersi in maniera incontrollata devono essere danneggiati i geni che ne regolano la crescita. È necessaria una serie di numerose mutazioni di questi geni prima che una cellula normale si trasformi in una cellula cancerosa. Il ruolo dei geni nei tumori ● Geni oncogeni ● geni oncosoppressori ● geni coinvolti nel cosiddetto "suicidio cellulare" (o apoptosi) ● geni implicati nei meccanismi di riparazione del DNA 19/12/2015 ONCOGENI 19/12/2015 DA PROTO-ONCOGENE A ONCOGENE 19/12/2015 ● Mutazioni puntiformi ● Delezioni ● Amplificazione genica GENI ONCOSOPPRESSORI -sono necessarie due mutazioni per inattivare un gene soppressore di tumore e di conseguenza per causare la perdita di controllo sulla crescita e sulla divisione cellulare 19/12/2015 K-RAS(oncogene) ● Monomerica ● Attività GTPasica ● Trasduzione segnali di proliferazione APC ( oncosoppressore) ● 19/12/2015 Agisce su proteina coinvolta nelle giunzioni cellula-cellula p53 ● 19/12/2015 Alterazione di p53 causa il progredire del ciclo cellulare DCC (oncosoppressore) ● ● DCC coinvolto nei processi di differenziamento e nell’adesione cellulare. Perdita di eterozigoti 19/12/2015 Instabilità cromosomica Genetics, cytogenetics, and epigenetics of colorectal cancer. Migliore L, Migheli F, Spisni R, Coppedè F. Abstract Most of the colorectal cancer (CRC) cases are sporadic, only 25% of the patients have a family history of the disease, and major genes causing syndromes predisposing to CRC only account for 5-6% of the total cases. The following subtypes can be recognized: MIN (microsatellite instability), CIN (chromosomal instability), and CIMP (CpG island methylator phenotype). CIN occurs in 80-85% of CRC. Chromosomal instability proceeds through two major mechanisms, missegregation that results in aneuploidy through the gain or loss of whole chromosomes, and unbalanced structural rearrangements that lead to the loss and/or gain of chromosomal regions. The loss of heterozygosity that occur in the first phases of the CRC cancerogenesis (in particular for the genes on 18q) as well as the alteration of methylation pattern of multiple key genes can drive the development of colorectal cancer by facilitating the acquisition of multiple tumor-associated mutations and the instability phenotype. PMID: 21490705 [PubMed - indexed for MEDLINE] MicroRNA nei tumori I microRNA sono implicati in diversi processi cellulari quali controllo del ciclo cellulare, differenziamentoI ed apoptosi. Molti geni dei miRNA sono localizzati in regioni genomiche frequentemente riarrangiate in tumori (siti fragili, regioni delete, regioni di break-point) 19/12/2015 MicroRNA come biomarcatori MicroRNA-21 as a potential colon and rectal cancer biomarker. Li T, Leong MH, Harms B, Kennedy G, Chen L. Source Tao Li, Mei Ha Leong, Lin Chen, Department of General Surgery, Chinese PLA General Hospital, Beijing 100853, China. Abstract Colorectal cancer (CRC) is one of the most common malignant diseases worldwide and the prognosis is still poor although much progress has been achieved in recent years. In order to reduce CRC-related deaths, many studies are aimed at identifying novel screening- and prognosis-related biomarkers. MicroRNAs (miRNAs) are a class of 18-27-nucleotide single-stranded RNA molecules that regulate gene expression at the posttranscriptional level. It has been demonstrated that miRNAs regulate a variety of physiological functions, including development, cell differentiation, proliferation, and apoptosis. They play important roles in various physiologic and developmental processes and in the initiation and progression of various human cancers. It has been shown that miRNAs can critically regulate tumor cell gene expression, and evidence suggests that they may function as both oncogenes and tumor suppressor genes. In CRC, miRNAs-21 is one of the most important miRNAs and is rapidly emerging as a novel biomarker in CRC, with good potential as a diagnostic and therapeutic target. In this review, we summarize the latest research findings of the clinicopathological relevance of miRNAs-21 in CRC initiation, development, and progress, highlighting its potential diagnostic, prognostic, and therapeutic application, as well as discussing future prospects. 19/12/2015 Laboratorio di ricerca in biologia molecolare della Fondazione Policlinico G.B. Morgagni di Catania Colture Cellulari Le colture cellulari sono sistemi semplificati che consentono il mantenimento di cellule in vitro; vengono utilizzate come modello in cui studiare l'effetto dell’espressione di fenomeni biologici. VANTAGGI SVANTAGGI Sistemi semplificati ed altamente riproducibili. Sistemi semplificati rispetto ad un organismo integrato. Concentrano l’analisi dei meccanismi cellulari del fenomeno in esame. Condizioni di esposizione alle sostanze diversi da quello in vivo. Controllo dell’ambiente di crescita. Instabilità genetica Economicità e rapidità di risposta. Difficoltà di correlare le concentrazioni con quelle in vivo Disponibilità di tipi cellulari Difficoltà ad ottenere colture sterili No problemi etici e legali (Riduzione numero animali sacrificati.) Sostanze inoculate possono interagire con il terreno di coltura Colture primarie: derivano direttamente da un tessuto o un organo per dissociazione meccanica o protealitica (tripsina + EDTA) delle singole componenti cellulari. Colture secondarie: sono cellule capaci di proliferare illimitatamente attraverso immortalizzazione della coltura. Esistono diversi metodi per ottenere questo risultato, per esempio: ● ● Introduzione del gene esogeno che codifica per la subunità catalica della telomerasi Utilizzo di oncogeni derivati da virus tumorali, che innescano meccanismi di trasformazione simili a quelli che determinano la proliferazione tumorale. Procedure iniziali Quando al paziente viene diagnosticato il carcinoma, si procede inizialmente in modo aspecifico attraverso un intervento chirurgico e una terapia adiuvante entro i 40 giorni successivi all'intervento, se c'è coinvolgimento di linfonodi. Una discreta percentuale riesce a guarire seguendo solo questa procedura. Se il tumore è troppo esteso o c'è metastasi, si prendono in considerazione le target therapy. Target Therapy A differenza dell'approccio della chemioterapia classica, che agisce su meccanismi aspecifici legati a caratteristiche proprie di tutte le cellule a rapida proliferazione, comprese quelle normali, la terapia mirata interviene sui meccanismi legati all'espressione di oncogeni e oncosoppressori , alla base della specifica azione di promozione tumorale , che ha come conseguenza la trasformazione della cellula da normale a patologica. L'aumento di comprensione del processo di carcinogenesi ha permesso infatti di individuare una serie sempre maggiore di mutazioni a carico dei geni che esprimono particolari enzimi che fanno parte di alcune cascate di segnali intracellulari, alterazioni in grado di sovvertire l'omeostasi, spingendo la cellula verso la proliferazione incontrollata e facendole acquisire caratteristiche di aggressività per l'organismo. <<E' molto importante cambiare il modo di vedere le malattie, guardando soprattutto alle alterazioni molecolari che le causano, per capire come sfruttare al meglio me opportunità offerte da questi nuovi approcci >> [F.De Braud, direttore dell'iIstituto Europeo di Oncologia di Milano] La target therapy in oncologia ha rivoluzionato l'approccio alla malattia neoplastica passando da una farmacologia basata sulla malattia a una terapia trasversale guidata dal difetto molecolare. Gli esperti sembrano concordare, il futuro sarà sempre più rivolto verso la personalizzazione delle cure. Ma per farlo va affinata la ricerca sui marcatori biologici, così da trattare con i costosi medicinali target solo chi risponde al trattamento, evitando, così, gli sprechi che vengono pagati a caro prezzo anche dalle casse del SSN. Epidermal Growth Factor Receptor (EGFR) ● ● ● ● ● ● E' un recettore tirosin-chinasico, con : -dominio extracellulare : interazione con il ligando -singolo dominio transmembrana idrofobico -dominio citoplasmatico: attività tirosin-chinasica Il gene che lo codifica è localizzato sul cromosoma 7 Stimola la proliferazione cellulare, la capacità del tumore di invadere e di dare metastasi, l'angiogenesi Innesca una serie di cascate implicate nella trasduzione del segnale Over-espressione delle EGFR e la FISH L’ ibridazione in fluorescenza in situ ( FISH) è una tecnica citogenetica che utilizza delle sonde a fluorescenza che si legano in modo estremamente selettivo ad alcune specifiche regioni del cromosoma, permettendo di determinare il numero di copie di un dato cromosoma presente all'interno del nucleo o di regioni presenti su specifici cromosomi. L'uso di fluocromi diversi consente di marcare le sonde in modo specifico, rendendo possibile la visualizzazione di bersagli cromosomici diversi nello stesso nucleo. FISH di una cellula normale FISH di una cellula che presenta overespressione del gene. Inibitori EGFR ● ● ● ● Anticorpi monoclonali :Cetuximab, Panitumumab Agiscono sul dominio extracellulare dell'EGFR comportandosi da inibitori esterni, competono con il ligando naturale Inibitori delle Tirosin-chinasi (TKIs): Gefitinib, Erlotinib Agiscono sul dominio intracellulare dell'EGFR bloccando l'attività tironsin-chinasica delle cellule, viene bloccata tutta la via di trasduzione del segnale Cetuximab Il Cetuximab è un anticorpo monoclonale di tipo IgG. Gli anticorpi monoclonali sono proteine che riconoscono, in maniera specifica, altre determinate proteine chiamate antigeni e si legano ad esse. Il Cetuximab si lega al recettore per il fattore di crescita epidermico (EGFR) che è appunto presente in sovra numero sulla superficie di cellule tumorali. Come risultato di questo legame , la cellula tumorale non può più ricevere i messaggi necessari per la crescita, la progressione e le metastasi. Il risultato è dunque una riduzione della neoplasia. È stato visto che circa il 60% dei pazienti risponde a questo tipo di trattamento. Gene K-ras Il gene K-ras ha una funzione fondamentale nel sistema di trasduzione del segnale valle dell’EGFR e ha un ruolo di estrema importanza nella regolazione della crescita cellulare,nella promozione dell’angiogenesi e nella riduzione dell’apoptosi. Fa parte della famiglie delle proteine Ras ,una classe di proteine GTPasiche , di cui fanno parte anche NRas e HRas. Mutazione K-ras La mutazione di K-ras più frequente è quella al codone 12 e consiste nella sostituzione dell’amminoacido glicina con la valina . Test del K-ras La determinazione del KRAS è essenziale perché lo stato della proteina KRAS può influenzare la prognosi della malattia e la risposta, la risposta a quelle cure mirate all'inattivazione del recettore del fattore di crescita epidermico (EGFR). Quindi, il medico può scegliere meglio se sottoporre o meno un paziente a un determinato trattamento con farmaci biologici mirati a inattivare il fattore di crescita epidermico EGF. Lo stato o la forma della proteina KRAS possono essere identificati con il test di Kras, un test semplice e non invasivo che analizza il DNA estratto dalle cellule tumorali di campioni di tessuto prelevati durante una biopsia o altre analisi. La presenza del gene KRAS mutato nelle cellule tumorali è individuabile attraverso diversi passaggi: -PCR -Sequenziamento -Procedura in laboratorio
Scaricare