Fondazione Lombardia per l'Ambiente
Le piccole guide per chi opera in campo ambientale
La tossicità
dei fanghi
di depurazione
D
F
N. 21
Presenza
di xenobiotici
organici
a cura di Pier Luigi Genevini
Pier Luigi Genevini è professore ordinario di Chimica del Suolo presso il Dipartimento di Fisiologia delle Piante Coltivate e
Chimica Agraria (DIFCA) dell’Università
degli Studi di Milano. È stato docente di
Uso e Riciclo delle Biomasse in Agricoltura
e di Fertilità del Suolo e Nutrizione delle
Piante.
È responsabile della Sezione di Chimica
del Suolo presso il DIFCA.
È autore di circa 150 pubblicazioni scientifiche che vertono sui problemi legati all'inquinamento dell’ambiente agrario, agli
aspetti nutrizionali dei vegetali e al reimpiego di biomasse non convenzionali quali
succedanee degli ammendanti tradizionali.
La tossicità
dei fanghi
di depurazione
Presenza di xenobiotici organici
A cura di
Pier Luigi Genevini
Fondazione Lombardia per l’Ambiente, Milano
Presidente: Giovanni Bottari
Vice Presidente: Achille Cutrera
Coordinatore Scientifico: Antonio Ballarin Denti
Progetto editoriale ideato da Salvatore Giannella
Coordinamento editoriale: Rosa Maria Panattoni, Francesca Cerletti
Progetto grafico
fotocomposizione:
Studio Tabloid, Milano
Stampa:
Arti Grafiche by Jodice Iuri
Sannazzaro (PV)
DICEMBRE 1996
COPIA NON COMMERCIABILE
E IN DISTRIBUZIONE GRATUITA
© Copyright Fondazione Lombardia per l’Ambiente
proprietà letteraria riservata.
Nessuna parte di questo volume può essere riprodotta
o utilizzata sotto nessuna forma, senza permesso
scritto, tranne che per brevi passaggi in sede di recensione
e comunque citando la fonte.
Indice
Presentazione di Antonio Ballarin Denti
pag. 9
Prefazione di Pier Luigi Genevini
11
Gli autori
13
Introduzione
15
Capitolo 1
MONOCICLICI AROMATICI
31
1.1
1.2
1.3
33
34
1.4
Suoli
Fanghi
Degradazione
1.3.1 Biodegradazione
Piante
Conclusioni
Bibliografia
35
39
41
42
Capitolo 2
CLORO-BENZENI
47
2.1
2.2
2.3
50
50
56
59
65
Suoli
Fanghi
Degradazione
2.3.1 Biodegradazione
2.3.2 Degradazione abiotica
5
2.4
2.5
Piante
Animali
Conclusioni
Bibliografia
67
71
74
75
Capitolo 3
DETERGENTI
3.1
3.2
3.3
3.4
3.5
3.6
Suoli
Acque
Fanghi
Degradazione
3.4.1 Biodegradazione
Piante
Animali
Conclusioni
Bibliografia
81
83
85
85
95
95
101
103
104
105
Capitolo 4
DIOSSINE E FURANI
109
4.1
4.2
4.3
4.4
110
111
111
115
115
126
128
129
131
4.5
4.6
Suoli
Acque
Fanghi
Degradazione
4.4.1 Biodegradazione
Piante
Animali
Conclusioni
Bibliografia
Capitolo 5
FENOLI
137
5.1
5.2
139
141
6
Suoli
Acque
5.3
5.4
5.5
5.6
Fanghi
Degradazione
5.4.1 Biodegradazione
Piante
Animali
Conclusioni
Bibliografia
141
141
143
152
153
154
155
Capitolo 6
FTALATI (PAE)
163
6.1
6.2
6.3
6.4
165
166
166
167
167
169
172
172
173
6.5
6.6
Suoli
Acque
Fanghi
Degradazione
6.4.1 Biodegradazione
Piante
Animali
Conclusioni
Bibliografia
Capitolo 7
IDROCARBURI POLICICLICI
AROMATICI (PAH)
7.1
7.2
7.3
7.4
7.5
7.6
Suoli
Fanghi
Acque
Degradazione
7.4.1 Biodegradazione
Piante
Animali
Conclusioni
Bibliografia
177
179
182
186
188
188
200
205
206
207
7
Capitolo 8
BIFENILI POLICLORURATI (PCB)
219
8.1
8.2
8.3
8.4
220
222
220
227
230
233
240
243
245
8.5
8.6
Suolo
Acque
Fanghi
Degradazione
8.4.1 Biodegradazione
Piante
Animali
Conclusioni
Bibliografia
Capitolo 9
PESTICIDI
253
9.1
9.2
9.3
9.4
9.5
9.6
255
255
256
256
269
271
262
Suoli
Acque
Fanghi
Degradazione
Piante
Animali
Bibliografia
Capitolo 10
ORGANOCLORURATI VOLATILI (VOC)
279
10.1
10.2
10.3
10.4
282
282
282
285
285
287
288
289
290
10.5
10.6
8
Acque e suoli
Aria
Fanghi
Degradazione
10.4.1 Biodegradazione
Piante
Animali
Conclusioni
Bibliografia
Presentazione
L
a depurazione delle acque reflue di origine civile e industriale ha assunto d
mensioni rilevanti da quando nel nostro come in altri paesi sono entrate in
vigore normative sulla qualità delle acque atte a prevenirne fenomeni di in quinamento.
D'altra parte, se questi interventi legislativi aiutano a migliorare la qualità delle
acque superficiali, con il progressivo aumento del numero degli impianti di tratta mento in esercizio, si pone con urgenza il problema dello smaltimento di fanghi ge nerati come residuo finale dal processo di depurazione. Si tratta di residui che, ac canto ad un contenuto di sali e elementi nutritivi utili ai suoli e alle pratiche agri cole, possono apportare una grande quantità di composti estranei ai cicli biologici
naturali (detti composti xenobiotici) alcuni dei quali dotati di elevato grado di tos sicità per l'uomo e le componenti biotiche dell'ambiente.
Del resto, a partire dalla legge 915 del 1982, le normative nazionali e comunita rie tendono correttamente ad incentivare il reimpiego di tali residui sui suoli agra ri o nei processi di compostaggio, favorendo l'immissione nei cicli geobiochimici na turali di sostanze che, se trattate solo come rifiuti, richiederebbero pesanti costi eco logici ed economici per lo smaltimento in discarica o in impianti di termodistruzio ne. Come risultato di queste politiche, nei vari paesi membri dell'Unione Europea,
una quota tra il 30 e il 50% dei fanghi di depurazione viene smaltita in agricoltura.
La Fondazione Lombardia per l'Ambiente, consapevole dell'importanza dell’ar gomento e della sua utilità ai fini degli interventi di carattere normativo e di con trollo della pubblica amministrazione, aveva inserito nel progetto coordinato di ri cerca “Effetti degli inquinanti nei sistemi agroforestali,” due linee di ricerca,
9
affidate al prof. Pierluigi Genevini del DIFCA (Università di Milano), sul tema
“Stima della presenza di sostanze xenobiotiche nei fanghi di depurazione
attraverso test di fitotossicità e saggi sul suolo” e alla prof. Annamaria Ferra ri, del DISTAM (Università di Milano) sul tema “Valutazione del rischio ecotossicologico e della biodegradazione di molecole xenobiotiche di origine
industriale in funzione dell’inquinamento ambientale”.
Il gruppo di ricerca del prof. Genevini, aveva colto l'occasione di questo progetto
anche per completare un precedente lavoro, edito in forma preliminare nel 1986, su
una catalogazione sistematica di tutti i composti xenobiotici reperibili nei fanghi di
depurazione valutandone metodologie analitiche e di monitoraggio ambientale, li velli di tossicità e limiti di accettabilità.
Questo importante patrimonio di dati e conoscenze è stato reso disponibile alla
Fondazione per una sua divulgazione agli studiosi e agli operatori istituzionali ed
economici del settore sia sul versante della produzione e dell'utilizzazione che su
quello del controllo e della certificazione.
Siamo pertanto grati di questa opportunità offertaci e siamo altresì convinti che
questa pubblicazione possa rappresentare un prezioso strumento di supporto tec nico ad interventi delle autorità amministrative e sanitarie della Regione Lombar dia coinvolte nel settore del recupero dei rifiuti in forme ambientalmente sicure e
sostenibili.
Antonio Ballarin Denti
Coordinatore Scientifico
Fondazione Lombardia per l'Ambiente
10
Prefazione
I
l reimpiego in agricoltura dei fanghi di risulta degli impianti di depurazio
è ormai divenuta pratica agronomica comune. L'ipotesi di riutilizzo, tra le
avversioni di molti, fu formulata circa 20 anni or sono e trovò la sua giustifi cazione nella necessità di non sperperare risorse carboniose ed elementi di fertilità
accanto ad una più facile ed economica gestione del problema rifiuti, settore nel qua le il comparto agricolo veniva chiamato come principale attore in grado di risolvere
la collocazione di un prodotto di non facile gestione.
In questi anni la ricerca scientifica, stimolata anche dall'importanza del proble ma, ha prodotto sull'argomento una considerevole mole di ricerche che hanno le gittimato tale pratica anche se, da parte di alcuni, continuano le perplessità che ave vano accompagnato il progetto fin dal suo nascere.
L'origine stessa dei fanghi, unita alle difficoltà di operare su un substrato per cer ti versi nuovo, alimenta periodicamente le ondate di avversione che di volta in vol ta fanno riferimento all'eccessivo apporto di metalli pesanti, alla diffusione di pato geni ed all'apporto di sostanze organiche xenobiotiche, nonchè alla scarsa o nulla
stabilizzazione della componente organica.
D'altra parte, il migliore sistema per controllare una pratica che, se mal con dotta, può sicuramente incidere negativamente a livello ambientale, è quello di
conoscere nel modo più puntuale possibile la composizione chimica dei fanghi
stessi in modo da poter quantificare i rischi ed attuare le strategie più idonee per
minimizzare l'apporto di sostanze estranee o comunque non compatibili con il
sistema suolo.
11
Infatti, ripercorrendo con la memoria gli ultimi anni, si è potuto verificare come
l'evoluzione dei sistemi di stabilizzazione sia ora in grado di garantire caratteristi che microbiologiche nettamente migliori anche delle usuali matrici organiche im piegate quali ammendanti; come il contenuto in metalli tenda alla diminuzione e
questo per un concorso di motivi che vanno da una ottimizzazione delle lavorazio ni, al conferimento di reflui più puliti e alla necessità di contenere i costi di produ zione.
A fianco di queste problematiche per certi versi già risolte o addirittura normate,
restano ancora alcuni aspetti su cui è necessario fare chiarezza: il contenuto in xe nobiotici organici e le modalità di conduzione dei test di fitotossicità necessari, al meno secondo il regolamento della Regione Lombardia (non esiste infatti alcuna
legge regionale in merito), per validare all'uso agricolo un fango di depurazione.
La redazione di un testo che raccolga le più importanti informazioni sulla pre senza di molecole organiche potenzialmente tossiche, vuole colmare un vuoto esi stente nella letteratura specifica e proporsi come mezzo di rapida consultazione per
chi è preposto all'opera di controllo e/o di gestione. Spesso infatti le norme prevedo no determinazioni chimiche a carico di molecole che, quando inserite nell'ambien te agrario, risultano poco o per nulla tossiche e raramente vengono proposti dei li miti la cui entità nasca da una approfondita disamina del problema.
Per tali ragioni l'opera è precipuamente rivolta ai funzionari delle USSL, alle
pubbliche amministrazioni, agli analisti che operano, a vari livelli, sia negli enti
pubblici che presso le società di recupero e agli ambientalisti che possono affrontare
in termini più circostanziati gli aspetti ecologici.
Il presente volume è nato con queste esigenze ed è frutto della collaborazione dei
colleghi della Sezione di Microbiologia del DISTAM (Dipartimento di Scienze e
Tecnologie Alimentari e Microbiologiche) della stessa Facoltà. Si è, in sostanza, vo luto comporre nel modo più sinottico possibile, quanto emerge dalle più recenti ri cerche in merito alla concentrazione delle più note e comuni molecole xenobiotiche,
alla possibilità di una loro degradazione, ai microorganismi implicati, trattando an che aspetti tossicologici sia nei confronti delle piante che degli animali.
La speranza è che il presente lavoro sia accolto con lo stesso interesse che aveva
caratterizzato la prima opera sull'argomento redatta con l'ausilio dei colleghi del l'Istituto di Ingegneria Sanitaria sì da poter affrontare e concludere gli aspetti co noscitivi di base con la stesura di un testo relativo ai test biologici.
Prof. Pierluigi Genevini
Straordinario di Chimica del Suolo
Università di Milano
12
Gli autori
L
’ideazione e l’impostazione del testo nascono da un progetto del Prof. Pi
Luigi Genevini e della Dr. Diana Borio cui vanno attribuiti gli aspetti re lativi alle caratteristiche ambientali delle famiglie delle molecole indagate,
nonché le notazioni sulla tossicità nei confronti delle piante e degli animali. Hanno
inoltre curato, per ogni xenobiotico, gli aspetti relativi alla concentrazione nei fan ghi ed il comportamento nell’ambiente suolo.
Pier Luigi Genevini - Professore Straordinario di Chimica del Suolo, già asso ciato di Fertilità del Suolo e Nutrizione delle piante e incaricato di Uso e Riciclo del le Biomasse in agricoltura, si interessa da tempo ai problemi connessi al reimpiegovalorizzazione di biomasse di recupero.
Diana Borio - Borsista, si interessa ai problemi connessi alla presenza nei fan ghi di inquinanti inorganici ed organici.
La parte relativa alla biodegradazione è stata curata dalla Sezione di Microbiolo gia Agraria, Alimentare, Ecologica del DISTAM e coordinata dalla Prof. Anna maria Ferrari. In particolare il paragrafo del capitolo clorobenzeni è stato redatto da
Cristina Salardi; quelli relativi ai capitoli diossine, PAH e insetticidi sono a cura di
Stefano Oggiano; quello del capitolo fenoli è stato curato da Luigi Allievi; quelli dei
capitoli monociclici aromatici, detergenti, ftalati e PCB sono di Grazia Baggi, Vin cenzina Andreoni, Roberta Fasoli.
13
Grazia Baggi - Professore Associato di Microbiologia Agraria e Forestale, stu dia la degradazione microbica di composti organici, con riferimento alla valutazio ne della biodegradabilità dei composti di sintesi.
Vincenzina Andreoni - Professore Associato di Microbiologia Agraria e Fore stale, si occupa di degradazione di xenobiotici, di reazioni di biotrasformazione, del
trattamento di reflui e della rimozione di metalli per via microbica.
Luigi Allievi - Ricercatore, incaricato del corso di Ecologia Microbica. Si occu pa di microbiologia del suolo e relativi metodi di studio, ecotossicologia microbica,
depurazione biologica.
Cristina Salardi - Dottore di Ricerca, è stata borsista presso il TNO (Paesi Bas si) e titolare di contratto biennale con la Fondazione Lombardia per l’Ambiente. Si
occupa di interazioni fra xenobiotici e microflora del suolo e metodiche avanzate per
lo studio della microflora; attualmente è titolare di borsa post-dottorato presso l’U niversità di Verona.
Stefano Oggiano - Tirocinante biologo, poi titolare di borsa EERO presso il
TNO (Paesi Bassi), si è occupato di bioremediation di ambienti marini inquinati da
idrocarburi.
Roberta Fasoli - Borsista, poi titolare di contratto biennale con la Fondazio ne Lombardia per l’Ambiente, si è interessata di degradazione microbica di xe nobiotici.
14
Introduzione
L’
utilizzo di fanghi di depurazione in agricoltura sta diventando un co
creto metodo di riciclaggio dei rifiuti, in grado di migliorare lo status nu trizionale del suolo essendo, al tempo stesso, la via più economica di
smaltimento. I vantaggi dati dall’applicazione del fango all’agro-sistema sono tali
da porsi a confronto con un fertilizzante chimico tradizionale. L’apporto di sostan za organica (contenuta nel fango circa al 50%) è infatti in grado di migliorare la
struttura del terreno, influenzando i fenomeni di infiltrazione, porosità, C.S.C.,
densità e stabilità degli aggregati. L’impoverimento di sostanza organica, conse guente alla mutata configurazione agricola di alcune zone (allevamenti senza ter ra, ecc.), ed alla situazione climatica e pedologica dei nostri suoli, rende necessarie
ripetute applicazioni di sostanza organica al terreno. Si potrebbe quindi ipotizzare
la "letamazione" apportata dal fango come pratica agricola ordinaria per poter
mantenere le migliori condizioni di fertilità del terreno.
La produzione attuale dei fanghi è intorno ai 35 kg/pro capite di fango (s.s.),
quindi in Italia dal trattamento delle acque di scarico si ottengono più di 1.400.000
t/anno di fango espresso su base secca, di cui il 40% potrebbe essere destinato all’a gricoltura.
La CEE pur avendo imposto dei limiti alle quantità totali di fango da som ministrare al terreno agrario e al relativo apporto di metalli pesanti, non ha
posto attualmente restrizioni alle potenziali quantità di altri composti xeno biotici presenti, quali i composti organici, sebbene alcuni Stati membri abbia no adottato delle disposizioni specifiche. In Germania ad esempio è vietato
l’impiego di fanghi contenenti diossine, in Svezia non è ammessa l’applicazio ne su suoli agrari, nel Regno Unito, infine, è stata messa in discussione l’uti lizzazione dei fanghi sui terreni a pascolo.
15
I composti organici presenti nei fanghi, infatti, pur essendo classificati tra i mas simi inquinanti nelle liste degli Organismi di Protezione Ambientale, non sono re golamentati né a livello nazionale, né comunitario.
In mancanza di una regolamentazione specifica, quindi, si deve fare riferimento
alla legge concernente lo smaltimento dei rifiuti tossici e nocivi (DPR 915 del
10.9.1982), dove solo alcuni composti vengono presi in considerazione.
Inoltre, risultano carenti le sperimentazioni scientifiche e le ricerche sistematiche
sul destino e comportamento dei composti organici potenzialmente dannosi.
Essendo, comunque, l’emergenza rifiuti sempre più drammatica non si può non
considerare la realtà del reimpiego agricolo dei fanghi; dal momento, però, che il ter reno agrario verrebbe così a fungere da serbatoio di rifiuti, diventa indispensabile
indagare sulle interazioni suolo-pianta relative all’immissione delle sostanze xeno biotiche nel terreno, delle quali, ad esclusione dei metalli pesanti, si sa ben poco.
La problematica legata ai metalli presenti nei fanghi, diversamente dalle molecole
organiche, è ancorata alle caratteristiche del suolo, in quanto l’immobilizzazione o
l’eventuale assimilabilità è regolata da modificazioni fisico-chimiche interne al ter reno, quali variazioni di pH, o presenza di particolari cationi od anioni in grado di
dar luogo a fenomeni di insolubilizzazione, leaching, con pericolo di inquinamento
delle falde idriche, o di aumentare la disponibilità di alcuni metalli per la pianta.
Al contrario, per le molecole organiche presenti nei fanghi, utilizzate dai batteri
come fonte di carbonio, si tratta di valutare la capacità degradativa della microflo ra, che non sempre è in grado di attaccare la molecola organica e digerirla comple tamente, ma spesso solo di romperla parzialmente dando luogo in taluni casi a com posti ancora più tossici di quelli di partenza.
Di tutti questi composti derivati da processi produttivi, o dall’uso ed abuso di
alcuni prodotti commerciali, che spesso sono noti solo attraverso alcune sigle co me PCB (policlorobifenili), LAS e NP (detergenti), PAH (poliidrocarburiaroma tici) ecc., si è molto discusso, arrivando persino al bando di alcune sostanze per
l’eccessiva persistenza osservata (PCB, DDT, ecc.) nei diversi comparti ambien tali (aria, acqua), dando sempre la priorità al consumo umano e all’eventuale ri schio ad esso legato.
Ben poche ricerche sono state effettuate, invece, sulla potenziale contaminazione
causata dai composti organici veicolati dai fanghi attraverso la catena alimentare
(piante coltivate-animali-uomo).
Emerge, quindi, la carenza di una classificazione dei composti presenti nei fan ghi in relazione alla loro assimilabilità da parte delle piante coltivate.
Gli studi fino ad ora condotti, infatti, valutano i composti organici in relazione
alle loro proprietà chimiche (Wild and Jones, 1992), e alle relative potenzialità di pe netrazione nelle piante, trascurando i fenomeni legati al metabolismo, al terreno, al
pH, ecc., affermazioni che peraltro possono essere tratte solo da sperimentazioni
16
specifiche, prendendo in considerazione il sistema terreno ed il sistema fisiologico
delle varie specie coltivate di interesse agricolo.
Il maggior contributo di composti organici potenzialmente tossici alle acque di
scarico è, solitamente, dovuto dalle acque reflue industriali, anche se gli scarichi do mestici non sono da sottovalutare. I prodotti di utilizzo più comune sono rappre sentati dai detersivi e dai cosmetici, che contengono soprattutto solventi e metalli
pesanti. Poi deodoranti e disinfettanti, che contengono naftalene, fenolo e clorofe noli. Talvolta, ma non frequentemente, possono essere presenti anche pesticidi, ver nici, smacchiatori, ecc.
I contaminanti solitamente più rilevati sono i seguenti: benzene, fenolo, 2,4,6 tri clorofenolo, 2 clorofenolo, 1,2 diclorobenzene, 1,4 diclorobenzene, 1,1,1 tricloroeta no, naftalene, toluene, dietilftalato, dimetilftalato, tricloroetilene, aldrin, dieldrin.
I composti organici, nei fanghi, possono essere volatilizzati, assorbiti, e quindi
immobilizzati, o trasportati lungo il profilo del suolo, anche fino alle acque sotter ranee. Alle normali quantità di applicazione, comunque, la lisciviazione è del tutto
insignificante (Webber and Lesage, 1989).
I composti organici adsorbiti possono essere in seguito chimicamente o fotochi micamente degradati, decomposti microbiologicamente, o rilasciati.
Lo scopo di questa ricerca è appunto quello di seguire il comportamento dei sud detti composti attraverso le loro proprietà chimiche e, in base a queste, ipotizzarne
l’adsorbimento, la degradazione, l’eventuale passaggio nelle piante, per verificare
tutti gli eventuali rischi di contaminazione legati all’impiego agricolo dei fanghi di
depurazione.
Il tipo di approccio accennato, data la complessità delle matrici indagata che
può contenere una serie infinita di molecole organiche, ha peraltro i suoi limiti,
che cercheremo di individuare ponendo comunque a confronto tutti i dati dispo nibili in letteratura sui singoli composti. I risultati ottenuti, infine, sono estre mamente influenzabili dalla natura stessa del terreno e da molti parametri am bientali quali, il pH, la temperatura, la flora microbica, il contenuto di sostanza
organica (S.O.), ecc.
Le proprietà chimiche delle molecole xenobiotiche in merito all’utilizzo dei fanghi
in agricoltura possono essere qui di seguito elencate:
• Coefficiente di ripartizione ottanolo/acqua (Kow)
• Costante di Henry (Hc)
• Idrosolubilità
• Bioconcentrazione (BFC)
• Emivita.
Nella tabella 1 sono riportati i valori dei composti più frequentemente rilevati
nei fanghi e le loro caratteristiche chimiche (Jacobs et al. 1987; Rogers 1987; Web ber and Lesage, 1989).
17
18
19
20
In merito ai coefficienti di partizione ottanolo/acqua è quindi possibile avere un’i dea di quali composti sia più probabile ritrovare nei fanghi; non saranno presenti, in
genere, i composti con un Log Kow < 2, mentre i composti ad alta Kow (> 3), asso ciandosi alle particelle solide durante il trattamento delle acque reflue, vengono in corporate nel fango durante la sedimentazione (Petrasek et al., 1983a).
Analogamente la volatilità sarà elevata solo se la costante di Henry sarà > 0,4.
Saranno quindi presenti nei fanghi i composti con un alto log Kow (> 3) e una
Hc molto bassa (< 0.4) (Petrasek et al., 1983b).
Va aggiunto, inoltre, che alcuni composti organici sono presenti in elevate con centrazioni nelle acque, per esempio i LAS (Rogers, 1987) e i solventi industriali
(benzene, toluene e xilene), ormai ubiquitari nei fanghi, sia perché usati indiscri minatamente, sia perché in grado di legarsi fortemente alla matrice organica del
fango tanto da penalizzare la volatilizzazione (Webber and Lesage, 1989).
I trattamenti ai fanghi non influenzano generalmente le proprietà fisico-chimi che di questi composti, che giungono così al terreno attraverso il fango stesso (Wild
and Jones, 1992).
D’altro canto è opportuno non considerare i fanghi come l’unica fonte di immis sione delle molecole organiche nel terreno, sono da aggiungersi gli apporti dati dal le deposizioni atmosferiche, dalle applicazioni di pesticidi, dagli ammendanti tradi zionali, quali i letami e dai residui organici (compost).
Se confrontati con i pesticidi, infatti, (applicati in genere in dose di 0.2-0.4 kg di
p.a./ha), i fanghi, (applicati in dosi di 10 t/ha), mostrano un apporto non superiore
a 0.001 kg/ha.
Le due caratteristiche negative dei fanghi risiedono nel fatto che consistono in
una miscela di composti la cui tossicità complessiva è sconosciuta, e che, nel caso
che vengano applicati agli stessi terreni per molti anni, generano il problema che al cune molecole recalcitranti possono dare, nel tempo, fenomeni di accumulo.
Molti composti organici, inoltre, sono ubiquitari nell’ambiente perché presenti a
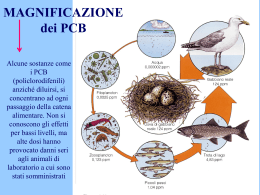
basse concentrazioni anche nell’aria ed entrano nell’agrosistema attraverso alter nanze di periodi di umido e asciutto. Policlorurati bifenili (PCB), poliidrocarburi
aromatici (PAH), pesticidi organoclorurati, idrocarburi clorurati a basso peso mo lecolare, plastificanti e solventi industriali sono stati tutti identificati nell’acqua
piovana (Spencer et al., 1988; Topp et al., 1986; Fries et al., 1981).
Suoli
Per quanto riguarda la componente suolo i principali fenomeni da tenere in con siderazione sono i seguenti: l’adsorbimento, la biodegradazione, la degradazione
abiotica, il leaching e la volatilizzazione.
L’adsorbimento dei composti organici nel suolo è particolarmente importante e
può essere espresso con un’isoterma lineare di adsorbimento. Questa ripartizione
21
suolo/particella e suolo/soluzione è descritta dal coefficiente Kd, che può esprimer si in funzione della sostanza organica (Kom) o del carbonio organico (Koc). L’ad sorbimento ritarda la lisciviazione, così che i composti con un’alta log Kow e una
bassa solubilità saranno meno rilasciati.
L’adsorbimento potenziale quindi è influenzato dal Kow:
log Kow < 2.5 basso adsorbimento
log Kow > 2.5 e < 4.0 medio adsorbimento
log Kow > 4.0 alto adsorbimento.
La biodegradazione è il meccanismo più importante di rimozione di composti
organici nel suolo, condizionato dai parametri cui si è già fatto riferimento, quali
pH, ecc.
I fanghi possono stimolare la flora microbica, ma contengono anche detergenti in
grado di aumentare la solubilità e la disponibilità di composti recalcitranti per i mi crobi. Al contrario, possono legare alcuni composti in modo tale da impedirne la de gradazione. Vengono perciò identificate 3 classi di composti in base al periodo di de gradazione (Wild et al., 1991; Ryan et al., 1988):
A < 10 gg
B 10-50 gg
C > 50 gg
Ad esempio, si è osservato che l’emivita dei PAH nel suolo trattato con fanghi era
inversamente correlata al Log Kow (Wild et al., 1991), così pure la persistenza dei
PCB e di diossine e furani (PCDD/Fs) che hanno proprietà simili ai PAH.
Anche il potenziale di lisciviazione è collegato alla persistenza nel suolo e al log
Kow: se log Kow è < 2.5 e la permanenza è superiore a 50 gg il leaching è maggio re, mentre composti caratterizzati da un log Kow > 4.0 hanno una scarsa mobilità.
In genere, i PAH, i PCB, i PCDD/F, alcuni pesticidi organo-clorurati ed alcuni clo robenzeni sono molto persistenti ed hanno un leaching assai ridotto, mentre i mo nociclici aromatici, alcuni clorobenzeni, gli alifatici a corta catena e i fenoli sono
prontamente degradati e lisciviati.
La degradazione abiotica include la fotolisi, l’idrolisi e l’ossidazione, che gene ralmente lasciano la struttura intatta. Ad esempio, i fenoli e alcuni PAH subiscono
fotolisi (Overcash, 1983), soprattutto per i PAH con meno di 4 anelli benzenici si è
osservata una degradazione nei suoli trattati con fanghi freschi (Wild and Jones,
1992a).
Per quanto concerne la volatilizzazione si possono applicare 2 criteri, il pri mo considera i composti con Hc superiore a 104 volatili, il secondo fa riferimento
al coefficiente di ripartizione aria/S.O. del suolo (Kao); i composti con Kao/Kow
109 sono volatili, con un rapporto inferiore sono meno volatili. Tra 104 e 109 i com posti sono semivolatili, come, ad esempio, i PCB, i PAH a basso peso molecolare,
i clorofenoli, alcuni PCDD/F e alcuni pesticidi. Anche all’interno di alcune clas -
22
si di composti, ci sono delle differenze rilevanti; ad esempio, tra i PAH, i cloro benzeni e i pesticidi organo-clorurati ci sono composti molto volatili e composti
affatto volatili.
Piante
L’uptake da parte delle piante dei composti organici presenti nei fanghi è in fluenzato dalle proprietà fisico chimiche del composto, dalle condizioni ambientali,
dal tipo di suolo e dalle caratteristiche della pianta, come il tipo di apparato radica le, la forma delle foglie e il contenuto in lipidi.
Le vie principali di entrata nella pianta sono le seguenti (Topp et al., 1986):
1) uptake radicale e traslocazione;
2) uptake fogliare;
3) uptake per contaminazione esterna dei fusti dal suolo e dalla polvere seguita
dalla ritenzione nella cuticola o dalla penetrazione attraverso essa;
4) uptake e traslocazione nelle cellule di riserva degli olii in piante come carote,
crescione, ecc..
La maggior parte degli esperimenti purtroppo non distinguono tra la prima e la
seconda possibilità, il che rappresenta un inconveniente data l’importanza dell’a sporto fogliare diretto rispetto all’asporto radicale e traslocazione per i composti vo latili e semivolatili (Fries and Marrow, 1981; Buckley, 1982; Bacci and Gaggi,
1985; Travis and Frey, 1988; Bacci et al., 1990; Travis and Arms, 1988).
L’uptake nelle radici può essere espresso come RCF (root concentration
factor) che è il rapporto tra la concentrazione nella radice ( g/g p.f.) e quella nel la soluzione esterna ( g/mL), mentre l’efficienza della traslocazione dalle radici ai
fusti è definita dal TSCF (transpiration stream concentration factor) che è il
rapporto tra la concentrazione nel sistema di traspirazione ( g per mL di acqua
traspirante) e quella nella soluzione esterna ( g per mL di soluzione esterna)
(Briggs et al., 1982) Il TSCF è indipendente dal denominatore ed ha un valore
max di 1 per asporto passivo.
In sperimentazioni su orzo (Briggs et al., 1983) è stata osservata una relazio ne lineare tra log RCF e log Kow, dove i composti più lipofili sono associati più
fortemente alla radice. La traslocazione ai fusti si esprimeva con un log Kow =
1.8. D’altra parte nel terreno possono intervenire molti fattori in grado di modi ficare l’uptake, per esempio, da altri autori sempre in piante di orzo, è stata rile vata una correlazione negativa tra RCF e Koc; quando però ci si riferiva alla con centrazione della soluzione del suolo la correlazione diventava positiva (Wild
and Jones, 1992).
Sostanze idrofobiche possono essere assorbite sulla superficie radicale e rimanere
legate ai lipidi delle membrane, come è stato riscontrato per alti livelli di PCB nelle
23
carote, che hanno un esoderma ricco in lipidi e, probabilmente, rappresentano il
peggior caso di uptake dai suoli trattati con i fanghi.
In sintesi, se consideriamo l’assunzione e il trasporto radicale come fenomeni pas sivi, l’asporto può essere descritto come una serie di reazioni consecutive di riparti zione, tra suolo ed acqua, tra soluzione del terreno e radici, tra radici e sistema re spiratorio, tra quest’ultimo e fusti. Questa serie di reazioni può essere collegata al
coefficiente di ripartizione ottanolo/acqua per quei composti con un alto log Kow
(PAH, PCB, PCDD/F), che sono quasi certamente assorbiti dal suolo e/o dalle ra dici della pianta. I composti, invece, con un basso coefficiente Kow, probabilmente,
sono traslocati nella pianta e nei suoi organi principali.
In merito all’uptake fogliare i composti possono entrare nella foglia attraverso
la cuticola, che, composta soprattutto da cere, tende a legare i composti lipofili e a
respingere quelli idrofili, o attraverso gli stomi.
I composti chimici a loro volta possono entrare o per diretta applicazione, o per
deposizione atmosferica o per assorbimento della molecola allo stato di vapore sia
attraverso la cuticola che attraverso lo stoma. Per i composti volatili è importante la
diffusione nella fase di vapore per poi entrare nelle radici o nei fusti. Per i composti
semivolatili con un alto log Kow la traslocazione dal sistema radicale potrebbe es sere minima, cosicché l’absorbimento allo stato di vapore può diventare una fonte
importante di contaminazione fogliare.
Da sperimentazioni, infatti, si è osservato che l’uptake dei composti organici da
foglie di orzo era positivamente correlato con la volatilizzazione delle molecole sud dette dal terreno (Topp et al., 1986).
Quando Hc è alta tende a ridurre la bioconcentrazione fogliare dei composti or ganici altamente lipofili, ma quando Hc è piccola essa può incrementare la bioaffi nità con i composti poco lipofili. Composti con alta lipofilia e volatilità avranno
un’altissima concentrazione fogliare.
Per quanto riguarda il metabolismo di questi composti all’interno della pianta
non sono stati condotti fino ad ora molti studi, ma è noto che alcuni composti pos sono essere metabolizzati velocemente e altri meno, come i PAH e i PCB, (Edwards,
1983; Harms and Langerbartels, 1986; Fletcher et al., 1989), che al limite, però,
possono essere parzialmente degradati in siti specifici: il dinitrobenzene ad esempio
viene degradato nelle radici, mentre il diclorobenzonitrile è metabolizzato solo nel le foglie (McFarlane et al., 1987).
Per alcuni composti il metabolismo è in funzione della struttura chimica e del ti po di pianta, ad esempio, la degradazione aumenta, diminuendo il numero di grup pi di cloro (Topp et al., 1986), mentre spesso la parziale rottura di queste molecole
organiche nelle piante comporta la formazione di coniugati polari e di frazioni non
estraibili (Lichtenstein, 1980; Casterline et al., 1985; Langerbartels and Harms,
1984; Ellwardt, 1977).
24
La tossicità di alcuni di questi composti è stata constatata più volte, anche in al tri comparti ambientali quali l’acqua e l’aria, ma poco si sa del meccanismo di con taminazione dei suoli causato dai fanghi.
Sull’assorbimento da parte delle piante coltivate, per esempio, si può affermare
quanto segue: anche se molte ricerche sono state condotte solo relativamente a
singoli gruppi di composti come PCB, PAH e altri organoclorurati (Babish et al.,
1979; Baxter et al., 1983; Kampe et Leschber, 1989; Goodin and Webber, 1989;
Bellin and O’Connor, 1990), generamente questi composti non sono assorbiti, ci
sono però evidenti arricchimenti di alcuni composti in colture da radice, ma la
traslocazione è inefficiente e di conseguenza la bioconcentrazione fogliare è mol to bassa; in genere poi gli aumenti sono confinati alle parti esterne delle radici che
vengono rimosse prima del consumo. È da sottolineare, in conclusione, come gli
studi effettuati sui composti organici presenti nei fanghi siano stati dispersivi,
senza tener conto delle proprietà chimiche che caratterizzano questi composti,
perché sono sicuramente più efficienti a livello di traslocazione nella pianta, e
quindi a rischio, i composti semivolatili con un log Kow intermedio ed alcuni
composti polari.
Animali
Il potenziale trasferimento di questi composti organici derivati dai fanghi nel be stiame è funzione di diversi fattori, quali le specie animali, il tipo e la dose di fango
applicato, se viene o meno praticato il pascolo, la stagione, la dieta, ecc.
Tre sono le vie di possibile ingestione: i composti vengono associati ai vegetali, il
suolo/fango aderisce alla vegetazione, il terreno ammendato viene direttamente in gerito. Molto dipende quindi, in caso di pascolo, dal grado di contaminazione del
terreno ingerito dagli animali, che, a sua volta, dipende dal clima, dalle abitudini
degli animali, dall’andamento meteorico, ecc.
In genere la media di suolo asportata dalla maggior parte del bestiame non è più
del 6% del totale asportato (s.s.), che, per un consumo bovino giornaliero tipico di
15 kg di s.s. eqivale a 0.9 kg di suolo trattato e 14.1 kg di vegetazione/giorno.
Nell’ipotesi che i composti organici nei suoli trattati fossero pari a 0.1, 1, 10,
100 ppm, la quantità ingerita sarebbe rispettivamente di 33, 330, 3300 e 33000
mg/anno.
Concentrazioni nelle piante di 0.1 ppm di composti organici xenobiotici sono co muni in campo.
Due caratteristiche sono comunque importanti la persistenza e la non polarità,
che permette al composto di concentrarsi nei lipidi, mentre composti polari non
tenderanno a bioconcentrarsi.
Per quantificare queste molecole organiche si è tentanto di utilizzare il fattore
BFC collegato alla dieta ma, la difficoltà di individuare uno stadio ideale in cui l’in -
25
gestione sia uguale all’escrezione e la necessità di tempi sperimentali lunghi, ren dono impossibile interpretare i dati (Fries, 1991).
Esistono diverse proposte ed equazioni relative alle proprietà fisiche dei composti
organici una delle quali è il rapporto BF (biotransfer factors) (Travis and Arms,
1988) tra la concentrazione nella carne o nel latte (ppm) e l’intake giornaliero del
composto organico (mg/g). Gli intakes giornalieri sono calcolati assumendo una
media di ingestione di cibo secco di 16 kg/die per animali in lattazione, e 8 kg/die
per animali non in lattazione.
In conclusione, i composti con un alto log Kow e una bassa solubilità in acqua so no quelli che tendono a bioaccumularsi.
Sperimentalmente si ottiene un andamento parabolico in cui un Log Kow di 5.8
dà un’altissima bioconcentrazione. Questo modello ipotizzato correlando le BCF di
composti organoclorurati nel tessuto adiposo umano al log Kow, può essere appli cato anche ad altri mammiferi (Sims and Overcash, 1983).
Questi composti, una volta ingeriti, possono passare attraverso la membrana ga strointestinale, entrare nel sangue o nel sistema linfatico e incorporarsi in tessuti o
organi. Alcuni composti altamente lipofili come gli idrocarburi alifatici lineari (Cn
> 29), pigmenti organici, polidimetilsiloxani e squaleni lineari non passano attra verso la membrana, anche se la maggior parte dei composti cloroorganici qui presi
in considerazione vengono assorbiti dal 40 all’80% della quota ingerita. Una volta
assorbiti si associano alle diverse parti corporee in proporzione al contenuto in lipi di; per esempio, sono state osservate concentrazioni decrescenti di dibenzopara diossina e dibenzofurani (PCDD/F) nel grasso addominale e subcutaneo, fegato,
muscoli e rene (Ryan et al., 1988).
Per quanto riguarda il metabolismo, molti di questi composti sono persistenti con
emivite di anni; 2.3.7.8-TCDD (triclorodibenzoparadiossina) ha una emivita di 5
anni nell’uomo, resistenti ancora sono PCDD e PCDF (dibenzoparadiossina e di benzofurani), PCB (policlorurati bifenili), HCB (esaclorobenzene), e i prodotti de rivati dalla parziale rottura della molecola del DDT.
Prontamente metabolizzati invece sono i DEHP (di-etil-exil-ftalati), i pesticidi
organofosforici, carbammati e esabromobenzene.
Altri composti come i PAH (poliidrocarburi aromatici) non sono tanto efficien temente assorbiti, possono però essere metabolizzati in prodotti intermedi molto pe ricolosi (Sims and Overcash, 1983).
In ogni caso il metabolismo impone un comportamento specifico al composto che
non può quindi essere ipotizzato in base alle semplici proprietà fisico-chimiche.
Per quanto riguarda il latte le concentrazioni di questi composti sono molto va riabili e rispondono ad alterazioni nel breve periodo, inoltre il latte è il prodotto più
influenzato dai contaminanti organici dei fanghi applicati al terreno, dipendendo
26
dalla diretta ingestione del fango che però può essere minimizzata se il fango viene
applicato con iniezioni sottosuperficiali.
Anche in campo le sperimentazioni riportano dati sull’ingestione di PCB (Fries,
1982), riportate poi nel capitolo specifico, dando dei dosaggi massimi a seconda del
tipo di dieta se integrata o meno con altri formaggi non trattati; in altri studi non
sono stati rilevati composti organici in bestiame alimentato al pascolo trattato con
fanghi (Baxter et al., 1983), o valori al limite della determinazione (dieldrin 0.2
ppb) (Rundle et al., 1984).
In sintesi, lo scopo di questa ricerca bibliografica è quello di approfondire la cono scenza delle proprietà fisico-chimiche dei composti organici ritrovabili nei fanghi, e
fornire delle indicazioni generali data la composizione estremamente varia dei fan ghi stessi, la scarsa letteratura esistente sui rapporti fanghi-terreno e la carenza di
sperimentazioni in campo a corto e lungo termine che permetterebbero di escludere
la pericolosità di alcuni composti inquinanti (es. PCB, PCDD/F).
Vengono considerate, infine, alcune tecniche agro-colturali come l’iniezione sot tosuperficiale dei fanghi, che non impedisce però il movimento dei composti volati li e semivolatili organici nel suolo, e le implicazioni di tutti i processi degradativi
biotici e abiotici, dalla formazione di frazioni residue alla lisciviazione e al traspor to legato all’associazione alla sostanza organica del suolo.
In merito alle piante l’uptake è minimo, ma va approfondito l’aspetto legato ad
alcune colture a rischio, quali carote e patate. I casi peggiori, come illustreremo, so no dovuti a composti polari con log Kow intermedio per l’asporto radicale, mentre
per quello fogliare i composti pericolosi sono quelli semivolatili organici, tra cui il
benzene, molto volatile, i PCB, che si legano alle cere della cuticola fogliare, e i clo robenzeni che potenzialmente entrano sia a livello radicale, che fogliare.
Per quanto riguarda la contaminazione degli animali, mancano, come vedremo,
ancora molti dati.
27
Bibliografia
BABISH J.G., STOEWSAND G.S.,
FURR A.K., PARKMAN T.P., BACHE
C.A.,
GUTENMANN
W.H.,
WSZOLEK P.G., LISK D.J., ( 1 9 7 9 ) :
Elemental and PCB content of tissues and
intestinal arylhydrocarbon hydroxylase
activity of Guinea pigs fed cabbage grown
on municipal sewage sludge . J. Agric.
Food Chem., 27, 399-402.
BACCI E., GAGGI C., (1985): P o l y clorinated biphenyls in plant foliage: tran slocation or volatilization from contamina ted soils? Bull. Environ. Contam. Toxicol.,
35, 673-681.
BACCI E., CALAMARI D., GAGGI C.,
VIGHI M., (1990): Bioconcentration of
organic chemical vapors in plant leaves:
experimental measurements and correla tion. Environ. Sci. Technol., 24, 885-889.
BAXTER J.C., AGUILAR M., BROWN
K., (1983): Heavy metals and persistent
organics at a sewage sludge disposal site. J.
Environ. Qual., 12, 311-319.
BELLIN C.A., O'CONNOR G . A .,
28
(1990): Plant uptake of PCP from sludge
amended soils. J. Environ. Qual., 19, 598602.
BRIGGS G.G., BROMILOW R . H .,
EVANS A . A ., ( 1 9 8 2 ) : R e l a t i o n s h i p s
between lipophilicity and root uptake and
traslocation of non-ionised chemicals by
barley. Pestic. Sci., 13, 495-504.
BRIGGS G.G., BROMILOW R . H .,
EVANS A.A., WILLIAMS M., (1983):
Relationships between lipophilicity and the
distribution of non ionised chemicals in bar ley shoots following uptake by the roots.
Pestic. Sci., 14, 492-500.
BUCKLEY E.H., (1982): Accumulation of
airborne polychlorinated biphenyls in folia ge. Science, 216, 520-522.
CASTERLINE J.L., BARNETT N . M .,
KU Y., (1985): Uptake, traslocation and
trasformation of PCP in soybean and spina ch plants. Environ. Res., 37, 101-118.
DPR 915 del 10-9-1982, Gazzetta
Ufficiale Repubblica Italiana n. 343
EDWARDS N.T., (1983): PAHs in the ter restrial environment -a review. J. Environ.
Qual., 12, 427-441.
ELLWARDT P., (1977): Variation in
content of PAHs in soil and plants by
using municipal waste compost in agricul ture. IAEA-SM- 211/31. Soil organic
Matter, 291-297.
FLETCHER J.S., GROEGER A . G .,
MCFARLANE J.C., (1989): Metabolism
of PCBs by plant tissue cultures.
Presented at 10th annual Meeting of
the society of Environ. Toxicol. and
Chemistry Conf. on Transboundary
Pollution. Oct 28-Nov2, Toronto,
Canada.
FRIES G.F., (1982): Potential PCB residues
in animal products from application of con taminated sewage sludge to land. J.
Environ. Qual., 11, 14-20.
FRIES G.F., MARROW G . S ., (1 9 8 1 ) :
Clorobiphenyl movement from soil to soy bean plants. J. Agric. Food Chem., 29,
757- 759.
FRIES G.F., (1991): Organic contaminants
in terrestrial foodchains. In: Organic conta minants in the Environment, K.C. Jones
(Ed.). Elsevier Applied Science Pub.,
207-236.
GOODIN J.D., WEBBER M.D., ( 1989):
Greenhouse studies with 14C-labelled orga nic contaminants . Presented at
Alternative Uses for Sewage sludge,
University of York, September.
HARMS H., LANGERBARTELS C .,
(1986): Standardized plant cell suspension
test systems for an ecotoxicologic evaluation
of the metabolic fate of xenobiotics. Plant
Sci., 45, 157-165.
JACOBS L.W., O'CONNOR G . A .,
OVERCASH M . A ., ZABIK M.J.,
RYGIEWICZ P., (1987): Effects of trace
organics in sewage sludges on soil plant
systems and assessing their risk to
humans. In: Land Application of sludge,
A.L. Page , T.J. Logan, J.A. Ryan (Eds),
Lewis Pub., Michigan.
KAMPE W., LESCHBER R ., (1 9 8 9 ) :
Occurence of organic pollutants in soil and
plants after intensive sewage sludge applica tions. In: D. Quaghebeur, I. Temmerman
and G. Angeletti (Eds), Organic contami nants in Wastewater, Sludge and Sediment:
Occurence, Fate and Disposal, Elsevier
Applied Science Publishers, London,
35-41.
LANGERBARTELS C., HARMS H.,
(1984): Metabolism of PCP in cell suspen sion cultures of soybean and wheat: PCP
glucoside formation. Z. Pflanzenphysiol.
Bd., 113, 201-211.
LICHTENSTEIN E.P., (1980): "Bound"
residues in soils and transfer of soil residues
in crops. Residue Rev., 76, 147-153.
MCFARLANE
C.,
NOTT C .,
WICKLIFF C ., PFLEEGER T .,
SHIMEBUKU R ., MCDOWELL M .,
(1987): The uptake, distribution and meta bolism of four organic chemicals by soy bean plants and barley roots. Environ.
Toxicol. Chem., 6, 847-856.
OVERCASH M.R., (1983): Land treat ment of municipal effluent and sludge: spe cific organic compounds. In: A.L. Page et
al. (Eds), Proc. Workshop on Utilization of
29
Municipal Wastewater and sludge on Land.
University of California, Riverside, 199226.
PETRASEK A.C., KUGELMAN I . J .,
AUSTERN B . M ., PRESSLEY T . A .,
WINSLOW L.A., WISE R.H., (1983 a):
Fate of toxic organic compounds in
wastewater treatment plants. J. Water
Pollut. Control Fed., 55, 1286-1296.
as related to their Henry's Law constants. J.
Environ. Qual., 17, 504-509.
TOPP E., SCHEUNERT I., ATTAR A.,
KORTE F., (1986): Factors affecting the
uptake of 14C labelled organic chemicals by
plants from soil. Ecotoxicol. Environ.
Safety, 11, 219-228.
TRAVIS C.C., H A T T E R M E R - F R E Y
H.A., (1988): Uptake of organics by aerial
plant parts: a call for research.
Chemosphere, 17, 277-283.
PETRASEK A.C., AUSTERN B . M .,
NEIHEISEL T.W., (1983b): Removal and
partitioning of volatile organic priority pol lutants in wastewater treatment.
Presented at the 9th US - Japan
Conference on Sewage Treatment
Tecnology, Tokyo, Japan.
TRAVIS C.C., ARMS A.D., ( 1 9 8 8 ) :
Bioconcentration of organics in beef, milk
and vegetation. Environ. Sci Technol., 22,
271-274.
ROGERS H.R., (1987): Organic contami nants in sewage sludge. Water Res. Centre
Rep. (EC 9322 SLD).
US EPA, (1985): Health effects of land
application of municipal sludge .
September.
RUNDLE H.L., CALCROFT M., HOLT
C., (1984): An assessment of accumula tion of Cd, Cr, Cu, Ni and Zn in the tis sues of British Friesian steers fed on the
product of land which has received heavy
applications of sewage sludge. J. Agric.
Sci., 102, 1-6.
WEBBER M.D., LESAGE S ., (1 9 8 9 ) :
Organic contaminants in Canadian munici pal sludges. Waste Management Res., 7, 6382.
RYAN J.A., BELL R.M., DAVIDSON
J.M., O’CONNOR G.A., (1988): Plant
uptake of non ionic organic chemicals
from soils. Chemosphere, 17 , 22992323.
SIMS R.C., OVERCASH M.R., (1983):
Fate of polynuclear aromatic compounds in
soil-plant systems. Residue Rev., 88, 1-67.
SPENCER W.F., CLIATH M.M., JURY
W . A .,
ZHANG
L . Z .,
(1 9 8 8 ) :
Volatilization of organic chemicals from soil
30
WILD S.R., BERROW M . L ., JONES
K.C., (1991): The persistence of PAHs in
sewage sludge amended agricultural soils.
Environ. Pollut., 72, 141-157.
WILD S.R., JONES K . C ., (1 9 9 2 a ) :
Monitoring the biological and abiotic loss of
PAHs from sewage sludge amended soils in
the laboratory. Environ. Toxicol. Chem.
WILD S.R., JONES K . C ., (1 9 9 2 b ) :
Organic chemicals entering agricultural
soils in sewage sludges: screening for their
potential to transfer to crop plants and live stock. Science of the Total Environment,
119, 85-119.
Capitolo 1
Monociclici
Aromatici
LA TOSSICITÀ D E IF A N G H ID I
I
DEPURAZIONE
principali composti appartenenti a questa classe sono rappresentati da benzene, toluene, xilene, etilbenzene ed dai loro nitro-composti, la cui struttura chimica è la seguente:
Benzene
• Coefficiente di ripartizione ottanolo/acqua (Log Kow): 2.13
• Costante di Henry: 5.43 x 10-3 atm. m 3/mole
Toluene
• Coefficiente di ripartizione ottanolo/acqua (Log Kow): 2.73
• Costante di Henry: 5.94 x 10-3 atm. m 3/mole
Xilene
32
Capitolo 1 MONOCICLICI AROMATICI
• Coefficiente di ripartizione ottanolo/acqua (Log Kow)
o-xilene : 3.12
m-xilene : 3.20
p-xilene: 3.15
• Costante di Henry
o-xilene : 5.10 x 10 -3 atm. m 3/mole
m-xilene: 7.68 x 10-3 atm. m 3/mole
p-xilene: 7.68 x 10 -3 atm. m 3/mole
Etilbenzene
• Coefficiente di ripartizione ottanolo/acqua (Log Kow): 3.15
• Costante di Henry: 8.44 x 10 -3 atm-m3/mole
In merito ai nitro-composti il 2,4 dinitrotoluene (DNT) è il maggior
inquinante risultante dalla produzione del 2,4,6 Trinitrotoluene, ed è
il materiale di partenza per la sintesi del toluendiisocianato, usato per
la produzione del poliuretano. Gli scarti produttivi sono risultati inquinanti e segnalati nella lista US EPA (1985).
1.1 Suoli
L’etilbenzene, se rilasciato nel suolo, in parte evapora (si caratterizza
infatti per una Hc alta) viene moderatamente adsorbito dal suolo stesso, non viene idrolizzato e può essere lisciviato fino alle acque di falda,
specialmente in un terreno a basso contenuto in sostanza organica.
Non esistono fonti naturali di emissioni di questo composto, che è
presente solo in casi di contaminazione, connessi alla sua produzione
(Howard, 1989).
33
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Altre sperimentazioni effettuate su xilene ed etilbenzene mettono in
evidenza come gli acidi umici presenti nel suolo giochino un ruolo
predominante nell’adsorbimento di questi composti (data la possibilità di interazione idrofobica) (Kango and Quinn, 1989).
In merito ai nitro-composti, sono stati condotti degli studi sull’adsorbimento del 2,4,6 trinitrotoluene dai quali è emerso che il coefficiente di adsorbimento medio del suolo (Kd) era pari a 4 e variabile
col tipo di suolo (Pennington, 1989).
1.2 Fanghi
Il contenuto in idrocarburi aromatici nei fanghi prelevati da un impianto petrolchimico viene riportato nella tabella che segue (cfr. tabel la 1.1, Andreottola and Bussalai, 1992).
In un confronto di fanghi di diversa origine, industriale e domestiParametro
Valore
pH
Umidità
Solidi totali
Solidi volatili
Solidi volatili (% s.s)
Densità (materiale sciolto)
Composti idrocarburici
Non aromatici
Nonene
Tetramero del propilene
Benzene
Toluene
Etilbenzene
Xileni
Cumene
C9 aromatici
Paraffine (C10-C20)
7.24
91.7 %
8.3
3.9
47.3%
0.93 kg/dm 3
250 mg/kg
1012 mg/kg
563 mg/kg
12 mg/kg
38 mg/kg
620 mg/kg
7259 mg/kg
467 mg/kg
943 mg/kg
10421 mg/kg
Tabella 1.1 - Caratteristiche chimicofisiche e contenuto di composti
idrocarburici nei fanghi prelevati
da un impianto petrolchimico
(da Andreottola and Bussalai, 1992).
34
Capitolo 1 MONOCICLICI AROMATICI
ca, sono state osservate delle concentrazioni di benzene e toluene
piuttosto rilevanti: le quantità di benzene osservate oscillano da 5 a 14
ppb per i fanghi industriali, e da n.d. a 4 ppb per quelli domestici; per
il toluene invece si hanno valori da 55 a 137 ppb nei fanghi del primo
tipo e da tracce a 33 ppb nei fanghi domestici (Crathorne et al.,1989).
1.3 Degradazione
1.3.1 Biodegradazione
I microrganismi capaci di utilizzare come fonte di carbonio per la
crescita i più semplici idrocarburi aromatici quali benzene, toluene,
etilbenzene e xileni (BTEX) sono distribuiti nel suolo e nelle acque anche se la tolleranza nei confronti di questi solventi è in genere bassa a
causa della loro tossicità. Fa eccezione uno Pseudomonas che cresce ad
alte concentrazioni di toluene, di p-xilene e di altri solventi (Inoue
and Horikoshi, 1989). La degradazione aerobica di BTEX da parte di
colture microbiche miste e pure è nota da tempo ed è stata oggetto di
numerose rassegne (Dagley, 1971). Studi più recenti hanno preso in
considerazione anche aspetti biochimici e genetici delle vie metaboliche implicate, evidenziando tra l’altro che la degradazione di toluene,
p- e m-xilene è geneticamente codificata dal plasmide Tol (Worsey
and Williams, 1975).
Di rilevante ed attuale interesse, data la tossicità acuta e carcinogenicità dei composti, è comunque la biodegradabilità di BTEX negli
ambienti naturali dove il processso microbico è influenzato da numerosi fattori tra cui la concentrazione dell’inquinante, la temperatura,
il pH, la disponibilità di nutrienti, ecc. Sono attualmente allo studio,
con risultati non sempre chiari, le interazioni di diversi inquinanti durante la biodegradazione. Tali interazioni, importanti per la comprensione del comportamento di BTEX nell’ambiente, possono essere
positive o negative, favorendo o ritardando la degradazione quando i
composti sono presenti in miscela. Si è osservato ad esempio che la
degradazione di benzene e p-xilene in colture miste e pure, era favorita in presenza di toluene, come pure quella di toluene e p-xilene in
presenza di benzene, mentre il p-xilene ritardava la degradazione di
benzene e toluene (Alvarez and Vogel, 1991).
35
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
In Mycobacterium vaccae la degradazione del benzene era leggermente ritardata quando toluene e benzene erano presenti in quantità
equimolari, mentre la produzione di 4-etilfenolo da etilbenzene aveva un effetto antagonista sulla degradazione di benzene e toluene
(Burback and Perry, 1993). Alcuni autori (Arvin et al., 1989) hanno
studiato l’effetto di microrganismi cresciuti su miscele di idrocarburi
aromatici sulla degradazione del benzene, dimostrando fra l’altro che
la degradazione di questo composto era stimolata dalla presenza di
toluene e o-xilene. Il toluene inoltre ha un effetto sinergico nella degradazione del tricloroetilene da parte di popolazioni microbiche del
suolo (Fan and Scow, 1993), mentre un ceppo di Pseudomonas degradava simultaneamente toluene e clorobenzene con induzione delle
catecolo 2,3- e 1,2-diossigenasi (Pettigrew et al., 1991).
Solo recentemente la degradazione anaerobica dei BTEX è stata studiata in colonne di suolo e microcosmi sotto differenti condizioni riducenti (riduzione del Fe, denitrificazione, riduzione del solfato e metanogenesi) (Grbic-Galic and Vogel, 1987; Zeyer et al., 1986). Toluene
e m-xilene venivano degradati da colture microbiche pure (Lovley
and Lonergan, 1990; Zeyer et al., 1990; Evans et al., 1991a) mentre la
degradazione anaerobica di benzene, p- e o-xilene è stata osservata
solo in coltura mista con risultati non sempre concordanti (Edwards
and Grbic-Galic, 1986; Reinhard et al.,1989; Kuhn et al.,1985; Major et
al., 1988; Wilson et al.,1986). In particolare si è osservato che il parziale metabolismo dell’o-xilene in condizioni di denitrificazione era dipendente dal toluene (Evans et al.,1991b).
Le sequenze degradative del metabolismo anaerobico di benzene e
toluene sono state studiate in consorzi metanogeni. I più comuni intermedi erano fenolo e cresoli dovuti alla ossidrilazione dell’anello
aromatico con incorporazione di ossigeno derivante dall’acqua (Vogel and Grbic-Galic, 1986; Grbic-Galic and Vogel, 1987). È stata anche
osservata la formazione da toluene di benzilalcool per ossidazione del
metile sostituente e sono state ipotizzate reazioni di demetilazione e
riduzione dell’anello aromatico (Grbic-Galic and Vogel, 1987). Più recentemente in esperienze con l4 C toluene è stata osservata la formazione di 14 C benzoato da parte di colture pure di Pseudomonas denitri ficans (Schocher et al., 1991).
Sono stati individuati diversi ceppi batterici in grado di degradare
i solventi aromatici, in particolare si è indagato sulla degradazione di
benzene, toluene, o-, m- e p- xilene, in suoli trattati con liquami; la
degradazione si verificava immediatamente non appena i microor-
36
Capitolo 1 MONOCICLICI AROMATICI
ganismi venivano aggiunti, mentre, senza l’inoculo, la degradazione
dei primi composti era più lenta e l’o-xilene diveniva poco degradabile. L’aggiunta di fanghi non stimolava la degradazione (Odenhuis
et al., 1989).
In un’indagine sperimentale effettuata per valutare la possibilità di
uno smaltimento combinato di alcuni rifiuti industriali (fanghi contenenti solventi organici aromatici) con RSU, si è notato che questa combinazione provocava un’accelerazione dei processi di degradazione
della frazione organica presente nei rifiuti urbani. Dai risultati ottenuti riguardo ai rilasci del percolato sembrerebbe che i composti aromatici siano stati biodegradati, probabilmente attraverso un passaggio nella forma di benzene (Andreottola and Bussalai, 1992).
Per quanto concerne la biodegradabilità dell’etilbenzene nel terreno si ipotizza che esso venga degradato lentamente dopo un certo acclimatamento. Infatti è stato osservato che dopo un periodo di adattamento, l’etilbenzene viene rapidamente degradato in fanghi attivi
inoculati (Howard,1989), mentre nelle acque di falda viene degradato in 8 gg (Howard, 1989).
Nitrobenzeni e nitrotolueni
I nitrobenzeni pur essendo considerati recalcitranti all’attacco microbico a causa della loro natura chimica possono essere attaccati da
taluni microrganismi. In alcuni Pseudomonas l’attacco iniziale dei nitrobenzeni avviene ad opera di diossigenasi, in altri l’attacco iniziale
è dovuto invece a monoossigenasi (Haigler and Spain, 1993). Recentemente è stata descritta una nuova specie di Rhodococcus, isolato da
suoli contaminati ed in condizioni limitanti di azoto, capace di degradare 1’1,3 dinitrobenzene (1, 3-DNB) con formazione intermedia di 4nitrocatecolo. Questo microrganismo utilizzava l’1, 3-DNB come fonte di azoto sia in assenza che in presenza di ammonio (Dickel and
Knackmuss, 1991).
I nitrobenzeni possono essere ridotti alle corrispondenti aniline sia
da microrganismi anaerobi, come nel caso di Haloanaerobium praeva l e n s (Oren et al., 1991), che da aerobi, come nel caso di S t r e p t o m y c e s
flavus (Glaus et al.,1992).
Il 2,4,6-trinitrotoluene (TNT) è un esplosivo di largo impiego, il cui
smaltimento ha causato inquinamento di suoli, di sedimenti e di acque. La sua biodegradazione è nota da tempo. Microrganismi del genere Pseudomonas (Won et al., 1976) e Veilonella alcalescens (Mc Cormick et al., 1976) sia in condizioni aerobiche che anaerobiche sono in
37
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
grado di degradare il TNT, attraverso la formazione intermedia di derivati idrossilaminici, alle ammine corrispondenti. Queste reazioni
sono state osservate avvenire anche in diversi sistemi naturali quali
acque, suoli, fanghi attivi e compost.
Il TNT viene degradato anche dai funghi: Rhizopus stolonifer (Klausmeier et al.,1974) e Phanerochaete chrysosporium (Fernando et al., 1990)
ne sono un esempio, e in particolare P.chrysosporium quando inoculato
in un campione di suolo era capace di degradare 1.3 mg/kg di TNT in
circa 18 giorni. L’aggiunta di glucosio non stimolava la degradazione
di TNT; al contrario quella di spiga di grano macinata permetteva di
raggiungere buoni livelli di rimozione, ma a tempi più lunghi. In presenza di 10 g/kg di suolo di TNT, P.chrysosporium non veniva inibito
ed il campione di suolo degradava circa 1’85% del TNT presente in 90
giorni. Il TNT viene metabolizzato anche dai batteri solfato riduttori.
Un ceppo di Desulfovibrio isolato da un digestore anaerobico metabolizzava in 7-10 giorni a 37°C 100 ppm di TNT a triaminotoluene crescendo in presenza di piruvato come fonte primaria di carbonio o di altri donatori di elettroni quali etanolo, lattato, formiato, H 2 + CO 2
(Boophaty et al.,1992). In condizioni limitanti di azoto, Desulfovibrio
trasformava il triaminotoluene a toluene; in presenza invece di ammonio il TNT era convertito a diaminonitrotoluene e non era mai convertito a toluene (Boophaty and Kulpa, 1992).
Il 2,4-dinitrotoluene (2,4-DNT), impurezza che accompagna la sintesi del TNT, è stato visto essere degradabile. Campioni di fanghi attivi, in condizioni anaerobiche ed in presenza di un cosubstrato, trasformavano il 2,4-DNT in una miscela di 2-amino-4 nitrotoluene, 4amino-2-nitrotoluene, 2-nitroso-4-nitrotoluene e 4-nitroso-2-nitrotoluene (Liu et al.,1984). Recentemente è stato riportata la completa mineralizzazion di 2,4 -DNT da parte di P. chrysosporium mediante perossidasi (Valli et al., 1991).
Cellule di Pseudomonas putida F1 e di Pseudomonas sp. Js 150 erano in
grado di degradare rispettivamente il 4-nitrotoluene (4-NT) a 2-metil5-nitrofenolo e 3-metil-6-nitrocatecolo che non venivano ulteriormente degradati (Robertson et al.,1992). Alcuni studiosi (Haigler and
Spain, 1993) hanno isolato da un suolo contaminato da 4-NT un ceppo
di Pseudomonas capace di mineralizzare il 4-NT utilizzandolo come
unica fonte di carbonio, azoto ed energia.
38
Capitolo 1 MONOCICLICI AROMATICI
1.4 Piante
Pur esistendo dei modelli teorici per prevedere il destino ambientale dei composti cosiddetti inquinanti, essi sono esclusivamente basati
su proprietà fisiche dell’ambiente (piogge, tipo di suolo, ecc.) o proprietà chimiche (log di Kow, Hc, ecc.) dei suoli contaminati, ignorando l’influenza del vegetale sul destino finale dell’inquinante.
Alcuni studi, anche se pochi (Fletcher et al., 1990), hanno messo in
luce la potenzialità di asporto di sostanze tossiche da parte delle piante (Bush et al.,1986; Edwards, 1986, Topp et al., 1986; McFarlane and
Pleeger, 1987) e come catalizzino le alterazioni chimiche di molti
composti potenzialmente tossici (Sanderman et al., 1984; Harms and
Langebartels, 1986; Groeger and Fletcher, 1988). Probabilmente questo approccio è dovuto al fatto che in genere si dà maggior importanza al danno esteriore, causato dallo xenobiotico, spesso non così evidente (Walton and Edwards, 1986).
Per colmare questa carenza è stata effettuata una sperimentazione
su un sistema di crescita in idroponica, utilizzando come pianta test
la soia e come composto chimico il nitrobenzene (NB), che è stato
somministrato in diversi dosaggi. A 0,02 e a 0,2 µg /ml le radici non
mostravano alcun sintomo di sofferenza; crescevano meno radici con
concentrazioni di 2 µg/ml e addirittura pochissime con 100 µg/ml. Si
intuisce che la crescita radicale era inibita direttamente dal nitrobenzene.
Con radioisotopi si è visto che l’80% della radioattività alle concentrazioni minori rimaneva nelle radici (il restante nel fusto), al contrario con 100 µg /ml di nitrobenzene si aveva un’eguale ripartizione tra
fusti e radici (tabella 1.2 e 1.3, Fletcher et al.,1988).
Si può concludere che alle concentrazioni minori c’era una diretta
corrispondenza tra NB somministrato e accumulo di NB nelle radici
e nei fusti, destando quindi dei seri rischi di contaminazione della
catena alimentare (Walton and Edwards, 1986), in accordo con la letteratura .
39
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Parte della pianta
Trattamento ( g / m l )
0.20
2.0
dpm x 10 2 ( % )
0.02
Fusti
Cloroformio (non polare)
M e t a n o l o - H 20 (polare)
Insolubile
Totale
Radici
Cloroformio (non polare)
M e t a n o l o - H 20 (polare)
Insolubile
Totale
Pianta totale
421 1(14) 2
101 (3)
89 (3)
6 1 1( 2 0 )
3 3 3( 1 1 )
7 2 2( 2 4 )
1.3111 (44)
2 . 3 6 6( 8 0 )
2.976
1.7552 (11)
304 (2)
372 (2)
2.428 (16)
1.297 (8)
3.928 (25)
7.997 (51)
13.222 (84)
15.650
1.948
293
384
2.625
100.0
(17)
(3)
(3)
(23)
2 . 4 7 2( 4 2 )
276 (5)
369 (6)
3 . 1 1 7( 5 3 )
1.336 (12)
3.733 (32)
3.867 (33)
8.936 (77)
11.550
7 6 7( 1 3 )
1 . 3 1 0( 2 2 )
6 4 7( 1 1 )
2 . 7 2 4( 4 7 )
5.840
1 - Il valore riportato è calcolato sull' analisi di 2 repliche.
2 - La distribuzione percentuale è calcolata dividendo le dpm in frazioni singole sul totale
delle dpm ricavate dalla pianta.
Tabella 1.2 - Ripartizione del 14C in piante di soia mature dopo 3 giorni
di trattamento con concentrazioni crescenti di nitro benzene 14C
(da Fletcher et al., 1988).
Parte della pianta
Trattamento ( g / m l )
0.20
2.0
g/100gg (% di accumulo)
0.02
Fusti
sol.circolante
Cloroformio (non polare)
M e t a n o l o - H 20 (polare)
Insolubile
Totale
Radici
Cloroformio (non polare)
M e t a n o l o - H 20 (polare)
Insolubile
Totale
Pianta totale
21
0.76 2 ( 0 . 3 8 ) 3
0.18 (0.09)
0.16 ( 0 . 0 8 )
1.1 ( 0 . 5 5 )
0.7
1.6
2.9
5.2
3.2
(0.4)
(0.8)
(1.5)
(2.6)
(1.6)
20
7.1 ( 0 . 3 5 )
1.2 ( 0 . 0 6 )
1 . 5( 0 . 0 8 )
9.8 ( 0 . 4 9 )
5.5
16.9
34.4
56.8
33.2
(0.3)
(0.8)
(1.7)
(2.9)
(1.7)
100.0
200
10.000
79.7 ( 0 . 4 0 ) 4491.5 ( 0 . 4 5 )
11.8 ( 0 . 0 6 ) 499.1 ( 0 . 0 5 )
15.6 ( 0 . 0 8 ) 668.9 ( 0 . 0 7 )
107.1 ( 0 . 5 4 ) 5659.5 ( 0 . 5 7 )
63.33
177.66
184.3
425.2
266.1
(0.3)
(0.9)
(0.9)
(2.1)
(1.3)
1961.5
3354.4
1662.1
6978.0
6318.8
(0.20)
(0.34)
(0.17)
(0.70
(0.63)
1 - grammi di nitrobenzene per 100 grammi.
2 - Le concentrazioni (g/100 g s.f.) sono calcolate sui dati riportati in tabella 2 e il peso fresco
delle piante, assumendo che l'anello benzenico rimanga integro (Lamourex and Rusness, 1986)
3 - I coefficienti di accumulo sono calcolati dividendo la concentrazione nella parte della pianta e il
NB presente nella soluzione circolante.
Tabella 1.3 - Concentrazioni nei tessuti e percentuale di accumulo di benzene
nelle parti della pianta dopo 3 giorni di trattamento con nitrobenzene 14C
(da Fletcher et al. 1988).
40
Capitolo 1 MONOCICLICI AROMATICI
Conclusioni
Il contenuto di monociclici aromatici nei fanghi varia a seconda della provenienza del fango stesso, da poche decine di ppb nei fanghi di
origine domestica a 1 centinaio di ppb per quelli di origine industriale.
Nel suolo sono molto mobili e possono arrivare fino alle acque di
falda, specialmente in suoli a basso contenuto di sostanza organica. I
monociclici aromatici presentano, comunque, una notevole degradazione; da sottolineare piuttosto è la volatilità di questi composti, che,
attraverso l’elevato assorbimento fogliare, possono essere pericolosi
a livello di contaminazione alimentare, anche se la contaminazione a
livello di foraggio si attesta su valori medi.
Medi risultano pure l’assorbimento radicale e la traslocazione, ma
varie sperimentazioni affermano una diretta corrispondenza tra xenobiotico somministrato e accumulo nelle radici e nei fusti.
In generale, l’utilizzo del fango come fertilizzante deve attuarsi con
qualche accorgimento, ad esempio, l’applicazione del fango al terreno con iniezioni sottosuperficiali limiterebbe molto la volatilizzazione e quindi la contaminazione fogliare.
41
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Bibliografia
ALVAREZ P.J.J., VOGEL T.M., (1991):
Substrate interactions of benzene, tolue ne, and para-xilene during microbial de gradation by pure cultures and mixed cul ture aquifer slurries. Appl. Environ. Mi crobiol., 57, 2981-2985.
ANDREOTTOLA, BUSSALAI, (1992):
Indagine sperimentale sullo smaltimento
combinato di rifiuti solidi urbani e indu striali in discarica controllata. Ingegneria
Ambientale, vol XXI, n. 6.
ARVIN E., JENSEN B.K., G U N D E RSEN A.T., (1989): Substrate interaction
during aerobic biodegradation of benzene.
Appl. Environ. Microbiol., 55, 3221-3225.
BOOPATHY R., KULPA C.F., W I LSON M., (1993): Metabolism of 2,4,6-tri nitrotoluene (TNT) by Desulfovibrio sp.
(B strain). Appl. Microbiol. Biotecnol.,
39, 270-275.
BOOPHATY R., KULPA C.F., (1992):
Trinitrotoluene (TNT) as a sole nitrogen
42
source for a sulfate-reducing bacterium
Desulfovibrio sp. (B strain 9 isolated
from an anaerobic digester). Current Mi crobiol., 25, 235-241.
BURBACK B.L., PERRY J. J., (1993):
Biodegradation and biotransformation of
groundwater pollutant mixtures by M icobacterium vaccae. Appl. Environ.
Microbiol., 59, 1025-1029.
BUSH B., SHANE L.A., WILSON L.R.,
BARNARD E . L ., BARNES D ., (1 9 8 6 ) :
Uptake of polychlorobiphenyl congeners
by purple loosestrife (Lythrum salicaria)
on the banks of the Hudson River. Arch.
Environ. Contam. Toxicol., 15, 285-290.
CRATHORNE B., DONALDSON K . ,
JAMES H . A ., ROGERS H . R ., ( 1 9 8 9 ) :
The determination of organic contami nants in UK sewage sludges. In: Organic
contaminants in wastewater, sludge and
s e d i m e n t. Ed. by D. Quaghebeur, I.
Temmermann and G. Angeletti. Elsevier Applied Science.
Capitolo 1 MONOCICLICI AROMATICI
DAGLEY S., (1971): Catabolism of aro matic compounds by microorganism.
Adv. Microb. Physiol., 6, 1-46.
DICKEL O., KNACKMUSS H . J . ,
(1991): Catabolism of 1,3 dinitrobenzene
by Rhodococcus sp.,QT.I. Arch. Micro biol., 157, 76-79.
EDWARDS E., GRBIC-GALIC D . ,
(1990): Abstr.Annu.Meet. Am. Soc. Mi crobiol., Q 50, p 296.
FLETCHER J.S., JOHNSON F . L ., MC
FARLANE J.C., (1988): Database asses sment of phitotoxicity data published on
terrestrial vascular plants. Environ. Tox.
and Chem., 7, 615- 622.
FLETCHER J.S., MCFARLANE J . C .,
PFLEEGER T ., WICKLIFF C ., ( 1 9 9 0 ) :
Influence of root exposure concentration
on the fate of nitrobenzene in soybean.
Chemosphere, 20, 513- 523.
EDWARDS N.T., (1986): Uptake, tran slocation and metabolism of anthracene in
bush bean (Phaseolus vulgaris L.). En viron. Tox. and Chem., 5, 659-665.
GLAUS M.A., HEIJMAN C . G . ,
SCHWARZENBACH R.P., ZEYER J . ,
(1992): Reduction of nitroaromatic com pounds mediated by Streptomyces sp.
exudates. Appl. Environ. Microbiol., 58,
1945-1951.
EVANS P.J., DZUNG T. M A N G ,
SHIN KIM KWANG, YOUNG L.Y.,
(1991a): Anaerobic degradation of tolue ne by a denitrifying bacterium. A p p l i e d
and Environmental Microbiology, Apr.,
1139-1145.
GRBIC-GALIC D., VOGEL T . M . ,
(1987): Transformation of toluene and
benzene by mixed methanogenic cultures.
Appl. Environ. Microbiol., 53, 254-260.
EVANS P.J., DZUNG T. M A N G ,
SHIN KIM KWANG, YOUNG L.Y.,
(1991b): Degradation of toluene and mxilene and trasformation of o-xilene by
denitrifying enrichment cultures . A p plied and Environmental Microbiology,
Feb., 450-454.
FAN S., SCOW K.M., (1993): Biodegra dation of trichloroethylene and toluene by
indigenous microbial populations in soil.
Appl. Environ. Microbiol., 59, 19111918.
FERNANDO T., BUMPUS J., A U S T
S.D., (1990): Biodegradation of TNT
(2,4,6-trinitrotoluene) By Phanerochaete chrysosporium. Appl. Environ. Mi crobiol., 56, 1666-1671.
GROEGER A.G., FLETCHER J . S .,
(1988): The influence of increasing chlori ne content on the accumulation and meta bolism of PCBs by Paul's Scarlet Rose cel ls. Plant Cell Rep., 7, 329-332.
HAIGLER B.J., SPAIN J.C., (1991): Bio transformation of nitrobenzene by bacte ria containing toluene degradative
pathways. Appl. Environ. Microbiol., 57,
3156-3162.
HAIGLER B.J., SPAIN J.C., (1993): Bio degradation of 4-nitrotoluene by Pseudomonas sp. strain 4 NT. Appl. Environ.
Microbiol., 59, 2239-2243.
HARMS H., LANGEBARTELS C .,
(1986): Standardized plant cell suspen sion test systems for an ecotoxicologic
43
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
evaluation of the metabolic fate of xeno biotics. Plant Sci., 45, 157-165.
HOWARD P.H., (1989): Handbook of
Environmental Fate and exposure data for
organic chemicals, Vol I, Large Produc tion and priority Pollutants. Lewis Pub.,
Michigan, USA.
INOUE A., HORIKOSHI K., (1989): A
Pseudomonas thrives in high concentra tions of toluene. Nature, 338, 264-266.
KANGO R.A., QUINN J . G ., ( 1 9 8 9 ) :
Adsorption studies of xilenes and ethyl benzene on soil and humic acid by a purge
and trap gas chromatographic method.
Chemosphere, 19, 1269-1276.
KLAUSMEIER R.E., OSMON J . L . ,
WALLS D.R., (1974): The effect of trini trotoluens on microorganisms. Rev. Ind.
Microbiol., 15, 309-311.
KUHN E.P., COLBERG P.J., S C HNOOR L., WANNER O., Z E H N D E R
J.B.,
SCHWARZENBACH
R.P.,
(1985): Microbial transformation of sub stituted benzenes during infiltration of
river water to groundwater: laboratory
column studies. Environ.Sci.Technol.,
19, 961-968.
LAMOUREX G.L., RUSNESS D . G .,
(1989): Xenobiotic conjugation in higher
plants. In: G.D. Paulson ed., Xenobiotic
Conjugation Chemistry.. Amer. Chem.
Soc. Washington DC., 62-105.
LIU D., THOMSON K., A N D E R S O N
A.C., (1984): Identification of nitroso
compounds from biotransformation of
2 , 4 - d i n i t r o t o l u e n e . Appl. Environ. Mi crobiol., 47, 1295-1298.
44
LOVLEY D.R., LONERGAN D . J . ,
(1990): Anaerobic oxidation of toluene,
phenol, and p-cresol by the dissimilatory
iron-reducing organism, GS-15 . A p p l .
Environ. Microbiol., 56, 1858-1864.
MAJOR D.W., MAYFIELD C . I . ,
BARKER J.F., (1988): Biotransformation
of benzene by denitrification in aquifer
sand. Ground Water, 26, 8-14.
Mc CORMICK NG., FECHERRY F.E.,
LEVINSONS H.S., (1976): M i c r o b i a l
transformation of 2,4,6-trinitrotoluene
and other nitroaromatic compounds. Ap pl. Environ. Microbiol., 31, 944-958.
M cF A R L A N E J.C., PLEEGER T .,
(1987): Plant exposure chambers for
study of toxic chemical-plant interactions.
J. Environ. Qual., 16 (4), 361-371.
ODENHUIS R.L., KUIJK L., L A MMERS A., JANSSEN D.B., WHITHOLT
B . , (1989): Degradation of chlorinated
and non chlorinated aromatic solvents in
soil suspensions by pure bacterial coltu res. Applied Microbiology and Biothecno logy, 30 (2), 211- 217.
OREN A., GUREVICH P., HENIS Y . ,
(1991): Reduction of nitrosubstituted
aromatic compounds by the halophilic
anaerobic eubacteria H a l o a n a e r o b i u m
Praevalens and Sporolobacter marismortui. Appl. Environ. Microbiol., 57,
3367-3370.
PENNINGTON J.C., (1989): Soil sorp tion and plant uptake of 2,4,6-trintroto luene. Sci. and Eng., 49, n.12.
PETTIGREW C.A., HAIGLER B . E . ,
SPAIN J.C., (1991): Simultaneous biode -
Capitolo 1 MONOCICLICI AROMATICI
gradation of chlorobenzene and toluene by
a Pseudomonas strain. Applied and En vironmental Microbiology, Jan., 157- 162.
REINHARD M.F., HAAG F., Mc
CARTY P.L., (1989): Abstr.Proc. Int.
Symp. on processes governing the movement and fate of contaminants in the
subsurface environments, Stanford,
Calif..
RIBBONS D.W., EATON R.W., (1982):
Chemical transformation of aromatic hy drocarbons that support the growth of mi croorganisms. In: Biodegradation and de toxification of environmental pollutants
(A.M. Chakrabarty ed), p 59-84, CRC
Press, Inc., Boca Raton, Fla.
ROBERTSON J.B., SPAIN J.C., HADDOCK J.D., GIBSON T.D., (1992): Oxi dation of nitrotoluens by toluene dioxygena se: evidence for a monooxygenase reaction.
Appl. Environ. Microbiol., 58, 2643-2648.
SANDERMAN H., SCHEEL D .,
TRENCH Th. V.D., (1984): Use of plant
cell cultures to study the metabolism of
environmental chemicals. Ecotoxicol. En viron. Safety, 8, 167-182.
SCHOCHER R.J., SEYFRIED B., VAZQUEZ F., ZEYER J., (1991): A n a e r o b i c
degradation of toluene by pure cultures of
denitrifying bacteria.
TOPP E., SCHEUNERT I., ATTAR A.,
KORTE F., (1986): Factors affecting the
uptake of 1 4C-labeled organic chemicals by
plants from soil. Ecotoxicol. Environ. Saf.
11, 219-228.
US EPA, (1985): Health effects of land ap plication of municipal sludge. September.
VALLI K., BROK B.J., JOSHI D . K . ,
GOLD M.H., (1991): Degradation of 2,4dinitrotoluene by the lignin-degrading
fungus Phanerochaete chrysosporium.
Appl. Environ. Microbiol, 58, 221-228.
VOGEL T.M., GRBIC-GALIC D . ,
(1986): Incorporation of oxygen from wa ter into toluene and benzene during anae robic fermentative transformation. Appl.
Environ. Microbiol., 52, 200-202.
WALTON B.T., EDWARDS N . T .,
(1986): Accumulation of organic consti tuents in terrestrial biota. In: Land Treat ment, a hazardous waste management al ternative, Ed. R.C. Loehr and J.F. Malina, Jr. Water Resources Symposium n.
Thirteen, by US EPA and The Univ. of
Texas, 73-86.
WILSON B.H., SMITH G.B., REES J.F.,
(1986): Biotransformation of selected
alkylbenzenes and halogenated - aliphatic
hydrocarbons in methanogenic aquifer
material: a microcosm study . E n v i r o n .
Sci. Technol., 20, 997-1002.
WON W.D., DI SALVO L.M., NG J.,
(1976): Toxicity and mutagenicity of
2,4,6-trinitrotoluene and its microbial
metabolites. Appl. Environ. Microbiol.,
31, 576-580.
WORSEY M.J., WILLIAMS P . A . ,
(1975): Metabolism of toluene and xyle nes by Pseudomonas putida (arvilla)
mt-2: evidence for a new function of the
TOL plasmid. J.Bacteriol., 124, 7-13.
ZEYER J., EICHER P., DOLFING J . ,
SCHWARZENBACH R.P., (1990):
Anaerobic degradation of aromatic hydro carbons. In: Biotechnology and Biodegra -
45
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
dation (Kamely D., Chakrabarty A.,
Omenn G.S. ed.). 33-40. Gulf Publishing Co., Houston.
ZEYER J., KUHN E.P., S C H W A R-
46
ZENBACH R.P., (1986): Rapid micro bial mineralization of toluene and 1,3-di methylbenzene in the absence of molecular
o x y g e n. Appl.Environ. Microbiol., 5 2 ,
944-947.
Capitolo 2
Cloro-Benzeni
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
I
l clorobenzene (CB) ha un vasto raggio di proprietà fisico-chimiche; tre diclorobenzeni (DCB) 1,2,4-triclorobenzene (1,2,4-TCB)
e esaclorobenzene (HCB) sono stati classificati tra i maggiori inquinanti nella lista US-EPA (1985) e dalla lista CEE, in quest’ultima è
anche inclusa una miscela tecnica di triclorobenzeni (TCB) (Jones and
Wild, 1991).
Vengono di seguito illustrate le formule di struttura dei principali
clorobenzeni:
DCB
• Coefficiente di ripartizione ottanolo/acqua (logKow): 3.38
• Costante di Henry: 1.20 x 10-3 0.0012 atm-m 3/mole a 20°C
TCB
• Coefficiente di ripartizione ottanolo/acqua (logKow): 4.02
• Costante di Henry: 1.42 x 10-3 atm-m3/mole a 20°C
48
Capitolo 2 CLORO - BENZENI
HCB
• Coefficiente di ripartizione ottanolo/acqua (logKow): 5.31
• Costante di Henry: 1.30 x 10 -3 atm-m3/mole a 23°C
Indubbiamente si tratta di inquinanti organici ubiquitari provenienti da vari processi di produzione di composti chimici usati sia industrialmente che non, e dallo smaltimento dei rifiuti (Howard, 1989;
Jones and Wild, 1991; USEPA, 1985; Rogers et al., 1989; Mugalinskii et
al., 1990).
L’1,2 DCB è soprattutto usato nei prodotti per la pulizia, nei solventi (anche miscele di TCB), additivi, ecc.
L’1,4-DCB viene usato industrialmente e come intermedio nella
produzione di pesticidi e, nell’ambito domestico, come insetticida e
deodorante.
L’1,2,4-TCB, accanto all’uso industriale come solvente, refrigerante
e composto intermedio chimico, viene usato anch’esso come insetticida contro termiti e per il trattamento delle acque reflue (Topp et al.,
1989).
TeCB, PeCB e HCB vengono usati come ritardanti in caso di incendi.
Non esistono vere e proprie fonti di esaclorobenzene che è un prodotto derivato da processi di produzione del tetracloroetilene, tricloroetilene, carbonio tetracloruro, cloro, dimetiltetraclorotereftalato, vinilcloruro, atrazina, propazina, simazina, pentacloronitrobenzene ed
è presente in numerosi pesticidi.
Infine i CB possono formarsi durante la disinfezione delle acque col
cloro e durante i processi di incenerimento dei rifiuti (Born et al.,
1989).
I CB sono in ogni caso uno dei maggiori e più frequenti gruppi di
monociclici aromatici sostituiti presenti nei fanghi (Wang and Jones,
49
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
1994b), il contenuto di CB può variare a seconda del tipo di fango, della provenienza e del trattamento subito, ma è sempre elevato nei fanghi industriali (Wang and Jones, 1994b).
2.1 Suoli
Nel terreno sono riportate concentrazioni medie di HCB pari a 0.01
ppm, con un range da 0 a 0.44 ppm (Howard, 1989), mentre in lavori
italiani sono state individuate concentrazioni di 40 ppb; in suoli americani si sono rilevate quantità fino a 55 µg/g (Howard, 1989).
2.2 Fanghi
Concentrazioni di CB nei fanghi sono riportate in tabella 2.1 (Rogers
et al., 1989; Jacobs et al., 1987)
In generale, sebbene le concentrazioni varino a seconda della fonte,
del tipo di fango e del trattamento, i fanghi provenienti da aeree industriali presentano le maggiori concentrazioni (Wang and Jones,
1991). Da questi dati risulta, inoltre, che la concentrazione tende a diminuire all’aumentare del numero di Cl nelle molecole, eccetto che
per HCB.
I composti più abbondanti sono DCB e TCB. Per quanto riguarda le
variazioni nel tempo è qui riportato uno studio sull’impiego agricolo
a lungo termine di 40 fanghi anaerobici conservati derivanti da un
unico impianto di Londra dove si producono fanghi da acque reflue
sia industriali che urbane, nel periodo dal 1942 al 1961, (Wang et al.,
1992). Nei fanghi, in quanto conservati, è possibile ci siano state delle
perdite, anche se non sostanziali. I fanghi utilizzati hanno una media
di S.O. del 42% con un range dal 26 al 49.8%, dato importante perché
in grado di influenzare l’efficienza di estrazione (tabella 2.2).
50
Capitolo 2 CLORO - BENZENI
51
LA TOSSICITÀ D E IF A N G H ID I
52
DEPURAZIONE
Capitolo 2 CLORO - BENZENI
53
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
La media dei CB nel fango era pari a 43.7 ppb (da 7.9 a 219 ppb). I
più abbondanti erano 1,4 diclorobenzene, 1,3-diclorobenzene, HCB e
1,2,4-TCB. Le concentrazioni generalmente diminuiscono con l’aumento dei gruppi clorurati, anche se HCB e PeCB hanno concentrazioni rilevanti (Wang et al., 1992; Wang and Jones, 1991).
Dalla tabella 2.2, sopra riportata, si può notare l’aumento di 1,4-DCB
e HCB nei fanghi nel periodo dal ’42 al ’61 che riflette l’incremento
d’uso di questi composti, mentre gli altri composti crescevano solo
dal ’54 in avanti. È difficile distinguere le varie fonti dei CB, ma dai risultati ottenuti si può dedurre che il loro contenuto nei fanghi attuali
è più alto di quello dei campioni conservati (Wang et al., 1992).
La concentrazione dei CB nei fanghi viene riportata in tabella 3
(ppb):
Composto
MCB
1,3 -DCB
1,4 -DCB
1,2 -DCB
1,3,5 -TCB
1,2,4 -TCB
1,2,3 -TCB
1,2,3,5 -TeCB
1,2,4,5 -TeCB
1,2,3,4 -TeCB
PeCB
HCB
ΣCBs
Frequenza (%)
Range
( g/kg)
Mediana
( g/kg)
Media a
( g/kg)
0
57.5
100
52.5
70.0
90.0
20.0
0
47.5
92.5
100
100
<5000
<2-86.1
4.11-50.6
<2-61.9
<0.3-3.14
<0.5- 9.36
<0.3-0.85
<0.1
<0.1-1.74
<0.1-6.32
0.08-2.36
0.72-6.89
7.90-219
<5000
2.44
19.3
2.73
0.50
1.13
<0.3
<0.1
<0.1
0.23
0.54
3.00
32.5
<5000
7.45 b - 8.30 c
21.1
7.52 b - 8.47 c
0.70 b-0. 79 c
1.56 b-1.61c
0.09 b- 0.33 c
<0.1
0.26 b- 0.31 c
1.32 b- 1.33 c
0.63
3.08
43.7 b
a) I valori non rilevati sono stati definiti separatamente:come zero b) o limiti d'analisi c).
Tabella 2.3 - Frequenza, range, mediana e media di concentrazioni
di Clorobenzeni nei fanghi (Rogers et al., 1989; Jacobs et al., 1987 ).
In tabella 2.4 (Rogers et al., 1989; Jacobs et al.,1987) vengono invece
riportate le concentrazioni di CB in 2 fanghi di diversa origine, l’effluente industriale (fango 2) mostra delle concentrazioni maggiori rispetto a quelle urbane (fango 1) (US EPA, 1986; Rogers et al., 1989; Jones and Wild, 1991; Wang and Jones, 1991) che restano tuttavia una
fonte importante di immissione di CB nell’ambiente. I composti bi sostituiti sono i più abbondanti: 1,4 diclorobenzene è il composto pre-
54
Capitolo 2 CLORO - BENZENI
sente a concentrazione più elevata nel fango 1; dato confermato anche
da altre analisi su fanghi domestici (in quanto usato come insetticida
repellente e deodorante), mentre 1,2 e 1,3 diclorobenzene sono più comunemente presenti ed in quantità maggiori, nei fanghi industriali
(Wang and Jones, 1991).
Il fango n.1 è normalmente applicato in agricoltura e, sebbene c’è
chi sostenga che i CB nei fanghi non rappresentino un rischio per il sistema suolo-pianta (Rogers et al., 1989), ci sono limitate informazioni
in proposito (Topp et al., 1989; Scheunert and Korte, 1986; Topp et al.,
1986).
Composto
Fango 1 (municipale n. 4)
media
% C.V.
Fango 2 (misto n.3)
media
% C.V.
CB
1,3 -DCB
1,4 -DCB
1,2 -DCB
1,3,5 -TCB
1,2,4 -TCB
1,2,3 -TCB
1,2,3 ,5 -TeCB
1,2,4,5 -TeCB
1,2,3,4 -TeCB
PeCB
HCB
ΣCBs
<10000
6.94
1020
56.2
2.44
40.2
3.57
2.96
10.6
8.03
11.1
22.2
1180
<10000
333
957
2370
41.1
351
259
30.1
17.8
57.5
55.0
273
4740
13.9
5.01
10.4
9.38
10.0
7.42
9.34
5.12
7.95
5.35
1.53
8.14
2.56
5.89
5.59
2.42
6.68
1.67
0.05
3.12
4.30
1.44
1.62
4.46
Tabella 2.4 - Media delle concentrazioni ( g/kg) di Clorobenzene
e % di variazione in due tipi di fanghi (da Rogers et al.1989;
Jacobs et al., 1987).
I dati più recenti in merito alle concentrazioni dei CB presenti nei
fanghi sono stati rilevati da Wang e Jones (1994a) su 12 fanghi inglesi
(tabella 2.5).
55
LA TOSSICITÀ D E IF A N G H ID I
Composto
MCB
1,3 -DCB
1,4 -DCB
1,2 -DCB
1,3,5 -TCB
1,2,4 -TCB
1,2,3 -TCB
1,2,3 ,5 -TeCB
1,2,4,5 -TeCB
1,2,3,4 -TeCB
PeCB
HCB
ΣCB
ΣCB-MCB
DEPURAZIONE
Frequenza (%)
Range
( g/kg)
Mediana
( g/kg)
Media
( g/kg)
dev. st.
25
75
100
100
100
100
100
100
100
100
100
100
100
100
nd-1.92 E+5
nd-467
561-2320
71.3-4110
1.31-35.4
14.7-1070
2.355-484
0.43-101
2.19-38.2
0.22-45.4
2.16-37.3
8.03-90.6
795-1.93 E+5
795-7770
nd
30.0
1250
237
6.02
51.1
9.11
2.48
5.76
4.41
4.85
17.2
3250
1900
3.63 E+4
82.3
1310
877
10.2
264
107
13.0
11.4
11.0
9.80
26.1
3.90 E+4
2720
6.88 E+4
133
494
1320
10.4
363
188
28.5
11.6
15.0
10.8
23.9
6.82 E+4
2210
Nota: nd = al di sotto dei limiti analitici, è trattato come 0
Tabella 2.5 - Frequenza, range, mediana, media deviazione standard del contenuto di CB nei fanghi (Wang and Jones, 1994a).
I risultati di questa ricerca confermano la diminuzione dei CB all’aumento del numero dei Cl, in accordo con la letteratura, e la maggior preferenza di CB nei fanghi industriali rispetto a quelli urbani.
Negli ultimi è predominante 1,4 DCB (ascrivibile all’uso domestico di
cui abbiamo già detto), mentre nei fanghi industriali prevale 1,2 DCB
(usato come solvente e detergente in diversi processi produttivi).
2.3. Degradazione
I CB generalmente sono molto stabili chimicamente e affatto reattivi, l’idrossilazione si verifica solo ad elevate temperature e in condizioni alcaline; tutti i CB sono composti non ionici. All’ aumentare del
numero di atomi di Cl i valori di Kow e Koc, che indicano la lipofilia
dei composti organici, aumentano, mentre la solubilità dei CB diminuisce e così pure la pressione di vapore.
I cloro-benzeni presenti nelle acque reflue durante il trattamento
delle stesse, possono o evaporare nell’atmosfera, o essere biodegradati, o adsorbiti su particolati di sostanza organica (meccanismo di ri-
56
Capitolo 2 CLORO - BENZENI
mozione importante in quanto lipofili e idrofobi, Govind et al., 1991).
Possiamo dunque ipotizzare che questi composti siano destinati a
concentrarsi nei fanghi, che diventano perciò una fonte importante di
immissione di CB nell’ambiente.
I CB applicati al suolo con i fanghi possono subire diversi processi,
adsorbimento sui solidi, volatilizzazione, leaching, uptake da parte
delle piante, run-off, ingestione da parte degli animali.
I fenomeni di adsorbimento e deadsorbimento nel suolo possono influenzare il grado di volatilizzazione o di leaching e la disponibilità
dei suddetti composti per la degradazione biologica e chimica, o l’uptake da parte delle piante. I CB sono come abbiamo detto composti
non ionici quindi il loro assorbimento è basato su processi fisici che
coinvolgono le forze di Van der Vaals.
Nei suoli umidi con scarso contenuto d’argilla ed elevata S.O. l’adsorbimento è correlato alla S.O. (Koc). L’adsorbimento in genere aumenta con la lipofilia (Kow) anche se per composti molto lipofili (log
Kow >7) tende a diminuire. In suoli con elevato contenuto d’argilla e
poca S.O. diventano importanti nei meccanismi d’assorbimento le interazioni tra i composti organici e le componenti minerali del suolo.
In suoli con Foc (frazione del carbonio organico del suolo) <0.05 il
contributo dei minerali all’adsorbimento di DCB e TCB era significativo (Wang and Jones, 1994b).
In alcuni casi i CB possono addirittura rimanere legati al terreno in
frazioni non estraibili, che è tipico dei composti organici non-polari
(Wang and Jones, 1994b) e la percentuale di questi residui diminuisce
all’aumentare del numero di Cl.
Tutti i CB sono caratterizzati, ad eccezione di HCB, da un log Kow <
5.3, e quindi possono teoricamente entrare nella pianta, a differenza di
quei composti con Kow > 5.3 e Koc compreso tra 3 e 2.5 che non sono
disponibili in quanto fortemente adsorbiti e immobilizzati nel suolo.
Per quanto riguarda la volatilizzazione, secondo la letteratura i CB
hanno un elevato potenziale di volatilizzazione dal suolo (Hc/Kow
>2.4E-7 atm 1/mole a 25°C); quindi, in relazione all’impiego di fanghi
contenenti CB è evidente quanta parte abbiano le condizioni ambientali e le tecniche di applicazione.
Diversi studi testimoniano la volatilizzazione di CB dai laghi e dalle acque costiere; 5 CB sono stati identificati nei gas dei rifiuti solidi
urbani; DCB e 1,2,4-TCB si perdevano per volatilizzazione durante la
digestione anaerobica del fango (Wang and Jones, 1994b). In altri
esperimenti si è osservato come prevalesse la volatilizzazione di
57
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
1,2,4-TCB, PeCB e HCB nel sistema suolo-pianta (Wang and Jones,
1994b).
La volatilità diminuisce all’aumento del numero dei Cl (eccetto per
HCB) e all’aumento della S.O. del suolo, quindi in relazione all’applicazione dei fanghi le proprietà del suolo possono influenzare la volatilità dei CB.
In merito al leaching, secondo i modelli della letteratura, i CB sono
poco mobili (td> 100 gg) eccetto MCB (td=61 gg) che è moderatamente mobile; in ogni caso il leaching è influenzato dal suolo e dai fattori
ambientali. Tuttavia, a discapito dei modelli teorici, sono stati ritrovati DCB e TCB nelle acque di falda (Wang and Jones, 1994b). Probabilmente questi composti lipofili possono penetrare nel suolo in
profondità attraverso i pori più grandi, ipotesi da tenere in considerazione nell’applicazione dei fanghi, se il fango apportato è liquido. In
genere però i CB tendono ad adsorbirsi sui solidi del terreno, processo favorito anche dalla sostanza organica presente nei fanghi, o a volatilizzarsi nell’aria, in relazione alla tecnica di applicazione del fango al terreno.
In particolare HCB è molto persistente nell’ambiente data la sua stabilità chimica e resistenza alla biodegradazione.
HCB si associa fortemente al suolo in quanto il Log di Koc va da 4 a
5; non è suscettibile al leaching, ma può essere eluito nei terreni con
un basso contenuto di carbonio organico. L’emivita rilevata nel terreno è pari a 1.530 gg (Howard, 1989).
Nell’atmosfera la degradazione è lenta con formazione di radicali
idrossilici ed emivita di 2 anni, i radicali vengono comunque rimossi
dalle precipitazioni e dalle deposizioni atmosferiche.
L’1,2,4- TCB se immesso nel suolo tende ad adsorbirsi alla sostanza
organica e non risultano sensibili i fenomeni di lisciviazione
(Howard, 1989); in acqua tende ad adsorbirsi ai sedimenti e a bioconcentrarsi; non vi è idrolisi, ma solo una lenta degradazione da parte
dei microrganismi che possono ritardare l’intensità dell’evaporazione; nell’aria l’emivita risulta di 18.5 gg.
La maggior fonte di 1,2 DCB è costituita senza dubbio dall’uso di
solventi, da questi deriva infatti fino al 25% dell’immissione annuale
nell’atmosfera, quindi la volatilizzazione diventa un meccanismo importante di inquinamento (Howard, 1989).
58
Capitolo 2 CLORO - BENZENI
Nel suolo è moderatamente o fortemente adsorbito e può verificarsi lisciviazione; viene infine degradato nel terreno in condizioni aerobiche, anche se lentamente.
2.3.1. Biodegradazione
La biodegradazione dei CB è testimoniata in colture in vitro, suolo,
sedimenti e fanghi. Il meccanismo di degradazione principale è l’ossidazione che porta alla formazione dei composti aromatici idrossilati, seguita da apertura dell’anello.
Per quanto riguarda i processi anaerobi, la declorurazione riduttiva
svolta da microrganismi può essere un’attività cometabolica, oppure
un tipo particolare di respirazione anaerobica (Fetzner and Lingens,
1994; Holliger and Schraa, 1994) in cui i clorobenzeni vengono utilizzati come accettori di elettroni. La dealogenazione come nuova via
degradativa anaerobica dei composti aromatici alogenati è stata proposta da Suflita et al. (1982): i microrganismi provenienti da sedimenti di lago e fanghi di depurazione erano in grado di dealogenare in
anaerobiosi l’anello aromatico.
La dealogenazione avviene in anaerobiosi rigorosa e dipende dal tipo di alogeno e dalla sua posizione, ma non dal numero di atomi di
alogeno presenti sulla molecola di acido benzoico. Un consorzio metanigeno stabile fu ottenuto da fango ed era in grado di mineralizzare
diversi alobenzoati fino a CH 4 e CO 2. Suflita et al. (1983) studiarono
poi la cinetica della dealogenazione microbica degli alogenobenzoati,
in condizioni metanigene.
La declorurazione riduttiva dell’esaclorobenzene in fango di depurazione anaerobio fu studiata da Fathepure et al. (1988). L’esaclorobenzene (190 M) veniva trasformato in tri- e di-clorobenzene entro 3
settimane di incubazione. Il tasso giornaliero di declorurazione era di
13,6 mol/l. L’esaclorobenzene veniva degradato secondo due vie;
quella principale prevedeva i seguenti passaggi:
esaclorobenzene
pentaclorobenzene
1,2,3,5-tetraclorobenzene
1,3,5-triclorobenzene.
L’altra via metabolica prevedeva i seguenti passaggi:
esaclorobenzene
pentaclorobenzene
1,2,4,5-tetraclorobenzene
1,2,4-triclorobenzene.
Ramanand et al. (1993) per l’esacloro- e pentacloro-benzene identificarono invece in microcosmi di suolo in condizioni metanigene la
seguente via metabolica:
59
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
1,2,3,4-tetraclorobenzene
1,2,3-triclorobenzene + 1,2,4-triclorobenzene
1,2-diclorobenzene + 1,4-diclorobenzene
clorobenzene.
Da tale ricerca risultò che sono presenti nel suolo microrganismi in
grado di rimuovere atomi di cloro nelle posizioni orto, meta e para.
Holliger et al. (1992) selezionarono delle colture, da colonne di percolamento, in grado di svolgere una declorurazione riduttiva dell’esaclorobenzene, del pentaclorobenzene, dei tre isomeri del tetraclorobenzene, del 1,2,3-triclorobenzene e del 1,2,4-triclorobenzene. Per
svolgere tale declorurazione furono utilizzati come donatori di elettroni lattato, glucosio, etanolo e isopropanolo.
Gantzer and Wackett (1991) studiarono la declorurazione riduttiva
catalizzata da coenzimi batterici contenenti metalli di transizione. I
coenzimi che possiedono metalli di transizione, quali la vitamina Bl2
(Co), il coenzima F 430 (Ni) e l’ematina (Fe), catalizzavano la declorurazione riduttiva dei benzeni policlorurati. Si notò un comportamento
costante: la velocità di declorurazione diminuiva con il decrescere del
numero di atomi di cloro. ln queste reazioni appariva una regio- e stereo-specificità. In base ai risultati, si ipotizzò che i citati coenzimi potessero avere un ruolo importante nella declorurazione dei composti
policlorurati in ambienti naturali e ingegnerizzati.
Un ulteriore studio sulla declorurazione riduttiva dell’esaclorobenzene catalizzata dalla vitamina B12 è stato svolto da Assaf-Anid et al.
(1992). L’esaclorobenzene veniva declorurato in un “aqueous biomimetic model system” contenente vitamina B 12. L’esaclorobenzene veniva declorurato a pentaclorobenzene ed una miscela di 1,2,4,5- e
1,2,3,5-tetraclorobenzene.
Non vi sono molte conoscenze sulla possibilità di trasformazione
dei clorobenzeni in condizioni denitrificanti. Bouwer and McCarty
(1983) studiarono la biotrasformazione dei composti clorurati a basse
concentrazioni in condizioni di denitrificazione. Nessuno dei composti aromatici mostrava di essere stato utilizzato, a concentrazioni
comprese fra 41 e 114 µg/l, dopo 11 settimane di incubazione.
Per quanto riguarda invece la condizione di aerobiosi, nell’ambito
di una vasta ricerca sulla biodegradabilità di inquinanti organici Tabak et al. (1981) studiarono anche la biodegradazione aerobia dei clorobenzeni. La capacità degradativa era seguita mediante rilevazione
di BOD, TOC, DOC, accompagnata da analisi gascromatografiche.
Furono studiati i seguenti clorobenzeni: clorobenzene, i tre isomeri
dei diclorobenzeni, 1,2,4-triclorobenzene ed esaclorobenzene. Gli ino-
60
Capitolo 2 CLORO - BENZENI
culi di partenza provenivano da rifiuti urbani. I benzeni policlorurati
inizialmente mostravano di subire una significativa attività biossidativa con graduale adattamento. L’esaclorobenzene si dimostrò resistente all’attacco da parte dei microrganismi in colture stazionarie. Il
miglior risultato fu quello con clorobenzene alla concentrazione di 5
mg/l: il composto spariva nel giro di 2-3 settimane di incubazione.
Con tale ricerca si poté concludere che più il benzene è alogenato,
maggiore è la resistenza all’attacco microbico in aerobiosi.
Vi sono inoltre degli studi svolti solo su singoli composti, come per
esempio la ricerca di Nishino et al. (1992) che è focalizzata sulla degradazione del clorobenzene. Furono isolati dei batteri da falda acquifera
e suoli contaminati, in grado di degradare il clorobenzene. Tali batteri
mineralizzavano il 54% del clorobenzene in 7 giorni. In tale ricerca furono anche studiate le diverse vie metaboliche di degradazione. Uno
dei ceppi fu anche in grado di degradare il p-diclorobenzene.
La biodegradazione di 1,2,3- e 1,2,4-triclorobenzene nel suolo fu investigata da Marinucci and Bartha (1979). A 20°C, l’1,2,4-triclorobenzene fu mineralizzato in 20 g di suolo ad una velocità di circa 1 nmoli/giorno e l’1,2,3-triclorobenzene fu mineralizzato ad una velocità di
circa la metà. Fertilizzanti minerali o cosubstrati non favorirono l’aumento della velocità di mineralizzazione del triclorobenzene. Le condizioni anaerobiche avevano un effetto negativo sulla mineralizzazione, mentre un aumento di temperatura aveva un effetto positivo.
In colture di arricchimento, l’aggiunta di glucosio e benzene causava
una stimolazione della mineralizzazione dell’1,2,4-triclorobenzene. Si
notò che nei suoli incubati con 1,2,3-triclorobenzene si poteva rinvenire 3,4,5-triclorofenolo, 2,6-diclorofenolo e 2,3-diclorofenolo, mentre
nei terreni trattati con 1,2,4-triclorobenzene erano poi presenti 2,4-,
2,5- e 3,4-diclorofenolo.
Feidieker et al. (1994) condussero un’ampia valutazione microbiologica e chimica di un sito contaminato da composti aromatici clorurati. Gli esperimenti di degradazione con colture miste mostravano
la degradazione aerobica di monoclorobenzene, 1,3- e 1,4-diclorobenzene, 1,2,4-triclorobenzene, 1,2,3,4- e 1,2,4,5-tetraclorobenzene,
mentre l’1,2-diclorobenzene e l’1,3,5-triclorobenzene non venivano
trasformati.
Esperimenti con colonne di suolo, finalizzati allo studio della biodegradazione di composti alogenati in condizioni reali, furono svolti
da Van der Meer et al. (1992). Lo scopo era di studiare i processi degradativi in siti dove erano avvenute infiltrazioni di acqua. I composti
61
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
con un numero elevato di atomi di cloro venivano trasformati preferibilmente in anaerobiosi.
Bouwer and McCarty (1982) confrontarono la rimozione dei clorobenzeni in colonne con crescita batterica, in presenza e non di carbone
attivo in granuli. Parecchi clorobenzeni erano biodegradati in entrambi i tipi di colonna; con l’utilizzo di marcatura radioattiva si poté
constatare che, in entrambe le colonne, la mineralizzazione era data
da meccanismi biologici. I medesimi autori (1985) studiarono inoltre
la biotrasformazione di tracce di clorobenzene in biofilm supportati
su acetato in condizioni aerobiche.
Gli studi sulla degradazione dei clorobenzeni da parte di colture
pure hanno principalmente utilizzato ceppi di Alcaligenes e P s e u d o monas. La degradazione del 1,4-diclorobenzene da parte di A l c a l i g e nes sp. ceppo A175 fu studiata da Schraa et al. (1986). Il microrganismo fu isolato da una coltura di arricchimento nella quale l’1,4-diclorobenzene fungeva da unica fonte di carbonio ed energia. Durante la crescita con 1,4-diclorobenzene in coltura pura, fu rilasciato il
cloro in quantità stechiometrica. Gli autori ipotizzarono che delle
diossigenasi fossero coinvolte nei passaggi iniziali della degradazione dei composti mentre la rottura dell’anello procedeva in posizione orto.
De Bont et al. (1986) isolarono da una miscela di campioni di suolo e
acqua un ceppo, da ascrivere al genere Alcaligenes, in grado di utilizzare 1,3-diclorobenzene come unica fonte di carbonio ed energia; anche in tale studio si notò il rilascio stechiometrico di cloro. Gibson et
al. (1968) notarono che Pseudomonas putida era in grado, utilizzando
toluene come unica fonte di carbonio, di ossidare i clorobenzeni a 3clorocatecolo.
Haigler et al. (1988) isolarono un ceppo di Pseudomonas in grado di
utilizzare 1,2-diclorobenzene o monoclorobenzene. Tale ceppo proveniva da fanghi attivi. Haigler et al. (1992) studiarono inoltre la
eventuale biodegradazione di una miscela da parte di Pseudomonas sp.
ceppo JS150. Tale ceppo era in grado di degradare in coltura continua
miscele di clorobenzene, benzene, toluene, naftalene, tricloroetilene e
1,2- e 1,4-diclorobenzene.
Due ceppi di Pseudomonas sono stati isolati da Sander et al. (1991).
Le colture di arricchimento provenivano da campioni di suolo di un
deposito di rifiuti industriali. Tali ceppi erano in grado di utilizzare
clorobenzeni come unica fonte di carbonio ed energia. Uno dei due
ceppi cresceva su monoclorobenzene, su tutti e tre gli isomeri di di-
62
Capitolo 2 CLORO - BENZENI
clorobenzene e sul 1,2,4-triclorobenzene, mentre l’altro ceppo utilizzava anche l’1,2,4,5-tetraclorobenzene. Durante la crescita su clorobenzeni entrambi i ceppi rilasciavano ioni cloro in quantità stechiometrica.
Un lavoro su Pseudomonas è stato svolto anche da Spain and Nishino
(1987). Il microrganismo era in grado di degradare l’1,4-diclorobenzene e venne selezionato da fanghi attivi; utilizzava anche il clorobenzene ed il benzene. Un batterio capace di utilizzare clorobenzene
fu isolato da Reineke and Knackmuss (1984) con colture di arricchimento provenienti da campioni di suolo e fango. La degradazione del
clorobenzene era via 3-cloro-cis-1,2-diidrossicicloesa-3,5-diene, 3-clorocatecolo, 2-cloro-cis,cis-muconato, trans-4-carbossimetilenbut-2-en4-olide, maleil-acetato e 3-ossiadipato.
Pettigrew et al. (1991) trovarono che il ceppo di Pseudomonas JS6 poteva biodegradare simultaneamente il clorobenzene ed il toluene.
Questo è degno di nota poichè in passato si era sempre verificata incompatibilità fra i due processi. Stevens et al. (1988) isolarono DCB-1,
unico microrganismo desulfuricante in grado di dealogenare i clorobenzoati. Questo fu il primo microrganismo riconosciuto in grado di
compiere la dealogenazione riduttiva come respirazione anaerobica.
Biodegradazione nella depurazione e nei fanghi
La completa degradazione dell’esaclorobenzene e di altri composti
policlorurati in un reattore a due fasi con biofilm fu studiata da Fathepure and Vogel (1991). Il primo stadio era anaerobico, mentre il secondo era aerobico. Alla fine dei due processi l’esaclorobenzene risultò trasformato per il 94%. Robertson (1994) osservò che in una vasca settica domestica erano necessari 7 giorni perché iniziasse la degradazione biologica del diclorobenzene.
Alcuni studi hanno mostrato come HCB potesse essere degradato
nei fanghi a PeCB, 1,2,4,5-TeCB, 1,2,4-TCB e poi gradualmente a DCB
in condizioni anaerobiche.
Il comportamento di 1,3 -, 1,4 - e 1,2-DCB, nonché 1,3,5-, 1,2,4- e
1,2,3 -TCB, è stato osservato durante la digestione anaerobica del fango (Kirk et al.,1989); 1,2,3,4- e 1,2,4,5- tetraclorobenzene venivano rimossi in 32 gg di incubazione, andando dal 25% di rimozione per il
1,3,5- TCB all’80% dell’1,4 DCB; la biodegradazione si osservava soprattutto per 1,3 e 1,4 DCB e 1,2,4- e 1,2,3- TCB .
In acque reflue sono state rilevate percentuali di biodegradazione
da parte di microrganismi del 20-50-70% , per concentrazioni da 5 a 10
63
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
ppm di 1,2,4-TCB . L’ossidazione di fanghi benzene-acclimatati conduce all’1% del COD teorico in 192 h (Howard, 1989).
Per il 1,2 DCB si è osservata una riduzione da 50 a 2-4 ppm in 7 gg
di incubazione utilizzando colture provenienti da fanghi urbani. In
un sistema a flusso continuo di fanghi attivi virtualmente è stato rimosso il 100% di 1,2 DCB (78% biodegradazione e 22% stripping)
(Howard, 1989).
I risultati sono comunque contradditori, infatti da parte di altri studiosi non è stata rilevata la biodegradazione di HCB sia in fanghi attivi che nel terreno (Howard, 1989).
Sempre in fanghi si è osservata la mineralizzazione incompleta di
composti clorurati presenti ad alte concentrazioni e la conversione a
composti con un minor numero di atomi di cloro attraverso reazioni
di riduzione e declorurazione biologica, in relazione alla posizione
del cloro (Woods et al., 1989).
La degradazione di solventi aromatici clorurati e non clorurati è
stata osservata per studiare l’effetto dell’inoculo in suoli trattati con
liquami con conseguente degradazione di benzene, toluene, o-, m- e
p-xilene, clorobenzene, o-DCB e 1,3,5 - TCB. Senza inoculo la degradazione era lenta, l’aggiunta di fanghi attivi non stimolava affatto la
degradazione (Odenhuis, 1989).
In sintesi ci sono poche informazioni riguardo alla biodegradazione
dei CB nel suolo, si sa solo che è generalmente molto lenta: anche in
studi di laboratorio in sistemi suolo-pianta la quantità mineralizzata
e metabolizzata di 1,2,4-TCB, PeCB e HCB era molto piccola, circa
1/31, 1/47 e 1/350 delle quantità rispettivamente perse per volatilizzazione (Wang and Jones, 1994).
In conclusione la biodegradazione non è il principale destino dei CB
applicati al suolo, i CB a basso numero di Cl inoltre volatilizzano facilmente sebbene essi siano molto più degradabili dei composti ad alto numero di Cl. L’applicazione di fanghi al terreno in ogni caso aumenterà l’adsorbimento dei CB sui solidi, che di conseguenza riduce
la biodegradazione, ma la presenza di altre sostanze nei fanghi, quali
i detergenti, possono aumentare la solubilità e quindi la biodisponibilità dei CB nel terreno, mentre altri nutrienti possono stimolare l’attività microbica (Wang and Jones, 1994). Per ipotizzare l’effettiva biodegradazione dei CB si fa dunque riferimento alla tabella che segue
(tabella 2.6) che indica l’emivita dei CB constatata da vari autori in diverse sperimentazioni (Wang and Jones, 1994).
64
Capitolo 2 CLORO - BENZENI
Composto
Emivita (gg)
MCB
1,2-DCB
1,3-DCB
1,4-DCB
1,2,3-TCB
1,2,4-TCB
1,3,5-TCB
1,2,3,4-TeCB
1,2,3,5-TeCB
1,2,4,5-TeCB
PeCB
HCB
10.0
18.0
1.1
1.9
72.0
24.0
130.0
63.0
300.0
500.0
230.0
1400.0
Tabella 2.6 - Emivite di CB calcolate da
vari autori (gg) (Wang and Jones,1994b).
2.3.2. Degradazione abiotica
I CB, in genere, sono abbastanza resistenti all’idrolisi in particolare
HCB e 1,2 DCB appaiono stabili sia all’idrolisi che alla fotolisi e all’ossidazione (Howard, 1989), solo MCB, che assorbe a 290-310 nm, è
sensibile agli UV.
La riduzione fotolitica dei composti cloroaromatici nei corrispondenti composti senza cloro comunque è lenta e inefficiente se si utilizzano solo i raggi UV; è però possibile migliorare questo procedimento utilizzando un composto aromatico foto-catalizzatore. È stata osservata una fotoriduzione per 4-clorobifenili usando antracene come
sensibilizzatore, (anche se l’antracene non è il composto ideale assorbendo solo nel vicino UV), piuttosto che il pirene, che in 2 ore di irraggiamento porta a una riduzione del 5.4% di 4-clorobifenili, contro
il 2.4% senza l’utilizzo di questa molecola (Epling et al., 1991). In ta bella 2.7 sono riportate le percentuali di riduzione ottenute per diversi composti clorurati (Epling et al., 1991).
Generalmente i composti clorurati a più alto peso molecolare reagiscono più velocemente. Il pentaclorobenzene, infatti, è molto rapido
mentre la reazione del 4-clorobifenile è lenta. Anche altri autori dimostrano che la presenza delle ammine è necessaria come mediatore
per migliorare l’efficienza fotocatalitica di declorurazione (nel visibile) dei composti cloroaromatici (Epling et al., 1991).
65
LA TOSSICITÀ D E IF A N G H ID I
66
DEPURAZIONE
Capitolo 2 CLORO - BENZENI
2.4. Piante
Abbiamo già accennato nell’introduzione a 4 possibili modi di uptake di composti organici da parte delle piante, assorbimento radicale e fogliare, contaminazione esterna dei fusti, uptake e traslocazione nelle cellule di riserva degli olii. I primi due modi sono i più comuni e si è proprio osservato che l’assorbimento fogliare è del tutto
comparabile a quello radicale per i composti volatili e semivolatili,
quali i CB.
In generale l’assorbimento radicale è direttamente proporzionale a
Kow e inversamente proporzionale alla solubilità, ma la traslocazione dalle radici ai fusti è più efficiente per composti con valori di solubilità intermedi. Perciò i composti chimici molto lipofili tendono ad
accumularsi nelle radici e rimanere legati ai lipidi delle membrane e
alla parete cellulare.
La concentrazione nella pianta espressa come SCF (stem concentration factor) raggiunge il massimo quando log Kow è tra 1 e 2; per i
composti con log Kow> 0 SCF diminuisce se il Foc aumenta. Secondo
questa tesi i CB, che hanno tutti log Kow >3, dovrebbero avere una
traslocazione ridotta all’interno della pianta ed essere limitati dall’aumento di Foc del suolo, tuttavia si è osservato che i CB posssono
accumularsi nelle radici o anche assorbirsi alle pareti cellulari esterne
senza penetrare nelle radici, come i PCB. In ogni caso le piante possono assorbire solo i composti non adsorbiti dalla frazione solida del
suolo.
I composti organici possono raggiungere la superficie fogliare delle
piante attraverso diversi modi, diretta applicazione di pesticidi o applicazione di fango, depositi atmosferici, volatilizzazione dal suolo. A
livello fogliare invece possono legarsi ai componenti della cuticola o
essere traslocati nella pianta, o diffondersi attraverso gli stomi. Si può
concludere che i composti con elevata solubilità vengono trasportati
nella pianta attraverso il floema mentre i composti lipofili si adsorbono alle cere della cuticola.
Anche la volatilità (Hc) e l’emivita dei composti possono essere utili nell’individuare i composti potenzialmente assorbiti dalle piante,
composti con log Hc > -2.6 atm 1/mole, come tutti i CB, vengono assorbiti ma se l’emivita è < di 10 gg evaporano prima di poter entrare
nella pianta, come 1,2-DCB e 1,4-DCB.
67
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Diversi esperimenti riportano la presenza di CB nelle piante: residui
di HCB sono stati rilevati in piante di grano cresciute da semi trattati
o su suoli contaminati; per HCB, PeCB e 1,2,4-TCB si è osservata la
formazione di residui legati ai tessuti vegetali che diminuiva coll’aumento del numero di Cl. In un sistema suolo-pianta dove il suolo era
trattato col fango, si è notato che i CB presentavano un fattore di
bioaccumulo maggiore di 1 s.s. (Wang and Jones, 1994b).
In sperimentazioni italiane (Howard, 1989) sono state rilevate concentrazioni di HCB da 1 a 5 ppb (s.s.) in foglie e licheni di vari alberi
(pino, quercia, edera, castagno, ginepro, fragole).
Uno degli indicatori più usati nell’indagine degli inquinanti lipofili
ambientali è il Pinus sylvestris. In sperimentazioni triennali si verificò
l’aumento della concentrazione di alcuni composti aromatici (cfr. fi gura 1, Warman 1990). Le differenze rilevate erano di circa 10 volte tra
le aree esposte e non esposte per i composti a bassa volatilità, quali
epta e octo clorurati aromatici e tra 3 e 5 volte per i composti più volatili, come penta e esa clorurati bifenili.
Un confronto tra diversi composti inquinanti pone la tossicità dei
PCB planari tra le più alte, soprattutto per 3,3’, 4,4’, 5- penta CB, tra 19
e 640 pg/g di s.s. di aghi di pino (cfr. tabella 2.8, Warman, 1990).
Dati sperimentali recenti confermano come avvenga l’uptake di HCB
e clorobenzeni da parte della pianta. Per HCB non si è osservata alcuna traslocazione dalle radici ai fusti e viceversa (analogamente a
OCDD, altro composto indagato, presente tuttavia in concentrazioni
molto inferiori rispetto ad HCB), mentre per i CB l’uptake dominante è
quello fogliare. Le bioconcentrazioni sono riportate in tabella 2.9 (Schroll et al., 1994)
Campione
HCB
PCB
da DIN
PCB
planari
1:3
2:3
4:3
6:3
10:3
1700
3200
2900
3800
2600
4400
4900
1300
5400
2000
110
22
70
640
530
Somma
di
PnCDD
25
23
9.2
28
15
Somma Somma di TCDD
TCDD
di
HpCDF (Nordico) (Nordico)
HxCDD
eq
eq e TEQ
originati
dai PCB
63
40
15
65
53
83
81
13
48
30
19
15
6.7
20
20
25
19
9.3
130
120
Tabella 2.8 - Confronto tra le concentrazioni di alcuni composti inquinanti.
I risultati sono espressi i pg/ grammo di aghi di pino s.s. (da Warman, 1990).
68
Capitolo 2 CLORO - BENZENI
Composto
Specie
vegetale
Piante in suoli trattati
radici
HCB
OCDD
Clorobenzene
orzo
avena
mais
rapa
lattuga
carota
carota
lattuga
carota
ravanello
9.0
7.2
10.5
30.3
246
450
0.742
24.4
45.1
33.1
Piante in suoli non trattati
fusti
radici
fusti
26.0
26.7
20.8
26.4
27.7
168
0.085
40.9
90.6
40.3
nd
nd
nd
nd
nd
nd
nd
13.9
71.7
53.8
26.3
29.8
25.1
26.1
27.6
202
0.084
49.7
100.7
39.9
Tabella 2.9 - Fattori di bioconcentrazione di 14C in un sistema chiuso suolopianta 7 giorni dopo l'applicazione di composti organici marcati al terreno
(concentrazione nella pianta s.s./concentrazione nel suolo s.s.).
Si è pure osservato l’assorbimento radicale e fogliare di HCB da varie piante (orzo, avena, grano, rape, lattuga e carote), ma non la traslocazione, così come confermato da altri autori (Kampe, 1989).
Studi sullo spinacio indicano un assorbimento del 95% per HCB dopo 4 gg dal trattamento a 23°C (Koeniger et al., 1992).
L’assorbimento comunque risulta più alto per le carote e minore per
alcune monocotiledoni (Cfr. tabella 2.10, Schroll and Scheunert, 1991).
69
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
% HCB % HCB%
(foglie
radici
c o n t r o l l i ) (piante
test)
orzo
avena
mais
rapa
lattuga
carota
1.07
0.90
0.95
1.03
0.64
3.36
0.07
0.10
0.30
0.14
1.01
3.94
HCB
semi
(piante
test)
% HCB
foglie
(piante
test)
radici
(piante
test)
Bf s.f.
foglie
(piante
test)
Bf s.f.
foglie
(controlli)
0.06
0.09
0.46
-
1.13
0.77
1.24
1.30
0.62
3.07
0.8
0.9
0.8
3.2
13.7
31.6
2.8
2.2
1.4
1.3
1.2
21.8
3.0
3.6
1.7
1.3
1.1
24.3
Bf s.f.
Tabella 2.10 - Assorbimento e fattore di bioaccumulo di HCB marcato nelle
piante testate rispetto ai controlli (Schroll and Scheunert, 1991).
Infine, i dati riportati in letteratura sull’uptake di HCB da parte delle piante vengono illustrati nella tabella che segue (tabella 2.11).
In sintesi i CB nel suolo possono essere assorbiti dalle piante sia attraverso le radici sia attraverso le foglie a causa della loro lipofilia e
volatilità, soprattutto nei suoli sabbiosi con poca sostanza organica.
La traslocazione all’interno della pianta è molto modesta a causa della loro scarsa solubilità. Il bioacccumulo di CB con un basso numero
di Cl sarà difficile in quanto possono essere degradati o volatilizzati
nell’aria. Per quanto riguarda i CB apportati coi fanghi i dati sperimentali sono molto carenti, si può solo affermare che dal momento
che il fango aumenta la sostanza organica del suolo, aumenta la capacità di assorbimento del terreno e quella della frazione solida per
cui diminuisce la volatilizzazione e di conseguenza l’assorbimento radicale e quello fogliare.
70
Capitolo 2 CLORO - BENZENI
Pianta/tessuto
Carote/radice
carote/radice
ravanello/ radice
ravanello/radice
barbabietola/colletti
barbabietola/radice
patata/tubero
lattuga/cespo
lattuga/cespo
lattuga/cespo
spinaci/foglie
foraggio >5cm
stoppie
faraggi/radice
foraggio
Tipo
di
suolo
sabbiosolimoso
ConcentraRange
Curva a
Curva b
zione
nei tessuti
di
di
nel suolo della pianta assorbimento assorbimento
( g/g)
( g/g)
0.189-2.529
0.079-15.635
1.9 c
0.140-0.31 c
0.45 c
0.008 c
0.01 c
0.05 c
0.09 c
0.011-0.02 c
0.36 c
0.065 c
0.25 c
0.03
0.20
0.62
0.41-6.18
15.8
1.77
9.0
0.2
0.08
0.40
0.45
0.38
9.0
1.63
3.13
0.25
a- curva di assorbimento: y/x dove y = concentrazione nel tessuto vegetale (p.f.) e x = concentrazione nel suolo (p.s.).
b- assorbimento sul peso secco assumendo le seguenti percentuali di scarto: carote 88%; ravanello
95%; bietola da zucchero 87,3%; patate 80%; lattuga 96% e spinaci 92% (USDA, 1979)
c- il rapporto tra peso fresco e secco è ottenuto dividendo il fattore di assorbimento per 0.12
Tabella 2.11 - Assorbimento di Esaclorobenzene (HCB) da parte delle piante
(da US EPA, 1986).
2.5. Animali
La potenziale tossicità nei confronti degli animali di questi composti persistenti e non polari è soprattutto legata al rischio di ingestione.
È nota la tossicità del clorobenzene per pesci, altri organismi acquatici, e batteri.
Dai dati raccolti dall’USEPA viene riportata una tabella (tabella 2.12)
nella quale viene illustrato l’uptake di HCB da parte degli animali (US
EPA, 1986).
È stato constatato, inoltre, che la tossicità aumenta all’aumentare
delle sostituzioni col cloro (Hallenback and Flowers, 1992) e, parallelamente, la sua bioconcentrazione (Wang et al.,1992).
Sperimentazioni sui lombrichi riportano che i CB erano accumulati
rapidamente e raggiungevano il loro massimo entro due settimane.
71
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Il picco di BCF di CB per il lombrico andava da 0.3 per 1.2.4-TCB a 6.9
per HCB, ( da 0.12 per TeCB a 19.5 per HCB in altri studi) e la BCF aumentava coll’aumentare di Kow. Comunque i CB erano metabolizzati velocemente, con emivite di 5 gg, eccetto HCB (27 gg) (Wang and
Jones, 1994b).
Specie
tessuti
analizzati
pollo (broiler)
pollo (gallina)
pollo
scimmia
grasso
grasso
uova
grasso
scimmia m.
scimmia f.
grasso
vacca
pecora
pollo
n.r.
n.r.
n.r.
1
n.d.
n.r.
n.r.
6.6-9.2
11-13
21-38
4.5-6.5
6.6-23.7
grasso del latte
0.62
23.7
4.3
10.7
18.1
2.10
4.3-18.1
10.7
18.1
3.1-3.9
grasso corporeo
0.62
3.1
3.1
0.1
1.90
8.77
8.53
0.9
2.6-3.4
2.2-3.8
2.0-3.7
6.5
grasso corporeo
uova
uova
quaglia
giapponese
concentrazione concentrazione
curva a
negli alimenti nei tessuti
di
analizzati
assorbimento
( g/g s.s.)
fegato
cervello
fegato
1.0
10.0
100.0
0.02
0.08
0.7
7.0
0.02
0.08
0.7
7.0
10.0
100.0
5
5
1.0
1.4
68.9
56.0
7.5
7.5
650.0
0.7
5.0
29.0
0.2
0.3
2.0
15.0
20.0
140.0
6.9
8.6
7.5
7.5
6.5
35.0
87.5
7.1
4.1
10.0
3.8
2.9
2.1
2.0
1.4
1.4
1.7
0.2
0.3
0.4
0.3
AA
Connor, 1984
ibid.
ibid.
Rozman
et al., 1978
Fries
and Marrow,
1975
Booth and
McDowell, 1975
ibid.
EPA, 1980
EPA, 1980
segue
72
Capitolo 2 CLORO - BENZENI
Specie
topo
ratto
tessuti
analizzati
concentrazione concentrazione
curva a
negli alimenti
nei tessuti
di
analizzati
assorbimento
( g/g s.s.)
167.0
56.0
8.0
68.9
83.0
17.0
125.0
0.4
0.3
10.4
2.1
15.6
AA
ibid.
EPA, 1980
a - Il fattore di assorbimento è = y/x, dove y = alla concentrazione nei tessuti animali, e x = alla
concentrazione negli alimenti
Tabella 2.12 - Assorbimento di Esaclorobenzene (HCB) da parte di animali
domestici e non (US EPA, 1986).
Il bestiame può ingerire sostanze inquinanti dall’ingestione diretta
del terreno durante il pascolo o attraverso l’alimentazione col foraggio. Nelle pecore si è osservato che entra nella dieta l’1-2% di suolo,
percentuale che aumenta con la durata del pascolo e se non vengono
somministrati altri alimenti.
In USA giornalmente le vacche in lattazione hanno un intake di terreno di circa 1% che aumenta al 4% in quelle non in lattazione.
Nei maiali l’i n t a k e rilevato è di 2-8% di terreno (Wang and Jones,
1994).
In ogni caso i problemi derivanti dall’utilizzo di fanghi fluidi possono essere ovviati da iniezioni di fango sottosuperficiali.
Sperimentalmente si è potuto osservare che i CB tendono ad accumularsi nel grasso animale: in Germania, in una sperimentazione decennale su latte di vacca, (’74-’84) si verificò una diminuzione da 0.16
a 0.02 ppm nel grasso del latte; mentre in USA la media era di 0.001
ppm, e in Jugoslavia 1.31 ppb (Howard, 1989).
In Canada residui di HCB sono stati identificati nel grasso di latte
vaccino a livello di 0.002 ppm.
In Jugoslavia sono state riscontrate concentrazioni di 1,2 diclorobenzene pari a 2.6 ppb in campioni di latte commerciali (Howard, 1989).
Nella carne le concentrazioni dei CB variavano da 0.02 µg / k g
(1,2,3,4- TeCB) a 5 µg/kg (1,4- DCB) in Iugoslavia e a 12 µg/kg di HCB
in Giappone; mentre la concentrazione di HCB nei maiali era di 7
µg/kg (Wang and Jones, 1994b).
Infine, dai dati riportati in letteratura basati su carcinomi in ratti, il
potere cancerogeno dell’HCB è pari a 1,67 mg/kg. die (US EPA,
1986).
73
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Conclusioni
I clorobenzeni, classificati tra i maggiori inquinanti nella lista USEPA ed in quella CEE, ed ormai inquinanti ubiquitari, provengono
dai vari processi di produzione di composti chimici e dallo smaltimento industriale. La concentrazione media dei CB nei suoli è intorno a 40 ppb, mentre il contenuto nei fanghi varia da 1000 a 5000 ppb
a seconda della provenienza del fango stesso.
I clorobenzeni presenti nelle acque reflue durante il trattamento
delle stesse, in virtù delle loro caratteristiche chimiche, tendono a
concentrarsi nei fanghi, che diventano perciò una fonte importante di
immissione di CB nell’ambiente.
Questi composti, infatti, presentano una scarsa degradazione e, in
quanto lipofili ed idrofobi, possono adsorbirsi fortemente ai particolati di S.O. nel suolo, o bioconcentrarsi nei sedimenti nell’acqua, ma
il DCB è anche suscettibile di leaching.
Alcuni di questi xenobiotici presentano, inoltre, una elevata volatilità, soprattutto penta ed esa CB, che diventa quindi un importante
meccanismo di inquinamento.
L’assorbimento radicale e fogliare elevati e così pure la traslocazione, possono, infatti, essere fonte di contaminazione del foraggio e di
conseguenza degli animali.
Le dosi di applicazione dei fanghi in agricoltura vengono perciò stabilite attraverso una percentuale di rischio accettabile calcolata sul
potere cancerogeno di HCB (1,67 mg/kg.die).
74
Capitolo 2 CLORO - BENZENI
Bibliografia
ASSAF-ANID N., NIES L., V O G E L
T.M., (1992): Reductive dechlorination of
a polychlorinated biphenyl congener and
hexachlorobenzene by vitamin B 1 2. Appl.
Environ. Microbiol., 58, 1057.
DE BONT J. A. M., VORAGE M. J. A.
W., HARTMANS S., VAN DEN
TWELL W. J. J., (1986): Microbial degra dation of 1,3-dichlorobenzene. Appl. En viron. Microbiol., 52, 677.
BORN J.G.P., LOUW R., MULDER P.,
(1989): Formation of dibenzodioxins and
chlorobenzenes in fly ash catalyzed reac tions of monochlorophenols. Chemosphe re, 19, 1629-33.
EPLING G.A., WANG Q. , QIU Q .,
(1991): Efficient utilization of visible light
in the photoreduction of chloroaromatic
compounds. Chemosphere, 22, 959-962.
BOUWER E. J., McC A R T Y P. L.,
(1982): Removal of trace chlorinated orga nic compounds by activated carbon and
fixed-film bacteria. Environ. Sci. Tech nol., 16, 836.
BOUWER E. J., McC A R T Y P. L.,
(1983): Transformation of halogenated or ganic compouds under denitrification
conditions. Appl. Environ. Microbiol., 45,
1295.
BOUWER E. J., McC A R T Y P. L.,
(1985): Utilization rates of trace haloge nated organic compounds in acetategrown biofilms. Biotechnol. Bioeng., 27,
1564.
FATHEPURE B. Z., TIEDJE J. M.,
BOYD S. A., (1988): Reductive dechlori nation of hexachlorobenzene to tri- and di chlorobenzenes in anaerobic sewage slud ge. Appl. Environ. Microbiol., 54, 327.
FATHEPURE B. Z., VOGEL T. M.,
(1991): Complete degradation of polychlo rinated hydrocarbons by a two-stage bio film reactor. Appl. Environ. Microbiol.,
57, 3418.
FEIDIEKER D., KÄMPFER P., D O T T
W., (1994): Microbiological and chemical
evaluation of a site contaminated with
chlorinated aromatic compounds and
hexachlorocyclohexanes. FEMS Micro biol. Ecol., 15, 265.
75
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
FETZNER S., LINGENS F., (1994):
Bacterial dehalogenases: biochemistry, ge netics, and biotechnological applications.
Microbiol. Rev., 58, 641.
GANTZER C. J., WACKETT L. P.,
(1991): Reductive dechlorination cataly zed by bacterial transition-metal coenzy mes. Environ. Sci. Technol., 25, 715.
GIBSON D. T., KOCH J. R., SCHULD
C. L., KALLIO R. E., (1968): Oxidative
degradation of aromatic hydrocarbons by
microorganisms. II. Metabolism of halo genated aromatic hydrocarbons. Bioche mistry, 7, 3795.
GOVIND R., P.A. FLHAHERTY, R.A.
DOBBS, (1991): Fate and effects of semi volatile organic pollutants during anaero bic digestion of sludge. Water Res. , 25,
547-556.
HAIGLER B. E., NISHINO S. F., SPAIN
J. C., (1988): Degradation of 1,2-dichloro benzene by a Pseudomonas sp. Appl. En viron. Microbiol. , 54, 294.
1,2,3-trichlorobenzene to 1,3-dichloroben zene. Appl. Environ. Microbiol., 58, 1636.
HOWARD P.H., (1989): Handbook of
Environmental Fate and Exposure Data
for organic chemicals, V o l . I , Large pro duction and Priority Pollutants. L e w i s
Pub., Michigan USA.
JACOBS L.W., O'CONNOR G . A .,
OVERCASH M . A ., ZABIK M . J ., RYGIEWICZ P., (1987): Effects of trace or ganics in sewage sludges on soil-plant sy stems and assessing their risk to humans.
In: A.L. Page, T.J. Logan and J.A. Ryan
(Eds), Land application if sludge-food
chain implications. Lewis Pub. Michigan, USA, 101-143.
JONES K.C., WILD S.R., (1991): Orga nic chemicals entering agricultural soils
in sewage sludges: screening for their po tential to transfer to crop plants and live stock. Foundation for Water Research,
Medmenham, UK.
HAIGLER B. E., PETTIGREW A. C.,
SPAIN J. C., (1992): Biodegradation of
mixtures of substituted benzenes by
Pseudomonas sp. s train JS150. Appl.
Environ. Microbiol., 58, 2237.
KAMPE W., (1989): Organic substances
in soils and plants after intensive applica tions of sewage sludge. In: Sewage sludge
treatment and use. Comm. of the Europ.
Communities, edited by A.H.
Dirkzwager and P. L'Hermite. Elsevier Applied Science.
HOLLIGER C., SCHRAA G., (1994):
Physiological meaning and potential for
application of reductive dechlorination by
anaerobic bacteria. FEMS M i c r o b i o l .
Rev., 15, 297.
KIRK P.W.W., ROGERS H.R. , LESTER J.N., (1989): The fate of chloroben zene and permethrins during anaerobic
sewage sludge digestion. Chemosphere,
18, 1771-1784.
HOLLIGER C., SCHRAA G., S T A M S
A. J. M., ZEHNDER A. J. B., (1992): En richment and properties of an anaerobic
mixed culture reductively dechlorinating
KOENIGER M., HAHN M., ZIEGLER
W., WALLNOEFER P.R., (1992): Uptake
of chlorinated hydrocarbons by plants surfa ces. Chemical abstracts, 116, n. 250125r.
76
Capitolo 2 CLORO - BENZENI
MARINUCCI A. C., BARTHA R.,
(1979): Biodegradation of 1,2,3- and 1,2,4trichlorobenzene in soil and liquid enrich ment culture. Appl. Environ. Microbiol.,
38, 811.
ROBERTSON W. D., (1994): C h e m i c a l
fate and transport in a domestic septic sy stem: site description and attenuation of
dichlorobenzene. Environ. Toxicol.
Chem., 13, 183.
MUGANLINSKII F.F., S A N D L E R
V.L., KAKHRAMANOV V.B., GUSEINOVA D.D., (1990): Possibilities of acti vation of the reaction of chlorobenzenes
with potassium phenolate. J. Appl. Chem.
USSR, 63, 854-856.
ROGERS H.R., CAMPBELL J . A .,
CRATHORNE B., DOBBS A.J., (1989):
The occurence of chlorobenzenes and per methrins in twelve U.K. Sewage sludges.
Water research, 23, 913-921.
NISHINO S. F., SPAIN J. C., BELCHER
L. A., LITCHFIELD C. D., (1992): Chlo robenzene degradation by bacteria isolated
from contaminated groundwater. Appl.
Environ. Microbiol., 58, 1719.
SANDER P., WITTICH R. M., F O R TNAGEL P., WILKES H., F R A N C K E
W., (1991): Degradation of 1,2,4-trichlo ro- and 1,2,4,5-tetrachlorobenzene by
Pseudomonas strains. Appl. Environ.
Microbiol., 57, 1430.
ODENHUIS, R.L., KUIJK L., L A MMERS A., JANSSEN D.B, W I T H O L T
B., (1989): Degradation of chlorinated
and non chlorinated aromatic solvents in
soil suspensions by pure bacterial cultu res. Applied Microbiol. and Biotechnol.,
30 (2), 211-217.
SCHEUNERT I., KORTE F., (1986):
Comparative laboratory and outdoor stu dies on the behaviour of 1 4C-labeled chlori nated benzenes in soil. In: Contaminated
S o i l. Assink J.K., and Van Dan Brink
W.J. Eds., 141-143 Martinus-Nigheff
Pub., Boston, USA.
PETTIGREW C. A., HAIGLER B. E.,
SPAIN J. C., (1991): Simultaneous biode gradation of chlorobenzene and toluene by
a Pseudomonas strain. Appl. Environ.
Microbiol., 57, 157.
SCHRAA G., BOONE M. L., J E T T E N
M. S. M., VAN NEERVEN A. R. W.,
COLBERG P. J., ZEHNDER A. J. B.,
(1986): Degradation of 1,4-dichlorobenze ne by Alcaligenes sp. strain A175. Appl.
Environ. Microbiol., 52, 1374.
RAMANAND K., BALBA M. T.,
DUFFY J., (1993): Reductive dehalogena tion of chlorinated benzenes and toluenes
under methanogenic conditions. Appl.
Environ. Microbiol., 59, 3266.
REINEKE W., KNACKMUSS H. J.,
(1984): Microbial metabolism of haloaro matics: isolation and properties of a chlo robenzene-degrading bacterium. Appl.
Environ. Microbiol., 47, 395.
SCHROLL R., SCHEUNERT I., (1991):
A laboratory system to determine separa tely the uptake of organic chemicals from
soil by plants roots and by leaves after va porization. Chemosphere, 97-108.
SCHROLL R., BIERLING B., CAO G.,
DORFLER U., LAHANIATI M., LANGENBACH T ., SCHEUNERT I .,
WINKLER R., (1994): Uptake patways of
77
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
organic chemicals from soil by agricultu ral plants. Chemosphere , 28, n. 2, 297303.
SPAIN J. C., NISHINO S. F., (1987):
Degradation of 1,4-dichlorobenzene by a
Pseudomonas sp. Appl. Environ. Micro biol., 53, 1010.
STEVENS T. O., LINKFIELD T. G.,
TIEDJE J. M., (1988): Physiological cha racterization of strain DCB-1, a unique
dehalogenating sulfidogenic bacterium.
Appl. Environ. Microbiol., 54, 2938.
SUFLITA J. M., HOROWITZ A . ,
SHELTON D. R., TIEDJE J. M., (1982):
Dehalogenation: a novel pathway for the
anaerobic biodegradation of haloaromatic
compounds. Science, 218, 1115.
SUFLITA J. M., ROBINSON J. A.,
TIEDJE J.M., (1983): Kinetics of micro bial dehalogenation of haloaromatic sub strates in methanogenic environments.
Appl. Environ. Microbiol., 45, 1466.
US EPA, (1985): Health Assessment Do cument for Chlorinated Benzenes.
US EPA, (1986): Land Application and
Distribution and marketing of sewage
sludge. Technical Support Document.
VAN DER MEER J. R., BOSMA T. N.
P., DE BRUIN W. P., HARMS H . ,
HOLLIGER C., RIJNAARTS H. H. M.,
TROS M. E., SCHRAA G., ZEHNDER
A. J. B., (1992): Versatility of soil column
experiments to study biodegradation of
halogenated compound under environ mental conditions. Biodegradation, 3,
265.
WANG M.J., JONES K.C., (1994a): The
chlorobenzene content of contemporary
UK sewage sludges. Chemosphere, 2 8 ,
n.6, 1201-1210.
WANG M.J., JONES K.C., (1994b):
Behaviour and fate of CBs introduced into
soil-plant systems by sewage sludge appli cation: a review. Chemosphere, 28, n.7,
1325-1360.
TABAK H. H., QUAVE S. A., MASHNI C. I., KE F., (1981): Biodegradability
studies with organic priority pollulant
compounds. J.Wat. Pollut. Control Fed,
53, 1503.
WANG M.J., JONES K. C., (1 9 9 1 ) :
Analysis of chlorobenzenes in sewage
sludge by capillary gas chromatography.
Chemosphere, 23, n.5, 677-691.
TOPP E., SCHEUNERT I. , KORTE
F ., (1989): Kinetics of uptake of 1 4C la belled chlorinated benzenes from soil by
plants. Ecotoxicol. Envir. Safety , 17,
157-166.
WANG M.J., MCGRATH S . P .,
JONES K. C., (1992): The chlorobenzene
content of archived sewage sludges. The
Science of the Total Environ., 121, 159175.
TOPP E., SCHEUNERT I., ATTAR A.,
KORTE F., (1986): Factors affecting the
uptake of 1 4C-labelled organic chemicals by
plants from soil. Ecotoxicol. Environ. Sa fety II , 219-228.
WARMAN K., (1990): Report on the
distribution of chlorinated aromatics
around a remote - located industrial si te. Chemosphere, 20, n.10/12, 15111516.
78
Capitolo 2 CLORO - BENZENI
WOODS S.L., FERGUSON J . F .,
BENJAMIN M . M ., (1989): Ch a r a c t e r i zation of chlorophenol and chloro -
methoxybenzene biodegradation during
anaerobic treatment. Environ. Sci. Tech nol., 23, n.1, 62-68.
79
Capitolo 3
Detergenti
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
LAB, LAS, NP, NPnEO
I LAS (alkil-benzen-solfonati lineari) derivati dalla solfonazione di
alchinbenzeni lineari (LAB), sono detergenti anionici commercializzati sotto forma di miscele contenenti omologhi alchilici (C10 - C15) e
fenil-isomeri, con una catena di lunghezza media di 12 atomi di C.
I LAS vengono usati comunemente nei prodotti per la pulizia, lavanderia, cosmetici, ecc.
Annualmente vengono impiegate circa 1.000.000 di tonnellate di LAS
e 470.000 t di LAE (alcoli lineari etossilati) sommando i consumi di
USA, Europa occidentale e Giappone (Struijs and Stoltenkamp, 1994).
Tra i più diffusi detergenti sintetici oltre ai LAS abbiamo gli alchil
Nome
Abbreviazione
Struttura
Detergenti non ionici
Nonylphenolpolyethoxylate
NPnEO n=3-20
Nonylphenoldiethoxylate
Nonylphenolmonoethoxylate
Nonylphenol
NP2EO n=2
NP1EO n=1
NP n=0
Nonylphenoxyethoxyaceticacid
NP2EC n=1
Nonylphenoxyaceticacid
NP1EC n=0
Detergenti anionici
Linearalkylbenzenesulphonate LAS
(Alkylchain with 8 to 15 carbon atoms)
Tabella 3.1 – LAS e NP.
fenoli polietossilati (APEO) e, molto utilizzati in Europa, sono gli
APEO con 9 atomi di carbonio (NPEO). Nella tabella 3.1 vengono riportata le formule di struttura di LAS e NP.
NP, NP1EO, NP2EO sono alcuni dei metaboliti di detergenti nonionici del tipo nonilfenolo polietossilati (NPnEO), detergenti ritrovabili nei fanghi in quantità ancora maggiori di quelle di iquinanti ambientali ubiquitari come i PCB, i PAH, ecc. Circa il 50% infatti di
82
Capitolo 3 DETERGENTI
NPnEO del refluo viene trasformato a NP e accumulato nel fango
(Brunner et al., 1988). È proprio in virtù di questa potenziale pericolosità del fango, in vista di un impiego agricolo, che risulta necessario
indagare sul destino degradativo di queste molecole.
3.1. Suoli
Concentrazioni medie di LAS in suoli trattati sono di 2-15 ppm
(Holt et al., 1989), mentre in suoli non recentemente trattati i livelli
scendono sotto 1 ppm (Topping and Waters, 1982). Una normale applicazione di fanghi può aumentare il contenuto di LAS del terreno da
7 a 16 ppm (Swischer, 1987).
In suoli trattati con fanghi le concentrazioni dei LAB erano minori di 5
ppb di s.s., mentre i LAS erano inferiori a 1 ppm con applicazioni di fango
contenenti 6 g/kg di LAS; in altri terreni si sono osservate concentrazioni
di LAS minori di 0.2-8.1 ppm (nella tabella 3.2, Holt and Bernstein, 1992).
n. parcella
LAS
analizzati
( g/g)
Applicazioni
di fango
Solidi totali
(kg/m2)
4
1.2
11
0.9
2.86
44
8.1
4.08
<0.2
2.00
6402
4.9
0.33
6553
3.7
2.39
6554
6.4
1.07
6554
0.8
1.53
140
11.3
Anni di trattamento
febbraio1974 7 novembre 1989 (12)
giugno 1979 7 novembre 1989 (9)
ottobre 1985 7 novembre 1989 (4)
maggio 1987 30 agosto 1989 (2)
maggio 1986 23 ottobre 1989 (4)
luglio 198623 ottobre1989 (3)
luglio198523 ottobre 1989 (3)
maggio 198523 ottobre 1989 (4)
Totale dei
LAS stimati
nei primi
20 cm ( g/g)
Rimozione
(%)
285
99.6
71.5
98.7
102
92.0
50
>99.6
8.4
41.6
59.8
93.6
26.8
76.3
38.3
98.0
Il primo mese indica l'ultima applicazione di fango e la data indica la data di campionamento.
Tabella 3.2 - Dati relativi alle concentrazioni dei LAS nei suoli trattati
con fanghi nel 1989 (da Holt and Bernstein, 1992).
83
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Altri livelli di LAS in suoli ammendati (in Germania e in Inghilterra) erano decisamente bassi, da 0.9 a 2.2 ppm (De Henau et al., 1986).
In suoli svizzeri trattati con fanghi, è stato riscontrato un contenuto molto inferiore a quello presente nel fango applicato; un esempio è
rappresentato da un suolo contenente 2 ppm di NP e 39 ppm di LAS,
valori che comunque suggeriscono una persistenza di questi composti nel suolo (cfr. figura 1 , McEvoy et al., 1987).
In Spagna le concentrazioni in suoli (coltivati a vigneti) ammendati
con fanghi andavano da 16.4 a 52.5 ppm subito dopo l’applicazione e
l’emivita variava da 26 a 33 giorni.
Figura 1 - Concentrazioni dei composti chimici pericolosi in fanghi stabilizzati
(mg/kg s.s.). LAS, NP, PCB, PAH, DI (dieldrin), Li (lindano),
DDE (1,1-bis-4 clorofenil-2,2 dicloroetilene), Cd (cadmio).
In suoli Svizzeri concentrazioni di 45 ppm diminuivano dopo i primi 10 giorni, con un emivita di 5 gg, mentre in altri suoli europei i valori oscillavano da 0.9 a 2.2 ppm. Un vasto studio inglese su suoli ammendati con fanghi rilevò contenuti di LAS da 0 a 2.5 ppm (presenti
in 42 suoli su 51 indagati). La concentrazione iniziale andava da 2.6 a
66.4 ppm e l’emivita era tra 7 e 22 gg (Mieure et al., 1990).
84
Capitolo 3 DETERGENTI
3.2 Acque
Da uno studio giapponese si rilevano concentrazioni di LAB nei fiumi di 37-721 ppb, nei sedimenti fluviali di 0-15.8 ppm, e nelle acque
reflue di 1970 ppb (in entrata) e 61 ppb (in uscita), mentre in Europa
negli effluenti degli impianti di trattamento delle acque si riscontrano
concentrazioni di 25-2200 ppb (Holt and Bernstein, 1992).
Indagini su suoli ad elevato e permanente grado di umidità hanno
mostrato un assorbimento di 5 kg di LAS e una rimozione di 20 kg all’anno, contro un’immissione di 35 kg (Kazuho Inaba, 1992).
Concentrazioni rilevate in acque provenienti da diversi impianti
oscillano da 36 a 202 ppb (Stephanou and Giger, 1982).
3.3 Fanghi
In genere si è constatato che questi composti finiscono negli impianti di trattamento per le acque reflue e vengono rimossi per il 95%
(Ward and Larson, 1989).
Altri autori riportano un’ efficienza di rimozione dei LAS dall’acqua reflua del 97- 99% e un residuo nei fanghi del 15-20% (Brunner et
al., 1988; De Henau et al., 1989), pari mediamente a 7 mg/g s.s.
Altri studi indicano che la concentrazione dei detergenti nei fanghi
può variare da 0.3 a 1.2% s.s.(McEvoy et al., 1987 ).
Le concentrazioni di LAS osservate nei fanghi anaerobici vanno da
9.3 a 18.8 ppm, mentre i LAB variano da 116 a 338 ppm s.s. (cfr. tabel la 3.3 e 3.4), anche se altri autori riportano valori di 17-430 ppm di s.s.
(Holt and Bernstein, 1992).
In fanghi attivi si rilevano valori di LAS da 62 a 98 ppm e di LAB da
58 a 78 ppm di s.s. Il rapporto LAS:LAB nei fanghi anaerobici varia da
60:1 a 100:1, ma nei fanghi attivi è di 1:1 (Holt and Bernstein, 1992).
Fanghi di impianti svizzeri contenenti circa 4 ppm di LAS e 1 ppm
di NP vengono normalmente applicati su suoli agrari (cfr. tabella 3.5,
Brunner et al., 1988).
Nella tabella che segue sono riportate le quantità di LAS individuate nei fanghi da altri autori (tabella 3.6, McEvoy et al., 1987). Le concentrazioni totali dei LAS andavano da 2.9 a 11.9 g /kg di s.s. (McE-
85
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
voy et al., 1987), valori piuttosto alti confermati anche da altri studi,
in cui si afferma che i LAS possono formare fino al 5% della frazione
fulvica del fango, quindi la loro concentrazione risulta più elevata nei
terreni trattati coi fanghi (McEvoy et al., 1987).
I valori di NP, invece, ed anche la tossicità corrispondente, sono inferiori rispetto ai LAS, il dato medio più rilevante è stato osservato in
un fango anaerobico stabilizzato: 1 g/kg (McEvoy et al., 1987).
Fango
Affluente
di Ashford
Fango digerito
di Ashford
Fango digerito
di Earlswood
(5 luglio 1989)
Fango digerito
di Earlswood
(30 agosto 1989)
Fango refluo di
Crawley
(30 agosto 1989)
Misto di
Earlswood
e Crawley
(13 maggio 1989)
Fango digerito
di Sittingbourne
Fango pressato
di Queenbourugh
Fango attivo
di Canterbury
(11 luglio 1989)
23 agosto 1989
26 settembre 1989
solidi (g/l)
LAB sui
LAB nei
LAB
solidi ( g / g ) liquidi ( g / g ) solidi:liquidi
LAB totale
(mg/l)
13.9
157.9
nd
nd
nd
21.2
169.5
nd
nd
nd
31.4
116.0
nd
nd
nd
31.9
251.0
94.9
84:1
8.10
30.9
206.0
59.3
107:1
6.43
36.8
155.0
38.5
148:1
5.74
29.6
387.9
nd
nd
nd
320.0
167.1
-
nd
nd
4.4
58.3
nd
nd
nd
2.8
4.8
77.2
77.8
nd
0
nd
-
nd
0.37
Tabella 3.3 - Concentrazioni di LAB nei fanghi (da Holt and Bernstein, 1992).
86
Capitolo 3 DETERGENTI
Fango
Affluente
di Ashford
Fango
digerito
di Ashford
Fango
digerito di
Earlswood
(5 luglio 1989)
Fango
digerito di
Earlswood
(30 agosto 1989)
Fango refluo di
Crawley
(30 agosto 1989)
Misto di
Earlswood
e Crawley (13
maggio 1989)
Fango
digerito di
Sittingbourne
Fango
pressato di
Queenbourugh
Fango attivo
di Canterbury
(11 luglio 1989)
23 agosto 1989
26 settembre 1989
solidi (g/l)
LAS sui
solidi ( g/g)
LAS nei
LAS
liquidi ( g/g) solidi: liquidi
LAS totale
(mg/l)
13.9
10.4
6.0
24:1
150.4
21.2
12.3
5.0
51:7
264.8
31.4
11.5
nd
nd
nd
31.9
18.8
6.1
98:1
604.2
30.9
18.1
9.4
59:1
568.7
36.8
10.3
6.5
58:1
386.7
29.6
nd
nd
nd
nd
320.0
9.3
nd
nd
nd
4.4
nd
nd
nd
nd
2.8
4.8
0.06
0.1
0.1
nd
1.5 :1
nd
0.28
nd
Tabella 3.4 - Concentrazioni di LAS nei fanghi (da Holt and Bernstein, 1992).
87
LA TOSSICITÀ D E IF A N G H ID I
Impianto
1
2
3
4
5
6
7
8
9
10*
11
12
13*
14*
15*
16
17
18
19
20
21
22
23
24
25
26*
27
28
29
DEPURAZIONE
Materiale
essiccato (%)
7.4
3.8
5.2
4.8
8.4
7.4
8.5
3.6
6.4
4.3
4.6
12.2
5.3
5.1
3.5
10.6
9.0
7.2
10.7
4.0
11.1
6.2
13.8
5.8
9.4
1.1
6.2
6.9
5.0
LAS
NP
(g/kg s.s.)
5.1
1.2
2.9
1.0
5.8
2.2
3.4
1.2
2.8
1.0
5.5
1.0
1.8
1.4
5.6
1.2
2.6
0.64
0.8
0.15
5.9
1.1
3.8
1.7
4.4
0.22
3.0
0.65
2.4
0.38
2.9
1.4
3.9
1.4
3.8
1.1
5.6
1.8
5.0
1.3
4.9
1.0
4.1
1.2
3.8
1.1
3.5
0.99
4.7
1.0
0.05
0.12
4.6
1.3
5.7
1.1
2.7
1.3
NP1EO
NP2EO
0.19
0.19
0.29
0.09
0.11
0.10
0.68
0.24
0.21
0.06
0.10
0.15
0.60
0.47
0.62
0.10
0.12
0.18
0.15
0.18
0.11
0.14
0.12
0.25
0.13
0.06
0.15
0.19
0.23
0.03
0.04
0.05
0.03
0.02
0.06
0.12
0.22
0.08
0.02
0.03
0.04
0.28
0.17
0.19
0.03
0.03
0.05
0.05
0.03
0.05
0.05
0.05
0.08
0.08
0.02
0.04
0.02
0.07
Nota: * Fango stabilizzato aerobicamente.
Tabella 3.5 - Concentrazioni di LAS, NP, NP1EO e NP2EO
in 29 campioni di fanghi digeriti anaerobicamente provenienti
da impianti di trattamento Svizzeri (da Brunner et al., 1988).
In uno studio svizzero si osservarono concentrazioni di NP pari a
0,45-2,53 g/kg di s.s. in 30 campioni di fanghi stabilizzati (Wahlberg
et al., 1990).
Altre concentrazioni di LAS nei fanghi sono riportate in tabella 3.7
per fanghi da trattare e fanghi stabilizzati; questi ultimi presentano
dei valori piuttosto alti, 30 g/kg, rispetto a quelli rilevati in altri studi:
5-15 g/kg (Ruitz Bevia et al., 1989).
88
Capitolo 3 DETERGENTI
Componenti
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
omologhi
a
n-decil
n-decil
n-decil
n-decil
n-undecil
n-undecil
n-undecil
n-undecil
n-undecil
n-dodecil
n-dodecil
n-dodecil
n-dodecil
n-dodecil
n-tridecil
n-tridecil
n-tridecil
n-tridecil
n-tridecil
n-tridecil
n-tetradecil
n-tetradecil
n-tetradecil
n-tetradecil
n-tetradecil
n-tetradecil
n-pentadecil
n-pentadecil
n-pentadecil
n-pentadecil
n-pentadecil
n-pentadecil
n-pentadecil
isomeri
4.5
3.6
2.7
1.8
5.5
4.6
3.7
2.8
1.9
5.6
4.7
3.8
2.9
1.1
6.6
5.7
4.8
3.9
2.1
1.11
6.7
5.8
4.9
3.1
2.11
1.12
7.8
6.9
5.9
4.11
3.12
2.13
1.14
b
quantità (%)
0.9
0.7
0.9
1.5
4.4
4.4
4.6
5.1
8.0
5.8
5.8
6.1
6.1
8.1
3.3
3.3
3.4
3.5
3.5
4.0
1.8
1.7
2.2
2.2
2.2
2.2
1.2
0.5
0.5
0.7
0.7
0.7
Nota: a) lunghezza della catena alchilica; b) numero degli atomi di carbonio nelle due catene alifatiche su ciascun lato del carbonio attaccato all'anello benzenico.
Tabella 3.6 - Distribuzione degli omologhi e degli isomeri dei LAS nei fanghi
(McEvoy et al., 1987).
89
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
min
Acque { disciolti (mg/l)
reflue { assorbiti s.s. (g/kg)
Acque {disciolti (mg/l)
trattate { assorbiti s. s. (g /kg)
Fanghi da digerire (g/kg)
Fanghi stabilizzati
6.1
13.8
0.07
3.9
13.6
21.2
LAS
media
7.3
29.0
0.14
4.1
22.8
30.2
max
9.4
42.5
0.23
4.2
31.6
39.7
Tabella 3.7 - Concentrazioni di LAS in fanghi da trattare e stabilizzati (Ruitz
Bevia et al., 1989).
In fanghi stabilizzati anaerobicamente si è osservato che il range di
NP è maggiore, di circa 6 volte (da 0.45 a 2.53 g/kg di s.s) di quello rilevato nei fanghi aerobici (da 0.08 a 0.31 g/kg di s.s), come se la condizione anaerobica favorisse la formazione di 4 nonilfenolo (Schaffner
et al., 1983; Giger et al., 1984).
Altre sperimentazioni riportano concentrazioni di 4-NP da 26 a
1100 ppm di s.s. in fanghi provenienti da 8 impianti di trattamento
svedesi (Wahlberg et al., 1990); le concentrazioni maggiori sono relative a quei fanghi digeriti anaerobicamente, mentre i fanghi trattati
anaerobicamente, ma non digeriti, risultano meno contaminati da NP
(cfr. figura 2, Wahlberg et al., 1990).
90
Capitolo 3 DETERGENTI
Figura 2 - Concentrazioni di NP e NP1EO ad NP3EO in campioni di fanghi
provenienti da 8 impianti municipali Svedesi. Tutti i campioni
sono stati digeriti anaerobicamente eccetto A, B e C1. C2 era un fango
digerito nell'impianto C. I campioni D, E, F, e G sono stati determinati
con GC/ECD, gli altri con GC/MS. Le barrette marcate(*) rappresentano
i limiti d'analisi con GC/ECD; le concentrazioni erano inferiori a questi limiti.
In fanghi attivi sono state rilevate nel 1986 concentrazioni pari a 4
g/kg di LAS e 1.2 g/kg di NP; due anni dopo i LAS erano aumentati
del 40% (5.5 g/kg) mentre NP decrebbe del 70% (0.33 g/kg), in concomitanza al bando degli NPnEO nell’1986 in Svizzera (Siegrist et al.,
1989).
Nella figura 3 sono riportate le concentrazioni di alcuni dei principali inquinanti organici, compresi i detergenti (Siegrist et al., 1989).
Nella tabella 3.8 sono invece illustrati i contenuti di LAS, NP e NpnEO
nei fanghi Svizzeri.
91
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Figura 3 - Range delle concentrazioni (mg/kg di solidi totali (ST)) di composti
organici recalcitranti nei fanghi. Di (dieldrin), Li (lindano), DDE
(metabolita del DDT). NPnEO sono stati vietati in Svizzera
nel 1986 a causa di un loro intermedio tossico il NP. L'area grigia
mostra le concentrazioni di LAS e NP nel 1986, l'area in bianco
le concentrazioni nel 1988 dei fanghi digeriti. Il valore medio dei LAS
è aumentato da 4.2 a 5.6 g/kg ST ed NP è diminuito da 1.2 a 0.33 g/kg
conseguentemente alle nuove restrinzioni (1986).
Viene ancora confermata la differenza tra fanghi anaerobici con
concentrazioni di LAS pari a 4.2 g/kg e fanghi aerobici, contenenti il
2.1 g/kg. Più rilevante la diversità del contenuto in NP pari a 1.2
g/kg in anaerobiosi e a 0.3 g/kg in aerobiosi (Siegrist et al., 1989).
A questo proposito viene ancora riportata una tabella che illustra il
contenuto di LAS e NP in fanghi anaerobici applicati al terreno (tabel la 3.9). Altri valori di detergenti in fanghi conservati vengono riportati nella tabella 3.10.
92
Capitolo 3 DETERGENTI
Refluo ( 1 . 9 . 1 09m 3/ a n n o )
range
mediana
quantità annuale Svizzera
quantità annuale in letteratura
Effluenti secondari
range
mediana
quantità annuale Svizzera
Fango (230000 t s.s/anno)
range
mediana
quantità annuale Svizzera
LAS
NPnEO,
NP1EO,
NP2EO
NP
g/m 3
g/ m 3
t/anno
t/anno
1-5
2.3
4400 (100 %)
5000
0.5-2.6
1.3
2500 (92%)
2000
0.020-0.047
0.03
60 (8%)
mg/m3
mg/3
t/anno
7-330
22
40 (1%)
60
120 (4%)
g/kg s.s.
g/kg s.s.
t/anno
0.05-5.9
3.8
870 (20%)
1-13
5
9 (1%)
0.15-2.2
1.2
270 (30%)
a)
a % (mol/mol) basata su 2700 t/anno
Tabella 3.8 - Concentrazioni di LAS, NP e NPnEO (n= da 3 a 20) nei reflui e
nei fanghi di impianti municipali Svizzeri nel 1985 (Siegrist et al., 1989).
data
di
applicazione
dei fanghi
luglio 1985
maggio 1986
% peso
secco
9.8
10.3
Concentrazione (g/kg s.s.)
LAS
5.2
5.5
NP
1.1
0.9
NP1EO
0.23
0.18
NP2EO
0.03
0.04
C.O. %
nd
24.6
Tabella 3.9 - Percentuale in peso secco e C organico e concentrazione
di LAS, NP, NP1EO, NP2EO in fanghi anaerobici applicati
al suolo nel 1985 e nel 1986 (Marcomini et al., 1989).
93
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Località, tempo di
conservazione (anni
antecedenti al 1986)
Menden-Bosperde 1 5
Menden-Bosperde 3 0
Edewechterdam
0.5
2
5
10
13
13
Essen -Werden
0.5
Essen -Werden
2
Essen-Eickennsheidt 20
1970/71
1950-64
1985/86
1983-85
1979-83
1975-79
1972-75
1972-75
1986
1984
1966
tipo di
fango
LAS
NP
NP1EO
refluo
refluo
digerito
digerito
digerito
digerito
digerito
digerito
digerito
digerito
digerito
2770
1664
9160
8610
3170
1560
245
195
1360
3310
1030
37
4
152
111
375
104
19
7
271
125
77
65
19
16
21
24
30
9
2
27
17
28
Tabella 3.10 - Concentrazioni di LAS, NP, Np1EO in campioni provenienti
da vari serbatoi di fango Tedeschi ( mg/kg di s.s.) (Witte, 1989).
Viene infine riportata una tabella riassuntiva delle quantità di LAS
e NP rilevate nei fanghi da diversi autori (tabella 3.11).
LAS
9.3-18.8
4 (media)
21200-39700
5000-15000
50-5900
5200 (media)
195-9160
2900-11900
-
NP
Autori
1 (media)
26-1100
150-2200
1000 (media)
7-375
450-2530
80-310
Holt e Bernstein, '92
Brunner et al., '88
Ruitz Bevia, '89
Ruitz Bevia. '89
Wahlberg et al., '90
Siegrist, '89
Marcomini et al., '89
Witte, '89
McEvoy et al., '87
Wahlberg et al., '90*
Shaffner, '83 **
Tabella 3.11 - Quantità di LAS e NP rilevate nei fanghi da diversi
autori (ppm s.s., *Fanghi anaerobici,**fanghi aerobici).
94
Capitolo 3 DETERGENTI
3.4. Degradazione
La tossicità e la biodegradabilità dei LAS tendono ad aumentare
quanto più il sostituente fenile è in posizione iniziale della catena alchilica e quanto maggiore è il numero degli atomi di carbonio della
catena stessa (Roberts, 1991).
Il dato più preoccupante consiste nel fatto che i LAS tendono ad accumularsi nei fanghi, pur essendo solubili in acqua e prontamente degradati nelle acque reflue. Questo comportamento dei detergenti nei
confronti dei colloidi, risiede proprio nelle loro caratteristiche lipofile e lipofobe, risultanti, rispettivamente, dalla attività dei gruppi alifatici e dei gruppi solfonati.
I LAS nei fanghi si adsorbono ai particolati organici e inorganici per
poi depositarsi in ambienti a basso tenore di ossigeno, quale, ad esempio, lo stadio primario meccanico del trattamento delle acque reflue.
La presenza di metalli pesanti nei fanghi, inoltre, può favorire l’adsorbimento dei LAS, adsorbimento che ritarda la loro degradazione,
come avviene nel suolo quando si associano alla frazione minerale.
I LAB presenti nei prodotti commerciali a base di LAS vengono rimossi per assorbimento su solidi durante il trattamento primario delle acque, in condizioni di anaerobiosi rimarranno sino alla fine del
trattamento nel fango (Holt et al., 1989).
3.4.1 Biodegradazione
I detergenti anionici quali gli alchilbenzensolfonati lineari (LAS) derivanti per solfonazione dagli alchilbenzeni lineari (LAB) e quelli non
ionici quali gli alchilfenoli polietossilati (APEO), il cui tipo più rappresentato è il nonilfenolo polietossilato (NPnEO), sono stati ritrovati a varie concentrazioni sia nelle acque che nei suoli trattati e non
trattati con fanghi.
I LAS sono considerati biodegradabili (Swisher, 1987) e la loro degradazione procede secondo tre tappe successive. La prima comporta
una b e t a / o m e g a ossidazione della catena alchilica con formazione di
solfo-fenil-alcanoati (Huddleston and Allred, 1963, Cain, 1987). È stato osservato che la biodegradabilità della catena alchilica è direttamente proporzionale alla sua lunghezza (Cain, 1987) e dipende dalla
posizione dell’anello aromatico sulla stessa (Hudddleston and Allred,
1963). Successivamente si ha desolfonazione e apertura dell’anello
95
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
benzenico. Queste ultime due fasi hanno luogo quando la lunghezza
della catena è stata ridotta almeno fino a 5 atomi di carbonio. La desolfonazione richiede l’intervento di un sistema enzimatico complesso contenente una diossigenasi (Cain and Farr, 1968; Locher et
al.1991).
Recentemente è stata dimostrata la desolfonazione al corrispondente fenolo di alcuni LAS modello, da parte di Pseudomonas putida S313
che utilizzava questi composti come unica fonte di S (Kertesz et al.,
1994). Ceppi di Pseudomonas, Achromobacter, Acinetobacter e numerosi
altri batteri Gram-negativi in coltura mista effettuavano una degradazione primaria dei LAS, ma nessuno era in grado di degradare
completamente il tensioattivo fornito come fonte limitante di carbonio e di energia (Hrsak et al., 1983; Sigoillot and Nguyen, 1990). Una
completa degradazione dei LAS era ottenuta con una coltura mista,
costituita da tre ceppi di Pseudomonas ed un Aeromonas, che si era dimostrata capace di mineralizzare in 13 giorni più del 25% dei LAS a
CO2 (Jimenez et al., 1991).
Nell’ambiente la biodegradabilità di questi detergenti dipende anche dall’origine dell’inoculo, dalla temperatura e dalla struttura dei
LAS. Infatti, studi fatti su tre colture derivanti da zone diverse di uno
stesso estuario (acqua dolce, salata e costiera) hanno dimostrato che
la velocità di biodegradazione era più elevata con la coltura mista
d’acqua dolce in estate e con l’aumento della distanza del gruppo
solfofenile dal gruppo metilico terminale (Terzic et al., 1992).
In un recente studio è stato osservato che i LAB, presenti in percentuale dal’1 al 3% nei LAS commerciali, venivano rapidamente rimossi dai suoli trattati con fanghi. La loro emivita era di 4,5 giorni per gli
isomeri esterni (2-fenil-), di 20 giorni per gli isomeri interni (6/7-fenil)
(Holt and Bernstein,1992).
I detergenti non ionici del tipo APEO sono di parziale e difficile degradazione, che si limita per lo più all’attacco della catena etossilica.
In recenti ricerche è stato isolato uno Pseudomonas che degrada un nonilfenolo etossilato con 9.5 EO (unità etossiliche) al corrispondente
composto con 2 sole EO (Maki et al., 1994). L’accorciamento della catena etossilica non è comunque un processo ecologicamente favorevole perchè è stato osservato che gli APEO a corta catena sono composti più tossici e resistenti (Patoczka and Pulliam, 1990; Yoshimura,
1986). La degradazione degli alchifenoli polietossilati nel trattamento
aerobico delle acque porta alla formazione di alchilfenoli mono e dietossilati che sono stati ritrovati come principali costituenti di grande
96
Capitolo 3 DETERGENTI
persistenza negli effluenti e nelle acque di fiume (Stephanou and Giger, 1982; Ahel et al., 1984).
In esperienze con sedimenti e fanghi anossici, la porzione polietossilica degli alchilfenoli polietossilati viene degradata a metano a concentrazioni minori o uguali a 500 mg/l, mentre il residuo alchilico rimane intatto anche dopo trattamento anaerobico (Wagener and
Schink, 1987). In suoli trattati con fanghi anaerobici è stato ritrovato
ad alte concentrazioni il 4-nonilfenolo che deriva dalla demolizione
della catena etossilica dei nonilfenoli polietossilati; il metabolita suddetto è molto tossico e quindi ecologicamente dannoso (Giger et al.,
1984; Schaffner et al., 1983)
Biodegradazione nella depurazione e nei fanghi
Studi in laboratorio e in campo indicano che i LAS sono biodegradati velocemente in condizioni aerobiche (Matthews, 1983), comunque il 10% o più (McEvoy and Giger, 1985) viene rimosso nel trattamento dei rifiuti da un adsorbimento sui solidi durante il trattamento
primario e non con i normali trattamenti anaerobici; il fango che ne risulta viene poi usato in agricoltura (in Inghilterra circa il 45%).
Dal momento quindi che i LAS non vengono degradati in anaerobiosi, livelli di 0.3 e 1.2% si rilevano sui solidi essiccati di questi fanghi (Sedlak and Broman, 1986; Holt and Bernstein, 1992). I LAS si associano alla parte solida del fango in misura dello 0.3 -1.2% (Holt et
al., 1989).
In suoli da pascolo soggetti ad un’annuale applicazione di fango il
valore iniziale di 45 ppm scendeva a 5 ppm in 104 gg (Holt et al., 1989).
In Svizzera, considerando le leggi nazionali (0.25 kg s.s/m 2 per anno), in suoli trattati con fanghi l’input annuale era di 1 g di LAS/m 2 e
0.3 g/m 2 di NP.
Nei pascoli, dopo 31 e 104 giorni dall’applicazione dei fanghi, si è
potuto notare rispettivamente l’80% e il 90% di rimozione nei primi 5
cm del suolo, con residui nell’ordine di alcuni ppm (LAS 5 ppm e NP
0.55 ppm) (Giger et al., 1987).
In suoli trattati con fanghi per 10 anni sono stati testati 5 omologhi
(da C10 a C14) a tre concentrazioni iniziali 2.5, 25 e 250 ppm, che sono
rispettivamente 0.1, 1, e 10 volte le concentrazioni dei suoli trattati
con fanghi. Con concentrazioni sia basse che alte la degradazione dei
LAS procedeva regolarmente: l’emivita da C10 a C14 era di 18-26 gg,
media 21, confrontabile con quella della cellulosa (17 gg). In suoli trat-
97
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
tati per un periodo più breve, i valori erano simili (16 gg) (Giger et al.,
1987) a quelli osservati anche da altri autori (Holt et al., 1989) che affermano un’emivita di 7-22 gg.
Il diagramma (figura 4 ) mostra la rimozione dei LAS in suoli trattati
con fanghi in funzione dell’intervallo di tempo tra le successive applicazioni (20 gg è l’emivita).
Figura 4 - Biodegradazione e rimozione dei LAS in suoli trattati con i fanghi
in funzione dell’intervallo di applicazione degli stessi. La rimozione
è calcolata sulla base di una emivita di 20 gg (Ward and Larson, 1989).
La maggior parte (90%) viene rimosso in 10 settimane, 99% in 20 settimane (Ward and Larson, 1989).
La mineralizzazione dei LAS era del 65%, ma il resto si ipotizza venga incorporato nella massa microbica o nel materiale umico del terreno e quindi reso indisponibile per la biodegradazione (Ward and Larson, 1989). I valori riscontrati sono simili a quelli della letteratura
98
Capitolo 3 DETERGENTI
Figura 5 - Biodegradazione di C11 - LAS (A) e C 14 - LAS (B)
nei suoli ammendati (Ward and Larson 1989).
99
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
(50% dopo 60 gg di incubazione, da 61 a 73% in suoli tedeschi dopo 14
gg in condizioni aerobiche). La produzione di CO 2 in ogni caso diminuiva a temperature basse (inverno) o in condizioni di anaerobiosi,
dato confermato da altri autori (Ward and Larson, 1989).
Pareri contrastanti sussistono invece riguardo al fatto che la biodegradazione dei LAS diminuisce se la concentrazione scende al di sotto di certi valori (10 ppm) (Ward and Larson, 1989).
La biodegradazione dei LAS in fanghi attivi ha mostrato un’efficienza pari al 95% con una permanenza del fango di 3 gg (4-10 gg) (De
Henau et al., 1989).
Altre sperimentazioni indicano una rapida rimozione di LAB dai
suoli ammendati (cfr. figura 5 ).
In sintesi i LAS presenti nelle acque reflue vengono assorbiti o precipitati sui solidi in sospensione in misura del 50% e rimossi quindi
per il 98% nell’impianto di trattamento. Il 35% dei LAS viene rimosso
per precipitazione, mentre quelli non degradati vengono poi rimossi
in operazioni successive quali disidratazione, compostaggio, ecc. Nella figura 6 viene illustrata la scomparsa del LAS durante il trattamento del fango (Ruitz Bevia et al., 1989).
Figura 6 - Scomparsa dei LAS durante il trattamento del fango.
100
Capitolo 3 DETERGENTI
In ogni caso i processi di disidratazione, mescolamento e compostaggio dei fanghi permettono di scendere al di sotto di 1/5 del valore di LAS iniziale per cui il fango da applicare in qualità di ammendante conterrà circa 4.8 g/kg di LAS (Ruitz Bevia et al., 1989).
Nel terreno di un’azienda vinicola ammendato con fanghi si è osservata una emivita di 26 gg, in ogni caso, essendo l’applicazione del
fango divisa in 2 volte all’anno (ogni 180 gg), non c’era rischio di accumulo, ipotesi confermata da una concentrazione di LAS nel suolo
dopo 3 anni molto bassa pari a 0.3 ppm (cfr. figura 7, Ruitz Bevia et al.,
1989).
Figura 7 - Contenuto di LAS nei suoli trattati con i fanghi (emivita di 26 gg,
applicazione del fango ogni 6 mesi.
3.5. Piante
In studi condotti sugli effetti dei LAS sulle piante e gli animali, in relazione alle concentrazioni di questi composti nel terreno, si è osservato che rimane un margine adeguato di sicurezza, da 1 a 2 ordini di
grandezza nell’irrigazione con acque reflue trattate, e di un fattore di
circa 8-15 nella fertilizzazione con fanghi (contenenti un valore tipico
di 0.3-1.2%).
La fitotossicità dei LAS (C10-C13) è stata determinata su sorgo, girasole, e fagiolo all’emergenza con dosi di 1, 10, 100 e 1000 ppm; i risultati mo-
101
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
strano un margine di sicurezza tale da prevenire effetti indesiderati sulle piante (fino a 100 ppm non c’è alcun effetto) (Mieure et al., 1990).
Un secondo studio effettuato su piante comuni incluse piante coltivate (C y p e r u s, giavone, sorgo, grano, mais, soia, Ipomea, Xanthium,
Abutilon t.) fu diviso in 2 tempi, seminando i semi subito dopo il trattamento col fango e dopo 2 settimane. La dose di fango era di 9000
kg/ha e la concentrazione dei LAS pari a 407 ppm. Per le piante irrigate (concentrazione di LAS nell’acqua intorno allo 0.02-0.9 ppm), in
genere la tossicità si evidenzia dai 10 ai 1000 ppm (cfr. tabella 3.12,
Mieure et al., 1990). Le concentrazioni usate erano 0.02-0.9 ppm di
LAS, mentre per effluenti di impianti di trattamento di fanghi attivi in
U.S., Canada, Svizzera e Germania sono riportate concentrazioni medie di 0.05, 0.09, e 0.07 ppm (Mieure et al., 1990).
specie
risultati
piselli
orchidee
riso
riso
orzo
fagioli, pomodori
pino Islandese di Norfolk
ravanello, cavolo cinese,
riso in idroponica
riso
orzo, ravanello, pisello,
pomodoro, lattuga
cocomero
inibizione della crescita a 50 mg/l
inibizione della crescita a 10 e 100 mg/l
inibizione della produzione a 50 mg/l
ingiallimento delle foglie a 50 mg/l
nessun effetto a 40 mg/l
stimolazione della crescita a 25 e 40 mg/l
crescita ridotta a 100 mg/l
10 mg/l è la concentrazione critica
5 mg/l stimolano la crescita, 40 mg/l la inibiscono
crescita ritardata a 1000 mg/l, nessun effetto a 100 mg/l
crescita ritardata a 100 mg/l, nessun effetto a 10 mg/l
Tabella 3.12 - Effetto dei LAS apportati coll'irrigazione sulle piante
(Mieure et al., 1990).
Se ne deduce che le specie più sensibili sono a livelli di 10 ppm nell’acqua irrigua, mentre comunemente si rileva un livello di 0.09.
Rimarrebbe quindi un margine di sicurezza pari a 10.2 ordini di
grandezza.
Nella seconda sperimentazione l’applicazione LAS-fango influisce positivamente, invece che negativamente, sulla crescita della
pianta, e risulta più evidente per le monocotiledoni che per le dicotiledoni.
102
Capitolo 3 DETERGENTI
La crescita diminuiva con le più alte concentrazioni di LAS applicate lo stesso giorno della semina (rispetto a 2 settimane prima), ma il
dato è irrilevante poichè la normale pratica agricola è quella di applicare il fango parecchie settimane prima della coltivazione.
In conclusione non c’erano effetti sulla semina e sulla crescita di nove piante con concentrazioni di LAS nel suolo di 407 ppm (cfr. tabella
3.13, Mieure et al., 1990).
Specie
Concentrazioni
( g/g)
0
"Yellow nutsedge"
prato
sorgo granella
grano
mais
soia
"Morningglory"
"Cocklebur"
"Velvet leaf"
media
0
0
0
0
0
0
0
0
0
0
a
0
0
0
0
0
0
0
0
0
0
69.6
1 5 10
25 40
15 25
20
5
15 15
5
20
20
16
10
5
40
9
b
90.7
15 25
30 55
15 40
15 20
25 30
15 15
25 25
20 0
20 40
20 28
111.8
15 10
30 40
20 35
20
5
25 10
10
5
10 20
30
5
30 25
21 17
154
15 25
25 50
20 35
20 5
10 10
5 5
10 20
0 5
5 25
12 17
283.3
5 10
10 40
0 30
0 15
10 15
0 10
5 30
0 10
5 35
4 22
407
0 25
0 55
5 40
5 0
0 20
0 50
0 10
5 0
0 25
1 20
a) non contengono fanghi nè LAS
b) Per ciascun paio di risultati il primo valore è la crescita rilevata effettuando la semina
nello stesso giorno del trattamento col fango contenente i LAS; il secondo valore è la crescita
rilevata effettuando la semina due settimane dopo l'aggiunta del fango.
Tabella 3.13 - Percentuale di crescita data da LAS C 11.36 contenuto nel fango
(Mieure et al., 1990).
3.6 Animali
Per quanto attiene i fattori di rischio ambientale dovuto ai suoli ammendati con i fanghi non si rilevano effetti di fitotossicità fino a 392
ppm di LAS nel suolo e fino a 235 ppm per il Lumbricus: per cui si possono fissare 3 ppm come limite superiore per esposizioni a lungo termine in suoli ammendati (concentrazione media 1 ppm o comunque
meno di 3 ppm). L’emivita va da 5 a 33 gg con una mediana di 15.2
gg. Considerando che le coltivazioni non sono mai seminate prima di
un mese dall’applicazione del fango i margini risultano sempre sufficientemente ampi.
103
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Conclusioni
I LAS (alchil benzen solfonati lineari), i LAB (alchilbenzeni lineari),
gli NPEO (alchil fenoli polietossilati con 9 C) e gli NPnEO (nonilfenolo polietossilati) sono i detergenti maggiormente presenti nei fanghi,
in quantità ancora maggiore a quella di inquinanti ambientali ubiquitari, come PCB, PAH, ecc.
Concentrazioni medie di LAS nei suoli trattati con fanghi sono di 02.5 ppm, il contenuto di NP è intorno ai 2 ppm, mentre i valori di LAB
rilevati sono di qualche ppb.
In genere questi composti finiscono negli impianti di trattamento
delle acque reflue e vengono rimossi dal 95% al 99%, cosicchè la concentrazione va da 0.3 a 1.2% s.s.
Pur essendo solubili in acqua e prontamente degradati nelle acque
reflue, tendono ad accumularsi nei fanghi, a causa delle loro caratteristiche lipofile e lipofobe. Nei fanghi il contenuto medio di LAS va
da 10 a 20 ppm (fino a 100 ppm in fanghi attivi), mentre i LAB vanno
da 20 a 400 ppm. Fanghi contenenti circa 4 ppm di LAS e 1 ppm di NP
vengono normalmente applicati su suoli agrari (Brunner et al., 1988).
La degradazione di questi composti risulta elevata e medio il rischio
di leaching, di assorbimento e traslocazione.
Il pericolo di una eventuale contaminazione alimentare, infine, è
da escludersi, in quanto si è osservato un margine adeguato di sicurezza da 1 a 2 ordini di grandezza nell’irrigazione con acque reflue
trattate, e di un fattore di circa 8-15 nella fertilizzazione coi fanghi,
contenenti un valore tipico di 0.3-1.2% .
Anche per quanto riguarda i rischi di contaminazione animale è opportuno attenersi al limite massimo di 3 ppm per esposizioni a lungo
termine in suoli ammendati (media 1 ppm).
È importante, in ogni caso, che il fango venga applicato al terreno
qualche settimana prima dell’inizio della coltivazione, come, del resto, prevede l’usuale pratica agricola.
104
Capitolo 3 DETERGENTI
Bibliografia
AHEL M., GIGER W., MOLNAR E . ,
SCHAFFNER C., (1984): Analysis of or ganic micropollutants in water. In:
A.Angeletti and A.Bjorseth EDS. (Reidel, Dordrecht, Netherlands, 1984),
280-288.
BRUNNER P.H., CAPRI S., MARCOMINI A., GIGER W., (1988): Occuren ce and behaviour of LAS, NP, NP mono
and NP diethoxilates in sewage and sewa ge sludge treatment. Wat. Res. , 22,
1465-1472.
CAIN R.B., (1987): Biodegradation of
anionic surfactants. Biochem. Soc. (UK)
Trans., 15, 7S-22S.
CAIN R.B., FARR D.R., (1968): Metabo lism of aryl-sulphonates by micro-organi sms. Biochem. J., 106, 859-877.
DE HENAU H., MATTHIJS E .,
NAMKUNG E ., (1989): Trace analysis
of LAS by HPLC detailed results from two
municipal sewage treatment plants. In:
Organic contaminants in wastewater,
sludge and sediment. Edited by D. Quaghebeur, I. Temmerman and G. Angeletti. Comm.of the Eur.Commun. Elsevier Applied Science.
DE HENAU H., MATTHIJS E., H O PPING W.D., (1986): LAS in sewage slud ges, soils and sediments: analytical deter mination and environmental safety consi derations. Int. J. Environ. Anal. Chem.,
26, 279-293.
GIGER W., BRUNNER P., S C H A F FNER C., (1984): 4-NP in sewage sludge:
accumulation of toxic metabolites from no nionic surfactants. Science, 225, 623-625.
GIGER W., BRUNNER P.H., AHEL M.
MCEVOY J., MARCOMINI A . ,
SCHAFFNER CH., (1987): O r g a n i s c h e
Waschmittelinhalstoffe und deren Abbau produkte in Abwasser und Klarschlamm.
Gas Wasser Abwasser, 67, 111-122.
HOLT M.S., BERNSTEIN S.L., (1992):
LAS in sewage sludges and sludge amen ded soils. Wat. Res., 26, n.5, 613-624.
105
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
HOLT M.S., MATTHIJS E ., WATERS
J ., (1989): The levels and fate of LAS in
sludge amended soils. In: Organic conta minants in wastewater, sludge and sedi ment. Edited by D. Quaghebeur, I.
Temmerman, G. Angeletti. Comm. of
the Eur.Commun. Elsevier Applied
Science.
HRSAK D., BOSNJAK M., JOHANID E S V., (1983): Enrichment of linear
alkyl-benezenesulphonate (LAS) degra ding bacteria in continuos culture. J. Ap pl. Bacteriol., 53, 413-422.
HUDDLESTON R.L., ALLRED R . C . ,
(1963): Microbial oxidation of sulfonated
a l k y l b e n z e n z e s. Dev. Ind. Microbiol., 4 ,
24-38.
JIMENEZ L., BREEN A., THOMAS N.,
FEDERLE T.W., SAYLER G. S., (1991):
Mineralization of LAS by a four-member
aerobic bacterial consortium. Appl. Envi ron. Microbiol., May, 1566-1569.
KAZUHO INABA, (1992): Quantitative
assessment of natural purification in we tland for LAS. Wat. Res., 26, n.7, 893-898.
KERTESZ M.A., KOLBENER P . ,
STOCKINGER H., BEIL S., C O O K
A.M., (1994): Desulfonation of linear
alkyl-benzenesulfonate surfactants and
related compounds by bacteria, Appl. En viron. Microbiol., 60, 2296-2303.
LOCHER H.H., LEISINGER T., COOK
A.M., (1991): 4-sulphobenzoate 3,4dioxygenase. Biochem. J., 274, 833-842.
MAKI H., MASUDA N., FUJIWARA
Y., IKE M., FUJITA M., (1994): Degra dation of alkylphenol ethoxylates by
106
Pseudomonas sp. strain TRO1. Appl.
Environ. Microbiol., 60, 2265-2271.
MARCOMINI A., CAPEL P., LICHTENSTEIGER TH., BRUNNER P.H.,
GIGER W., (1989): Fate of organic pollu tants in sludge amended soil and sludge
only landfills: LAS, NP e PCB. In: Orga nic contaminants in wastewater, sludge
and sediment . Edited by D. Quaghebeur, I. Temmerman, G. Angeletti.
Comm.of the Eur.Commun. Elsevier
Applied Science.
MATTHEWS P.J, (1983): A g r i c u l t u r a l
utilisation of sewage sludge in the UK.
Wat. Sci. Tech., 15, 135-149.
MCEVOY J., GIGER W., (1985): Accu mulation of LAS surfactants in sewage
sludges. Naturwissenschaften, 72, 429431.
MCEVOY J. GIGER W., SCHAFFNER
C., AHEL M. , BRUNNER P.H., (1987):
The occurence of detergent derived organic
micropollutants in sewage sludges and soils
amended with sludge. In: Current perspec tives in environmental biogeochemistry.
Edited by G. Giovannozzi-Sermanni, P.
Nannipieri, C.N.R.-I.P.R.A.
MIEURE J.P., WATERS J., HOLT M.S.,
MATTHIJS E., (1990): Terrestrial safety
assessment of LAS. Chemosphere , 21,
n.1-2, 251-262.
PATOCZKA J., PULLIAM G . W . ,
(1990): Biodegradation and secondary ef fluent toxicity of ethoxylated surfactants.
Water Res., 24, 965-972.
ROBERTS D.R., (1991): Application of
QSAR to biodegradation of LAS isomers
Capitolo 3 DETERGENTI
and homologues. The Science of the Total
Environ., 109/110, 301-306.
RUITZ BEVIA F., PRATS D., RICO C.,
(1989): Elimination of LAS during sewa ge treatment, driyng and compostage of
sludges and soil amending processes. In:
Organic contaminants in wastewater,
sludge and sediment. Edited by D. Quaghebeur, I. Temmerman, G. Angeletti.
Comm. of the Eur. Commun. Elsevier
Applied Science.
SCHAFFNER C., BRUNNER P.H., GIGER W., (1983): 4-NP, a highly concentra ted degradation product of nonionic surfac tants in sewage sludge . In: Processing and
use of sewage sludge. Proceeding of the
third Inter. Symp., Brighton 27-30.
SEDLAK R. I., BOOMAN K.A., (1986):
A study of LAS and alcohol ethoxylate re moval at a municipal wastewater treat ment plant. Soap Cosmet. Chem. Spec.,
62, 44.
SIEGRIST H., ALDER A ., BRUNNER
P . H ., GIGER W ., (1989): P a t h w a y
analysis of selected organic chemicals
from sewage to agricultural soil. I n :
Sewage sludge treatment and use. Edited
by A.H. Dirkzwager, P.L'Hermite. Elsevier Applied Science. Comm. of the
Eur. Commun.
SIGOILLOT J.C., NGUYEN M . H . ,
(l990): Isolation and characterization of
surfactant degrading bacteria in a marine
environment. FEMS Microb. Ecol., 7 3 ,
59-68.
STEPHANOU E., GIGER W., (1982):
Persistent organic chemicals in sewage ef fluent. II.Quantitative determinations of
nonyphenol and nonyphenol- ethoxylates
by glass capillary gas chromatography.
Environ. Sci. Technol., 16, 800.
STRUIJS J., STOLTENKAMP J., (1994):
Testing surfactants for ultimate biodegra d a b i l i t y. C h e m o s p h e r e, 28, n.8, 15031523.
SWISHER R.D., (1987): Surfactant bio d e g r a d a t i o n. 2nd edn Marcel Dekker,
New York.
TERZIC S., HRSAK D., AHEL M . ,
(1992): Primary biodegradation kinetics
of linear alkylbenzene sulphonates in
estuarine waters. Wat. Res., 26, 585591.
TOPPING B.W., WATERS J., (1982):
Monitoring of cationic surfactants in
sewage treatment plants. Tenside Deterg.,
19, 164-169.
TSCHUI M. , BRUNNER P.H., GIGER
W., (1986): Accumulation of refractory 4NP during mesophilic anaerobic sludge
stabilization. In CEC New developments
in processing of sludges and slurries.
Ed.by A.M. Bruce, P. L'Hermite, P.J.
Newman, Elsevier Applied Science
Publishers.
WAGENER S., SCHINK B., (1987):
Anaerobic degradation of nonionic and
anionic surfactants in enrichment cutures
and fixed-bed reactors. Wat.Res., 21, 615622.
WAHLBERG C., RENBERG L., WIDEQUIST U., (1990): Determination of NP
and NP ethoxylates as their pentafluoro benzoates in water, sewage sludge and bio ta. Chemosphere, 20, n.1- 2, 179-195.
107
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
WARD T.E., LARSON R . J ., ( 1 9 8 9 ) :
Biodegradation kinetics of LAS in sludgeamended agricultural soils. Ecotoxico logy and Environ. Safety, 17, 119-130.
wastewater, sludge and sediment. Edited
by D. Quaghebeur, I. Temmerman and
G. Angeletti. Comm.of the Eur.Commun. Elsevier Applied Science.
WITTE H., (1989): Investigations of the
entry of selected organic pollutants into
soils and plants by use of sewage sludge in
agricolture. In: Organic contaminants in
YOSHIMURA K . , (1986): B i o d e g r a d a tion and fish toxicity of nonionic surfac tants. J.Am. Oil Chem. Soc., 63, 15901596.
108
Capitolo 4
Diossine e Furani
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
M
olte delle sostanze, cosiddette indesiderabili, presenti negli impianti di trattamento dei rifiuti possono contaminare
l’ambiente attraverso le acque o fenomeni di volatilizzazione. Da sperimentazioni svolte si è dedotto che le miscele di isomeri rilevate, alcune delle quali estremamente tossiche, non sono mai
state prodotte industrialmente e raggiungono l’ambiente solo come
prodotti derivati, o impurezze e prodotti residui provenienti dall’incenerimento: benzodiossine policlorurati (PCDD), TCDD, policlorurati e polibromurati, dibenzofurani (PCDF e PBDF), polialogenati difenileteri (PHDPE) ecc.
Le possibili fonti di inquinamento da diossina o furani sono:
• le quantità di PCDD/F introdotti nell’atmosfera (risultante dal
l’alternanza di umido o asciutto)
• la formazione di PCDD/F all’interno del trattamento dei rifiuti
(geneticamente dai clorofenoli, dal PCP in presenza di ipoclorito,
attraverso la formazione di analoghi dello zolfo ai PCDD/F, per
esempio da pentaclorotiofenolo, ecc.)
• l’introduzione di PCDD/F da varie fonti (industria tessile, della
pelle, del metallo, della carta, olii di raffreddamento, dall’incenerimento di rifiuti ospedalieri e dei rifiuti in genere, dalle automobili, da prodotti per la pulizia, e da conservanti per il legno, ecc.).
Se ne deduce che l’inquinamento di questi composti è ormai ubiquitario e alle fonti citate vanno aggiunte le deposizioni atmosferiche, seguite dal run-off, il riscaldamento domestico e quello industriale.
È opportuno, quindi, indagare maggiormente sul destino di queste
molecole, dato che la quantità di PCDD/F rilevata nei fanghi è comunque alta considerando che non vi sono significative fonti di produzione dirette; ad esempio il limite massimo permesso in Germania
è di 29 kg di PCDD/F per anno, che corrisponde a circa il 60% delle
quantità annuali rilevate (Girth et al., 1991).
4.1 Suoli
In Svezia sono stati eseguiti diversi campionamenti per quantificare i PCDD e i PCDF presenti nel suolo arabile; dal confronto effettua-
110
Capitolo 4 DIOSSINE E F URANI
to è emerso che le aree vicine ad arterie di traffico contenevano,
espressi in equivalenti di tossicità (TEQ) da 13 a 49 pg TEQ/g S.O.
mentre campioni di terreno prelevati in aree meno urbanizzate, contenenevano tra 9 e 32 pg TEQ /g S.O. Entrambe le aree dunque potrebbero influenzare le concentrazioni del suolo agricolo (Broman et
al., 1990).
4.2 Acque
Da uno studio effettuato in merito alla presenza di diossine e furani
in 37 impianti di trattamento di acque municipali, gli unici isomeri rilevati a livelli apprezzabili erano diossine epta e octa clorurate, solo la
octa clorodibenzopara-diossina (OCDD) era sempre presente nei diversi campioni, mentre in alcuni non c’erano TCDD e TCDF.
4.3 Fanghi
In diverse Nazioni è continuamente in discussione l’utilità della
fertilizzazione agricola con fanghi per i conseguenti rischi di contaminazione ad essa legati. Sono stati condotti numerosi studi su fanghi contenenti PCDD (dibenzopara-diossina) e PCDF (dibenzofurano) e sui terreni ai quali venivano applicati. In Germania è stato fissato un valore massimo di 100 ng I-TEQ/kg per PCDD e PCDF nei
fanghi destinati al terreno agricolo e un limite di applicazione di 5 t
per ettaro per 3 anni. Elevate concentrazioni di diossine infatti sono
state identificate anche nei fanghi di origine domestica (Rappe and
Andersson, 1992; Horstmann et al., 1992, 1993) oltre che in quelli industriali e da alcuni è stata indicata la possibilità che questi composti
si formino direttamente nei fanghi attraverso la trasformazione enzimatica di precursori organo-alogenati quale, ad esempio il clorofenolo (Oberg et al, 1993) o durante il trattamento termico dei fanghi
stessi (Abendt et al., 1993).
In una ricerca svedese (Broman et al., 1990) la concentrazione media
di PCDF e PCDD nei campioni di fango analizzati era di 79 pg TEQ/g
111
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
S.O. e la fertilizzazione con fanghi (1t s.s./ha per anno) aumentava le
concentrazioni rilevate nel terreno (sopra riportate) del 2-3%. Considerando quindi le concentrazioni di background dei suoli, ci vorrebbero almeno 50 anni nel caso dei PCDD, e 30 nel caso dei PCDF, perchè
il fango apporti al terreno altrettanto (Broman et al., 1990).
Le più alte concentrazioni di diossine/furani sono state rilevate nelle acque reflue e nei fanghi trattati (cfr. tab.1, Ho and Clement, 1990).
Risultati simili vengono riportati da altre sperimentazioni sui fanghi
in cui TCDD era pari a 150 ppt, esa-CDD a 2.1 ppb, epta-CDD intorno
ai 6.3 ppb e OCDD maggiore di 60 ppb. I benzofurani erano presenti
solo in tracce (Ho and Clement, 1990).
Altri autori ancora rilevarono in fanghi di impianti urbani quantità
pari a 2.2 ppt di 2,3,7,8-TCDD, che rappresentava circa il 7 % dei
TCDD totali (34 ppt), mentre esa-CDD era intorno a 1.5 ppb, eptaCDD circa 9.7 ppb e OCDD pari a 59 ppb (Lamparski et al.,1984).
In Germania la media della sommatoria delle diossine e furani in 72
campioni di fanghi era circa di 20 ppb di s.s. (Girth et al., 1991). Altre
analisi mostrano concentrazioni di PCDD e PCDF superiori a 100 ppb,
prevale sempre il contenuto in OCDD (Klopffer et al., 1990).
Nella tabella 4.2 (Naf et al., 1990) vengono riportate altre concentrazioni di questi composti in campioni di acqua, fanghi ed aria in un imCongeneri
tetraCDD
pentaCDD
esaCDD
eptaCDD
OCDD
tetraCDF
pentaCDF
esaCDF
eptaCDF
OCDF
Refluo
Effl.
primario
Effl. secondario
Fango
Fango trattato
f
f a range b
(ppt)
(ppt)
range
f
(ppt)
range
f
(ppb)
range
f
(ppb)
0/54
0/54
0/54
0/54
4/54
1/54
0/54
0/54
0/54
1/54
0.1-1
0.1
-
0/44
0/44
0/44
2/44
4/44
1/44
0/44
0/44
0/44
2/44
1-4
0.1-11
0.3
0.5-0.5
0/50
0/50
0/50
6/50
25/50
3/50
1/50
1/50
1/50
4/50
1-14
1-309
5-25
3
4
25
2-31
0/49
1/49
1
2/49
1-4
10/49 1-73
26/49 0.6-304
0/49
1/49
1
0/49
0/49
0/49
-
0.7-28
5
3
0/8
0/8
0/8
0/8
2/8
1/8
0/8
0/8
0/8
0/8
a =frequenza di rilevamento (campioni positivi sul totale dei campioni analizzati)
b =range delle concentrazioni (ptt per acque reflue primarie e secondarie, ppb per fanghi
reflui e trattati)
Tabella 4.1 - Diossine e furani clorurati presenti nei reflui e nei fanghi
di un impianto di controllo delle acque (da Ho and Clement, 1990).
112
range
Capitolo 4 DIOSSINE E F URANI
113
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
pianto di trattamento delle acque reflue. Il flusso dell’impianto di
PCDD/F era approssimativamente di 0.4-0.5 g/anno, la maggior parte, quindi, veniva eliminata come fango digerito.
Il fango primario mostra le concentrazioni maggiori, i PCDD/F diminuiscono poi nel fango digerito (16, 13 e 9 ng/g s.s.) nel quale aumenta comunque la % di tossicità (0.24%, 0.22 e 0.32%) (Naf et al.,
1990). I composti predominanti sono l’eptaCDD e l’octaCDD, isomeri già osservati da altri ricercatori (Rappe et al., 1989), mentre i composti poco clorurati aumentano nel fango digerito. Questo relativo
aumento di composti con meno atomi di cloro e più tossici, può essere dovuto alla declorurazione degli epta e octa CDD. Di questo fango
digerito, circa il 90% viene usato come fertilizzante in campo (Naf et
al., 1990).
Analisi recenti sul contenuto in PCDD e PCDF in 16 fanghi inglesi
provenienti da aree diverse vengono illustrate nella tabella che segue
(tabella 4.3).
Origine
da aree agricole
mista (industriale
e da aree agricole)
industriale/domestica
(scarso apporto
industriale)
industriale /domestica
media
range
23.3
9-73
42.5
29-67
42.3
52.8
21-105
7.6-192
Tabella 4.3 - Concentrazioni di PCDD e PCDF in fanghi inglesi
(ng I-TEQ /kg s.s.) (Jackson and Edulijee, 1994).
Altri composti cloraromatici presenti negli effluenti industriali (cartiere, ecc.) sono gli alkil benzil clorurati (C5-PCBB), presenti in concentrazioni di 10- 120 ng/l negli effluenti, e da 5 a 33 ng/g nei fanghi
essicati (Koistinen, 1992), quantità quindi maggiori di PCDD e PCDF
presenti in misura inferiore a ng/l (ptt), o a 10 pg /l nell’effluente
(Beck et al.,1988; Amendola et al.,1989).
Anche in altre indagini su composti cloroaromatici planari (PLAC)
sono stati ritrovati gli RPCDF alchilati policlorodibenzofurani, nei
fanghi delle cartiere ammontano, ad esempio, a diverse centinaia di
ng/g, mentre la concentrazione di PCDD a PCDF è al di sotto del
ng/g (Buser et al., 1989; Beck et al., 1989).
114
Capitolo 4 DIOSSINE E F URANI
La tossicità di questi composti è sconosciuta ma la loro presenza e
struttura indica una possibile attività diossinsimile dal momento che
assomigliano ad altri policlorobenzeni e azoossibenzeni (Tanabe et
al.,1987) o a PCB planari e sono quindi tuttora oggetto di studio (Koistinen, 1992).
4.4 Degradazione
È noto che i movimenti attraverso il suolo di queste sostanze (leaching e volatilizzazione) sono molto lenti, è importante invece la diffusione in fase di vapore e la fotolisi in superficie.
L’emivita nel suolo è molto variabile, si può ipotizzare comunque
una persistenza di circa 10 anni (di 2,3,7,8-TCDD) (Jackson and
Eduljiee, 1994).
4.4.1 Biodegradazione
Il destino ambientale delle dibenzo-p-diossine e dei dibenzofurani
clorurati dipende da numerosi fattori, abiotici e biotici, tra cui i principali sono la fotodegradazione, la mobilità, la volatilità e la degradazione chimica e biologica. Rispetto alla fotodegradazione, gli altri
processi sembrano essere relativamente meno importanti. A causa
della sua estrema tossicità, il composto che ha ricevuto maggiore attenzione è la 2,3,7,8-tetraclorodibenzo-p-diossina (TCDD), mentre i
dati che riguardano i furani clorurati sono più scarsi. Questi ultimi,
comunque, hanno una struttura molecolare molto simile a quella delle diossine.
La biodegradazione è stata studiata in ambienti e in condizioni diverse (suolo e sedimenti, aerobiosi e anaerobiosi), in presenza di colture pure e di comunità microbiche, ma le potenzialità metaboliche
dei microrganismi nei confronti delle diossine (Arthur and Frea, 1989)
e dei furani clorurati sono limitate. Si tratta pertanto di composti persistenti nell’ambiente: la emivita della TCDD nel suolo è compresa tra
1 e 10 anni (Norris, 1981; Connell and Miller, 1984) mentre nei sedimenti varia tra 550 e 590 giorni (Connell and Miller, 1984).
In letteratura vengono riportati vari studi riguardo alla degradazione in presenza di colture microbiche pure. Matsumura and Benezet
115
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
(1973) hanno esaminato in coltura liquida circa 100 ceppi microbici
puri capaci di degradare pesticidi persistenti per verificare se fossero
in grado di metabolizzare la TCDD. Sono stati identificati cinque ceppi, tra cui l’eumicete Trichoderma viride e il batterio Pseudomonas puti da, che hanno mostrato una qualche capacità biodegradativa, ma in
nessun caso si è avuta mineralizzazione. Klecka and Gibson (1979)
hanno verificato in Pseudomonas il potenziale metabolico per la dibenzo-p-diossina non clorurata, trovando che essa veniva co-ossidata a
cis-1,2-diidro-1,2-diidrossidibenzo-p-diossina e a 1,2-diidrossidibenzo-p-diossina.
In studi successivi utilizzando Beijerinckia capaci di degradare il difenile, Klecka and Gibson (1980) hanno riscontrato che, quando la crescita avveniva in presenza di succinato e difenile, si aveva la co-ossidazione delle dibenzo-p-diossine clorurate e non clorurate. Le diossine monoclorurate (1-clorodibenzo- e 2-clorodibenzo-p-diossina) venivano ossidate più estesamente rispetto ai composti non clorurati,
ma una clorurazione ulteriore inibiva notevolmente l’ossidazione. Rispetto al difenile, il tasso relativo di ossidazione per le dibenzo-pdiossine monoclorurate superava il 72%, mentre nel caso della 1,2,4triclorodibenzo-p-diossina era pari all’8,9%. Come negli studi precedenti condotti su Pseudomonas, il composto cis-diidrossi era il primo
metabolita individuabile dell’ossidazione della dibenzo-p-diossina
non clorurata. Tuttavia, esso veniva convertito a 1,2-diidrossidibenzo-p-diossina, che in Beijerinckia si è rivelato un forte inibitore della
2,3-diidrossidifenil ossigenasi e della catecolo ossigenasi. Da questi
studi gli autori hanno concluso che le dibenzo-p-diossine clorurate e
non clorurate inducono la sintesi in Beijerinckia di enzimi capaci di ossidare il nucleo aromatico. Tuttavia, questo non accade per gli isomeri con un alto numero di atomi di cloro. Parsons et al. (1989) riportano
la co-ossidazione, in presenza di difenile, di alcune dibenzo-p-diossine e dibenzofurani a basso contenuto di cloro da parte di Alcaligenes
ceppo JB1, senza comunque che si arrivasse ad una biodegradazione
completa.
Hutter and Philippi (1982) hanno esaminato in laboratorio numerose colture microbiche, sia pure sia miste, per valutarne la eventuale
capacità di degradare la TCDD. La degradazione è risultata scarsa a
prescindere dai microrganismi coinvolti e dalle condizioni colturali
impiegate e solo l’1% del tossico è stato metabolizzato. Anche in questo caso, non si è avuta mineralizzazione. Dopo tempi di incubazione
lunghi (fino a parecchi mesi) è stato individuato per la prima volta un
116
Capitolo 4 DIOSSINE E F URANI
metabolita della TCDD, identificato come 1-idrossi-2,3,7,8-tetraclorodibenzo-p-diossina (Philippi et al., 1981, 1982).
Altre ricerche hanno confermato la scarsa tendenza dei microrganismi a metabolizzare la TCDD. Quensen and Matsumura (1983)
hanno studiato la degradazione in coltura pura di Bacillus megate r i u m, proveniente da collezioni, e di Nocardiopsis, isolato dal suolo.
Nuovamente, la biodegradazione è apparsa poco rilevante. Durante
lo stesso esperimento, sono stati isolati da un suolo agricolo arricchito con naftalene due batteri non identificati che mostravano una certa capacità di degradare la TCDD, ma il metabolismo era limitato. È
stato suggerito, ma non dimostrato, che gli organismi capaci di biotrasformare la TCDD possiedono una monossigenasi che va ad idrossilare una delle posizioni non sostituite sugli anelli aromatici della
molecola. Bumpus et al. (1985) riportano che l’eumicete Phanerochae te chrysosporium è in grado di mineralizzare la TCDD in condizioni ligninolitiche e di limitazione per l’azoto, grazie all’intervento di ligninasi extracellulari. Questi enzimi hanno una bassa specificità di
substrato (la lignina ha una struttura polimerica molto complessa e
variabile) per cui possono attaccare varie molecole organiche. L’autore suggerisce che anche altri basidiomiceti possono avere la stessa
capacità. Hammel et al. (1986) hanno studiato il metabolismo di Pha nerochaete chrysosporium, determinando che, come risultato dell’azione della ligninasi sulla dibenzo-p-diossina non clorurata, veniva prodotto un catione.
Wittich et al. (1992), nel corso di una ricerca sui batteri che possono
metabolizzare la dibenzo-p-diossina, hanno isolato un ceppo di
Sphingomonas da colture di arricchimento inoculate con campioni di
acqua proveniente dal fiume Elba. Il ceppo RW1 può crescere utilizzando come unica fonte di carbonio e di energia la dibenzo-p-diossina
e il dibenzofurano. Wilkes et al. (1996) hanno valutato se Sphingomo nas ceppo RW1 fosse in grado di ossidare composti clorurati derivati
dalla dibenzo-p-diossina e dal dibenzofurano. I risultati hanno mostrato che questo ceppo può degradare varie diossine e furani mono e
diclorurati, ma non metabolizza i composti che hanno più di due atomi di cloro nella molecola. La maggior parte delle dibenzo-p-diossine
e dei dibenzofurani mono e diclorurati analizzati in questo studio sono stati degradati, rispettivamente, ai corrispondenti catecoli e salicilati mono e diclorurati; si è riscontrata anche la contemporanea formazione di catecoli e salicilati non clorurati. Sulla maggior parte dei
substrati si è verificato un attacco ossidativo per intervento di due
117
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
atomi di ossigeno a livello dei nuclei aromatici sia sostituiti sia non
sostituiti. Il ceppo RW1 non è potuto crescere a spese delle dibenzo-pdiossine e dei dibenzofurani monoclorurati come unica fonte di carbonio, con l’eccezione del 4-clorodibenzofurano che è stato convertito
stechiometricamente a 3-clorosalicilato.
In aggiunta agli studi in coltura pura, sono state condotte varie ricerche su comunità microbiche provenienti da differenti campioni
ambientali. I dati confermano che il potenziale biodegradativo nei
confronti delle diossine clorurate è basso. Kearney et al. (1972) hanno
effettuato uno studio su due tipi di suolo, trovando che la TCDD persisteva in entrambi per almeno un anno. Uno dei due (ricco in argilla
e limo) conteneva il 2,5% di sostanza organica ed era inizialmente più
attivo dal punto di vista microbico. L’altro (ricco in sabbia e limo)
conteneva lo 0,9% di sostanza organica, con una attività microbica iniziale limitata. La TCDD è stata introdotta in entrambi i suoli con concentrazioni pari a 1, 10 e 100 mg/kg. Dopo un anno, tra il 54 e il 71%
della TCDD aggiunta era ancora presente, con piccole differenze tra i
due suoli. Ward and Matsumura (1978) hanno studiato la biodegradazione della TCDD nei sedimenti e nelle acque di due laghi del Wisconsin (Stati Uniti). Nei campioni di sola acqua, dopo una incubazione di 589 giorni, circa il 70% della TCDD era ancora presente. Il
metabolismo risultava stimolato dalla presenza di sedimenti e dall’aggiunta di nutrienti. Matsumura et al. (1983) hanno utilizzato uno
stagno all’aperto come modello di un ecosistema acquatico, trovando
che la emivita della TCDD era approssimativamente uguale ad un anno. Sebbene la biodegradazione possa avere avuto un certo ruolo, la
maggior parte della degradazione è imputabile a fenomeni abiotici
(fotodegradazione).
Camoni et al. (1982) hanno raccolto nell’area di Seveso, dopo qualche anno dall’incidente, campioni di suolo contaminato da TCDD con
una concentrazione di 0,1 mg/kg. Era lecito attendersi che i microrganismi, dopo un periodo di esposizione relativamente lungo, si fossero adattati alla presenza della TCDD e, una volta stimolati, fossero
in qualche modo capaci di metabolizzarla. Come controllo è stato utilizzato un suolo, simile a quello di Seveso nelle caratteristiche fisiche
e nella composizione, a cui è stata aggiunta TCDD per arrivare ad una
concentrazione finale di 0,1 mg/kg. Un trattamento ulteriore era rappresentato dalla presenza o assenza di sostanza organica aggiuntiva.
I suoli sono stati incubati aerobicamente per 480 giorni. Analisi periodiche hanno confermato la persistenza della TCDD in tutti i campioni;
118
Capitolo 4 DIOSSINE E F URANI
inoltre, non sono state riscontrate differenze nella biodegradazione
tra il suolo proveniente da Seveso e il controllo, nè tra i campioni con
o senza aggiunta di materiale organico. Nel complesso, questi risultati suggeriscono che i microrganismi capaci di metabolizzare la TCDD
non sono molto diffusi nell’ambiente. Anche dopo tempi di esposizione al tossico relativamente lunghi, i microrganismi indigeni non
sono risultati efficaci nella degradazione della TCDD. Come per alcuni pesticidi, la persistenza ambientale di questa molecola può essere
spiegata con il fatto che gli organismi presenti nell’ambiente non hanno la potenzialità enzimatica di degradarla.
Per quanto riguarda la biodegradazione delle dibenzo-p-diossine e
dei dibenzofurani policlorurati in anaerobiosi, alcuni studi hanno
mostrato che questi composti vengono convertiti da consorzi metanogeni in derivati meno clorurati (Adriaens et al., 1995), similmente a
quanto accade per i difenili e per altri composti aromatici policlorurati (Mohn and Tiedje, 1992).
Un aspetto che può essere importante per spiegare l’apparente resistenza delle dibenzo-p-diossine e dei debenzofurani clorurati alla degradazione microbica è legato alle loro caratteristiche chimico-fisiche.
La TCDD è altamente idrofoba, ha un alto coefficiente di ripartizione
ottanolo/acqua e, come altri composti organici clorurati, è apolare.
Malgrado la sua tendenza a distribuirsi nella fase solvente nei sistemi
solvente/acqua, essa è solo debolmente solubile nella maggior parte
dei solventi (Quensen and Matsumura, 1983; Connell and Miller,
1984). Questo suggerisce che il passaggio della TCDD attraverso la
membrana cellulare può essere difficile a causa della sua trascurabile
solubilità nei lipidi. Perciò, la mancata assunzione nella cellula microbica può essere uno dei fattori che limitano il metabolismo della
TCDD nell’ambiente, come proposto da Quensen and Matsumura
(1983). La scoperta da parte di Bumpus et al. (1985) che la TCDD viene degradata enzimaticamente a CO 2 da Phanerochaete chrysosporium,
indica che il metabolismo enzimatico della TCDD è possibile ma è limitato dal trasporto di membrana. Nel caso di Phanerochaete, infatti,
l’attacco iniziale sulla TCDD avviene extracellularmente e solo in una
fase successiva i metaboliti più polari vengono trasportati all’interno
della cellula per essere ulteriormente metabolizzati. È possibile che
enzimi degradativi specifici per la TCDD non si siano evoluti non perchè il metabolismo della TCDD sia intrinsecamente impossibile, ma
perchè essa, essendo poco solubile nell’acqua e nei lipidi ed essendo
fortemente legata al suolo, risulta poco biodisponibile.
119
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Matsumura et al. (1983) e Quensen and Matsumura (1983), nei loro
studi sulla degradazione della TCDD in colture pure di Bacillus mega terium e di Nocardiopsis, hanno trovato che la natura del solvente era il
fattore più importante che ne influenzava il metabolismo. I solventi
presi in esame comprendevano olio di mais, etanolo, dimetil solfossido ed etil acetato. L’olio di mais inibiva la degradazione della TCDD,
mentre il dimetil solfossido e l’etil acetato, rispetto all’etanolo, la stimolavano in modo significativo. In presenza di nutrienti aggiuntivi,
l’etil acetato è stato il solvente più efficace nella stimolazione del metabolismo della TCDD. Questo è molto importante, in quanto la messa a punto di metodi che consentano di mobilizzare le molecole per
l’attacco microbico può rendere possibile l’induzione della degradazione in situ.
Strettamente connessa alla idrofobicità della TCDD è la sua affinità
per la componente solida del suolo, specialmente per l’argilla e per la
sostanza organica. Aggiungendo 2,7-diclorodibenzo-p-diossina o
TCDD a differenti tipi di suolo variabili per il contenuto di sostanza
organica, la mobilità di entrambe le diossine è risultata inversamente proporzionale alla quantità di sostanza organica presente (Kearney et al., 1973). L’adsorbimento viene ritenuto uno dei maggiori fattori che contribuiscono alla persistenza in quanto rende la TCDD non
disponibile per l’attacco microbico (Quensen and Matsumura, 1983;
Dagani, 1984). Per esempio, nell’area coinvolta dall’incidente di Seveso, dopo un anno dalla contaminazione, la mobilità della TCDD
era limitata ai primi 8 cm del suolo (Di Domenico et al., 1982). Helling et al. (1973) hanno trovato che la TCDD risultava non mobile in
cinque tipi di suolo che differivano notevolmente per le proprietà
chimico-fisiche.
Jackson et al. (1986) hanno esaminato dieci tipi diversi di suolo, confermando la bassa mobilità della TCDD. Questa ricerca indica che la
sostanza organica presente nel suolo non sarebbe così importante nel
determinare la mobilità della TCDD. Per ambienti esposti da molti anni a questo tossico, i fattori che ne regolano la mobilità sono gli elettroliti del suolo e i co-contaminanti clorurati. La presenza di elettroliti inibisce la mobilità, mentre la presenza di co-contaminanti clorurati la favorisce.
Parson (1992) ha condotto uno studio, in soluzioni acquose, sulla
degradazione da parte di Alcaligenes ceppo JB1 di una miscela composta da 2-cloro-, 1,3-dicloro-, 2,8-dicloro- e 1,2,4-triclorodibenzo-pdiossina. In alcune delle colture sono stati aggiunti in sospensione 100
120
Capitolo 4 DIOSSINE E F URANI
mg/l di sedimenti. Dopo 168 ore di incubazione, nelle colture contenenti sedimenti la quantità degradata di tutti i quattro composti è stata superiore alla quantità disponibile in soluzione all’inizio della prova. Pertanto, dopo tempi di incubazione relativamente brevi, le frazioni adsorbitesi ai sedimenti erano legate in modo sufficientemente
poco stabile da risultare disponibili per la biodegradazione. Tuttavia,
la velocità degradativa nelle colture in presenza di sedimenti è risultata inferiore rispetto a quella nelle colture che ne erano prive. Questo
implica che tempi di residenza più lunghi, come quelli che si hanno in
campo, possono condurre ad un abbassamento significativo della velocità biodegradativa, specialmente nel caso di composti altamente
clorurati e quindi più idrofobi.
La natura della matrice ambientale è determinante nel regolare la
biodisponibilità della TCDD, influendo sulla tossicità e sulla biodegradazione (Quensen and Matsumura, 1983; Tsushimoto et al., 1982).
Per aumentare la biodisponibilità, sono stati impiegati tensioattivi
formulati per solubilizzare i pesticidi alogenati (Arthur, 1987). Concentrazioni dei tensioattivi non tossiche per i microrganismi hanno
solubilizzato la TCDD legata al suolo. Trattando per 6 mesi un suolo,
in condizioni aerobiche, con un tensioattivo appropriato, la concentrazione della TCDD è scesa da 2,0 a 0,99 mg/kg. La precedente incubazione per un anno, in aerobiosi, dello stesso suolo fertilizzato non
ha influito sulla concentrazione della TCDD. Dal momento che non è
stata individuata alcuna mineralizzazione della TCDD e i suoi potenziali metaboliti non sono stati analizzati, non è chiaro se la eliminazione della TCDD nel suolo trattato con tensioattivi fosse dovuta a
fattori biotici o chimico-fisici. Per esempio, è possibile che sia aumentata la volatilità. In ogni caso, tenendo presente che il suolo analizzato risultava contaminato da più di dieci anni, i risultati suggeriscono
che la decontaminazione attraverso l’uso di tensioattivi o di altri
agenti mobilizzanti può essere vantaggiosa.
La concentrazione o la natura fisica di un composto possono inibire
gli organismi o i loro enzimi, andando ad influire sulla persistenza
nell’ambiente. Questo aspetto ha ricevuto scarsa attenzione nel caso
della TCDD. Sebbene numerose ricerche abbiano confermato la tossicità della TCDD per gli organismi superiori, pochi sono i lavori che riguardano la tossicità per i microrganismi. Bollen and Norris (1979)
hanno valutato la respirazione (rilascio di CO2) in un terreno forestale e in un suolo in presenza di TCDD. La TCDD è stata aggiunta in
concentrazioni molto basse (13,1x10 -9 , 13,1x10 -7, 13,1x10 -5 mg/kg al
121
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
terreno forestale; 5,2x10-9, 5,2x10-7, 5,2x10 -5 mg/kg all’altro). I campioni sono stati incubati aerobicamente per 28 giorni. La TCDD non ha
avuto alcun effetto sul terreno forestale ma ha stimolato la respirazione nell’altro suolo. Gli autori hanno concluso che la stimolazione della respirazione nel suolo concordava con quello che hanno chiamato
“Principio di Heuppe” (dal nome di un batteriologo del XIX sec.): i
composti che sono letali a certe concentrazioni, inibiscono lo sviluppo a concentrazioni subletali e stimolano l’attività biologica a concentrazioni ancora più basse. È stato suggerito che la TCDD a concentrazioni superiori a quelle usate nell’esperimento avrebbe inibito la respirazione nei due suoli, ma questa ipotesi non è stata verificata.
Arthur and Frea (1987) hanno esaminato l’attività microbica in suoli provenienti dall’area di Times Beach, Missouri (Stati Uniti). I campioni sono stati ammendati con farina di erba medica (Medicago sati va) e la sperimentazione è durata 50 giorni. I parametri microbiologici considerati comprendevano: conta dei batteri aerobi, dei batteri aerobi oligotrofi, degli eumiceti, degli attinomiceti, misura dell’attività
deidrogenasica, fosfatasica acida e alcalina, arilsolfatasica, rodanesica e infine valutazione della respirazione (evoluzione di CO 2). I suoli
contenevano 0,008, 1,1 o 2,4 mg/kg di TCDD, concentrazioni decisamente più alte di quelle utilizzate da Bollen and Norris (1979). La
maggior parte dei parametri rilevati era comparabile a quella di un
suolo simile usato come controllo, ma non contaminato da TCDD. Per
quanto riguarda la respirazione, i suoli in cui erano presenti le due
concentrazioni più alte di TCDD rilasciavano una quantità di CO2 decisamente superiore al controllo e al suolo con la concentrazione più
bassa, senza che la TCDD fosse mineralizzata. Questi risultati contrastano con quanto suggerito da Bollen and Norris (1979). In un lavoro
successivo, Arthur (1987) ha condotto una ricerca su suoli del New
Jersey (Stati Uniti), in cui erano presenti fino a 26,3 mg/kg di TCDD,
trovando che la respirazione non veniva inibita dalla presenza del
tossico. Pertanto, apparentemente la TCDD nel suolo non sembra essere tossica per i microrganismi.
La persistenza ambientale di alcuni composti organici dipende anche dalla loro configurazione sterica, che può prevenire od ostacolare
l’attacco enzimatico. La posizione di un sostituente alogenato su un
anello aromatico può sia attivare sia ritardare la degradazione. Nel
caso della TCDD, posizioni adiacenti di solito soggette all’idrossilazione da parte di ossigenasi sono occupate da atomi di cloro. Questo è
vero anche per la 1,3,6,8-tetraclorodibenzo-p-diossina, che è soggetta
122
Capitolo 4 DIOSSINE E F URANI
a subire trasformazioni metaboliche minime nel suolo e nei sedimenti (Muir et al., 1985). Le diossine con meno cloruri sembrano più suscettibili all’attacco enzimatico. Per esempio, in campioni di suolo la
2,7-diclorodibenzo-p-diossina è stata ossidata a CO2 e metaboliti polari (Kearney et al., 1972). Pertanto l’ingombro sterico, insieme ad altre caratteristiche della TCDD (bassa solubilità in acqua, forte legame
con il suolo e i sedimenti, bassa biodisponibilità, potenziale tossicità
dei composti parenti e dei metaboliti), contribuisce alla sua persistenza ambientale.
L’ultimo aspetto che può influire sulla biodegradazione è dovuto al
fatto che nell’ambiente può mancare qualche fattore essenziale alla
crescita microbica oppure può essere presente qualche ulteriore tossico che inibisce i microrganismi degradanti. Nel caso della TCDD, anche in condizioni presumibilmente ottimali per la crescita quali quelle in laboratorio, il metabolismo è risultato basso o inesistente. Spesso
la TCDD è presente nell’ambiente associata a vari co-contaminanti,
che potrebbero essere tossici per i microrganismi e limitare il potenziale biodegradativo. Tuttavia, Arthur (1987) e Arthur and Frea (1987)
riportano l’esistenza di una considerevole attività microbica in suoli
provenienti dall’area di Times Beach e dal New Jersey, a dispetto dell’alto contenuto di solventi estraibili. Una ulteriore possibilità è che i
co-contaminanti vengano preferiti come substrato e perciò ritardino il
metabolismo della TCDD nell’ambiente. Questo fenomeno è stato osservato per alcuni carboidrati (per esempio, il glucosio spesso viene
preferito al lattosio). Meyer et al. (1984) hanno dimostrato che esso è
applicabile anche agli idrocarburi aromatici. Pertanto, se non si tiene
conto di questa problematica, le previsioni sulla biodegradazione di
xenobiotici in miscela nell’ambiente basate su ricerche condotte su
singoli inquinanti possono essere non realistiche.
Trattamento biologico (bioremediation) e degradazione abiotica
La bonifica di aree contaminate da composti organici alogenati persistenti è difficile e costosa. Essa può essere realizzata mediante incenerimento o rimozione per scavo (Esposito, 1980). Tuttavia, incenerire grandi quantità di suolo non è nè economico nè sicuro dal punto di
vista ambientale (può provocare un inquinamento secondario), mentre accumularlo non può rappresentare una soluzione definitiva.
Crescente è l’interesse per la biodegradazione in situ, anche se il
trattamento biologico presenta alcuni problemi in quanto, nei test di
123
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
laboratorio e nelle prove in campo, la biodegradazione della TCDD
non è stata significativa. Come nel caso di molti altri idrocarburi clorurati, essa è particolarmente resistente all’attacco microbico. Tuttavia, Bumpus et al. (1985) hanno dimostrato che l’eumicete P h a n e r o chaete chrysosporium può attaccare una serie di composti altamente
persistenti e tossici, tra cui la TCDD. Esso potrebbe quindi essere impiegato per la biodegradazione in situ.
Alcuni autori hanno osservato la rapida fotodegradazione e declorurazione di OCDD e OCDF sulla superficie del suolo, con la conseguente formazione di isomeri meno clorurati (30% di trasformazione
in 16 gg) (Jackson and Eduljiee, 1994). Dal momento che nel fango
prevale solitamente la presenza di OCDD, la fotodegradazione assume una certa importanza nei suoli ammendati coi fanghi, anche se si
verifica solo a 0.1-0.5 mm dalla superficie; comunque l’incorporazione del fango nel terreno, la prevalenza di specie altamente clorurate
e di conseguenza meno volatili, la matrice lipidica e organica del fango stesso, che è in grado di legare fortemente questi composti riducendone la mobilità nel suolo, possono influenzare la percentuale di
fotodegradazione (Jackson and Eduljiee, 1994).
La fotodegradazione mediante luce solare o radiazione UV non è
stata presa in considerazione come tecnologia per la detossificazione
di aree contaminate, in quanto l’effetto è limitato al solo strato superficiale. Nessuno studio aveva dimostrato un vantaggioso uso contemporaneo di microrganismi e di radiazione luminosa per la degradazione di composti altamente persistenti. L’ostacolo principale è
stata la sensibilità dei microrganismi alla radiazione UV. Per superare questo problema Katayama and Matsumura (1991) hanno isolato
un ceppo di Phanerochaete chrysosporium resistente alla radiazione
UV. L’uso contemporaneo di radiazione UV e del ceppo BKM F-1767
in un mezzo di coltura limitante per l’azoto ha determinato una velocità degradativa superiore a quella ottenuta con l’impiego separato
delle due tecniche.
I risultati su TCDD mostrano chiaramente una maggior velocità di
mineralizzazione di questo composto in presenza di azioni fotochimiche, che giunge al 5.8% in 40 gg (contro lo 0.27% ottenuto solo con
l’eumicete e lo 0.19% senza entrambi) (Katayama and Matsumura,
1991).
Altri esperimenti rilevano valori di mineralizzazione intorno al 97%
delle quantità applicate inizialmente, con un simultaneo trattamento
con l’eumicete e con UV a 254 o 300 nm. Analoghi risultati si ottenne-
124
Capitolo 4 DIOSSINE E F URANI
ro con altri composti organici persistenti quali, DDT, dieldrin, eptacloro, toxafene, TCB, ecc. (Katayama and Matsumura, 1991).
Recentemente l’attenzione si sta focalizzando sui reattori biologici,
all’interno dei quali è possibile ottimizzare le condizioni biodegradative. È stato dimostrato che i microrganismi degradanti possono crescere adesi a fibre acriliche; in questo modo si viene a creare una ampia superficie attiva dal punto di vista biodegradativo. Facendo ruotare le fibre o pompando attraverso di esse una soluzione contenente
il materiale da trattare, si può ottenere una velocità di reazione superiore a quella che si avrebbe in una sospensione di cellule microbiche.
L’impiego di alcuni eumiceti e di radiazione luminosa, che agisce sugli strati superficiali, consentirebbe la degradazione delle diossine e
di altri composti organici clorurati.
Dal momento che non sempre è possibile isolare direttamente dall’ambiente colture microbiche pure capaci di mineralizzare gli xenobiotici tossici, una via per superare questo problema implica il ricorso
a tecniche di ingegneria genetica, che consentono di produrre ceppi
dotati di nuove proprietà metaboliche, microrganismi specializzati
per il trattamento biologico dei vari inquinanti ambientali.
Poichè la maggior parte dei suoli è aerobica solo nei primi strati, la
biodegradazione in condizioni anaerobiche potrebbe essere vantaggiosa (Rugge et al., 1993). La rimozione di atomi di cloro da altri composti aromatici alogenati è già stata osservata in condizioni di metanogenesi e di solfato-riduzione, ma non in presenza di nitrato-riduzione. Più recentemente è stata riscontrata la declorurazione di dibenzo-p-diossine e di dibenzofurani policlorurati da parte di consorzi microbici metanogeni (Adriaens et al., 1995). La biodegradazione
in condizioni denitrificanti sarebbe vantaggiosa in quanto il potenziale redox richiesto non è molto rigoroso e i batteri denitrificanti sono tutti facoltativi e perciò tolleranti nei confronti dell’ossigeno molecolare.
Per realizzare la biodegradazione anaerobica della TCDD in situ, occorre avere a disposizione una popolazione microbica stabile capace
di dealogenare i composti aromatici. A tale scopo, Rugge et al. (1993)
hanno condotto uno studio sulla degradazione di composti aromatici
clorurati solubili in acqua analoghi della TCDD (2-clorofenolo, 3-clorofenolo, 4-clorofenolo, 2,3-diclorofenolo, 3,4-diclorofenolo, 4,5-diclorocatecolo, catecolo), in condizioni sia metanogeniche sia denitrificanti. Utilizzando colture miste provenienti da sedimenti, è stata osservata, in entrambe le condizioni anaerobiche, la dealogenazione dei
125
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
monoclorofenoli (con formazione di fenoli) e dei diclorofenoli (con
formazione di monoclorofenoli e di fenoli). Il catecolo clorurato, invece, non è stato biodegradato in nessuna delle due condizioni colturali, mentre il catecolo non clorurato è stato metabolizzato solo in condizioni metanogene. In alcune colture, contenenti una miscela dei vari composti, è stato aggiunto n-butanolo per testarne la potenzialità di
impiego come agente solubilizzante, ma esso ha inibito la mineralizzazione in condizione sia metanogene sia denitrificanti.
4.5 Piante
L’uptake di PCDD/F presenti nei fanghi da parte delle piante coltivate è stato indagato soprattutto in relazione ai rischi di contaminazione della catena alimentare.
In merito all’assorbimento radicale il potenziale uptake di PCDD/F
sembra dipendere dalla concentrazione di inquinanti nella sostanza
organica, piuttosto che dalle quantità presenti in totale. Dal momento
che l’aggiunta di fanghi non aumenta solo gli inquinanti, ma anche il
contenuto di materia organica del suolo (la S.O. media presente nel
suolo tedesco è 5-6% di s.s. e l’apporto dato dal fango è dello 0.7%),
l’aumento della concentrazione risulta comunque inferiore rispetto
all’aumento totale (Broman et al., 1990).
L’importanza della concentrazione di questi composti nel suolo in
relazione ad altre vie di assorbimento, come per esempio i depositi atmosferici, è tuttora difficile da dimostrare per l’insufficiente numero
di dati disponibili (Broman et al., 1990).
Gli stessi autori hanno comunque osservato che la volatilizzazione
dei PCDD/F dal suolo e dai depositi che si rilevano sulle superfici fogliari è in corrispondenza al contenuto del suolo: si è infatti dimostrato che la vicinanza alle fonti di emissione influenza il livello di
PCDD/F negli aghi di pino (Broman et al.,1990).
In uno studio su mais e fagiolo allevati su suoli contaminati si è osservato che l’uptake di 2,3,7,8-TCDD alle parti aeree di queste piante è
di bassa entità, e può essere ulteriormente ridotto dall’aggiunta di torba (Sacchi et al., 1986).
Dal momento che si tratta di composti che evaporano dal suolo nell’atmosfera con una pressione di vapore piuttosto alta (Bacci and Gag-
126
Capitolo 4 DIOSSINE E F URANI
gi, 1987), nell’aria i PCDD tendono a ripartirsi nel modo seguente: i
meno alogenati nella fase di vapore e quelli con più atomi di cloro,
principalmente, nel particolato atmosferico; anche se altri autori riportano, in contraddizione con l’affermazione precedente, che anche
i composti fino a 6-8 Cl si possono ritrovare nella fase di vapore (Eitzer and Hites, 1989).
Il trasferimento aria-superficie fogliare deve quindi essere preso in
considerazione, a livello di uptake da parte della pianta, particolarmente per i composti meno solubili, caratterizzati da una bassa mobilità nell’acqua e conseguentemente, una trascurabile traslocazione
per via radicale in suoli inquinati (Reicschl et al., 1989a, 1989b).
In seguito a ciò è stata condotta una sperimentazione riguardante la
potenziale volatilizzazione del PCDD dai suoli contaminati, calcolando il fattore di biocencentrazione su foglie di piante di azalea. I risultati indicano come i composti cosiddetti poco volatili possono muoversi in modo significativo dal suolo nell’atmosfera. Se si tratta di
composti non polari, come la maggior parte dei PCDD, si rileva una
forte bioconcentrazione foglia/aria. (Bacci et al., 1992)
Le indagini condotte sulla presenza di queste sostanze nei fanghi
destinati all’agricoltura ed i relativi rischi di contaminazione della catena alimentare hanno portato alcuni Paesi come la Germania a limitare le applicazione dei fanghi ad alcune colture, escludendo ad esempio i terreni a pascolo. Allo scopo di verificare la reale pericolosità
delle diossine apportate dai fanghi è stato recentemente concluso uno
studio approfondito sull’ entità dell’uptake da parte delle piante coltivate e il conseguente consumo da parte degli animali e dell’uomo
(Jackson and Eduljiee, 1994).
Nel modello proposto i fanghi venivano distribuiti sotto forma liquida ai terreni a pascolo (2.42 t /ha) alla profondità di 1 cm, e in forma solida alle terre arabili (12.5 t /ha), in quest’ultime il fango era incorporato nel terreno a 20 cm di profondità. La concentrazione di
background dei suoli arabili inglesi è di 2.27 ng I-TEQ/kg s.s. di PCDD
e PCDF (Kjeller et al., 1991), i risultati di questa sperimentazione indicano un contenuto di 2.99-3.91 nei suoli arabili e 5.08-8.63 ng
I-TEQ /kg s.s. nei terreni a pascolo. Dati tedeschi riportano concentrazioni nei terreni a pascolo trattati coi fanghi di 2-10 ng I-Teq/kg s.s.
(McLachlan, 1994).
Il modello prevede dunque un aumento nei suoli arabili di 0.1 e nei
pascoli 0.38 ng I-TEQ /kg s.s. per una sola applicazione di fango pro-
127
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
venienti da aree agricole (cfr. tabella 4.3) in accordo con Wild et al.
(1994) che accertano un incremento di 0.22 ng I-TEQ /kg s.s. nei suoli
arabili (la differenza è data dal considerare o meno la possibilità di
perdite dopo l’applicazione del fango).
L ’u p t a k e da parte delle piante coltivate (patate, vegetali da foglia,
vegetali da radice e cereali) nel modello prevedeva dunque l’applicazione del fango a suoli con un background di 2.27 ng I-TEQ /kg s.s. per
10 anni (è però stato considerato solo l’assorbimento radicale e non
quello atmosferico). I risultati, illustrati nella tabella (tabella 4.4), mostrano valori al di sotto di quelli permessi dal Ministero dell’Agricoltura Inglese (MAFF, 1992) tranne per i cereali. Nei vegetali da foglia
bisogna però considerare la mancanza dell’apporto atmosferico. Sperimentazioni tedesche della durata di 30 anni mostrano valori di 0.351.2 ng I-TEQ /kg s.s. di PCDD/F nell’erba da pascolo, le concentrazioni più elevate possono essere ascritte a un numero maggiore di applicazioni e ai depositi atmosferici.
vegetali
patate
cereali
vegetali da radice
vegetali da foglia
background
valore previsto per
suoli trattati
con i fanghi
dati MAFF
1.4 x 10 - 2
6.7 x 10 - 2
7.5 x 10 - 3
5.2 x 10 - 3
2.6 x 10 - 2
1.1 x 10 - 1
1.3 x 10 - 2
9.0 x 10 - 3
4 x 10 - 2
5 x 10 - 2
9 x 10 - 2
2 x 10 - 2
Tabella 4.4 - Confronto tra le concentrazioni di PCDD/F nei vegetali previste
dal modello e quelle del MAFF (Jackson and Eduljiee, 1994).
4.6 Animali
Anche per quanto riguarda gli animali le indagini finora condotte
sull’apporto di PCDD/F da parte dei fanghi sono in relazione al rischio di contaminazione alimentare.
Nello studio di Jackson and Edulijee (1994) cui è già stato accennato,
dopo una decennale applicazione di fanghi a terreni con un b a c k ground di 2.27 ng I-TEQ /kg s.s. si sono ipotizzati dei valori per le concentrazioni di PCDD/F nella carne, assumendo dei valori di b a c k ground per l’erba da pascolo di 0.88 ng I-TEQ /kg s.s. e per la carne, in
128
Capitolo 4 DIOSSINE E F URANI
assenza di trattamenti con fanghi, di 0.55 ng I-TEQ /kg s.f. (valori simili a quelli indicati dal MAFF).
Le concentrazioni di PCDD/F previste vanno da 0.73 a 0.96 ng ITEQ /kg s.f., mentre dopo una singola applicazione di fango sono pari a 0.57 - 0.60 ng I-TEQ /kg s.f. in accordo con altri autori (Wild et al.,
1994) che hanno ipotizzato valori di 0.7 ng I-TEQ /kg s.f dopo una sola applicazione di fango (con background di 0.41 ng I-TEQ /kg s.f.).
A proposito del latte, invece, con valori di background di 0.05 ng ITEQ /kg s.f. (simili a quelli del MAFF e a quelli di Wild et al., 1994) si
è previsto un aumento dopo una singola applicazione di fango di
0.044-0.046 ng I-TEQ /kg s.f. contro lo 0.164 ng I-TEQ /kg s.f. di Wild
et al. (1994). In ogni caso si è al di sotto del valore indicato come massima concentrazione tollerabile per il latte intero che è di 0.7 ng
I-TEQ /kg s.f. stabilito dal MAFF.
Dopo trent’anni di trattamento con fanghi i valori previsti erano di
1.5-1.9 ng I-TEQ /kg s.f. di PCDD/F nel grasso del latte in accordo
con l’1.1-2 ng I-TEQ /kg s.f. osservato da altri autori (McLachlan et
al., 1994).
Le conclusioni di questo studio sono quindi che i fanghi provenienti da aree agricole contribuiscono in maggior misura alla contaminazione alimentare da parte di PCDD/F, ma l’apporto complessivo di
queste sostanze da parte dei fanghi non sembra comportare rischi per
la salute umana.
Infatti, assumendo un’ emivita dei PCDD/F nei terreni ammendati
di 10 anni, il massimo incremento giornaliero stimato è di 0.8 pg I-TEQ
/kg per giorno, che significa un aumento del 45% rispetto agli attuali
livelli di background. Per chi consumasse solo prodotti provenienti da
terreni trattati con fanghi si prevede un valore di circa 2 pg I-TEQ/kg
per giorno, abbondantemente al di sotto i limiti indicati dal MAFF per
il TDI (intake dato dalla dieta) pari a 10 pg I-TEQ/kg per giorno.
Conclusioni
Le diossine appartengono a quel gruppo di sostanze inquinanti, ormai ubiquitarie, che, pur non essendo prodotte industrialmente, raggiungono l’ambiente o come prodotti derivati, o come residui provenienti dall’incenerimento.
129
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Nei suoli sono stati rilevati dei valori di PCDD e PCDF, espressi in
equivalenti di tossicità, che vanno dai 10 ai 50 pg TEQ /g di S.O., valori leggermente inferiori provenivano dalle aree meno urbanizzate.
La concentrazione di questi composti nei fanghi era pari a 79 pg
TEQ/g di sostanza organica; la fertilizzazione con i fanghi aumenta
dunque il contenuto iniziale del terreno del 2-3 %.
Solitamente nei fanghi le concentrazioni medie vanno da 20 a 100
ppb .
Generalmente poco degradabili e poco lisciviabili, questi composti
mostrano un’alta ritenzione a livello radicale (TCDD), ma scarsi assorbimento e traslocazione.
Il potenziale uptake da parte delle radici delle piante dipende, comunque, dalla concentrazione degli inquinanti nella sostanza organica del terreno, che, ricordiamo, viene a sua volta aumentata dall’applicazione del fango.
Anche la volatilizzazione dipende dal contenuto di questi composti
nel suolo; è rilevante soprattutto per i composti poco solubili e quindi
meno mobili nell’acqua e minimamente traslocati per via radicale.
In ogni caso, risulta più pericolosa la contaminazione degli animali
attraverso l’ingestione del suolo, rispetto alla contaminazione aerea
del foraggio, piuttosto bassa.
Possiamo concludere infine che, anche se ci vorrebbero 50 anni per
fornire al terreno coi fanghi quantità pari al contenuto iniziale di diossine nel suolo, la tossicità di questi composti, insieme a quella di altri
composti diossinsimili (RPCDF alchilati policlorodibenzofurani, ecc.)
è tuttora oggetto di studio.
130
Capitolo 4 DIOSSINE E F URANI
Bibliografia
ABENDT R., BALZER W., P L USCHKE P., (1993): Formation of
PCDD/F during drying process of sewage
sludge. Organohalogen Compounds, 11,
289-292.
ADRIAENS P., FU Q., GRBIC-GALIC
D., (1995): Bioavailability and trasforma tion of highly chlorinated dibenzo-pdioxins and dibenzofurans in anaerobic
soils and sediments. Environ. Sci. Tech nol., 29, 2252.
AMENDOLA G., BARNA D., BLOSSER R., LAFLEUR L., MCBRIDE A.,
THOMAS F., TIERNAN T., WHITTEMORE R., (1989): The occurence and fa te of PCDDs and PCDDFs in five blea ched kraft pulp and paper mills. Chemo sphere, 8, 1181-1188.
ANTHONY K.W. HO, C L E M E N T
R.E., (1990): Chlorinated dioxins/furans
in sewage and sludge of municipal water
pollution control plants. Chemosphere,
20, 10/12, 1549 - 1552.
ARTHUR M.F., (1987): Soils containing
2,3,7,8-tetrachlorodibenzo-p-dioxin:
aspects of their microbial activity and the
potential for their microbially-mediated
decontamination. Ph.D. diss. The Ohio
State Univ., Columbus (Diss. Abstr.
87-26585).
ARTHUR M.F., FREA J.I., (1987): M i crobial activity in soils containing 2,3,7,8TCDD. Environ. Toxicol. Chem., 7, 5.
ARTHUR M.F., FREA J.I., (1989):
2,3,7,8-tetrachlorodibenzo-p-dioxin:
aspects of its important properties and its
potential biodegradation in soils. J. Envi ron. Qual., 18, 1.
BACCI E., GAGGIC., (1987): Chlorina ted pesticides and plant foliage: transloca tion experiments. Bull Environ. Toxicol.,
37, 850-857.
BACCI V., CEREJEIRA M. J., GAGGI
C., CHEMELLO G., CALAMARI D.,
VIGHI M., (1992): Chlorinated dioxins:
Volatilization from Soils and Bioconcen tration in Plant Leaves. Bull. Environ.
Contam. Toxicol., 48, 401-408.
131
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
BECK H,. DROSS A., ECKART K.,
MATHAR W., WITTKOWSKI R .,
(1989): PCDDs, PCDFs and related com pounds in paper products. Chemosphere,
19, 655-660.
BECK H., ECKART K., MATHAR W.,
WITTOWSKI R ., (1988): Occurence of
PCDD and PCDF in different kinds of pa per. Chemosphere, 17, 51-57.
BOLLEN W.B., NORRIS L.A., (1979):
Influence of 2,3,7,8-tetrachlorodibenzo-pdioxin in a forest floor and soil. Bull. En viron. Contam. Toxicol., 22, 648.
BROMAN D., NAF C., ROLFF C. , ZEBUHR Y., (1990): Analysis of polychlori nated dibenzo-p-dioxins (PCDD) and
polychlorinated dibenzofurans (PCDF) in
soil and digested sewage sludge from
Stockolm, Sweden.
CONNELL D.W., MILLER G.J., (1984):
Chemistry and Ecotoxicology of Pollu tion. John Wiley and Sons, New York.
DAGANI R., (1984): Dioxin bioavailabi lity research: future approaches ponde red. Chem. Eng. News, 62, 18.
DI DOMENICO A., VIVIANO G.,
ZAPPONI G., (1982): E n v i r o n m e n t a l
persistence of 2,3,7,8-TCDD at Seveso.
In: Chlorinated Dioxins and Related
Compounds: Impact on the Environment
(O. Hutter, ed.), p. 105. Pergamon
Press, New York.
EITZER B.D., HITES R.A., ( 1 9 8 9 ) :
Dioxins and furans in the ambient atmo sphere: a baseline study. Chemosphere,
18, 593-598.
BUMPUS J.A., TIEN M., WRIGHT D.,
A U S T S.D., (1985): Oxidation of persi stent environmental pollutants by a white
rot fungi. Science, 228, 1434.
ESPOSITO M.P., DRAKE H.M.,
SMITH J.A., OWENS T.W., (1980):
Dioxins: Vol. 1. Sources, exposure, tran sport, and control. EPA 600/2-80-156.
Industrial Environ. Res. Lab., USEPA;
Cincinnati, OH.
BUSER H.R., KJIELLER L.O., SWANSON S.E., RAPPE C ., (1989): M e t h y l ,
polymetyl, and alkylplychlorodibenzofu rans identified in pulp mill sludge and se diments. Environ. Sci. Technol., 2 3 ,
1130-1137.
GIRTH R., KLOPFFER W., RIPPEN
G., PARTSCHT H ., (1991): In v e s t i g a tions on potential sources of polyclorina ted dibenzo-p-dioxins and dibenzofurans
in sewage sludges. Chemosphere, 23, n.
11/12, 1653-1659.
CAMONI I., DI MUCCIO A., PONTECORVO D., VERGORI L.,(1982): Labo ratory investigation for the microbiologi cal degradation of 2,3,7,8-tetrachlorodi benzo-p-dioxin in soil by addition of orga nic compost. In: Chlorinated Dioxins and
Related Compounds: Impact on the Envi ronment (O. Hutzinger, ed.), p. 95. Pergamon Press, Oxford.
HAMMEL K.E., KALYANARAMAN
B., KIRK T.K., (1986): Oxidation of
polycyclic aromatic hydrocarbons and di benzo-p-dioxins by Phanerochaete chrysosporium ligninase. J. Biol. Chem., 261,
16948.
132
HARRISON N., (1994): Dioxins in food:
MAFF studies in Derbyshire. Paper pre-
Capitolo 4 DIOSSINE E F URANI
sented at at the International symposium on Dioxins, Furans, PCBs and
PAHs, 5-6 January, Lancaster, UK.
HELLING C.S., ISENSEE A.R.,
WOOLSON E.A., ENSOR P.D.J., JONES G.E., PLIMMER J.R., KEARNEY
P.C., (1973): Chlorodioxins in pesticides,
soils, and plants. J. Environ. Qual., 2,
171.
HORSTMANN M., MCLACHLAN
M., REISSINGER M., (1992): Investiga tions of the origin of PCDD/F in munici pal sewage sludge. Organohalogen com pounds, 9, 97-100.
HORSTMANN M., MCLACHLAN
M., REISSINGER M., (1993): F u r t h e r
investigations of the sources of PCDD/F
in municipal sewage sludge. Organohalo gen compounds, 11, 293-296.
HUTTER R., PHILIPPIM., (1982): Stu dies of microbial metabolism of TCDD
under laboratory conditions. In: C h l o r i nated Dioxins and Related Compounds:
Impact on the Environment (O. Hutzinger et al., ed.), p. 87. Pergamon Press,
Oxford.
JACKSON D.R., ROULIER M.H.,
GROTTA H.M., RUST S.W., WARNER J.S., (1986): Solubillity of 2,3,7,8TCDD in contaminated soils. In: Chlori nated Dioxins and Dibenzofurans in Per pective (C. Rappe et al., ed.), p. 185.
Lewis Publishers, Chelsea, MI.
JACKSON A.P., EDULJIEE G . H . ,
(1994): An assesment of the risks associa ted with PCDD/F following th application
of sewage sludge to agriculutral land in
the UK Chemosphere, 29, 12, 2523-2543.
KATAYAMA A., MATSUMURA F . ,
(1991): Photochemically enhanced micro bial degradation of environmental pollu tants. Environ. Sci. Technol., 25, 1329.
KEARNEY P.C., WOOLSON E.A., ELLINGTON C.P.,(1972): Persistence and
metabolism of chlorodioxins in soils. En viron. Sci. Technol., 6, 1017.
KEARNEY P.C., WOOLSON E.A.,
ISENSEE A.R., HELLING C.S., (1973):
Tetrachlorodibenzodioxin in the environ ment: sources, fate, and decontamination.
Environ. Health Perspect., 5, 273.
KJIELLER L. O., JONES K.C., JOHNSTON A.E., RAPPE C., (1991): Increa ses in polychlorinated dibenzo-p-dioxin
and furan content of soils and vegetation
since the 1840s. Environ. Sci. Technol.,
25, 1619-1627.
KLECKA G.M., GIBSON D.T., (1979):
Metabolism of dibenzo 1 , 4 - d i o x i n b y
Pseudomonas species. Biochem. J., 180,
639.
KLECKA G.M., GIBSON D.T., (1980):
Metabolism of dibenzo-p-dioxin and chlo rinated dibenzo-p-dioxins by a B e i j erinckia species. Appl. Environ. Micro biol., 39, 288.
KLOPFFER W., RIPPEN G., GIRH R.,
PARTSCHT H., STOLL U., MULLER
J., (1990): Untershugengen uber mogliche
Quellen der polychlorirten Dibenzodioxi ne und Dibenzofurane in Klarschlammen.
Final Report to Umweltbundesamt
(UBA), Berlin.
KOISTINEN J., (1992): Alkyl polychlo robibenzyls and planar aromatic chloro -
133
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
compounds in pulp mill products, ef fluents, sludges and exposed biota. Che mosphere, 24, 5, 559-573.
LAMPARSKI L.L., NESTRICK T.J.,
STENGER V . A ., (1984): Presence of
chlorodibenzo dioxins in a sealed 1933
sample of dried municipal sewage sludge.
Chemosphere, 13, 361-365.
MATSUMURA F., BENEZET H . J . ,
(1973): Studies on the bioaccumulation
and microbial degradation of 2,3,7,8-tetra chlorodibenzo-p-dioxin. Environ. Health
Perspect., 5, 253.
MATSUMURA F., QUENSEN J., TSUSHIMOTO G., (1983): Microbial degra dation of TCDD in a model ecosystem. In:
Human and Environmental Risks of Ch lorinated Dioxins and Related Com pounds (R.E. Tucker et al., ed.), p. 191.
Plenum Press, New York.
MCLACHLAN M.S., HINKEL M.,
REISSINGER M., HIPPELEIN M.,
KAUPP H., (1994): A study of the in fluence of sewage sludge fertilization on
the concentrations of PCDD/F and PCB
in soil and milk. Environ. Pollution, in
press.
MEYER J.S., MARCUS M.D., BERGMAN H.L., (1984): Inhibitory interac tions of aromatic organics during micro bial degradation. Environ. Toxicol.
Chem., 3, 583.
MOHN W.W., TIEDJE J.M., (1992):
Microbial reductive dehalogenation. Mi crobiol. Rev., 56, 482.
MUIR D.C.G., YARECHEWSKI A.L.,
COBERT R.L., WEBSTER G.R.B.,
134
SMITH A.E., (1985): Laboratory and
field studies on the fate of 1,3,6,8-tetrach lordibenzo-p-dioxin in soil and sediments.
J. Agric. Food Chem., 33, 518.
NAF C., BROMAN D., ISHAQ R., ZEBUHR Y., (1990): PCDDs and PCDFs in
water, sludge and air saples from various
levels in a waste water treatment with re spect to composition changes and total
flux. Chemosphere, 20, 10/12, 15031510.
NORRIS L.A., (1981): The movement,
persistence, and fate of phenoxy herbicides
and TCDD in the forest. Residue Rev., 80,
65.
OBERG L.G., WAGMAN N., ANDERSSON R., RAPPE C., (1993): D e
novo formation of PCDD/Fs in compo st and sewage sludge - a status report.
Organohalogen Compounds, 11, 297302.
PARSON J.R., (1992): Influence of su spended sediment on the biodegradation of
chlorinated dibenzo-p-dioxins. Chemo sphere, 25, 1973.
PARSON J.R., STORMS M . C . M . ,
(1989): Biodegradation of chlorinated di benzo-p-dioxins in batch and continuous
cultures of strain JB1. Chemosphere, 1 9 ,
1297.
PHILIPPI M., KRASNOBAJEW V . ,
ZEYER J., HUTTER R., (1981): Fate of
TCDD in microbial cultures and in soil
under laboratory conditions. In: Micro bial Degradation of Xenobiotic and Recal citrant Compounds (T. Leisinger, R.
Hutter, A.M. CooK, J. Nuesch, ed.), p.
221. Academic Press, London.
Capitolo 4 DIOSSINE E F URANI
PHILIPPI M., SCHMID J., WIPF H.K.,
HUTTER R., (1982): A microbial meta bolite of TCDD. Experientia, 38, 659.
QUENSEN J.F., MATSUMURA F . ,
(1983): Oxidative degradation of 2,3,7,8tetrachlorodibenzo-p-dioxin by microor ganisms. Environ. Toxicol. Chem., 2, 261.
RAPPE C., KJIELLER L.O., ANDERSSON R., (1989): Analysis of PCDDs and
PCDFs in sludge and water samples. Che mosphere, 19, 13-20.
RAPPE C., ANDERSSON R ., ( 1 9 9 2 ) :
Analysis of PCDDs and PCDFs in wa stewater from disk washers and washing
machines. Organohalogen Compounds, 9,
191-194.
REICSCHL A., REISSENGER M.,
HUTZINGER O., (1989 a): Organische
Luftschadstoffe und ihre Bedeutung fur
die terrestrische Vegetation. UWSF-Z
Umweltchem Okotox, 2, 32-41.
REICSCHL A. REISSENGER M., THOMA H., HUTZINGER O., (1989 b): Up take and accumulation of PCDD/F in ter restrial plants: basic considerations. Che mosphere, 19, 467-474.
RUGGE C.D., AHLERT R.C., O’CONNOR O.A., (1993): Development of bac terial cultures which can metabolize
structural analogs of dioxin. Environ.
Progr., 12, 114.
SACCHI G.A., VIGANÒ P., FORTUNATI G., COCUCCI S.M., (1986): Ac cumulation of 2,3,7, 8 tetrachlorodibenzop-dioxin from soil and nutrient solution
by bean and maize plants. Experientia, 42,
586-588.
TANABE S., KANNAN N., SUBRAMANIAN A.N., WATANABE S.,
TATSUKAWA R., (1987): Highly toxic
coplanar PCBs: occurence, source, persi stency and toxic implications to wildlife
and humans. Environ. pollution 47, 147163.
TSUSHIMOTO G., MATSUMURA F.,
SAGO R., (1982): Fate of 2,3,7,8 tetrach lorodibenzo-p-dioxin (TCDD) in an out door pond and in model ecosystems. Envi ron. Toxicol. Chem., 1, 61.
WARD C.T., MATSUMURA F., (1978):
Fate of 2,3,7,8-tetrachlorodibenzo-p-dioxin
(TCDD) in a model aquatic ecosystem. Ar ch. Environ. Contam. Toxicol., 7, 349.
WILD S.R., HARRAD S.J., J O N E S
K.C., (1994): The influence of sewage
sludge applications to agricultural land
on human exposure to PCDDs and
PCDFs. Environ. Pollution, 83, 357369.
WILKES H., WITTICH R.M., TIMMIS
K.N., FORTNAGEL P., FRANCKE W.,
(1996): Degradation of chlorinated diben zofurans and dibenzo-p-dioxins by
Sphingomonas sp. strain RW1. Appl.
Environ. Microbiol., 62, 367.
WITTICH
R.M.,
WILKES
H.,
SINNWELL V., FRANCKE W., FORTNAGEL P. (1992): Metabolism of diben zo-p-dioxin by Sphingomonas sp. strain
RW1. Appl. Environ. Microbiol., 5 8 ,
1005.
135
Capitolo 5
Fenoli
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
I
composti fenolici rappresentano probabilmente i maggiori costituenti dei rifiuti industriali. Sono connessi all’industria del
carbone, alle raffinerie di petrolio, alla lavorazione della carta,
resine, plastiche, adesivi, ecc.
Nel 1985 il consumo mondiale era di 100.000 t soprattutto nel settore tessile, in quello dei pesticidi agricoli, dei conservanti per il legno,
ecc. (Wild and Jones, 1992).
Di seguito è riportata la formula di struttura dei principali prodotti fenolici impiegati.
Fenolo
• Coefficiente di ripartizione ottanolo/acqua (Log Kow):1.46
• Costante di Henry: 3.97 x 10-7 atm-m3/mole
2,4 Dinitrofenolo (2,4 DNP)
• Coefficiente di ripartizione ottanolo/acqua (Log Kow):1.54
• Costante di Henry: 8 x 10 -10 atm-m3/mole
138
Capitolo 5 FENOLI
I clorofenoli e i fenoli alogenati in genere, sono biocidi usati soprattutto per la conservazione del legno, quali disinfettanti ecc. Il clorofenolo più largamente impiegato è il PCP (pentaclorofenolo), la cui formula di struttura è la seguente:
PCP (pentaclorofenolo)
• Coefficiente di ripartizione ottanolo/acqua (Log Kow): 5.12
• Costante di Henry: 2,75 x 10 -6 atm-m3/mole
In Inghilterra (Wild and Jones, 1992), la presenza dei PCP residui
nell’ambiente è stata stimata essere nell’ordine delle 53 t (ambienti
non direttamente esposti) con il 94% di PCP associato al suolo, e, a
questo apporto, va aggiunta una quantità pari a 30 t dei siti più esposti (vicinanze fabbriche, poli produttivi, ecc.). Tra le fonti di immissione di PCP nell’ecosistema la prima in ordine di importanza è quella industriale, la seconda deriva dalla combustione di rifiuti, la terza
dall’applicazione dei fanghi in agricoltura. 300 o 400 t/anno sono
usate attualmente nelle industrie inglesi, più di 100 t/anno sono rilasciate attraverso sversamenti, volatilizzazione e acque di scarico, anche se in parte il PCP viene degradato attraverso la fotolisi e la biodegradazione.
5.1. Suoli
Nell’orizzonte superficiale del suolo la concentrazione di PCP è in
media intorno ai 2 ppb, il che significa che, nella realtà inglese (SAU),
la quantità presente nei primi 10 cm di suolo è di 50.000 kg di PCP;
139
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Comparto ambientale
Quantità (kg)
suolo (0-10) cm
acqua
acqua sedimenti (0-5) cm
aria
vegetazione
uomo
totale (Inghilterra)
50000
2500
56
625
65
30
53276
% sul totale
93.85
4.69
0.11
1.17
0.12
0.06
100
Tabella 5.1 - Concentrazioni di background di PCP nella realtà
ambientale Inglese (UK) (Wild and Jones, 1992).
Rilascio diretto di PCP
Rilascio indiretto di PCP
Fonte
Emissione annuale stimata
industria del legname
127 t (volatilizzazione)
175 kg (fuoriuscite)
3 t per 10 t di PCP usate
18 t
<2kg
1.2 kg
0.058 kg
potenzialmente alta
<1kg
potenzialmente bassa
6t
industria tessile
coltivazione dei funghi
incenerimento
combustione carbone
combustione carbon fossile
combustione legno pre-trattato
combustione olio/gas
combustione petrolio
fanghi
Tabella 5.2 - Stime di emissione annuali di PCP in funzione di diverse
attività industriali (da Wild and Jones, 1992).
nell’acqua il contenuto è di circa 0.2 ppb, nell’aria 2.5 ng/m 3 e nelle
piante la concentrazione è pari a 1 ppb (cfr. tabella 5.1, Wild and Jones,
1992).
Esclusi i siti contaminati (suoli vicini ad industrie della produzione
del legno) la concentrazione di PCP varia da 0.7 a 730 ppm; dalle diverse fonti risulterebbe quindi (cfr. tabella 5.2) che in Inghilterra verrebbero immesse nell’ambiente 100 t di PCP/anno (pari a 1/4 dei PCP
usati) (Wild and Jones, 1992).
140
Capitolo 5 FENOLI
5.2. Acque
Le concentrazioni nelle acque di scarico sono pari a 0.90-2440 µg/l,
secondo altri autori da 1 a 1400 µg/l (US EPA ,1985).
5.3 Fanghi
Le concentrazioni di PCP e fenoli nei fanghi osservate da alcuni autori risultavano variabili: il PCP andava da 0.2 a 8495 ppm, mentre i
fenoli oscillavano da 0.1 a 288 ppm s.s. Veniva confermata, inoltre,
una percentuale di rischio di emissione di questi composti nell’incenerimento dei fanghi (Hansen and Chaney, 1984).
Altre concentrazioni di fenoli osservate nei fanghi vanno da 5 a
17000 µg/l. Il PCP va da 10 a 10500 µg/l (US EPA, 1985).
Da sperimentazioni è risultato che, dopo 5 giorni dal trattamento,
nei fanghi rimaneva circa il 36% di fenoli, mentre il 47% è ritrovabile
nelle acque, con un fattore di accumulo nel fango pari a 1.100. (Piccolo 1991).
Da altri studi è risultato che sul 40% di 1,2 x10 6 tonnellate (s.s.) di
fanghi che vengono usati in agricoltura, le concentrazioni dei composti fenolici vanno da 0.172 a 8490 ppm. L’uso del fango aumenterebbe quindi la concentrazione di 24 ppb/anno, circa 10 volte di più
delle concentrazioni di background prima riportate (Wild and Jones,
1992).
È importante sottolineare infine che, da indagini svolte, i fenoli risultano presenti nei fanghi industriali e non i quelli domestici
(Crathorne et al.,1989).
5.4 Degradazione
Basandosi sulla costante di dissociazione (pKa 9.994), il fenolo è
parzialmente dissociato e quindi il comportamento sia in acqua che
nel suolo risulta influenzato dal pH.
141
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Essendo i fenoli relativamente solubili in acqua, sono anche più
mobili nel terreno, arrivando sino ad inquinare le acque di falda
(Knezovich et al., 1988).
Nell’atmosfera vengono degradati direttamente dalla luce nel range di 290-330 nm (Howard, 1989).
Il 2,4 dinitrofenolo nel suolo è piuttosto mobile, anche se in parte
può adsorbirsi sulle argille (ad esempio il 2- NP e il 4- NP formano dei
complessi molto stabili).
Numerosi studi infine sono stati effettuati sul PCP, che è ormai un
inquinante ambientale ubiquitario (cfr. tabella 5.3 per background, Larsen et al., 1991).
Atmosfera
Idrosfera
Litosfera
Biosfera
uomo
Comparto
ambientale
Concentrazione
Autori
area urbana
area agricola
pioggia
5 ng/m 3
1 ng/m 3
10-50 ng/l
acque dolci
acque marine
acque dolci/
sedimenti
sedimenti marini
0 . 2 µg / l
8 ng/l
0.9 µg / K g
WHO (1987)
WHO (1987)
Leuenberger et al.
(1985)
Hobbs et al. (1991)
Murray et al. (1981)
Hobbs et al. (1991)
0.2 µg / K g
suolo
piante
bestiame
pesci d'acqua dolce
pesci d'acqua salata
grasso
2 µg / K g
1 µg / K g
10-50 µg / K g
10 µg / K g
5 µg / K g
10-20 µg / K g
livello corporeo
latte
550 µg
0.03-2.8 µg / l
Wegman and
van den Broek (1983)
Harrad et al., (1991)
Eriksson et al. (1989)
Ryan et al. (1985)
Jones (1981)
Jones (1981)
Mussalo-Rauhamaa et
al. (1989)
Wild and Jones (1992)
Gebefugi
and Korte (1982)
Tabella 5.3 - Concentrazioni di background di PCP nei diversi comparti
ambientali (da Larsen et al., 1991).
Il PCP nell’atmosfera si trova generalmente sotto forma non ionica,
quasi sempre gassosa, piuttosto che adsorbita su particolati dell’aria.
La degradazione avviene per fotolisi e possibili reazioni con ozono e
radicali idrossilici.
142
Capitolo 5 FENOLI
In acqua il PCP è nella forma anionica, a causa delle sue caratteristiche debolmente acide; l’anione assorbe le radiazioni ed è fotodegradato, subisce una parziale idrolizzazione mentre una piccola parte
viene degradata microbicamente (anche i clorofenoli). Comunque, la
maggior parte si sospende e va a finire nei sedimenti. Il PCP persiste
nell’acqua da 2 ore a 120 gg.
Nel suolo, invece, il PCP si adsorbe sulle particelle organiche; l’entità
dell’adsorbimento varia col pH, ed è massimo con pH tra 4,6 e 5,1 e minimo sopra 6,8. In condizioni neutre o alcaline, però, viene rilasciato
nella sua forma ionica. L’adsorbimento risulta più elevato nei suoli organici.
Nel suolo viene rapidamente degradato bio e abioticamente, o si
idrolizza, o viene fotodegradato. In genere prevale la biodegradazione sebbene dipenda dalle proprietà fisico-chimiche del suolo, dalla
flora microbica e dal grado di esposizione ai PCP. Il PCP ha un’emivita media da settimane a mesi.
La fotodegradazione del PCP, comunque, quando i composti sono
adsorbiti su supporti solidi, aumenta del 70% (Piccolo, 1991).
5.4.1 Biodegradazione
La degradazione microbica dei vari clorofenoli è stata estesamente
studiata in vari ambienti e condizioni (suolo, acque dolci e salate, impianti di depurazione) oltre che con colture di laboratorio di ceppi microbici puri. Sono state abbastanza ben individuate anche le possibili
vie metaboliche. Una certa letteratura esiste anche per quanto riguarda nitrofenoli e cresoli.
Colture pure e vie degradative
Appare estesamente e da tempo studiata la biodegradazione in aerobiosi dei clorofenoli in colture di laboratorio da parte di ceppi microbici puri, generalmente ben identificati, provenienti da collezioni
ufficiali oppure isolati da ambienti contaminati. Molto poco considerata risulta invece la degradazione in condizioni di anaerobiosi ed in
particolare utilizzando batteri anaerobi obbligati: solo due ceppi di
questo tipo risultano finora isolati e studiati (Madsen and Licht, 1992;
Mohn and Kennedy, 1992a). Esistono dati di degradazione in coltura
pura per tutti i 19 clorofenoli: esempi tratti dall’ampia letteratura
scientifica a disposizione sono riportati nella tabella 5.4.
143
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
C l o r o f e n o l o Microrganismo *
Autore
2-MCP
Loos et al., 1967
Dawson and Chang, 1992
Cole et al., 1994
Loos et al., 1967
Balajee and Mahadevan, 1990
Dawson and Chang, 1992
Spokes and Walker, 1974
Spokes and Walker, 1974
Spokes and Walker, 1974
Spokes and Walker, 1974
Spokes and Walker, 1974
Knackmuss and Hellwig, 1978
Dapaah and Hill, 1992
Haigler et al., 1992
Walker, 1973
Hofrichter et al., 1994
Loos et al., 1967
Tyler and Finn, 1974
Häggblom et al., 1988
Madsen and Licht, 1992
Walker, 1973
Hofrichter et al., 1994
Häggblom et al., 1988
Haigler et al., 1992
Häggblom et al., 1988
Hofrichter et al., 1994
Madsen and Licht, 1992
Chu and Kirsch,1973
Knackmuss and Hellwig, 1978
b: Arthrobacter s p .
Pseudomonas gladioli
non identificato -AN
4-MCP
b: Arthrobacter s p .
Azotobacter chroococcum
Pseudomonas gladioli
tutti i MCP b: Achromobacter s p .
Bacillus s p .
Mycobacterium coeliacum
Nocardia (3 c.)
Pseudomonas (4 c.)
Pseudomonas s p .
Pseudomonas putida
Pseudomonas s p .
e: Rhodotorula glutinis
Penicillium frequentans
2,4 - DCP
b: Arthrobacter s p .
Pseudomonas s p .
Mycobacterium s p .
non identif. (Clostridium sp. ?)- AN
e: Rhodotorula glutinis
Penicillium frequentans
2,5 - DCP
b: Mycobacterium s p .
Pseudomonas s p .
2,6 - DCP
b: Mycobacterium s p .
3,4 - DCP
e : Penicillium frequentans
3,5 - DCP
b: non identif. (Clostridium sp.?) -AN
tutti i DCP b: non identif. (Corynebacterium sp.?)
Pseudomonas sp. (tranne 2,6 DCP)
Rhodococcus sp. (tranne 2,6 -DCP)
Desulfomonile tiedjei (tranne 2,4e 2,6-DCP) - AN
2,3,4 - TCP b: Arthrobacter sp. (E)
2,4,5 - TCP
Arthrobacter sp. (E)
non identif. (Clostridium sp. ?) - AN
e: Phanerochaete chrysosporium
2,4,6- TCP
b: Arthrobacter sp. (E)
non identific. (Clostridium sp. ?)
- AN
tutti i TCP
b: non identif. (Corynebacterium sp. ?)
Rhodococcus s p .
Mycobacterium sp. (tranne 4,4,5 -TCP)
Desulfomonile tiedjei (tranne 2,4,6 e 3,4,5 - TCP) -AN
2,3,4,5 - TCP a: Arthrobacter sp. (E)
non identif. (Clostridium sp. ?) -AN
Häggblom et al., 1988
Mohn and Kennedy, 1992 a
Schenk et al., 1989
Schenk et al., 1989
Madsen and Licht, 1992
Joshi and Gold, 1993
Schenk et al., 1989
Madsen and Licht, 1992
Chu and Kirsch, 1973
Häggblom et al., 1988
Häggblom et al., 1988
Mohn and Kennedy, 1992 a
Schenk et al., 1989
Madsen and Licht, 1992
segue
144
Capitolo 5 FENOLI
C l o r o f e n o l o Microrganismo *
Autore
2,3,4,6 - TCP b: Desulfomonile tiedjei - AN
e: 99c. di almeno 22 spp.
2,3,5,6 - TCP b: Desulfomonile tiedjei - AN
tutti i TCP
b: non identif. (Corynebacterium sp.?)
Rhodococcus s p .
Mycobacterium s p .
PCP
b: non identif. (Corynebacterium sp.?)
Rhodococcus ( 2 c . )
Mycobacterium s p .
Arthrobacter sp. (E) non
identif. (Clostridium sp. ?) - AN
Pseudomonas s p .
Mycobacterium fortuitum ( E )
Flavobacterium sp. (E)
Desulfomonile tiedjei - A N
e: almeno 56 c. di 29 spp. diverse
Mohn and Kennedy, 1992 a
Gee and Peel, 1974
Mohn and Kennedy, 1992 a
Chu and Kirsch, 1973
Häggblom et al., 1988
Häggblom et al., 1988
Chu and Kirsch, 1973
Häggblom et al., 1988
Häggblom et al., 1988
Schenk et al., 1989
Madsen and Licht, 1992
Radehaus and Schmidt, 1992
Uotila et al., 1992
Xun et al., 1992
Mohn and Kennedy, 1992 a
Seigle-Murandi et al., 1992
* b = batteri - e = eumiceti - sp. = specie non determinata - spp.= specie non determinate - c.= ceppi,
non necessariamente di diversa specie - AN = coltura in anaerobiosi - (E) = studio su enzimi estratti del microrganismo
Tabella 5.4 - Microrganismi (batteri ed eumiceti) riconosciuti capaci
di degradare i 19 clorofenoli.
Microrganismi già esposti al contatto coi clorofenoli appaiono normalmente in grado di degradarli immediatamente quando rimessi a
contatto coi composti (adattamento) anche se non necessariamente
con lo stesso isomero (adattamento incrociato); ad esempio PCP agisce in tal senso per tutti gli altri clorofenoli. Microrganismi non previamente adattati spesso richiedono un tempo di latenza anche di parecchi giorni prima di iniziare la degradazione; tale comportamento
è comunque da ritenersi logico quando si abbia a che fare con composti xenobiotici. In anaerobiosi si verifica una declorurazione enzimatica di tipo riduttivo, in cui gli atomi di cloro sono via via sostituiti da idrogeno. Partendo da PCP, la progressiva perdita di cloro sull’anello aromatico rende i composti formatisi meno suscettibili di
ulteriore riduzione, pur potendo il processo portare in condizioni ottimali fino a fenolo non sostituito. I primi atomi di cloro allontanati
sono quelli in posizione orto (2-), poi para (4-) ed infine meta (3-); questa sequenza risulta verificata anche a partire da clorofenoli non
completamente sostituiti. E’ stata notata tuttavia anche una declorurazione in orto e meta, ma non in para. Quando il processo avviene accoppiato alla solfato-riduzione, una microflora specializzata risulta
145
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
preferire invece una successione di declorurazione para-meta-orto. In
aerobiosi il processo complessivo di degradazione risulta diverso per
mono- e di-clorofenoli rispetto a tri-, tetra- e penta-. Nei primi generalmente avviene dapprima una idrossilazione, poi la rottura dell’anello e solo successivamente declorurazione. Per i clorofenoli almeno tri-sostituiti, la rottura dell’anello normalmente avviene solo
quando è libero da cloro e risulta successiva ad una serie di passaggi
di idrossilazione e declorurazione, alcuni dei quali appaiono lenti e
difficili.
Quest’ultimo fatto spiega perchè si sia riscontrata degradazione di
PCP più veloce in anaerobiosi che in aerobiosi. La degradazione dei
clorofenoli fortemente sostituiti spesso avviene ad opera di una microflora sensibilmente diversa da quella che agisce su MCP e DCP
(Crawford and O’Reilly, 1990; Madsen and Licht, 1992; Murray and
Richardson, 1993).
Suolo
Biodegradazione di monoclorofenoli nel suolo era già stata segnalata negli anni ’50 (Walker, 1954). Da allora si sono accumulati numerosi dati sulla degradazione in tale ambiente in varie condizioni, oppure in colture di arricchimento direttamente derivate dal suolo, di molti dei 19 clorofenoli, dal mono- al penta-sostituito; particolarmente
numerose sono le ricerche riguardanti il PCP. Tale composto è risultato degradato sia in aerobiosi che in anaerobiosi e persino, nello stesso sito (un terreno di risaia), più velocemente in assenza di ossigeno
che in aerobiosi (Kuwatsuka and Igarashi, 1975). Dati di degradazione nel suolo esistono anche per altri clorofenoli, mono-, di-, tri- e tetra-sostituiti (Alexander and Aleem, 1961; Baker and Mayfield, 1980;
Lang and Viedt, 1994). Studiando percolati di discarica Fischer e Pecher (1993) evidenziarono degradazione di 2,4,6-TCP, 2,3,4,6-TCP e
PCP solo quando si verificava metanogenesi e non se il processo anaerobico si fermava alla fase acidogena.
Biodegradazione più o meno intensa in aerobiosi in un suolo dell’Ontario (Canada) fu rilevata anche a bassa temperatura (0° e 4°C), almeno per quanto riguarda i tre MCP, 2,4-DCP e PCP (Baker et al., 1980).
Bioremediation
I composti altamente clorurati, in particolare il PCP, sono presenti
talvolta sulla superficie del terreno ad altissime concentrazioni (migliaia di ppm) e sono in genere resistenti alla biodegradazione. Viene
146
Capitolo 5 FENOLI
di seguito illustrato un sistema di decontaminazione di terreni contaminati con clorofenoli.
Nel fango fresco, si è osservata una rapida e completa declorurazione riduttiva del PCP attraverso microrganismi anaerobi, importante poichè i prodotti declorurati sono meno tossici, meno facili da
accumulare e più suscettibili di ulteriori degradazioni biologiche aerobiche e anaerobiche. Nella bonifica di suoli contaminati da industrie di trattamento del legno, si è indagato proprio sulla potenziale
attività degradativa in fanghi anaerobi aggiunti al terreno contenente PCP.
L’aggiunta dei fanghi anaerobi (5 g/kg) a terreni incubati anaerobicamente ha un effetto degradativo del PCP, riducendolo da 70 µmoli/kg al di sotto della soglia di rilevamento (circa 0.5 µmoli/kg) in 28
gg. Nell’incubazione anaerobica del terreno senza aggiunta di fanghi
è risultata una perdita del 45% di PCP in 56 gg. Nel terreno incubato
aerobicamente, con o senza aggiunta di fanghi, la diminuzione di concentrazione del PCP è stata del 10% alla fine di 56 gg di incubazione.
I risultati indicano che l’attività declorurante riduttiva presente nel
fango è stata in seguito trasferita nel terreno con il fango ammendante. La lenta e parziale perdita di PCP nel terreno anaerobico non ammendato indica che la microflora indigena presenta scarse capacità di
degradare il PCP. Sono appunto i microrganismi decloruranti dei fanghi anaerobici i responsabili della rimozione del PCP.
Per definire l’influenza dell’applicazione del fango e della concentrazione iniziale di PCP sulla degradazione del PCP stesso si può concludere che alle più alte applicazioni di fango (25 g/kg di suolo) il
tasso di degradazione di PCP e l’accumulo di principio attivo sono
stati più rapidi di quelli a 10 g/kg. A più alte percentuali di fango il livello del PCP ha raggiunto un massimo dopo 28 gg diminuendo poi a
40 gg. La stimolazione della microflora da parte dell’addizione del
fango è stata efficace al di sopra di 30 ppm di PCP; alla fine dell’incubazione circa l’80% del PCP può risultare trasformato in tri-di e monoclorofenoli.
In conclusione, l’aggiunta di fanghi anaerobi al terreno contenente
da 37-111 µmoli/kg (10-30 ppm) di PCP ha provocato una rimozione
del PCP in circa un mese di tempo, con le dosi di fango solitamente
usate in agricoltura .
La bioremediation di suoli contaminati con PCP è stata saggiata
con successo sfruttando anche l’inoculazione nel suolo stesso di vari
ceppi fungini e batterici (Briglia et al., 1990; Crawford and O’Reilly,
147
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
1990; Lamar and Evans, 1993). Lo stesso PCP veniva degradato anche
in un reattore biologico che sfruttava suolo come inoculo microbico
(Rutgers et al., 1993). In un altro tipo di reattore, soil slurry è stato decontaminato da 4-MCP (Kiilerich et al., 1993).
Acque e sedimenti
La biodegradazione dei vari clorofenoli è stata studiata in acque superficiali dolci e marine e nei rispettivi sedimenti, oltre che nelle acque sotterranee. Sono reperibili svariati dati di effettiva degradazione in aerobiosi o anaerobiosi di vari clorofenoli, dal mono- al pentasostituito, da parte della microflora di acque dolci (fiume o canale, lago, stagno) o di estuario e dei loro sedimenti (Baker et al., 1980; BladesFillmore et al., 1982; Pignatello et al., 1983; Genthner et al., 1989;
Kohring et al., 1989; Zhang and Wiegel, 1990 e 1992; Häggblom et al.,
1993a; Kong et al., 1994). Come in generale per le attività microbiche
in ambienti acquatici, è stata evidenziata l’importanza della microflora adesa ad un supporto solido, quindi la particolare funzione fisica
svolta in questo senso dal sedimento, anche roccioso (Blades-Fillmore et al., 1982; Pignatello et al., 1983). Alcune ricerche hanno evidenziato nel caso di anaerobiosi la possibilità di accoppiamento dei processi degradativi con la metanogenesi e con le respirazioni anaerobiche (nitrato- e solfato-riduzione) (Häggblom and Young, 1990; Häggblom et al., 1993b). Come nel caso del suolo, anche per i sedimenti di
fiume (Ontario, Canada) la bassa temperatura (0°C) non è risultata limitare, qualora ne esista la potenzialità, l’effettiva degradazione microbica, ma al massimo rallentarla (Baker et al., 1980).
Anche se risultano più considerati i sedimenti e le acque di estuario, le ricerche hanno riguardato anche acque marine vere e proprie.
Ad esempio Kuiper and Hanstveit (1984) hanno evidenziato biodegradazione di 4-MCP e 2,4-DCP da parte della comunità microbica
presente nell’acqua del Mare del Nord. Importante è anche il destino
dei clorofenoli nelle acque sotterranee, che ne possono facilmente essere contaminate. Il PCP non risultò in realtà degradato in acque della Florida da parte della microflora del terreno sovrastante, in contrasto coi già citati dati sulla biodegradabilità nel suolo di per sè
(Mueller et al., 1991). La possibilità di bonificare acque mediante biofiltri contenenti rodococchi immobilizzati su matrice poliuretanica è
stata saggiata invece con successo da Valo e colleghi (1990) per un
miscuglio di 2,4,6-TCP con 2,3,4,6-TCP e PCP; quest’ultimo risultò
mineralizzabile a CO 2.
148
Capitolo 5 FENOLI
Depurazione e fanghi
La degradazione di clorofenoli per azione microbica durante trattamenti di depurazione o da parte di consorzi microbici da essi provenienti è stata studiata in anni recenti soprattutto in riferimento a processi anaerobi, anche metanogenici, impiegando prevalentemente
reattori o dispositivi di laboratorio, ma molto spesso fanghi e liquami
provenienti da impianti in scala reale. Molti clorofenoli sono risultati
efficacemente biodegradati in anaerobiosi, eventualmente dopo una
preliminare acclimatazione non necessariamente in presenza dello
stesso clorofenolo degradato (c r o s s - a c c l i m a t i o n) (Boyd and Shelton,
1984).
I1 PCP è stato degradato in vari dispositivi anaerobi ed è possibile
una mineralizzazione completa a CO2 e CH 4. In alcuni casi è stata necessaria l’addizione di sostanza organica d’altro tipo (cometabolismo), in altri questa è risultata solo stimolante sul processo (Guthrie
et al., 1984; Mikesell and Boyd, 1986; Nicholson et al., 1992; Hendriksen et al., 1992; Wu et al., 1993).
Test di degradazione durante processi anaerobi sono riportati nella
letteratura scientifica praticamente per tutti i clorofenoli non completamente clorurati: ognuno dei composti almeno in qualche ricerca è
risultato biodegradato (Boyd and Shelton, 1984; Mohn and Kennedy,
1992b; Madsen and Aamand, 1992; Nicholson et al., 1992; Bisaillon et
al., 1993; Parker et al., 1993). In particolare il 4-MCP è risultato poter
fungere da fonte di carbonio nella denitrificazione, cioè è stato ossidato biologicamente per mezzo del nitrato (Melin et al., 1993).
Dato che composti fortemente alogenati sono risultati più facilmente degradati (dealogenati) in anaerobiosi che in aerobiosi, condizione
d’altra parte in generale più favorevole alla veloce e completa mineralizzazione di un composto organico, è stata proposta e saggiata una
alternanza anaerobiosi-aerobiosi per il trattamento depurativo. Una
sperimentazione di tale tipo è stata condotta con successo da
Kafkewitz e colleghi (1992) su 2,4,6-TCP, impiegando un unico consorzio microbico per ambedue le fasi del processo.
La biodegradazione in aerobiosi risulta come accennato più facile
per fenoli scarsamente clorurati. Nonostante ciò è risultato possibile
degradare completamente ed efficacemente in un reattore inoculato
con fanghi attivi anche PCP, ottenendone la trasformazione in CO2 e
biomassa microbica; tale possibilità è stata confermata anche utilizzando reattori a letto fluidizzato e per altri clorofenoli (Moos et al.,
1983; Puhakka and Jarvinen, 1992; Makinen et al., 1993). I1 PCP è sta-
149
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
to biodegradato anche in un reattore che impiegava l’eumicete filamentoso Phanerochaete chrysosporium immobilizzato su membrana
(Venkatadri et al., 1992). Lo stesso microrganismo era in un altro caso
in grado di utilizzare 2-MCP, con diverse strutturazioni del bioreattore (Armenante et al., 1992).
La rimozione dei fenoli nei fanghi attivi aerobici è in sintesi più del
90%, anche se inibizioni parziali sono state rilevate in reattori aerobici con reflui industriali e fanghi attivi con concentrazione di 50 ppm
di fenoli. In reattori anaerobici, invece, il periodo di acclimatamento è
più lungo e la degradazione è di circa due settimane.
La degradazione con colture acclimatate provenienti da suolo,
compost, ecc. è del 95% in 1-2 gg, contro 2-5 gg nel suolo (Howard,
1989). Per quanto riguarda il paraclorofenolo nei fanghi attivi si è osservata una degradazione completa per concentrazioni di 50 ppm
(Arbuckle and Kennedy, 1989).
Infine, in un impianto di trattamento delle acque reflue è stata osservata una rimozione dei CP del 71% (la concentrazione era intorno a
4-120 ppb), nel fango rimaneva il 18% mentre l’1% era volatilizzato in
8-10 gg (Ettala et al., 1992).
L’azione fotolitica degli UV, eventualmente potenziata dalla presenza di composti quali H 2O2 o TiO 2, può innalzare notevolmente la
capacità degradativa, come riscontrato per clorofenoli a diverso grado di sostituzione (Miller et al., 1988; D’Oliveira et al., 1993). Anche
una pre-ozonizzazione può facilitare la biodegradazione, come riscontrato su 2-MCP (Stowell et al., 1992). Si è evidenziata inoltre la
possibilità di ossidare i composti con l’impiego dell’enzima perossidasi, eventualmente immobilizzato su supporti di vario tipo, in presenza di H 2O 2; questa tecnica è stata saggiata con successo su mono- e
di-clorofenoli (Siddique et al., 1993).
Nitrofenoli e cresoli
La degradazione microbica dei NP in aerobiosi avviene con liberazione di nitrito, rilasciato per sostituzione del nitrogruppo sull’anello benzenico con un gruppo idrossilico, seguita da rottura dell’anello
stesso. Questo comportamento è stato verificato con ceppi batterici su
4-NP: con Moraxella da Spain and Gibson (1991) e con Arthrobacter da
Jain et al. (1994), che hanno proposto le rispettive vie degradative, e
questo rappresenta la conferma di precedenti dati ottenuti prevalentemente con ceppi di Pseudomonas isolati da suolo o reflui e appartenenti a diverse specie: Ps. putida che utilizzava 2- o 3-NP come sola
150
Capitolo 5 FENOLI
fonte di carbonio e azoto (Zeyer and Kearney, 1984), Ps. aeruginosa che
agiva su 4-NP (Daughton and Hsieh, 1977) e specie non determinate
che trasformavano 4-NP (Munnecke and Hsieh, 1974) oppure 2- o 4NP utilizzati come sola fonte di carbonio (Simpson and Evans, 1953).
In anaerobiosi agiscono invece enzimi riduttivi ed il nitrogruppo
viene trasformato in amino-gruppo, in qualunque posizione si trovi
sull’anello aromatico. D’altra parte anche in aerobiosi il nitrogruppo può essere ridotto ad ammonio, come rilevato da Germanier and
Wuhrmann (1963, come riferito in Zeyer and Kearney, 1984), utilizzando uno Pseudomonas. Il batterio fotosintetico Rhodobacter capsu latus trasformava in anaerobiosi 2,4-DNP in 2-amino-4-nitro-fenolo
ed agiva anche sui mononitrofenoli e su 2,4-, 2,5- e 3,4-DNP, nonchè
su 2,4,6-TNP (Blasco and Castillo, 1993). Clostridium pasteurianum e
vari metanobatteri e solfato-riduttori trasformavano in amino-derivati 3- e 4-NP e 2,4-DNP (Gorontzy et al., 1993; Boopathy, 1994). Anche due batteri alofili anaerobi si sono rivelati in grado di trasformare nelle corrispondenti amine i mono-nitrofenoli e 2,4DNP (Oren
et al., 1991). Gli stessi nitrofenoli, oltre a 2,4,6TNP, erano ridotti dall’idrogeno per azione di estratti cellulari di Veillonella alkalescens
(McCormick et al., 1976).
Trasformazioni biologiche a carico dei nitrofenoli sono state rilevate anche nell’ambiente naturale ed in vari materiali; 4-NP ad esempio
risultò degradato in un suolo (Scow et al., 1989), in un impianto sperimentale a fanghi attivi (Nyholm et al., 1992) ed in bacini d’acqua dolce (Spain et al., 1984). In anaerobiosi tutti i mono-nitrofenoli subivano completa mineralizzazione in fanghi di digestione anaerobica di liquami civili (Boyd et al., 1983).
Per quanto riguarda i cresoli, un enzima presente in P s e u d o m o n a s
putida converte p-cresolo in alcool 4-idrossibenzilico ed anche 4idrossibenzaldeide. Sono stati clonati e sequenziati i geni che lo codificano (Kim et al., 1994). Anche uno Pseudomonas gladioli isolato da
torba, ed una specie non determinata di Pseudomonas, sono risultati in
grado di trasformare i tre cresoli in aerobiosi (Dawson and Chang,
1992; Haigler et al., 1992). Oltre ai batteri, si sono rivelati in grado di
assimilare i cresoli anche alcuni lieviti isolati dal suolo e saggiati a
temperatura piuttosto bassa (10°C). Uno di tali lieviti (Rhodotorula au r a n t i a c a) reinoculato nel suolo rendeva più veloce la rimozione dei
cresoli (Middelhoven et al., 1992).
In anaerobiosi un consorzio batterico isolato da liquami suini trasformava in condizioni metanogeniche o-cresolo in acido 3-metil-
151
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
benzoico, probabilmente attraverso processi cometabolici (Bisaillon
et al.,1991). Sempre in anaerobiosi, ma in condizioni denitrificanti, pcresolo era ossidato mediante nitrato da un ceppo batterico a 4-idrossi-benzoato attraverso una serie di deidrogenazioni e idratazioni
(Bossert and Young, 1986).
La possibilità di degradazione microbica dei vari cresoli è stata inoltre verificata in ambienti naturali o durante processi di depurazione.
Riguardo alla prima condizione, i composti risultarono trasformabili
in acque sotterranee da parte della microflora del suolo sovrastante
(Mueller et al., 1991) ed, in un secondo caso, dalla microflora nell’acqua stessa in condizioni metanogeniche (Bekins et al., 1993). In uno
studio limitato al p-cresolo, la degradazione avveniva in sedimenti di
fiume in condizioni anaerobiche di solfato-riduzione (Mort and
Dean-Ross, 1994). I tre cresoli sono risultati degradati in un impianto
di depurazione sperimentale di laboratorio per denitrificazione a fanghi attivi a due stadi anaerobio-aerobio (Richards and Shieh, 1989). I
composti furono completamente mineralizzati anche in fanghi di digestione anaerobica di liquami civili incubati in soluzione salina in
condizioni anaerobiche di metanogenesi (Boyd et al., 1983).
5.5 Piante
Da uno studio con radioisotopi si è constatato che l’utilizzo dei fenoli da parte delle piante può avvenire nei modi che seguono: riduzione, ossidazione, idrolisi (I), modifica della attività biologica predisponendola a reazione di coniugazione (II), incorporazione nella parete della cellula, che funziona come punto di deposito e detossificazione (III). (Ad esempio, per aromatici e eteroaromatici la lignina risulta essere il sito di maggior legame.) Possono poi essere rilasciati,
mineralizzati e incorporati nella S.O. del suolo, o essere asportati dalle piante coltivate.
In merito all’assorbimento di fenoli da parte dei vegetali, su soia in
idroponica si è osservata una rapida perdita di fenolo che dalla soluzione si lega alle radici; meno dell’1.5% giungeva ai germogli della
pianta. Il coefficiente Kow, che farebbe presupporre il contrario, non
è quindi sufficiente per indicare un possibile assorbimento nella
pianta (O’Reilly and Crawford, 1989).
152
Capitolo 5 FENOLI
In uno studio su pomodoro e mais (Pogany and Pawlizki, 1990) si è
notato l’assorbimento e la metabolizzazione del 2,4 DCP che viene associato alla parete. Nel mais c’era una forte associazione (anche nella
soia) con una frazione residua di 49.5%, mentre nel pomodoro restava solo il 18.5%.
Questi residui possono essere rilasciati alla sostanza organica del
suolo ed il 16% essere mineralizzato (in base alle condizioni del suolo,
della biomassa, del clima, ecc. )
Sempre in laboratorio si è osservata la disponibilità dei residui anche alle successive colture erbacee (quali Lolium multiflorum). L’asporto cresceva in relazione al tempo di incubazione, non c’era volatilizzazione né effetti fitotossici. In pieno campo dunque si avrebbero
dei valori ancora inferiori (50 volte meno) (Pogany and Pawliski,
1990).
Infine in un sistema di laboratorio suolo-pianta che utilizzava orzo,
carote, crescione, mais e fagioli si è studiato l’assorbimento di 2,4,6
triclorofenolo (2 ppm p.f). Durante 7 - 21 gg (carote) la mineralizzazione variava da 17 a 25 %. L’asporto appariva principalmente fogliare (atmosferico) e i fattori di bioaccumulo erano inferiori a 1 in
merito all’asporto radicale, eccetto che per l’orzo che era pari a 2.5
(Scheunert et al., 1989).
5.6 Animali
Negli animali i fenoli sono componenti naturali, ad esempio nel coniglio sono state rilevate quantità pari a 1.6 ppm (Howard, 1989).
In merito alla tossicità di questi composti sono stati effettuati diversi studi sui QSAR (quantitative structure activity relationship). In
una sperimentazione sul potere di inibizione dei clorofenoli su microorganismi in fanghi attivi, si è osservato che la tossicità aumenta
dai monoclorofenoli ai triclorofenoli, eccetto per quelli sostituiti nelle
posizioni 2,6 mentre 2,3,4,6- tetra e penta clorofenolo risultano meno
tossici di 2,3-, 3,5- dicloro- e 2,3,4- triclorofenolo.
Anche il QSAR, comunque, offre una interpretazione riduttiva, in
quanto collega il coefficiente Log Kow (in base alla lipofilia) alla potenziale tossicità di questi composti (Shigeoke et al., 1988).
153
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Conclusioni
I fenoli, alcuni dei quali ormai inquinanti ubiquitari (ad esempio
PCP), sono presenti nel suolo in concentrazioni di qualche ppb.
Nei fanghi la concentrazione dei fenoli presenti varia da 5 a 17000
ppm, mentre il PCP da 10 a 10500 ppm. E’ bene sottolineare, comunque, che l’utilizzo del fango tende ad aumentare la concentrazione
del contenuto di fenolo del terreno (24 ppb/anno, Wild and Jones,
1992). Questi composti, d’altro canto, presentano un’ampia degradazione, largamente dimostrata alle dosi di fango impiegate in agricoltura. Tuttavia, la loro solubilità (vedi Kow) comporta un leaching non
trascurabile e la possibilità di muoversi nel suolo fino ad inquinare le
acque di falda, o di adsorbirsi sulle argille o sulla S.O. del suolo (soprattutto il PCP, ritenuto fortemente a livello radicale), divenendo
pericolosi per gli animali attraverso l’ingestione del suolo.
Nelle piante sono stati osservati un medio assorbimento e traslocazione ed anche la presenza di residui per le colture successive non ha
dato problemi di tossicità (i valori in campo erano del tutto trascurabili). Il bioccumulo è in ogni caso risultato inferiore a 1.
In conclusione, l’elevata degradazione di questi composti diminuisce il rischio di tossicità ad essi legata, escludendo la necessità di particolari restrinzioni all’utilizzo dei fanghi in agricoltura.
154
Capitolo 5 FENOLI
Bibliografia
ALEXANDER M., ALEEM M . I . H . ,
(1961): Effect of chemical structure on mi crobial decomposition of aromatic herbici des. Agric. Food Chem., 9, 44.
LITZ D.F., (1993): Modeling steadystate
methanogenic degradation of phenols in
groundwater. J. Contam. Hydrol., 14, 279.
ARBUCKLE W.B., KENNEDY M . S .,
(1989): Activated sludge response to a pa rachlorophenol transient. J. Wat. Pollut.
Control Fed., 61, 476-480.
BISAILLON J.G., LEPINE F., BEAUDET R., SYLVESTRE M., (1991): C a r boxylation of o-cresol by an anaerobic con sortium under methanogenic conditions.
Appl. Environ. Microbiol., 57, 2131.
ARMENANTE P.M., LEWANDOWSKI G., UL HAQ I., (1992): Mineraliza tion of 2-chlorophenol by P. chrysosporium using different reactor designs. Ha zard. Waste Hazard. Mater., 9, 213.
BISAILLON J.G., LEPINE F., BEAUDET R., SYLVESTRE M., (1993): Poten tial for carboxylation-dehydroxylation of
phenolic compounds by a methanogenic
consortium. Can. J. Microbiol., 39, 642.
BAKER M.D., MAYFIELD C.I., INNIS
W.E., (1980): Degradation of chlorophe nols in soil, sediment and water at low
temperature. Water Res., 14, 1765.
BLADES-FILLMORE L.A., CLEMENT
W.H., FAUST S.D., (1982): The effect of
sediment on the biodegradation of 2,4,6trichlorophenol in Delaware river water.
J. Environ. Sci. Health, A17, 797.
BALAJEE S., MAHADEVAN A., (1990):
Influence of chloroaromatic substances on
the biological activity of Azotobacter chroococcum. Chemosphere, 21, 51.
BEKINS B.A., GODSY E.M., GOER-
BLASCO R., CASTILLO F., ( 1 9 9 3 ) :
Characterization of a nitrophenol reducta se from the phototrophic bacterium Rhodobacter capsulatus ElF1. Appl. Envi ron. Microbiol., 59, 1774.
155
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
BOOPATHY R., (1994): Transformation
of nitroaromatic compounds by a metha nogenic bacterium, Methanococcus sp.
(strain B). Arch. Microbiol., 162, 167.
BOSSERT I.D., YOUNG L.Y., (1986):
Anaerobic oxidation of p-cresol by a deni trifying bacterium. Appl. Environ. Mi crobiol., 52, 1117.
BOYD S.A., SHELTON D.R., (1984):
Anaerobic biodegradation of chlorophe nols in fresh and acclimated sludge. Appl.
Environ. Microbiol., 47, 272.
BOYD S.A., SHELTON D.R., BERRY D.,
TIEDJE J.M., (1983): Anaerobic biodegra dation of phenolic compounds in digested
sludge. Appl. Environ. Microbiol., 46, 50.
BRIGLIA M., NURMIAHO-LASSILA
E.L., VALLINI G., SALKINOJA-SALONEN M., (1990): The survival of the
pentachlorophenol-degrading R h o d ococccus chlorophenolicus PCP-1 and
Flavobacterium sp. in natural soil. Bio degradation, 1, 273.
CHU J., KIRSCH E.J., (1973): U t i l i z a tion of halophenols by a pentachlorophe nol metabolizing bacterium. Dev. Ind.
Microbiol., 14, 264.
CRAWFORD R.L., O’REILLY K . T . ,
(1990): Bacterial degradation of chlo rophenols. In: Reviews in Environmental
Toxicology, Vol. 4, (Hodgson E., ed.),
p.113. Toxicology Communications,
Raleigh, USA.
CRATHORNE B., DONALDSON K.,
JAMES H.A., ROGERS H . R ., ( 1 9 8 9 ) :
The determination of organic contami nants in UK. sewage sludge. In: Organic
contaminants in wastewater, sludge and
sediment. Edit. by D. Quaghebeur, I.
Temmerman and G. Angeletti. Comm.
of the Europ. Commun., Elsevier Applied Science.
DAPAAH S.Y., HILL G.A., (1992): Bio degradation of chlorophenol mixtures by
Pseudomonas putida. B i o t e c h n o l .
Bioeng., 40, 1353.
DAUGHTON C.G., HSIEH D.P . H . ,
(1977): Parathion utilization by bacterial
symbionts in a chemostat. Appl. Environ.
Microbiol., 34, 175.
DAWSON T.D., CHANG F.H., (1992):
Screening test of the biodegradative capa bility of a new strain of P s e u d o m o n a s
gladioli (BSU 45124) on some xenobiotic
organics. Bull. Environ. Contam. Toxi col., 49, 10.
COLE J.R., CASCARELLI A.L.,
MOHN W.W., TIEDJE J.M., ( 1 9 9 4 ) :
Isolation and characterization of a novel
bacterium growing via reductive dehalo genation of 2-chlorophenol. Appl. Envi ron. Microbiol., 60, 3536.
D’OLIVEIRA J.C., GUILLARD C.,
MAILLARD C., PICHAT P., (1993):
Photocatalytic destruction of hazardous
chlorine- or nitrogen-containing aromatics
in water. J. Environ. Sci. Health, A28, 941.
CRAWFORD R.L., MOHN W . W . ,
(1985): Microbial removal of PCP from
soil using a Flavobacterium. E n x y m e
Microb. Technol., 7, 617-620.
ETTALA M., KOSKELA J., K I E S I L A
A., (1992): Removal of chlorophenols in a
municipal sewage treatment plant using
activated sludge. Wat. Res., 26, 797-804.
156
Capitolo 5 FENOLI
FISCHER U., PECHER K., (1993): T e sting stability of chlorophenols and lindane
( -HCH) in different leachates originating
from anaerobic municipal waste decompo sition. Waste Manage. Res., 11, 203.
GEE J.M., PEEL J.L., (1974): Metabolism
of 2,3,4,6 tetrachlorophenol by micro-or ganisms from broiler house litter. J. Gen.
Microbiol., 85, 237.
GENTHNER B.R.S., PRICE W.A.,
PRITCHARD P.H., (1989): Characteri zation of anaerobic dechlorinating consor tia derived from aquatic sediments. Appl.
Environ. Microbiol., 55, 1472.
GORONTZY T., KUVER J., BLOTEV O G E L K.H., (1993): Microbial tran sformation of nitroaromatic compounds
under anaerobic conditions. J. Gen. Mi crobiol., 139, 1331.
GUTHRIE M.A., KIRSCH E.J.,
WUKASCH R.F., GRADY C . P . L . ,
(1984): Pentachlorophenol biodegrada tion. II. Anaerobic. Water Res., 18, 451.
HAGGBLOM M.M., YOUNG L. Y . ,
(1990): Chlorophenol degradation coupled
to sulfate reduction. Appl. Environ. Mi crobiol., 56, 3255.
HAGGBLOM M.M., NOHYNEK L.J.,
SALKINOJA-SALONEN M.S., (1988):
Degradation and o-methylation of chlori nated phenolic compounds by Rhodococcus and M y c o b a c t e r i u m strains. Appl.
Environ. Microbiol., 54, 3043-3052.
HAGGBLOM M.M., RIVERA M.D.,
YOUNG L.Y., (1993a): Effects of auxi liary carbon sources and electron accep tors on methanogenic degradation of chlo -
rinated phenols. Environ. Toxicol. Chem.,
12, 1395.
HAGGBLOM M.M., RIVERA M.D.,
YOUNG L.Y., (1993b): Influence of al ternative electron acceptors on the anaero bic biodegradability of chlorinated phenols
and benzoic acids. Appl. Environ. Micro biol., 59, 1162.
HAIGLER B.E., PETTIGREW C.A.,
SPAIN J.C., (1992): Biodegradation of
mixtures of substituted benzenes by
Pseudomonas sp. strain JS150. Appl.
Environ. Microbiol., 58, 2237.
HANSEN L.R., CHANEY L., ( 1 9 8 4 ) :
Environmental and food chain effects of
the agricultural use of sewage sludges.
Review in Environmental Toxicology, 1,
103-171.
HENDRIKSEN H.V., LARSEN S., AHRING B.K., (1992): Influence of a supple mental carbon source on anaerobic dechlo rination of pentachlorophenol in granular
sludge. Appl. Environ. Microbiol., 5 8 ,
365.
HOFRICHTER M., BUBLITZ F., FRITSCHE W., (1994): Unspecific degrada tion of halogenated phenols by the soil
fungus Penicillium frequentans Bi 7/2.
J. Basic Microbiol., 34, 163.
HOWARD P.H., (1989): Handbook of
Environmental Fate and exposure data for
organic chemicals, Vol.I, Large produc tion and priority Pollutants. Lewis Pub.,
Michigan. USA.
JAIN R.K., DREISBACH J.H., SPAIN
J.C., (1994): Biodegradation of p-ni trophenol via 1,2,4-benzenetriol by an
157
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Arthrobacter sp. Appl. Environ. Micro biol., 60, 3030.
JOSHI D.K., GOLD M.H., (1993): De gradation of 2,4,5 trichlorophenol by the
lignin-degrading basidiomycete P h a n erochaete chrysosporium. Appl. Envi ron. Microbiol., 59, 1779.
KAFKEWITZ D., ARMENANTE P.M.,
LEWANDOWSKI G., KUNG C . M . ,
(1992): Dehalogenation and mineraliza tion of 2,4,6-trichlorophenol by the se quential activity of anaerobic and aerobic
microbial population. Biotechnol. Lett.,
14, 143.
KIILERICH O., BUITRON G., CAPDEVILLE B., (1993): Use of a sequencing
batch reactor to study the biodegradation
of 4-chlorophenol in soil. Biotechnol. Tec.,
7, 149.
KIM J., FULLER J.H., CECCHINI G.,
MCINTIRE W.S., (1994): Cloning, se quencing, and expression of the structural
genes for the cytochrome and flavoprotein
subunits of p-cresol methylhydroxylase
from two strains of Pseudomonas putida. J. Bacteriol., 176, 6349.
KNEZOVICH J. P., HIRABAYASHI
J.M., BISHOP D.J., HARRISON F . L .,
(1988): The influence of different soil ty pes on the fate of phenol and its biodegra dation products. Chemosphere, 17, 11,
2199-2205.
GEL J., (1989): Anaerobic dechlorination
of 2,4-dichlorophenol in freshwater sedi ments in the presence of sulfate. Appl. En viron. Microbiol., 55, 2735.
KONG I.C., HUBBARD J.S., JONES
W.J., (1994): Dechlorination activity
(cross-acclimation) of freshwater sedi ments adapted to mono- and di-chlorophe nols. J. Environ. Sci. Health, A29, 921.
KUIPER J., HANSTVEIT A.O., (1984):
Fate and effects of 4-chlorophenol and 2,4dichlorophenol in marine plankton com munities in experimental enclosures. Eco toxicol. Environ . Saf., 8, 15.
KUWATSUKA S., IGARASHI M . ,
(1975): Degradation of PCP in soils. II.
The relationship between the degradation
of PCP and the properties of soils, and the
identification of the degradation products
of PCP. Soil Sci. Plant Nutr., 21, 405.
LAMAR R.T., EVANSJ.W., (1993): So lid-phase treatment of a pentachlorophe nol-contaminated soil using lignin-degra ding fungi. Environ. Sci. Technol., 2 7 ,
2566.
LANG E., VIEDT H., (1994): Degrada tion by and toxicity to bacteria of chlori nated phenols and benzenes, and hexach lorocyclohexane isomers. Microb. Ecol.,
28, 53.
KNACKMUSS H.J., HELLWIG M . ,
(1978): Utilization and cooxidation of ch lorinated phenols by Pseudomonas sp. B
13. Arch. Microbiol., 117, 1.
LARSEN S., HENDRIKSEN H.V.,
AHRING B . K ., (1991): Potential for
thermophilic (50°C) Anaerobic Dechlori nation of PCP in different ecosystems.
Appl. and Environ. Microbiol., J u l y ,
2085-2090.
KOHRING G.W., ZHANG X., WIE-
LOOS
158
M.A.,
ROBERTS
R.N.,
Capitolo 5 FENOLI
ALEXANDER M., (1967): Phenols as
intermediates in the decomposition of phe noxyacetates by an Arthrobacter species. Can. J. Microbiol., 13, 679.
MADSEN T., AAMAND J., (1992):
Anaerobic transformation and toxicity of
trichlorophenols in a stable enrichment cul ture. Appl. Environ. Microbiol., 58, 557.
MADSEN T., LICHT D., (1992): I s o l a tion and characterization of an anaerobic
chlorophenol-transforming bacterium.
Appl. Environ. Microbiol., 58, 2874.
MAKINEN P.M., THENO T.J., FERGUSON J.F.,
ONGERTH
J.E.,
PUHAKKA J.A., (1993): C h l o r o p h e n o l
toxicity removal and monitoring in aero bic treatment: recovery from process
upsets. Environ. Sci. Technol., 27, 1434.
MCCORMICK N.G., FEEHERRY F.E.,
LEVINSON H.S., (1976): M i c r o b i a l
transformation of 2,4,6-trinitrotoluene
and other nitroaromatic compounds. Ap pl. Environ. Microbiol., 31, 949.
MELIN E.S., PUHAKKA J.A., SHIEH
W.K., (1993): Degradation of 4-chlo rophenol in denitrifying fluidized-bed
process. J. Environ. Sci. Health, A 2 8 ,
1801.
MIDDELHOVEN W.J., KOOREVAAR
M., SCHUUR G.W., (1992): D e g r a d a tion of benzene compounds by yeasts in
acid soils. Plant Soil, 145, 37.
MIKESELL M.D., BOYD S.A., (1986):
Complete reductive dechlorination and
mineralization of pentachlorophenol by
anaerobic microorganisms. Appl. Envi ron. Microbiol., 52, 861.
MILLER R.M., SINGER G.M., ROSEN
J.D., BARTHA R., (1988): Sequential de gradation of chlorophenols by photolytic
and microbial treatment. Environ. Sci.
Technol., 22, 1215.
MOHN W.W., KENNEDY K.J., (1992a):
Reductive dehalogenation of chlorophenols
by Desulfomonile tiedjei DCB-1. Appl.
Environ. Microbiol., 58, 1367.
MOHN W.W., KENNEDY K . J . ,
(1992b): Limited degradation of chlo rophenols by anaerobic sludge granules.
Appl. Environ. Microbiol., 58, 2131.
MOOS L.P., KIRSCH E.J., WUKASCH
R.F., GRADY C.P.L., (1983): Pentachlo rophenol biodegradation. I. Aerobic. Wa ter Res., 17, 1575.
MORT S.L., DEAN-ROSS D., (1994):
Biodegradation of phenolic compounds by
sulfate-reducing bacteria from contami nated sediments. Microb. Ecol., 28, 67.
MUELLER J.G., MIDDAUGH D.P.,
LANTZ S.E., CHAPMAN P.J., (1991):
Biodegradation of creosote and pentachlo rophenol in contaminated groundwater:
chemical and biological assessment. Appl.
Environ. Microbiol., 57, 1277.
MUNNECKE D.M., HSIEH D . P . H . ,
(1974): Microbial decontamination of pa rathion and p-nitrophenol in aqueous me dia. Appl. Microbiol., 28, 212.
MURRAY W.D., RICHARDSON M . ,
(1993): Development of biological and
process technologies for the reduction and
degradation of pulp mill wastes that pose
a threat to human health. Crit. Rev. Envi ron. Sci. Technol., 23, 157.
159
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
NICHOLSON D.K., WOODS S.L.,
ISTOK J.D., PEEK D.C., (1992): Reduc tive dechlorination of chlorophenols by a
pentachlorophenol-acclimated methano genic consortium. Appl. Environ. Micro biol., 58, 2280.
NYHOLM N., JACOBSEN B.N., PEDERSEN B.M., POULSEN O., (1992):
Removal of organic micropollutants at
ppb levels in laboratory activated sludge
reactors under various operating condi tions: biodegradation. Wat. Res., 26, 339.
OREN A., GUREVICH P., HENIS Y . ,
(1991): Reduction of nitrosubstituted aro matic compounds by the halophilic anae robic eubacteria Haloanaerobium
praevalens and Sporohalobacter marismortui. Appl. Environ. Microbiol., 57,
3367.
O ' R E I L L Y K. T., CRAWFORD R . L .,
(1989): Degradation of PCP by Polyu rethane-immobilized Flavobacterium cel ls. Appl. and Environ. Microbiol. sept.,
2113-2118.
PARKER W.J., FARQUHAR G.J.,
HALL E.R., (1993): Removal of chlo rophenolics and toxicity during high-rate
anaerobic treatment of segregated kraft
mill bleach plant effluents. Environ. Sci.
Technol., 27, 1783.
PICCOLO A., (1991): Contenuto e dina mica nel suolo di composti xenobiotici ap plicati con fanghi e compost. In: Riciclo di
biomasse di rifiuto e di scarto e fertilizza zione organica del suolo. Patron Ed.,
279-286.
PIGNATELLO J.J., MARTINSON
M.M., STEIERT J.G., CARLSON R . E . ,
160
CRAWFORD R.L., (1983): Biodegrada tion and photolysis of pentachlorophenol
in artificial freshwater streams. Appl. En viron. Microbiol., 46, 1024.
POGANY E., PAWLIZKI K. H., (1990):
Formation, Distribution and Bioavailabi lity of Cell Wall Bound Residues of 4- Ch loroaniline and 2,4-Dichlorophenol. Che mosphere, 21, 349-358.
PUHAKKA J.A., JARVINEN K . ,
(1992): Aerobic fluidized-bed treatment of
polichlorinated phenolic wood preservati ve constituents. Water Res., 26, 765.
RADEHAUS P.M., SCHMIDT S . K . ,
(1992): Characterization of a novel Pseudomonas sp. that mineralizes high con centrations of pentachlorophenol. Appl.
Environ. Microbiol., 58, 2879.
RICHARDS D.J., SHIEH W.K., (1989):
Anoxic-oxic activated-sludge treatment of
cyanides and phenols. Biotechnol.
Bioeng., 33, 32.
RUTGERS M., BOGTE J.J., BREURE
A.M., VAN ANDEL J.G., (1993):
Growth and enrichment of pentachlo rophenol-degrading microorganism in the
nutristat, a substrate concentration con trolled continuous culture. Appl. Envi ron. Microbiol., 59, 3373.
SABER D. L., CRAWFORD R . L .,
(1985): Isolation and Characterization of
Flavobacterium Strains that degrade
PCP. Appl. and Environ. Microbiol. Dec.,
1512-1518.
SCHENK T., MULLER R., MORSBERGER F., OTTO M.K., LINGENS F . ,
(1989): Enzymatic dehalogenation of pen -
Capitolo 5 FENOLI
tachlorophenol by extracts from Arthrobacter sp. strain ATCC 33790. J. Bacte riol., 171, 5487.
SHIEH W.K., PUHAKKA J.A., MELIN
E., TNUNKANEN T., (1990): Immobili zed-cell degradation of chlorophenols.
Asce. J. Environ. Eng. 116, 683-697.
SPAIN J.C., GIBSON D.T., (1991):
Pathway for biodegradation of pnitrophe nol in a Moraxella sp. Appl. Environ.
Microbiol., 57, 812.
SPAIN J.C., VAN VELD P.A., MONTI
C.A., PRITCHARD P.H., CRIPE C.R.,
(1984): Comparison of p-nitrophenol bio degradation in field and laboratory test
systems. Applied Environ. Microbiol., 48944.
SHIGEOKA T., YOSHIDA K., HOSAKA C., HAYATSUKI Y., YAMAUCHI F., (1988): Growth inhibition of acti vated sludge microorganism by chlorophe nols and structure-activity relationships
and its relation with microbial degrada tion. Pollution Abstracts, 20, 89-05181P.
SPOKES J.R., WALKER N., (1974):
Chlorophenol and chlorobenzoic acid cometabolism by different genera of soil bac teria. Arch. Microbiol., 96, 125.
SCOW K.M., SCHMIDT S.K.,
ALEXANDER M., (1989): Kinetics of
biodegradation of mixtures of substrates
in soil. Soil Biol. Biochem., 21, 703.
STOWELL J.P., JENSEN J.N., WEBER
A.S., (1992): Sequential chemical/biologi cal oxidation of 2-chlorophenol. Water
Sci. Technol., 26, 2085.
SEIGLE-MURANDI F., STEIMAN R.,
BENOIT-GUYOD J.L., MUNTALIF B.,
SAGE L., (1992): Relationship between
the biodegradative capability of soil mi cromycetes for pentachlorophenol and for
pentachloronitrobenzene. Sci. Total Envi ron., 123/124, 291.
TYLER J.E., FINN R.K., (1974): Growth
rates of a Pseudomonas on 2,4-dichlo rophenoxyacetic acid and 2,4-dichlorophe nol. Appl. Microbiol., 28, 181.
SIDDIQUE M.H., ST. PIERRE C.C., BISWAS N., BEWTRA J.K., TAYLOR
K.E., (1993): Immobilized enzyme cataly zed removal of 4-chlorophenol from
aqueous solution. Water Res., 27, 883.
SIMPSON J.R., EVANS W.C., (1953):
The metabolism of nitrophenols by certain
bacteria. Biochem. J., 55, XXIV.
SCHEUNERT I., BIN C., KORTE F.,
(1989): Fate of 2,4,6- trichlorophenol- 1 4C
in a laboratory soil-plant system. Chemo sphere,19, 1715-1720.
UOTILA J.S., KITUNEN V.H., SAASTAMOINEN T., COOTE T., HAGGBLOM M.M., SALKINOJA-SALONEN M.S., (1992): Characterization of
aromatic dehalogenases of M y c o b a c t erium fortuitum CG-2. J. Bacteriol., 174,
5669.
US EPA, (1985): Health effects of land ap plication of municipal sludge. Sep. 1985.
VALO R.J., HAGGBLOM M.M.,
SALKINOJA-SALONEN
M.S.,
(1990): Bioremediation of chlorophenol
containing simulated ground water by
immobilized bacteria. Water Res., 2 4 ,
253.
161
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
VENKATADRI R., TSAI S.P., VUKANIC N., HEIN L.B., (1992): Use of a bio film membrane reactor for the production
of lignin peroxidase and treatment of pen tachlorophenol by Phanerochaete chrysosporium. Hazard. Waste Hazard. Ma ter., 9, 231.
WALKER N., (1954): Preliminary obser vations on the decomposition of chlo rophenols in soil. Plant Soil, 5, 194.
WALKER N., (1973): Metabolism of ch lorophenols by Rhodotorula glutinis.
Soil Biol. Biochem., 5, 525.
WILD S.R., JONES K.C., (1992): PCP in
the UK environment. In: A budget and
source inventory. Chemosphere, 24, 833845.
WU W.M., BHATNAGAR L., ZEIKUS
J.G., (1993): Performance of anaerobic
granules for degradation of pentachlo rophenol. Appl. Environ. Microbiol., 59,
389.
162
XUN L., TOPP E., ORSER C.S., (1992):
Confirmation of oxidative dehalogenation
of pentachlorophenol by a F l a v o b a c t erium pentachlorophenol hydroxylase. J.
Bacteriol., 174, 5745.
ZEYER J., KEARNEY P.C., (1984): De gradation of o-nitrophenol and p-ni trophenol by a Pseudomonas putida. J.
Agric. Food Chem., 32, 238.
ZHANG X., WIEGEL J., (1990): S e quential anaerobic degradation of 2,4-di chlorophenol in freshwater sediments.
Appl. Environ. Microbiol., 56, 1119.
ZHANG X., WIEGEL J., (1992): T h e
anaerobic degradation of 3-chloro-4-hy droxybenzoate in freshwater sediment
proceeds via either chlorophenol or hy droxybenzoate to phenol and subsequen tly to benzoate. Appl. Environ. Micro biol., 58, 3580.
Capitolo 6
Ftalati (PAE)
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
G
li esteri ftalici sono dei composti chimici utilizzati comunemente nei processi produttivi di varie plastiche (inclusi
PVC), di insetticidi, cosmetici, inchiostri, munizioni ed olii
industriali e lubrificanti (Pierce et al., 1980). Come plastificanti non
sono polimerizzati nella matrice plastica e possono col tempo migrare nell’ambiente esterno (Fatoki and Vernon, 1990); altre fonti di contaminazione sono rappresentate dagli scarichi industriali (Junglaus
et al., 1978) e dai run-off urbani (Lester, 1986).
Sono formulati industrialmente tramite l’esterificazione di alcoli e
anidridi ftaliche (Fatoki and Vernon, 1990).
La struttura chimica è la seguente:
Di(2 etilexil) ftalato (DEHP)
• Coefficiente di ripartizione ottanolo/acqua (Log Kow) : 5.11
• Costante di Henry: 1.1 x 10 -5 atm-m3/mole
Dibutil Ftalato
164
Capitolo 6 FTALATI (PAE)
• Coefficiente di ripartizione ottanolo/acqua (Log Kow): 4.72
• Costante di Henry: 4.6 x 10-7 atm-m3/mole
Dietil Ftalato
• Coefficiente di ripartizione ottanolo/acqua (Log Kow): 2.47
• Costante di Henry: 4.8 x 10-7 atm-m3/mole
Butil benzil ftalato
• Coefficiente di ripartizione ottanolo/acqua (Log Kow): 4.91
• Costante di Henry: 1.3 x 10-6 atm-m3/mole
6.1 Suoli
In suoli trattati con fanghi sono state osservate concentrazioni di DEHP
intorno a 13 ppm, con un c.v. pari al 26% circa (Eiceman et al., 1989).
165
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
6.2. Acque
Nella tabella 6.1 sono riportate le concentrazioni degli ftalati nelle
acque.
Composto
dietilftalato
ni-n-butilftalato
De Walle et al., 1981
Burns and Roe, 1982
Frequenza di C o n c e n t r a z i o n e Frequenza di
Concentrazione
rilevamento (%)
range ( g /l)
rilevamento (%)
range ( g /l)
91
91
1.34-290
0.26 -123
53
64
1- 42
1- 140
Tabella 6.1 - Concentrazioni di alcuni ftalati presenti nelle acque reflue
(da US EPA, 1985).
Altre concentrazioni di DEP, BMP, DBP, DEHP e DIOP in acque
trattate vanno da 0.4 a 33.5 ppb (Fatoki and Vernon, 1990).
6.3. Fanghi
Tra gli ftalati sono specialmente i composti D,2 etil-exil ftalato
(DEHP) e diottiftalato (DOP) ad essere immessi nell’ambiente in
grande quantità. Il loro accumulo nei fanghi è stato riscontrato con
valori superiori a 900 ppm (USA) e intorno a 40 ppm in Italia (Piccolo
1991), valore confermato da analisi su fanghi di impianti urbani, nei
quali gli ftalati mostrano concentrazioni variabili da 1 a 30 ppm s.s.
(Ringstad et al., 1989). Altri autori affermano una concentrazione media di 109 ppm s.s. (da 4 a 273 ppm) (Naylor and Loerh, 1982a).
Il DOP è presente sia nei fanghi industriali che in quelli domestici,
mentre il dibutil-ftalato è soprattutto presente in quelli industriali
(Crathorne et al., 1989).
Altre concentrazioni di ftalati nei fanghi sono riportate nella tabella
6.2 (US EPA, 1985).
166
Capitolo 6 FTALATI (PAE)
Composto
Frequenza di rilevamento
Concentrazione
Range ( g /l)
95
45
10
43
2- 47000
1- 6900
4- 1024
2- 45000
Bis (2-etilexil)ftalato
Di-n-butilftalato
Di-n-octilftalato
Butilbenzilftalato
Tabella 6.2 - I principali ftalati presenti nei fanghi urbani (da US
EPA, 1985, Burns and Roe 1982).
6.4 Degradazione
6.4.1 Biodegradazione
Gli ftalati e gli esteri ftalici (PAE) sono facilmente degradati aerobicamente in diversi ecosistemi (Nomura et al., 1989). Sia batteri Grampositivi e Gram negativi che muffe, isolati dal suolo, si sono dimostrati capaci di mineralizzare un’ampia gamma di esteri ftalici (Kurane, 1977) mediante l’attività di una esterasi aspecifica di natura inducibile che li idrolizza (Kurane et al., 1980; Taylor et al., 1981).
Il di-etil-ftalato (DEP) nel suolo viene degradato aerobicamente
(Howard, 1989). Il DEP ha una semivita di 2.2 gg e raggiunge il 99%
della degradazione in 28 gg (Howard, 1989). Si è osservato che 5 o 10
ppm di DEP in acque reflue domestiche in condizioni aerobiche a
25°C vengono completamente degradati in 7 gg (Howard, 1989); altri
riportano tempi di 24 ore per degradare 1 ppm di DEP (94%) in un sistema semicontinuo di fanghi attivi (Howard, 1989). Ancora, in digestori di fanghi anaerobici la degradazione andava dal 32% dopo 4 settimane allo 0% dopo 8 settimane (Dorney et al., 1985).
La biodegradazione è il principale destino del butilbenzilftalato
(BBP) che è infatti prontamente degradato in fanghi attivi (99% in 48
ore per concentrazioni di 3.3 ppm), fanghi semicontinui, acqua salata
o dolce e in condizioni anaerobiche (>90% in 1 settimana con concentrazioni di 20 ppm).
Studi di degradazione del 2-etil-exil-ftalato (DEHP), condotti con
una colonna di suolo inoculata con un ceppo di Nocardia erythropolis e
percolata con 3000 ppm di DEHP, hanno permesso di rilevare che,
mentre la completa rimozione dello ftalato dal percolato avveniva in
167
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
1 giorno, quella dal suolo era quasi completa in 32 giorni (Kurane et
al., 1978). La degradazione di DEHP è stata osservata in suoli limosi
con velocità diversa e temperatura dipendente (Maturw, 1974) e in
idrosuoli, anche se più lentamente (Johnson and Lulves, 1975).
Nei sedimenti di acque dolci è stato osservato che la velocità di degradazione degli esteri ftalici con catena alchilica lineare è più elevata che per quelli con catena alchilica ramificata (Johnson et al., 1984).
La degradazione avviene anche in acque superficiali, ma qui il forte
adsorbimento di DEHP alle particelle organiche sospese ne riduce
fortemente la degradazione (Taylor et al., 1981; Saeger and Tucker,
1976; Baughman et al., 1980).
Il DEHP apportato dal fango incrementa dunque il contenuto di
ftalati nel suolo, ma anche quello della sostanza organica che assorbe fortemente questi composti lipofili. L’eccesiva mobilità nel suolo
ed il leaching conseguente sono però da escludersi, data la bassa persistenza dei residui.
La biodegradazione aerobica di DEHP, DBP in fanghi attivi è confermata da vari autori (Howard, 1989). L’acclimatazione è comunque
importante: emivite di 0.8 gg per DEHP sono state rilevate nei fanghi
attivi (Howard, 1989); mentre il DBP era completamente mineralizzato nel fango in 2 settimane in condizioni anaerobiche e il 28% veniva
perduto dopo 7 gg in una miscela di compost (Howard, 1989).
Dati sulla degradazione di DEHP nel terreno (Schmitzer et al., 1988)
sono pari al 10% dopo 9 gg in condizioni aerobiche a temperatura
ambiente, mentre in un sistema di laboratorio suolo-orzo veniva degradato più dell’ 8% dopo 7 giorni. In prove di campo il contenuto di
DEHP nel terreno era pari al 7% dell’apporto iniziale, e dopo 2 cicli di
crescita (104 gg) nel suolo si era ridotto all’ 1.7%. L’emivita del DEHP
è di circa 95 gg (Schmitzer et al., 1988). Si può in ogni caso affermare
che il DEHP è mineralizzato prontamente nel suolo a CO 2 (Schmitzer
et al., 1988) ed anche nei fanghi attivi aerobici, mentre in condizioni
anaerobiche il DEHP non è degradato (Scheunert et al., 1987; Shelton
et al., 1984).
I PAE possono infatti essere degradati anaerobicamente, ma molto
più lentamente e, generalmente, non vengono completamente mineralizzati. In suoli anaerobici è stata riscontrata una degradazione del
33% dopo 30 giorni di incubazione, contro il 90% osservato con suoli
aerobici (Shanker et al., 1985). Invece con prove in batch di digestione
di fanghi anaerobici, condotte per 32 giorni, non è stata osservata alcuna degradazione del DEHP (Ziogou et al., 1989).
168
Capitolo 6 FTALATI (PAE)
In prove di degradazione anaerobica utilizzando un inoculo di fanghi, in un periodo di incubazione da 50 a 100 gg gli ftalati, i dibutil ftalati e basse concentrazioni (20 ppm) di dimetilftalato e dietilftalato
erano degradati a metano dal 75 al 100%; concentrazioni maggiori
(100-200 ppm) di questi ultimi erano degradati fino al 25 o 50% (Junglaus et al., 1978).
6.5 Vegetali
L ’u p t a k e di DEHP da parte delle piante coltivate in suoli trattati è
stato indagato da molti autori (Overcash et al., 1986), senza individuare i metaboliti derivati.
Infatti, nelle piante non è chiaro l’iter degli ftalati, in quanto non si
distinguono i diversi metaboliti che si muovono attraverso lo xilema
(da studi su crisantemo e spinacio) (Overcash et al., 1986). L’ assorbimento da parte delle piante era comunque molto ridotto in sperimentazioni su patate (tabella 6.3), ove si è rilevata una concentrazione dello 0.1% sul totale della radioattività applicata ed in piante di orzo che
dopo 2 cicli di crescita mostravano lo 0.005% (cfr. tabella 6.4, Schmitzer et al., 1988).
I risultati ottenuti (Schmitzer et al., 1988) sono in accordo con altre
ricerche su crisantemo, rapa e spinacio, cresciuti in suoli trattati, in
cui non si rilevano tracce di DEHP (Kato et al., 1981).
Altri autori (Krell and Sandermann, 1986) in sperimentazioni su
grano notarono che il DEHP non entrava nelle cellule della pianta, ma
era scisso e adsorbito dalla cuticola fogliare, dai trigliceridi e dagli altri componenti della parete cellulare, per essere poi metabolizzato
molto rapidamente, soprattutto in B-D- glucosil coniugati polari; dato confermato anche da altre ricerche ed attribuito all’associazione di
questi composti alla clorofilla (Dorney et al., 1985).
169
LA TOSSICITÀ D E IF A N G H ID I
Campione
profondità
suolo
0 - 20 cm
20 -30 cm
30 -40 cm
40 -50 cm
totale
orzo
baccelli
grani
paglia
radici
totale pianta
acqua
percolata
piante, I
periodo
vegetativo
acqua
percolata,
I periodo
veget.
totale
DEPURAZIONE
Estratto
ppm ( a
%( b
non
estraibile
ppm
<0.001
<0.001
<0.001
<0.001
<0.001
0.01
<0.01
<0.01
<0.01
0.01
0.007
<0.001
<0.001
0.001
0.003
0.003
0.010
<0.001
0.002
0.005
0.006
<0.001
0.002
0.006
0.006
0.006
0.019
0.009
%
1.33
0.09
0.09
0.19
1.70
<0.001
0.001
<0.001
0.002
0.003
totale
ppm
0.007
<0.001
<0.001
0.001
0.003
%
1.34
0.09
0.09
0.19
1.71
0.009
0.016
0.006
0.024
0.015
<0.001
0.003
<0.001
0.002
0.005
<0.01
0.01
0.11
0.51
2.34
a) ppm di DEHP C 1 4 basato sul peso secco del suolo e il peso fresco della pianta
b) Percentuale della totale radioattività applicata.
Tabella 6.3 - Concentrazioni residue di DEHP C 14 e dei suoi metaboliti nel
suolo, piante di orzo, acqua percolata, in due periodi di vegetazione (446 gg)
dopo il trattamento del suolo (profondità 0-10 cm) in condizioni di campo
(da Schmitzer et al., 1988).
Studi sull’assorbimento da parte delle piante (lattuga, carote, peperone e festuca) del DEHP, largamente presente nei fanghi, hanno mostrato che le concentrazioni nelle piante cresciute su suoli ammendati
erano indipendenti dalla quantità di fango applicata per lattuga, bacche di peperone e radici di carote.
Dalle bioconcentrazioni (BCF) calcolate si notava un piccolo asporto
di DEHP (da 0.01 a 0.03 dpm/g), in ogni caso, siccome il DEHP (come
tale) non è stato determinato in nessuna pianta, l’asporto dello ftalato
è di minima importanza e non limitante l’utilizzo del fango per queste
colture (Aranda et al., 1989). Anche in campo non si è visto alcun effetto su mais, soia, grano, festuca (cfr. tabella 6.5 , Aranda et al., 1989).
170
Capitolo 6 FTALATI (PAE)
Campione
profondità
suolo
0 - 20 cm
20 -30 cm
30 -40 cm
40 - 50 cm
totale
patate,
pelate
pelle
germogli
radici
totale pianta
acqua
percolata
totale
Estratto
ppm ( a
%( b
non
estraibile
ppm
<0.024
<0.001
<0.001
<0.001
0.010
4.78
<0.04
<0.01
0.02
4.85
0.009
<0.001
<0.001
0.001
0.004
0.010
0.004
0.009
0.030
0.009
0.009
0.001
0.002
0.002
0.014
0.067
0.028
0.110
0.130
0.067
%
totale
ppm
%
1.84
0.02
0.05
0.12
2.03
0.033
<0.001
<0.001
0.001
0.014
6.62
0.06
0.06
0.14
6.88
0.060
0.009
0.0020
0.007
0.096
0.077
0.032
0.119
0.160
0.076
0.069
0.010
0.022
0.009
0.110
0.01
0.51
7.50
a) ppm di DEHP C 1 4 basato sul peso secco del suolo e il peso fresco della pianta
b) Percentuale della totale radioattività applicata.
Tabella 6.4 - Concentrazioni residue di DEHP C 14 e dei suoi metaboliti
nel suolo, patate, acqua percolata, in un periodo di vegetazione (111 gg)
dopo il trattamento del suolo (profondità 0-10 cm) in condizioni di campo
(da Schmitzer et al., 1988 ).
Trattamento
Carote
Fusti
1
2
4
5
media
CV, %
b
0.30 a
0.16
0.31
0.35
0.28
23
Radici
Peperone
Pianta
Frutto
0.15
0.12
0.11
0.15
0.13
23
0.14
0.10
0.18
0.17
0.15
20
0.07
0.06
0.09
0.09
0.08
23
Festuca
0.30
0.15
0.22
0.27
0.24
34
a) I dati sono la media di 3 repliche.
b) I coefficienti di variazione (CV) sono basati su una varianza nella pianta di dpm/g (s.s.).
dpm/g pianta
BCF= ---------------dpm/ g suolo
Tabella 6.5 - Bioconcentrazione (BCF) di DEHP C 14 nelle piante
(da Aranda et al., 1989 ).
171
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
In sperimentazioni sulla tossicità e il metabolismo di n-butil ftalato
in cellule di pomodoro non è stato rilevato alcun effetto inibente fino
a concentrazioni di 10 ppm. Gli ftalati venivano degradati ad acido
benzoico, tuttavia non si è riusciti ad identificare i composti di degradazione intermedi (Pogany et al., 1990), (affermazione in contrasto
con quella che ipotizza una trasformazione a B-D- glucosil coniugati).
Dalle indagini effettuate e data la bassa persistenza dei residui nel
suolo, si può concludere che l’uptake da parte delle piante è di importanza trascurabile.
6.6 Animali
Il DEHP è relativamente non tossico (LD 50 = 309 mg su ratto)
(Aranda et al., 1989). In ogni caso, dal momento che il DEHP ha indotto degli effetti cancerogeni sui topi, un potenziale assorbimento da
parte delle piante deve essere considerato, per evitare un’eventuale
contaminazione alimentare (Schmitzer et al., 1988; Naylor and Loehr,
1982a,b), anche se le dosi di fango normalmente applicate in agricoltura non dovrebbero comportare nessun rischio.
Conclusioni
Gli esteri ftalici sono presenti nei fanghi mediamente da 30 fino a
100 ppm.
La forte lipofilia e l’assenza di volatilità permettono a questi composti di legarsi alla sostanza organica del terreno, in genere però, non
mostrano problemi di degradazione, per cui l’eccessiva mobilità nel
suolo ed il leaching conseguente sono da escludersi.
Data la bassa persistenza dei residui, anche l’uptake da parte delle
piante coltivate è di importanza trascurabile. In ogni caso, l’iter degli
ftalati nelle piante è stato ampiamente indagato senza individuare i
metaboliti derivati; dalle bioconcentrazioni calcolate, comunque, risulta un assorbimento minimo e non limitante per l’utilizzo del fango
in agricoltura alle dosi solitamente impiegate.
172
Capitolo 6 FTALATI (PAE)
Bibliografia
ARANDA J.M., O’CONNOR G.A., EICEMAN G.A., (1989): Effects of sewage
sludge on Di-(2Ethilhexyl) Phthalate Up take by plants. J. Environ. Qual., 18, 4550.
BAUGHMAN G.L., PARIS D . F . ,
STEEN W.C., (1980): Quantitative ex pression of biotransformation. In: Maki
A.W., Dickson K.L., Cairns J., ed. Bio transformation and fate of chemicals in
the environment, Washington, DC,
American Society for Microbiology,
105-111.
CRATHORNE B., DONALDSON K .,
JAMES H . A ., ROGERS H . R ., ( 1 9 8 9 ) :
The determination of organic contami nants in UK sewage sludges. In: Organic
contaminants in wastewater, sludge and
sediment. Edited by D. Quaghebeur, I.
Temmermann
and
G.Angeletti.
Comm. of the Eur. Commun. Elsevier
Applied Science.
DORNEY J.R., WEBER J.B., OVERCASH M.R., STREK H.J., (1985): Plant up -
take and soil retention of phthalic acid ap plied to Norfolk Sandy Loam. J. Agric.
Food Chem., 33, 398-403.
EICEMAN G.A., GARDEA-TORRESDEY J.L., O'CONNOR G.A., URQUHART N.S., (1989): Sources of error
in analysis of municipal sludges and slud ge-amended soils for Di -(2-ethylhexyl)
phthalate. J. of Environ. Quality, 18(3),
374-379.
FATOKI O.S., VERNON F., (1990):
Phthalate esters in rivers of greater Man chester area, UK. The Science of the total
Environment, 95, 227-232.
HOWARD P.H., ( 1 9 8 9 ): Handbook of
Environmental Fate and Exposure Date
for organic chemicals, Vol.I, Large pro duction and priority pollutants. L e w i s
Pub., Michigan, Usa.
JOHNSON B.T., LULVES W., (1975):
Biodegradation of dibutyl-phthalate and di2-ethyexyl phthalate in freshwater hydro soil. J.Fish Res. Board Can., 32, 333-339.
173
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
JOHNSON B.T., HEITKAMP M.A., JONES J.R., (1984): Environmental and che mical factors influencing the biodegrada tion of phthalic acid esters in freshwater se diments. Environ. pollut. , B8, 101-118.
LESTER S.N., (1986): Presence of orga nic micropollutants in sewage sludges. In:
Processing Use of Sewage Sludge,
proceeding of the Third Intern Symp.,
Brighton, Sept. 27-30.
JUNGCLAUS G.A., LOPEZ-AVILA
V., HITES R.A., (1978): Organic com pounds in an industrial wastewater: a ca se study of their environmental impact.
Environ. Sci. Technol., 12, 88-96.
MATURW S.P., (1974): R e s p i r o m e t r i c
evidence of the utilization in soil of dioctyl and di-2-ethylhexil phthalate plasti cizers. J. environ. Qual., 3, 207-209.
KATO K., NAKAOKA T., IKEDA H . ,
(1981): Contamination of Phthalic Acid
Esters in vegetables . Chem Abstr. , 95,
60034k.
KRELL H.W., SANDERMANN H. Jr.,
(1986): Metabolism of the persistent pla sticizer chemical Bis-(2ethylhexyl) phtha late in cell suspension cultures of wheat
(Triticum aestivum L.). D i s c r e p a n c y
from the intact plant. J. Agric. Food
Chem., 34, 194-198.
KURANE R., SUZUKI T., TAKAHAR A Y., (1978): Removal of phthalate
esters-in-soil column inoculated with mi c r o o r g a n i s m. Agric. Biol. Chem., 42,
1469-1478.
KURANE R., SUZUKI T., TAKAHARA Y., (1977): Isolation of microorgani sms growing on phthalate esters and de gradation of phthalate esters by Pseudomonas acidovorans 256-1. Agric. Biol.
Chem., 41, 2119-2123.
KURANE R., SUZUKI T., TAKAHARA
Y., (1980): Induction of enzymes involved
in phthalate esters metabolism in Nocardia erythropolis and enzymatic hydroly sis of phthalate esters by commercial lipa ses. Agric. Biol. Chem., 44, 529-536.
174
NAYLOR L.M., LOEHR R.C., (1982a):
Priority pollutants in municipal sewage
sludge. Part I. Biocycle, 21, 18-22.
NAYLOR L.M., LOEHR R.C., (1982b):
Priority pollutants in municipal sewage
sludge. Part II. Biocycle, 23, 39-42.
NOMURA Y., TAKADA N., OSHIMA
Y., (1982b): Isolation and identification of
phtalate-utilizing bacteria. J . F e r m e n t .
Bioeng., 67, 297-299.
OVERCASH M.R., J.B. WEBER,
TUCKER W., (1986): Toxic and priority
organics in municipal sludge land treat ment systems, USEPA.
PICCOLO A., (1991): Contenuto e dina mica nel suolo di composti xenobiotici ap plicati a fanghi e a compost. In: Riciclo di
biomasse di rifiuto e di scarto e fertilizza zione organica del suolo. Patron Ed.,
279-286.
PIERCE R.C., MATHUR S.P., W I LLIAMS D.T., BODDINGTON M . J . ,
(1980): Phthalate esters in the aquatic en vironment. Pub. NRCC No.17583, National Research Council Canada 2f Hites R. A. (1973): "Analysis of trace orga nic compounds in New England Rivers".
J. Chromatogr. Sci., 11, 570-574.
Capitolo 6 FTALATI (PAE)
POGANY E., WALLNOFER P.R., ZIEGLER W., MUCKE W., (1990): Metabo lism of o-nitroaniline and Di-n-Butyl
Phthalate in cell suspension cultures of
tomatoes. Chemosfere, 21, 4-5, 557-562.
RINGSTAD O., DRANGSHOLT H.,
ORELD F ., ( 1 9 8 9 ): Analysing organic
micropollutants in sewage sludge using a
GC/MS Priority Pollutants Scheme. In:
Organic contaminants in wastewater,
sludge and sediment. Edited by D. Quaghebeur, I. Temmermann, G.Angeletti. Comm. of the Eur. Commun. Elsevier Applied Science.
SAEGER V.W., TUCKER E.S., (1976):
Biodegradation of phthalic acid esters in
river water and activated sludge. A p p l .
Environ. Microbiol., 31, 29-34.
SCHEUNERT I., VOCKEL D., S C HMITZER, J., KORTE, F., (1987): Biomi neralization rates of 14 C-labelled organic
chemicals in aerobic and anaerobic su spended soil. Chemosfere, 16, 1031- 1041.
SCHMITZER J.L., SCHEUNERT I . ,
KORTE F., (1988): Fate of Bis-(2ethylhexyl) (C 1 4) Phtalate in laboratory
and outdoor soil-plant systems. J. Agric.
Food Chem., 36, 210-215.
SHANKER R., RAMAKRISHNA C.,
SETH P.K., (1985): Degradation of some
phtalic acid esters in soil. Environ. Pol lut., 39, 1-7.
SHELTON D.R., BOYD S.A., T I E D J E
J.M., (1984): Anaerobic biodegradation of
phthalic acid esters in sludge. E n v i r o n .
Sci. Technol., 18, 93-97.
TAYLOR B.F., CURRY R.W., CORCORAN E.F., (1981): Potential biodegrada tion of phthalic acid esters in marine re gions. Appl. Environ. Microbiol., 42, 590595.
US EPA, (1985): Health effects of land ap plication of municipal sludge. September.
ZIOGOU K., KIRK P.W.W., L E S T E R
J.N., (1989): Behaviour of phthalic acid
esters during batch anaerobic digestion of
sludge. Water Res. , 23, 743-748.
175
Capitolo 7
Idrocarburi
Policiclici
Aromatici (PAH)
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
G
li idrocarburi aromatici policiclici sono composti organici
con più anelli benzenici. I più comuni sono rappresentati da:
Naftalene, Benzopirene, Fenantrene, Fluorantrene, Antracene e derivati.
Naftalene
Benzopirene
Fenantrene
Fluorantrene
Antracene
Provengono dalla incompleta pirolisi di materiali organici come
carbone, petrolio, carburante, legno ecc.
Tra le varie fonti vi sono soprattutto scarichi industriali, domestici
(basso), run-off urbani, idrocarburi del petrolio (bitume, asfalto, ecc.)
pioggia, rilascio dai rifiuti, reattori ecc, volatilizzazione... Le concentrazioni di background del suolo sono dovute ai PAH rilasciati nell’atmosfera, che ricadono poi sulla superficie terrestre con le precipitazioni. I run -off possono contenere fino a 1 ppm di PAH che durante i temporali può aumentare fino a 100 volte rispetto a condizioni di
tempo asciutto (Lester, 1983).
I nitro-PAH, invece, sono formati dalla nitrazione dei PAH. Questi
composti sono stati individuati nel toner delle fotocopiatrici, nei particolati dell’aria, nell’olio dei motori, nell’emissione dei motori diesel,
nel cibo cotto al barbecue, nelle foglie di tè, ecc. (Rafii et al.,1991).
Dal momento che i fanghi sono sempre maggiormente inquinati (Jones et al., 1989) e poichè è stato osservato un aumento del contenuto
di PAH nel suolo in relazione al loro utilizzo in agricoltura (Wild et
al., 1990), si è cercato di indagare sulla reale pericolosità di questi
composti, considerando anche che alcuni di essi (ad esempio il benzo(a)pirene) sono cancerogeni (Wild and Jones , 1991).
178
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
7.1 Suoli
I PAH esistono naturalmente nei suoli forestali in concentrazioni
dai 40 ai 1300 ppb, e mediamente intorno ai 90 ppb nei suoli agrari
(Piccolo, 1991).
La concentrazione media dei suoli oscilla tra i 10 e i 30 ppb, fino a
un max di 500 ppb (Genevini et al., 1989), ma c’è chi sostiene come valore tipico del suolo concentrazioni da 1 fino a 1000 ppb (Genevini et
al., 1989).
Concentrazioni di PAH in suoli scozzesi in relazione alla sostanza
organica del suolo sono riportate nella tabella 7.1 (Jones, 1989).
n.
campione
PCB
( g/kg)
% peso
perso
nell’estrazione
% argille
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
1.4
1.7
2.6
2.7
5.6
nd
2.5
2.9
0.26
0.96
3.4
1.3
0.34
4.9
2.9
6.4
6.8
3.8
4.1
6.2
4.6
7.1
12.2
2.8
2.0
7.1
0.98
4.7
0.96
11.2
7.1
4.0
0.86
0.80
0.53
1.2
0.94
1.0
0.66
1.4
1.1
0.61
0.16
0.20
0.73
0.98
0.08
15.6
0.08
21.3
0.66
1.00
0.81
0.80
15.0
18.5
12.1
15.8
16.0
26.8
19.4
27.7
23.9
23.9
19.2
15.9
16.3
13.6
16.9
15.6
15.9
13.2
19.0
25.5
16.6
13.7
17.4
22.3
16.1
11.2
26.2
PAH
( g/kg)
149
165
119
178
409
301
515
264
240
272
235
157
583
738
1610
784
5366
400
260
2158
1665
9632
666
54516
8281
6983
3838
segue
179
LA TOSSICITÀ D E IF A N G H ID I
n.
campione
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
DEPURAZIONE
PCB
( g/kg)
% peso
perso
nell’estrazione
% argille
PAH
( g/kg)
7.9
10.2
2.8
1.5
4.1
2.5
1.8
2.1
1.7
2.6
0.30
1.3
2.3
0.71
2.4
4.0
3.0
0.60
1.2
nd
0.56
2.0
7.2
1.1
0.29
1.4
1.4
1.9
4.2
5.6
9.0
1.7
28.0
14.2
12.3
1.2
0.75
1.1
0.81
1.1
1.1
1.9
0.73
2.0
26.9
20.7
20.3
13.3
18.4
16.2
20.2
19.9
24.7
18.9
12.9
14.2
17.4
11.8
21.9
38.0
22.6
28.7
8.4
17.7
19.1
28.6
884
856
551
313
351
171
206
177
141
224
6743
180
173
282
253
161
269
125
156
947
153
108
Tabella 7.1 - Concentrazioni di PCB e PAH in suoli Scozzesi (da Jones, 1989).
Altre sperimentazioni riportano nel ’68 delle concentrazioni di 180
ppb come valore tipico delle zone agricole inglesi prima del trattamento con fanghi (Jones et al., 1989a,b), che aumentò dapprima a 330
ppm, probabilmente a causa di una combinazione tra inquinamento
atmosferico e contaminazione da fanghi applicati alla parcelle vicine,
ed in seguito, fino a valori maggiori di 500 ppb (nel 1989).
In suoli americani il contenuto in PAH varia da 100 a 54500 ppb. In
ogni caso, le maggiori quantità si rilevano nelle aree urbane, vicino a
fonti di emissione, in suoli ad alto contenuto in sostanza organica e,
talvolta, in suoli ammendati con fanghi (Wild and Jones, 1991).
Da analisi effettuate su suoli norvegesi è risultato un contenuto in
PAH che oscilla da 1 ppb a 993 ppb, le concentrazioni più alte sono
state osservate vicino agli impianti di produzione di alluminio (Vogt
et al., 1987).
In suoli gallesi il range rilevato nello strato di 0-5 cm mostra un contenuto in PAH costante, le differenze si rilevano a seconda della più o
180
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
meno intensa urbanizzazione dell’area. In generale i suoli ricchi in
S.O., quali torbe o suoli con foreste di alberi decidui e conifere, contengono concentrazioni maggiori (Jones et al., 1989b).
campionamento
trattamenti in campo
fluoran- benzo benzo benzo Indeno benzo
trene
(k)
(b)
(a)
(1,2,3,
(ghi)
fluoran- fluoran- pirene
cd) perilene
trene
trene
pirene
controllo
dopo il fango
dopo il raccolto
5 t s.s.
dopo il fango
10 t s.s.
dopo il raccolto
10 t s.s.
fattore
d'incremento
dopo il fango
fattore
d'incremento
dopo il raccolto
dopo il fango
dopo il raccolto
min
max
x
min
max
x
min
max
x
min
max
x
5 t s.s.
10 t s.s.
5 t s.s.
10 t s.s.
61
51
20
420
102
10
100
37
20
420
42
20
160
59
1,7
0,7
17
15
nn
90
21
nn
40
11
nn
90
10
nn
40
15
1,2
0,6
41
43
20
190
54
20
80
34
20
190
30
10
90
39
1,3
0,7
30
27
nn
140
33
nn
50
16
nn
140
17
nn
80
26
1,1
0,6
36
33
nn
120
39
nn
60
25
10
120
24
10
80
34
1,1
0,7
48
37
nn
130
45
10
60
21
nn
130
27
nn
70
29
0,9
0,6
0,6
1,2
0,7
1,0
0,8
0,9
0,6
1,0
0,8
1,0
0,6
0,8
Tabella 7.2 - Risultati di una ricerca in campo. Il contenuto in PAH del suolo
dopo l'utilizzo del fango e dopo il raccolto. Media di 7 campioni di suolo.
Concentrazioni in g/kg di s. s.; n.n.<10 g/kg di s. s. (da Witte, 1989 ).
Dalla tabella sopra riportata (tabella 7.2, Witte, 1989) si nota che il livello di benzofluorantrene in suoli non trattati era pari a 17 ppb,
mentre per il naftalene altri autori riportano concentrazioni di 48.3
ppb vicino ad impianti di produzione di Al ed in suoli non inquinati il
valore era pari a 46.2 ppb (Howard, 1989).
181
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
7.2 Fanghi
Nei fanghi si trovano miscele con concentrazioni da 1 fino a 10 ppm
(Wild and Jones, 1989). Esiste perciò la possibilità di un accumulo di
PAH in suoli ammendati con fanghi, indicata anche da altre sperimentazioni, che rilevano concentrazioni in suoli trattati pari a 7-8
ppm ed oltre (Piccolo, 1991). Altri studi riportano dei valori che oscillano da 13 ppm in fanghi di origine civile (da aree rurali), a 140 ppm
in fanghi molto inquinati (Wild et al., 1991a,b).
Da altri autori è stato osservato un accumulo di PAH nel terreno dopo il trattamento con i fanghi e un aumento da 5 a 10 volte la dotazione iniziale (Kampe, 1989). Il benzopirene era presente da 0.005 a 0.04
ppm, (massimo 0.015 e minimo 0.1 ppm di s.s), valori tutti al di sotto
o uguali a quelli della bibliografia (Kampe, 1989). Quando si verificò
l’aumento, la media di benzopirene era di 0.2 e per gli altri PAH di
0.03 - 0.3 ppm, concentrazioni quindi molto basse, più vicine ai valori
olandesi (0.05 o 1) che ai valori permessi (11-20 ppm) (Kampe, 1989).
In altri studi la concentrazione di benzopirene nei fanghi variava da
0.27 a 0.57 ppm (Genevini, 1989), mentre il contenuto medio dei PAH
(somma di 8 PAH indagati) era di 7-8 ppm (Genevini, 1989).
È stato osservato, inoltre, che anche il compostaggio può indurre un
aumento di PAH nel terreno (cfr. tabella 7.3, Genevini, 1989).
Poliarene
terreno
Benzo (b,k,j) - fluorantrene
Benzo(e)pirene
Benzo(a)pirene
Perilene
Dibenzo (a,h)-antracene
dibenzo(a,c)-antracene
Benzo(ghi)- perilene
112
48.3
23.2
4.2
17.5
38.1
13.4
terreno +
fango
129
52.4
31.5
5.9
17.1
43.6
9.3
terreno +
compost
fresco
144
78.0
89.2
7.2
28.3
57.5
24.4
terreno +
compost
maturo
176
88.0
40.7
7.0
29.6
63.4
27.5
Tabella 7.3 - Quantità di PAH in terreni trattati con fanghi e compost (ppb)
(da Genevini, 1989).
Nella tabella 7.4 sono riportate altre concentrazioni di PAH nei fanghi (Lester, 1983): i valori vanno da 0.01 ppb per benzopirene a 11.43
ppb per fluorantrene. Le differenze riscontrate sono dovute ai diversi
metodi analitici utilizzati (Lester, 1983).
182
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
Composto
Fluorantrene
Benzo(b)fluorantrene
Benzo(k)fluorantrene
Crisene/benz(a)-antracene
Benzo(e)pirene
Benzo(a)pirene
Perilene
Dibenz (a,h)antracene
Indeno (1,2,3c-d)pirene
Benzo(ghi) perilene
Concentrazione g / g
Germania G e r m a n i a
CecoGran
1966 (31) 1977 (27) S l o v e n i a B r e t a g n a
*n=2
n=5
1978 (28) 1979 (29)
n=10
n=3
3.26-4.09
0.51-2.16
0.52-2.06
0.75-1.76
0.63-0.66
0.64-0.67
0.52-0.69
4.28
3.22
3.22
3.57
1.40
1.70
0.51
0.26
1.34
1.10
1.0-5.78
0.11-1.31
0.02-0.008
0.01-0.27
0.05-0.10
0.03-0.15
0.38-1.87
0.02-0.10
0.91
0.30
0.27
0.42
0.30
0.23
Gran
Bretagna
1981 (39)
n=12
0.34-11.43
0.06-9.14
0.06-4.57
0.12-9.14
0.06-6.86
0.06-9.14
* n= numero dei campioni analizzati
Tabella 7.4 - Concentrazioni di PAH nei fanghi (da Lester, 1983).
Le sperimentazioni in campo mostrano che l’accumulo in PAH non
può essere misurato dopo una singola applicazione di fango, come afferma anche la legge tedesca. In vaso, il contenuto in PAH aumentava
in relazione alla dose di fango, con 500 t/ha però l’incremento era minore delle aspettative; non apparivano comunque effetti a lungo termine dovuti all’intenso utilizzo di fanghi (figura 1).
Inoltre i calcoli mostrano che più del 90% di inquinamento doveva
essere originato da altre fonti (Witte, 1989).
Figura 1 - Effetti a lungo termine: correlazione tra dose di fango e contenuto
nel terreno di fluorantrene e benzo(k)fluorantrene (ppb di solidi totali).
183
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
In fanghi industriali sono stati estratti ancora una volta più PAH
che in quelli di origine domestica: soprattutto naftalene, alkilnaftalene, fenantrene, metilfenantrene, antracene e metilantracene; tutti
PAH o PAH alkilsostituiti (Crathorne et al., 1989).
Altri autori mostrano come le diverse quantità ritrovate nei fanghi
siano imputabili alle regioni di provenienza e non alla grandezza degli impianti (cfr. tabella 7.5, Witte, 1989). I valori di PAH erano intorno
ai 300-1600 ppb s.s., (benzopirene) con una media di 626 ppb. La somma dei 6 PAH esaminati era in media di 5206 ppb (cfr. tabella 7.6, Witte, 1989).
Regione
Regione
Regione
Regione
Totale
1
2
3
4
n.
campioni
n. dei
trattam.
28
20
6
3
57
14
10
6
3
37
fluoran- benzo benzo benzo Indeno benzo
trene
(k)
(b)
(a)
(1,2,3,
(ghi)
fluoran- fluoran- pirene
cd) perilene
trene
trene
pirene
1752
1654
2508
2207
1822
365
251
488
500
345
733
549
898
997
699
699
435
878
727
626
558
609
1230
1020
671
1220
649
1417
1206
1043
Tabella 7.5 - Media del contenuto in PAH di fanghi provenienti da regioni
differenti. Le concentrazioni sono espresse in g/kg di s.s.
Composto
Min
Max
Mediana
Media
Fluorantrene
Benzo(k)fluorantrene
Benzo(b)fluorantrene
Benzo(a)pirene
Indeno (1,2,3c-d)pirene
Benzo(ghi) perilene
Totale PAH
200
nn
nn
100
200
nn
1350
7670
1000
1800
2000
2000
3410
16650
1600
300
680
520
600
890
4650
1822
345
699
626
670
1043
5206
Tabella 7.6 - Contenuto di PAH in 57 fanghi provenienti
da 38 impianti di trattamento ( g/kg di s.s.) (da Witte 1989 )
Altre concentrazioni di benzopirene (B(a)P), rilevate su un campione di 100 fanghi, variavano da n.d. (<0.05 ppm) a 7.7 ppm s.s. (media
0.92). È da sottolineare il fatto che non c’erano differenze tra la quantità di B(a)P nel fango proveniente da aree urbane e quella relativa ad
aree agricole (cfr. tabella 7.7, Aichberger and Reiferrauer, 1983).
184
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
Fanghi
Fanghi
Fanghi
Fanghi
di origine agricola
urbani
industriali
misti
range
media
moda
0,07-6,9
0,21-7,7
n.d.-0,8
n.d.-7,7
0,91
0,93
0,92
0,24
0,46
0,26
Tabella 7.7 - Contenuto di Benzo(a)pirene nei fanghi
( g/kg s.s.) ( da Aichberger et al., 1983).
Infine, da sperimentazioni a lungo termine su fanghi anaerobici applicati all’agricoltura la media di PAH nei fanghi è risultata di circa 50
ppm (da 18 a 125). Più abbondante era il benzo(ghi)perilene con una
concentrazione media di 10 ppm. Il contenuto diminuisce da 125 a 29
ppm dopo il 1961, in corrispondenza alle nuove norme legislative
(Wild and Jones, 1991).
Non si hanno riduzioni di PAH con trattamento di raffreddamento
o essiccazione (70°C) (Wild and Jones, 1991).
Altre concentrazioni di PAH nei fanghi sono riportate nella tabella
7 . 8 (Marks et al., 1992). Segue infine una tabella riassuntiva (t a b e l l a
7.9) delle quantità di PAH presenti nei fanghi rilevate da vari autori.
PAH
mg/l
mg/kg
max
CCL
mg/kg (1990) *
Naftalene
Fluorene
Fenantrene
Antracene
Fluorantrene
Benz(a)antracene
Crisene
Benz(a)pirene
1117
239
368
682
47
55
157
44
1096
223
343
636
44
51
146
41
42
nessuno
34
28
nessuno
20
15
12
Nota: Benzo(a) antracene, benzo(a)pirene e crisene sono cancerogeni.
* CCL= livello di concentrazione dei composti. Il valore indica la massima concentrazione ammessa per i costituenti pericolosi di K051 rifiuti per una corretta applicazione al terreno dei rifiuti stessi.
Tabella 7.8 - PAH rilevati in quantità significative in fanghi di origine
petrolchimica (da Marks et al., 1992).
185
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
PAH
AA
13 - 140
0.03 - 0.3 (media)
7 - 8 (media)
18 - 125
135 - 1665
Wild et al., 1991 a,b
Kampe et al., 1989
Genevini, 1989
Wild and Jones, 1991
Witte, 1989
Tabella 7.9 - Concentrazioni di PAH nei fanghi rilevate
da vari autori (ppm).
7.3 Acque
Le concentrazioni di PAH nelle acque sono riportate nella t a b e l l a
7.10 (Valls et al., 1989): nelle acque reflue c’è una maggior presenza di
PAH a maggior peso molecolare; il raddoppio osservato è in accordo
al corrispondente valore di Kow, e conseguentemente al numero di
anelli di PAH (Valls et al., 1989).
logKow
acque reflue ( g / L )
D
LABs
LASs
NPEOs
TBPs
coprostanolo
fenantrene
pirene
benzo(a) pirene
8.8
2.5
6.6
4.0
10.7
4.6
5.2
6.1
3-33
127-400
37-123
28-84
37-50
----
P
P/D
15-52
1.6-5
nd
-0.1-0.5 2-4 10-3
2-3
0.03-0.07
630-825 16.5-17
-------
acque costiere (ng/L)
D
P
2
-845
2.8
6
----
10
nd
0.5
0.1
242
0.69
0.16
nd
sedimenti
( g/g s.s.)
P/D
5
23-50
--6 10-4
0.1-6.6
-3
3 10
0.1-0.3
806.7
32-284
0.03 4-405 10-3
0.05 13-757 10-3
0.02 94-768 10-3
Tabella 7.10 - Concentrazioni di alcuni inquinanti in acque reflue
(D=disciolto e P= particolato), marine e sedimenti (Valls et al., 1989).
Nella tabella 7.11 viene illustrato il contenuto di PAH in acque di
scarico urbane, mentre nella tabella 7.12 è riportata la media di 5 fonti
di acque di scarico (Strup, 1982).
186
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
Composto
livello (ppb)
Naftalene
Acenaftilene
Acenaftene
Fluorene
Fenantrene
Antracene
Fluorantrene
Pirene
Benz(a)antracene
Crisene
Benz(b)fluorantrene
Benz(k)fluorantrene
Benz(a)pirene
Dibenz (a,h)antracene
Benz(ghi)perilene
Indeno(1,2,3-cd)pirene
20
250
11.6
6.1
5.0
11.3
0.3
2.3
0.64
2.0
0.3
0.14
0.21
0.4
0.42
0.96
rilevamento
%
0 gg
7 gg
38+/-3
79+/-8
79+/-8
77+/-5
83+/-6
82+/-6
127+/-6
88+/-4
74+/-6
89+/-16
88+/-12
86+/-4
101+/-7
86+/-3
86+/-6
106+/-6
24+/-5
88+-9
86+/-7
75+/-8
89+/-9
88+/-7
124+/-7
89+/-5
71+/-7
92+/-9
86+/-9
89+/-7
98+/-8
89+/-5
90+/-5
97+/3
background
(ppb)
MDL
(ppb)
<4
<20
1.8+/-10
<0.4
<0.3
<0.3
0.7+/-0.05
<0.2
<0.02
0.3+/-0.1
<0.02
<0.02
<0.003
<0.06
<0.15
<0.08
4.0
20
1.0
0.4
0.3
0.3
0.05
0.2
0.02
0.1
0.02
0.02
0.03
0.06
0.15
0.08
Tabella 7.11 - Concentrazioni di PAH in acque reflue trattate (Strup, 1982).
Composto
Naftalene
Acenaftilene
Acenaftene
Fluorene
Fenantrene
Antracene
Fluorantrene
Pirene
Benz(a)antracene
Crisene
Benz(b)fluorantrene
Benz(k)fluorantrene
Benz(a)pirene
Dibenz (a,h)antracene
Benz(ghi)perilene
Indeno(1,2,3-cd)pirene
Rilevamento
76+/-37*
91+/-8
87+/-2
90+/-18
100+/-19
92+/-10
115+-19
94+/-12
88+/-15
90+/-4
95+/-25
94+/-14
91+/-4
87+/-2
85+/-4
91+/-8
* Media di 4 campioni di acque di scarico
conservate per 7 gg +/- la deviazione
standard delle misurazioni.
Tabella 7.12 - Contenuto medio
di PAH in campioni di acque reflue
(ppb) (da Strup, 1982).
187
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
7.4 Degradazione
7.4.1 Biodegradazione
I PAH in genere sono molto resistenti alla degradazione biologica,
studiando il grado di biodegradazione di composti organici tossici si
sono osservati per i PAH dei valori più o meno variabili: fattori importanti nel favorire la biodegradazione appaiono l’alta temperatura,
le basse concentrazioni, l’alta capacità fertilizzante del suolo e un ambiente anionico (US EPA, 1985).
La degradazione microbica degli idrocarburi policiclici aromatici è
stata studiata in ambienti e in condizioni differenti (suolo, acque dolci e salate) ed in presenza di colture miste e pure. L’ossigeno molecolare costituisce un elemento essenziale per la iniziale idrossilazione
dei PAH da parte dei microrganismi. Gli eumiceti filamentosi, a differenza dei batteri, riescono a detossificare ma raramente metabolizzano a fondo queste molecole. Recentemente sta crescendo l’interesse
per la degradazione in condizioni anaerobiche, anche se i dati sono
ancora scarsi. Le vie metaboliche coinvolte nella degradazione microbica dei PAH a basso peso molecolare sono ormai state chiarite, mentre meno si sa riguardo al metabolismo dei composti ad alto peso molecolare.
Gli idrocarburi policiclici aromatici possono essere completamente
degradati (mineralizzati) o venire trasformati solo parzialmente sia
da una comunità microbica (attraverso meccanismi di cometabolismo) sia da una singola specie (Gibson and Subramanian, 1984; Cerniglia, 1984; Cerniglia and Heitkamp, 1989). Dalla letteratura scientifica a disposizione risulta che un certo numero di batteri, eumiceti e
alghe sono in grado di ossidare in coltura pura i PAH qui trattati (Cerniglia, 1992), anche se la maggior parte dei dati riguarda i composti a
più basso peso molecolare.
I PAH sono composti idrofobi e la loro persistenza nell’ambiente è
dovuta soprattutto alla bassa solubilità in acqua. Essi sono associati
principalmente alla fase solida del suolo, in particolare alla componente organica (Means et al., 1980). In generale, la velocità di degradazione è inversamente proporzionale al numero di anelli presenti nella
molecola, per cui le molecole a più basso peso molecolare, come il naftalene, vengono biodegradate più rapidamente di quelle ad alto peso
molecolare (Heitkamp et al., 1987; Cerniglia and Heitkamp, 1989). Ad
188
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
esempio, la emivita del naftalene va da 2,4 a 4,4 settimane, mentre nel
caso del benzo(a)pirene essa è compresa tra 200 e 300 settimane (Cerniglia, 1992). Tuttavia, i valori sono diversi a seconda che vengano calcolati in laboratorio o in campo (Wild et al., 1991a, 1991b), probabilmente perchè in campo i parametri ambientali sono variabili. Le emivite tendono ad essere più brevi in ambienti contaminati da PAH rispetto a ecosistemi incontaminati, in quanto nei primi è già presente
una ampia popolazione di batteri capaci di degradare queste molecole
(Herbes and Schwall, 1978; Shiaris, 1989; Guerin and Jones, 1989).
Il cometabolismo (co-ossidazione) determina un aumento della degradazione dei PAH ad alto peso molecolare, specialmente nel caso di
composti con quattro o più anelli aromatici (Keck et al., 1989; Sims and
Overcash, 1983). Sims et al. (1988) hanno osservato che i PAH ad alto
peso molecolare sono più resistenti alla degradazione nel suolo quando sono presenti come composti puri, mentre vengono attaccati più facilmente se si trovano all’interno di miscele complesse di composti.
I meccanismi biochimici implicati nella degradazione microbica del
naftalene, del fenantrene e dell’antracene sono stati chiariti (Cerniglia, 1984; Cerniglia et al., 1992; Gibson and Subramanian, 1984). Meno si sa sulle vie metaboliche del fluorantrene e del benzo(a)pirene
(Barnsley, 1975; Heitkamp and Cerniglia, 1988, 1989; Kelley and Cerniglia, 1991; Mueller et al., 1990; Weissenfels et al., 1990a, 1991).
Sia per i procarioti che per gli eucarioti, perchè abbia inizio l’attacco
enzimatico sugli anelli aromatici è necessaria la presenza di ossigeno
molecolare (Gibson et al., 1968; Chapman, 1979; Dagley, 1971, 1975;
Gibson and Subramanian, 1984), che viene incorporato nel substrato
per intervento di ossigenasi. La iniziale ossidazione dell’anello rappresenta il passaggio che limita la velocità biodegradativa (Cerniglia
and Heitkamp, 1989). Oltre alle ossigenasi, nel catabolismo dei PAH
possono essere importanti anche altri sistemi enzimatici, quali le metano monossigenasi (Colby and Dalton, 1976; Colby et al., 1977, 1978;
Dalton et al., 1981) e le lignina perossidasi (Bumpus, 1989; Bumpus et
al., 1985; Gold et al., 1989; Haemmerli et al., 1986; Hammel, 1989; Aust, 1990). Crescente è anche l’interesse per la degradazione in anaerobiosi (Mihelcic and Luthy, 1987, 1988; Bertrand et al., 1989; Hutchins
et al., 1991).
Il metabolismo dei PAH in coltura microbica pura e le trasformazioni cometaboliche operate da comunità di microrganismi sono studiati da quasi 80 anni. Le vie degradative utilizzate dai batteri e dagli
eumiceti differiscono tra loro.
189
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
I batteri incorporano nel nucleo aromatico entrambi gli atomi di una
molecola di ossigeno per intervento di diossigenasi, con formazione
di cis-diidrodioli (Gibson et al., 1990). I c i s-diidrodioli vengono poi
deidrogenati stereoselettivamente da deidrogenasi (Patel and Gibson,
1974), che rigenerano il nucleo benzenico con formazione di intermedi diidrossilati (catecoli). Anche la rottura successiva dell’anello aromatico viene catalizzata da diossigenasi altamente regio- e stereoselettive (Gibson and Subramanian, 1984). Come prerequisito per questa reazione, sull’anello aromatico devono essere presenti due gruppi
idrossilici in posizione orto o para l’uno rispetto all’altro (Evans et al.,
1965; Gibson et al., 1968; Barnsley, 1976a, 1976b; Chapman, 1979). Se i
due gruppi OH sono in posizione orto, la rottura dell’anello può avvenire tra di essi ( orto-scissione, catalizzata da diossigenasi intradioliche), oppure in posizione adiacente ad uno dei due (m e t a -s c i s s i o n e ,
catalizzata da diossigenasi extradioliche).
Differentemente dai batteri, gli eumiceti (sia ligninolitici sia non ligninolitici) incorporano un solo atomo di ossigeno molecolare nel
nucleo aromatico. L’eumicete non ligninolitico meglio studiato, Cun ninghamella elegans, utilizza una monossigenasi per incorporare nel
nucleo aromatico un atomo di ossigeno molecolare, mentre l’atomo
rimanente viene ridotto ad acqua (Cerniglia, 1984). L’intermedio risultante può essere ulteriormente metabolizzato da una epossido
idrolasi a formare un t r a n s-diidrodiolo, oppure, mediante un riarrangiamento non enzimatico, può trasformarsi in un fenolo, che può
coniugarsi con solfato, acido glucuronico o glucosio. Gli eumiceti filamentosi idrossilano i PAH come preludio alla detossificazione,
mentre nella maggior parte dei batteri l’ossidazione precede la rottura degli anelli aromatici e l’assimilazione del carbonio (Cerniglia,
1984; Cerniglia et al., 1992; Sutherland, 1992). Per gli eumiceti, come
per i batteri, il metabolismo dei PAH è altamente regio- e stereoselettivo (Cerniglia, 1984; Cerniglia and Gibson, 1980a, 1980b; Cerniglia et
al., 1983, 1990).
I fotoautotrofi eucarioti e procarioti possono costituire una eccezione ai meccanismi ossidativi analizzati fino ad ora, in quanto nel caso
dei cianobatteri e delle alghe verdi sono stati individuati come prodotti di trasformazione diidrodioli in configurazione sia cis- sia trans(Cody et al., 1984; Lindquist and Warshawsky, 1985; Warshawsky et
al., 1988; Narro et al., 1992a, 1992b). Cerniglia et al. (1980a, 1980b)
hanno osservato che il cianobatterio marino Oscillatoria ceppo JCM
ossida il naftalene, in condizioni fotoautotrofe, prevalentemente a 1-
190
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
naftolo. Il naftolo si forma attraverso un intermedio ossidato tra gli
atomi di carbonio in posizione 1 e 2, piuttosto che per idrossilazione
diretta (Narro et al., 1992a). Il metabolismo del naftalene e del fenantrene per i cianobatteri è simile a quello riportato nel caso degli eumiceti. L’alga verde d’acqua dolce Selenastrum capricornutum, in condizioni fotoautotrofe, ossida il benzo(a)pirene con formazione di cis-diidrodioli; questo suggerisce il coinvolgimento di una diossigenasi simile a quella dei procarioti eterotrofi piuttosto che l’utilizzo delle monossigenasi dei cianobatteri e degli eucarioti (Warshawsky et al, 1988,
1990). Ulteriori studi sono necessari per caratterizzare gli enzimi implicati nell’ossidazione dei PAH da parte delle alghe.
I metanotrofi sono in grado di trasformare una serie di xenobiotici, compresi i composti aromatici (Colby and Dalton, 1976; Colby et
al., 1977, 1978; Dalton et al., 1981). Brusseau et al. (1990) hanno riportato che Methylococcus trichosporium OB3b ossida il naftalene con
formazione di 1- e 2-naftolo. I meccanismi esatti implicati nella degradazione dei PAH da parte dei metanotrofi non sono ancora stati
determinati.
Recentemente ha destato molto interesse la capacità dell’eumicete
Phanerochaete chrysosporium di degradare un certo numero di composti
xenobiotici, tra cui alcuni PAH (Bumpus et al., 1985; McFarland et al.,
1989; Lin et al., 1991). Questo basidiomicete produce esoenzimi in grado di degradare la lignina (ligninasi) e che hanno la potenzialità di attaccare composti ad alto peso molecolare e/o insolubili, che non attraversano la parete cellulare batterica (Hammel et al., 1986). Le ligninasi
dipendono da un sistema enzimatico supplementare che fornisce il perossido di idrogeno necessario per l’ossidazione della lignina. La lignina ha una struttura chimica polimerica assai complessa e le subunità fenoliche di cui è costituita sono legate tra loro in modo variabile.
Pertanto le ligninasi hanno un bassa specificità di substrato e possono
degradare molti inquinanti organici diversi. La maggior parte dei meccanismi riportati sono cometabolici; tuttavia, utilizzando colture pure
di Phanerochaete chrysosporium limitate per l’azoto (condizioni ligninolitiche), in 27 giorni di incubazione si è ottenuta una rimozione del 70100%, in qualche caso fino a completa mineralizzazione, di differenti
PAH, tra cui fenantrene, fluorantrene e antracene (Bumpus, 1989). È
stata osservata anche la completa degradazione ad acqua ed anidride
carbonica del benzo(a)pirene (Sanglard et al., 1986).
Hammel et al. (1992) riportano che Phanerochaete chrysosporium ossida il fenantrene in posizione C-9 e C-10, con formazione di acido 2,2-
191
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
difenico come prodotto della rottura dell’anello. Tali risultati indicano che questo eumicete utilizza una via metabolica diversa rispetto a
Cunninghamella elegans e ai batteri, che attaccano il fenantrene in posizione C-3 e C-4. Sutherland et al. (1991) riferiscono che, in condizioni
non ligninolitiche, Phanerochaete chrysosporium trasforma il fenantrene in fenoli e trans-diidrodioli, similmente a Cunninghamella elegans.
Queste osservazioni mostrano che Phanerochaete chrysosporium può ricorrere a vari meccanismi enzimatici per l’attacco ossidativo iniziale
dei PAH (Hammel et al., 1992).
In futuro questo eumicete potrebbe essere impiegato nei trattamenti biologici di suoli contaminati da molecole ad alto peso molecolare,
supportato da batteri in grado di attaccare i metaboliti a basso peso
molecolare da esso prodotti. Brodkorb and Legge (1992) hanno condotto uno studio su un terreno contaminato da petrolio e catrame, osservando che la presenza di Phanerochaete chrysosporium ha determinato un aumento della mineralizzazione del fenantrene da parte della microflora indigena. Morgan et al. (1993) hanno riscontrato, in un
suolo sabbioso e argilloso, un aumento della biodegradazione del
benzo(a)pirene dopo aver inoculato una sospensione di spore di Pha nerochaete chrysosporium ATCC 24725 e di Chrysosporium lignorum
CL1. Perchè l’inoculo e la biodegradazione fossero efficaci è stato necessario aggiungere fonti di carbonio supplementari.
Per quanto riguarda la biodegradazione microbica delle molecole
ad alto peso molecolare, sebbene siano state proposte alcune vie metaboliche (Gibson & Subramanian, 1984), le informazioni sono ancora
scarse. Viene riportata la biotrasformazione eucariotica del fluorantrene (Pothuluri et al., 1990, 1992) e sono stati isolati batteri capaci di
ossidare e co-ossidare questo composto (Kelley and Cerniglia, 1991;
Weissenfels et al., 1991; Foght and Westlake, 1988; Mueller et al., 1989,
1990). Mycobacterium PYR-1 è capace di mineralizzare in coltura pura
il fluorantrene (Kelley and Cerniglia, 1991; Kelley et al., 1991), e può
far aumentare in modo significativo la mineralizzazione del
benzo(a)pirene in sedimenti in cui siano presenti microrganismi indigeni (Kelley and Cerniglia, 1991; Heitkamp and Cerniglia, 1989). Le
vie cataboliche proposte mostrano che la biodegradazione andrebbe
dalla iniziale ossidazione e formazione di prodotti intermedi non ulteriormente metabolizzati alla completa mineralizzazione.
Come già accennato, poco si sa ancora riguardo alla biodegradazione in anaerobiosi. All’interno di sistemi acqua-suolo, è stata riportata
la degradazione di composti a basso peso molecolare, tra cui il nafta-
192
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
lene, in condizioni denitrificanti (Mihelic and Luthy, 1988). La degradazione è risultata più lenta che in aerobiosi. Sono comunque necessarie ulteriori ricerche per chiarire quali siano le vie metaboliche impiegate, quali i microrganismi responsabili e quali i fattori che limitano il processo. Non sono ancora state condotte ricerche sulla degradazione anaerobica dei composti ad alto peso molecolare.
La degradazione microbica dei PAH in ambiente acquatico e terrestre è fortemente influenzata da una ampia serie di fattori abiotici e
biotici, che comprendono la temperatura, il pH, le caratteristiche del
suolo, l’aerazione, i nutrienti, la profondità, la diffusione, gli adattamenti microbici, la biodisponibilità, la precedente esposizione a queste sostanze, la disponibilità di acqua, la presenza di altri tossici, le
proprietà chimico-fisiche, le concentrazioni, fattori stagionali (Manilal
and Alexander, 1991; Atlas, 1991; Wang et al., 1990; Shiaris, 1989; Cerniglia and Heitkamp, 1989; Wild et al., 1991a, 1991b). Vari studi hanno
dimostrato che una precedente esposizione e acclimatazione della microflora ai PAH o ad altri idrocarburi nel suolo o nei sedimenti aumenta la velocità degradativa (Thomas et al., 1989; Bauer and Capone,
1985, 1988; Heitkamp and Cerniglia, 1987; Heitkamp et al., 1987).
L’inerbimento (Aprill and Sims, 1990) è stato studiato a proposito
della detossificazione dei PAH presenti nei suoli a basse concentrazioni; esso conduce al miglioramento delle proprietà fisico-chimiche
del suolo contaminato, all’ aumento della flora microbica e al maggior
contatto tra microrganismi, radici e composti tossici (Sims, 1986; Coover and Sims, 1987). Dato che i PAH sono idrofobi e non volatili (alto
peso molecolare) si legano alle particelle non polari del suolo, così la
sostanza organica lipofila assorbe e immobilizza i PAH (Sims and
Overcash,1983), che sono quindi caratterizzati da un basso potenziale
di lisciviazione (US EPA, 1983; Sims et al., 1987), eccetto naftalene,
acenaftilene e acenaftene.
La degradazione più efficiente è sicuramente quella biologica, ma
decresce al crescere degli anelli (Bulman et al., 1985), anche se alcuni
PAH ad alto peso molecolare sono degradati dai microrganismi tramite coossidazione (usando un composto più degradabile). Il sistema
radicale delle foraggere a radice stolonifera o rizomatosa che arriva
fino a 10 cm ha un effetto positivo sulla biodegradazione. Dall’esperimento su benzo(a)pirene, benzo(a) antracene, dibenzo(a,h)antracene
e crisene è risultato, infatti, che i PAH erano degradati più velocemente nelle parcelle coltivate piuttosto che nei controlli (59 gg contro
151 gg). In 219 gg vi era una degradazione completa per tutte le unità.
193
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
La scomparsa era correlata alla solubilità in acqua dei PAH (Aprill
and Sims, 1990).
In suoli trattati con fanghi si è osservato da parte di alcuni autori
un aumento della concentrazione di PAH, ma in 4 anni dall’interruzione del trattamento si è notata una diminuzione del 60%, e in 20 anni del 90% .
I singoli PAH, infatti, avevano una persistenza diversa a seconda
del peso molecolare, l’emivita andava da meno di 2 anni per il naftalene a quasi 16 anni per il coronene. Questo maggior tempo per la degradazione poteva essere ascritto anche ad un’infuenza dovuta alla
presenza di metalli pesanti nei fanghi che, com’è noto, interferiscono
con i processi microbici (Wild et al., 1991a,b).
Per il naftalene altri autori riportano un’emivita media da poche
ore a giorni in presenza di altri PAH nel suolo, mentre la biodegradazione risulta più lenta in assenza di questi altri composti (emivita
> 80 gg) (Howard 1989). Così come avviene nelle acque inquinate pare che la degradazione aumenti parallelamente alla concentrazione
del naftalene, in ogni caso non è testimoniata la biodegradazione
anaerobica (Howard 1989).
Per composti lipofili come i PAH, se non vengono rimossi, o solo
parzialmente, dalla sedimentazione primaria dei fanghi, la biodegradazione aerobica successiva dipende dalla loro solubilità, che è un fattore veramente limitante. Da sperimentazioni si è inoltre osservato
che, dopo il trattamento a caldo per facilitare la disidratazione dei
fanghi, si ha una forte associazione alle particelle solide (Lester, 1983).
In una ricerca effettuata sull’applicazione di letami misti a fanghi è
risultato un accumulo nel suolo di PAH a basso peso molecolare, subito dopo l’applicazione, che scompariva però in circa un mese. Dopo
3 mesi dal trattamento, invece, il contenuto in PAH aumentava, ad
eclusione dei PAH a basso peso molecolare (Diercxsens, 1987). Sempre in questa sperimentazione, da un confronto tra i vari tipi di spandimento con fertilizzanti minerali, liquami o fanghi, solo questi ultimi aumentavano apprezzabilmente le concentrazioni di PAH del terreno (Diercxsens, 1987).
Riguardo al controllo genetico, nella degradazione del naftalene e
del fenantrene è stato rilevato il coinvolgimento di plasmidi (Williams, 1981; Zylstra and Gibson, 1991; Sanseverino et al., 1993). Menn
et al. (1993) hanno condotto una ricerca che ha dimostrato come in
Pseudomonas fluorescens il sistema enzimatico coinvolto nella degradazione del naftalene intervenga anche nel catabolismo di PAH a pe-
194
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
so molecolare più alto, quali l’antracene e il fenantrene. Poco si sa dei
meccanismi che regolano il metabolismo batterico dei PAH ad alto
peso molecolare.
Trattamento biologico (bioremediation) e degradazione abiotica
I processi di rimozione dal suolo e di decomposizione che determinano il destino degli idrocarburi policiclici aromatici sono la volatilizzazione, la lisciviazione, l’idrolisi, la fotolisi e la biodegradazione.
Per quanto riguarda la volatilità anche se i PAH sono caratterizzati
da un alto coefficiente di ripartizione ottanolo/acqua e da una bassa
costante di Henry, quelli a 2 o 3 anelli possono essere persi per volatilizzazione (Wild et al.1991).
I PAH possono essere lentamente degradati attraverso reazioni fotochimiche (Piccolo, 1991) tuttavia la degradazione microbica viene
considerata la via principale per la decontaminazione dei sedimenti e
degli strati superficiali e sub-superficiali del suolo (Sims et al., 1990),
mentre i meccanismi di rimozione abiotici sembrano essere potenzialmente importanti solo per i PAH a due o a tre anelli (Park et al.,
1990; Wild and Jones, 1993). Uno dei principali problemi associati agli
interventi di trattamento biologico è che risulta difficile stabilire
quanta parte abbia la degradazione microbica nella eliminazione dei
contaminanti organici dall’ambiente e quanto la degradazione non sia
invece dovuta a fattori abiotici (Madsen, 1991).
Per effettuare interventi efficaci di bioremediation, dal momento
che la degradazione di molte sostanze inquinanti, tra cui il naftalene,
è mediata da operoni specifici inducibili, codificati a livello plasmidiale (Sayler et al., 1990), l’espressione di questi geni può essere usata come misura della presenza, della disponibilità e della biodegradazione di un particolare inquinante o di un gruppo di sostanze tossiche. Heizer et al. (1992) hanno messo a punto un sistema che consente di stimare la biodisponibillità del naftalene e del salicilato, un
suo metabolita. Questo metodo utilizza un ceppo bioluminescente,
Pseudomonas fluorescens HK44, che è stato sottoposto ad interventi di
ingegneria genetica. L’andamento della biodegradazione può essere
valutato anche con altre metodiche. Graves et al. (1991) hanno monitorato in continuo, tramite un respirometro elettronico, la respirazione batterica (BOD) durante la crescita su un substrato costituito da
composti organici misti provenienti da suoli e acque contaminati, rilevando una correlazione diretta fra il consumo di ossigeno e la biodegradazione.
195
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Un aspetto importante, preliminare a qualunque tipo di trattamento biologico, consiste nella valutazione dei rischi associati alla contaminazione e nella determinazione del grado di intervento richiesto e
del metodo che deve essere adottato. I metodi di trattamento biologico impiegati in suoli contaminati da composti organici, compresi i
PAH, sono stati descritti da vari ricercatori (Bradford and Krishnamoorthy, 1991; Golueke and Diaz, 1989; Morgan and Watkinson,
1989; Ryan et al., 1991; Soczo and Staps, 1988) e consistono di una sola o di una combinazione delle tre tecniche seguenti (Wilson and Jones, 1993).
(1) Trattamento in situ. Il suolo contaminato non viene rimosso ma
è trattato nel luogo in cui si trova; esso risulta poco alterato dal processo (Hilberts et al., 1985; Wilson and Brown, 1989). Vengono aggiunti nutrienti e una fonte di ossigeno (in genere perossido di idrogeno, anche se è fortemente reattivo e può essere tossico ad alte concentrazioni), e/o, per incrementare la biodegradazione, si ricorre all’inoculo di microrganismi specifici previamente adattati. Esiste anche un terzo tipo di approccio che prevede l’aggiunta di induttori specifici per gli operoni catabolici che regolano l’attività degradativa
(Ogunseitan et al., 1991). Spesso l’acqua che percola nel terreno viene
raccolta e, dopo essere stata trattata in superficie (fanghi attivi, lagune aerate, ecc.), viene riciclata.
Il successo del trattamento in situ dipende fortemente dalla permeabilità del suolo, in quanto è necessario che l’ossigeno possa trasferirsi
facilmente nei vari strati. Catallo e Portier (1992) hanno studiato, all’interno di mesocosmi, la rimozione e detossificazione di rifiuti contenenti PAH (tra cui antracene e fenantrene) provenienti da raffinerie,
utilizzando consorzi microbici sia indigeni sia previamente adattati. I
risultati hanno mostrato che la degradazione ad opera dell’inoculo
commerciale è stata superiore nei primi 14 giorni, mentre nella fase
successiva c’è stato un sostanziale aumento della degradazione da
parte del consorzio indigeno, che ha in qualche caso eguagliato la velocità dell’inoculo già adattato in partenza. Pochi sono, ad ogni modo,
gli studi che hanno dimostrato la sopravvivenza nell’ambiente naturale di colture microbiche di laboratorio, isolate da suoli contaminati,
capaci di degradare i PAH, specialmente quelli ad alto peso molecolare. Sono state condotte anche alcune ricerche sull’uso di microrganismi sottoposti a manipolazione genetica (Grund and Gunsaulus,
1983; Blackburn et al., 1987), ma anche in questo caso ci sono stati pro-
196
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
blemi di sopravvivenza delle colture di laboratorio nell’ambiente naturale. Un altro tipo di metodica consiste nell’isolare direttamente dal
suolo contaminato i microrganismi che verranno usati per il trattamento; i microrganismi che si mostrano più veloci nella biodegradazione vengono mantenuti in coltura di laboratorio e poi reintrodotti
nel suolo, in modo da accelerare la degradazione.
In letteratura sono riportati vari studi condotti in situ su materiali di
rifiuto e in aree contaminate da PAH (Aprill et al., 1990; Weissenfels
et al., 1990b; Morgan and Watkinson, 1990; Ellis et al., 1991). Dai dati
a disposizione si può affermare che questo tipo di trattamento presenta il vantaggio di essere relativamente poco costoso, ma comporta
tempi di bonifica lunghi ed è inefficace per la rimozione dal suolo, in
un intervallo di tempo ragionevole, dei PAH ad alto peso molecolare,
in quanto essi, avendo una bassa solubilità in acqua, sono fortemente
adsorbiti alla fase organica. Inoltre, vi sono limitazioni dovute alla
temperatura ambientale e alle caratteristiche del suolo.
(2) Trattamento locale/Letti opportunamente preparati. Il trattamento nel suolo di materiali contaminati rappresenta una delle prime forme di trattamento locale ed è stato ampiamente utilizzato dall’industria petrolifera per lo smaltimento di liquami oleosi (Morgan
and Watkinson, 1989). Dopo avere versato il materiale di rifiuto sul
suolo sotto forma di impasto liquido, l’area interessata viene fertilizzata, irrigata e addizionata con limo, al fine di mantenere condizioni ottimali di contenuto di nutrienti, di umidità e di pH. La zona
viene anche arata per aumentare l’aerazione e per far sì che la degradazione dei contaminanti avvenga in modo omogeneo nei vari
strati del suolo. Di norma, i microrganismi coinvolti nel processo appartengono alla popolazione indigena. Tuttavia, per aumentare la
velocità degradativa, è possibile inoculare microrganismi già adattati. Lo svantaggio principale di questa metodica consiste nella possibilità che i contaminanti si spostino dall’area in cui avviene il processo.
Più recentemente, sono stati utilizzati letti opportunamente preparati; il materiale di rifiuto viene rimosso dal luogo di origine e viene
distribuito, sotto forma di una miscela con acqua, all’interno di una
area che generalmente è rivestita da materiale poco permeabile (polietilene ad alta densità o argilla) in modo da evitare che i contaminanti si disperdano nell’ambiente. Per ottimizzare la degradazione, la
zona viene fertilizzata, irrigata, il pH è controllato e qualche volta
197
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
vengono inoculati microrganismi specializzati e si aggiungono tensioattivi, così da aumentare la biodisponibilità. Si è visto che i tensioattivi incrementano la solubilizzazione dei PAH (Edwards et. al,
1991; Jafvert, 1991), specialmente a concentrazioni superiori alla concentrazione critica per la formazione di micelle (concentrazione micellare critica). Per la solubilizzazione del fenantrene e dell’antracene,
i risultati migliori sono stati ottenuti utilizzando tensioattivi non ionici etossilati (Liu et al., 1991). Tuttavia, concentrazioni troppo alte
possono inibire l’attività microbica (Laha and Luthy, 1991) o costituire un substrato di crescita preferenziale per i microrganismi. Aronstein et al. (1991) hanno riscontrato, dopo l’aggiunta di tensioattivi
non ionici a basse concentrazioni (10 µg/g di suolo), un aumento della biodegradazione del fenantrene senza osservare un incremento apprezzabile della sua solubilizzazione. Molti dei problemi correlati all’uso dei tensioattivi devono comunque ancora essere risolti (tossicità,
degradabilità, ecc.) e la ricerca per superarli continua (Bryniok et al.,
1990; Werner and Brauch, 1988). Il compostaggio rappresenta un’altra
forma di trattamento locale, ma questa tecnica è stata poco usata per
trattare suoli contaminati da idrocarburi.
Anche nel caso di trattamenti locali sono state condotte varie ricerche (Bossert et al., 1984; Song et al., 1990; Wang and Bartha, 1990;
Sherman et al., 1990; Srivastava et al., 1990; Bewley et al., 1989; Stroh
et al., 1990; Ellis et al., 1991). I risultati di questi studi indicano che,
per uno stesso suolo, la velocità di degradazione dei PAH usando
questo tipo di tecnica risulta superiore a quella ottenibile con il trattamento in situ, in quanto all’interno dei letti le condizioni per la degradazione possono essere più facilmente favorite. Pertanto questo tipo
di tecnica è preferibile al trattamento in situ, particolarmente se la terra contaminata può essere facilmente scavata e rimossa. Occorre comunque tenere presente che la degradazione è significativa soprattutto per i PAH a basso peso molecolare, mentre per quelli ad alto peso molecolare essa avviene in tempi lunghi.
(3) Bioreattori. Il suolo contaminato viene rimosso e distribuito sotto forma di impasto liquido all’interno di reattori operanti in fase semisolida, nei quali è possibile ottimizzare le condizioni per la biodegradazione. Questo consente di avere risultati relativamente rapidi ed
efficaci. Normalmente i reattori sono in batch. Per aumentare la velocità degradativa, si fa uso di una popolazione microbica già acclimatata proveniente da un batch precedente. Il processo degradativo com-
198
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
porta una iniziale dissoluzione degli inquinanti nella fase acquosa, a
seguito della produzione di emulsionanti da parte dei microrganismi.
Successivamente avviene l’attacco microbico attraverso il normale metabolismo aerobico (Castaldi and Ford, 1992). Dopo il trattamento, il
materiale presente nel bioreattore viene fatto passare attraverso un sistema che separa l’acqua dalla terra e l’acqua viene riciclata.
Sebbene i bioreattori non siano ancora stati utilizzati ampiamente
per trattare suoli contaminati da PAH, essi sono stati testati in alcune
ricerche dimostrando, per uno stesso suolo, una maggiore velocità
degradativa dei PAH rispetto a quella ottenibile con trattamenti di tipo locale (DeKreuk and Annokke, 1988; Rittman and Johnson, 1989;
Van den Munckhof and Veul, 1990). Questi studi hanno mostrato che
l’uso di bioreattori consente di ridurre i tempi di degradazione ed è
più efficace rispetto agli altri trattamenti biologici, ma a suo discapito risulta l’elevato incremento del volume da trattare in quanto al terreno viene aggiunta acqua in grande quantità (Nocentini et al., 1995).
Anche per questo tipo di trattamento, i risultati migliori sono stati ottenuti con i composti a basso peso molecolare. Va sottolineato che,
sebbene vi siano alcuni dati che riguardano questa tecnica (Annokkee, 1990; Weissenfels et al., 1990b), i bioreattori sono ancora in
fase di sviluppo e sono necessarie ulteriori ricerche per ottimizzarne
l’efficienza e ridurne i costi di gestione per un eventuale uso su vasta
scala.
Biodegradazione nella depurazione e nei fanghi
In studi sul trattamento biologico di fanghi di origine petrolchimica, contenenti perciò numerosi composti recalcitranti quali il benzo(a)pirene, la cui concentrazione andava da 285 ppm sul secco a 3475
ppm ed in uscita da 3.1 a 21.7 ppm (concentrazioni media 1485 ppm e
12.6 ppm in corrispondenza del limite USEPA per l’utilizzo agricolo),
è stata osservata una rimozione di questo composto in reattori aerobici pari al 90%. In presenza di solidi la degradazione aerobica era molto più efficiente, la biodegradazione era stimolata dall’aggiunta di detergenti anionici che aumentavano la solubilità del B(a)P e diminuivano i VOC (idrocarburi organici volatili), e l’aggiunta di idrocarburi
alifatici aromatici forniva un nuovo substrato per il cometabolismo.
Notevoli livelli di degradazione sono stati osservati anche per benzo(a)antracene e benzo(b)fluorantrene (Marks et al., 1992).
199
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
7.5 Piante
Le piante possono potenzialmente ricevere i PAH da diversi processi:
• asporto dalla soluzione circolante attraverso tessuti radicali;
• adsorbimento sulla superficie radicale come nelle carote e
colture da radice (in genere di scarsa entità, data la forte
associazione alla S.O.);
• asporto fogliare di PAH volatili dalla superficie del suolo
(solitamente trascurabile, date le proprietà fisico-chimiche di
questi composti, Ryan et al.,1988);
• adsorbimento di PAH dall’atmosfera, tramite la superficie fogliare;
biosintesi di alcuni PAH nelle cellule delle piante (Wild and
Jones, 1991).
È stato osservato che i PAH vengono assimilati dalle piante tanto
più facilmente quanto più basso è il loro peso molecolare (Piccolo,
1991).
In ogni caso, l’adsorbimento dei PAH, quando si verifica (è difficile
discriminare infatti tra i PAH apportati e quelli di origine metabolica), raggiunge concentrazioni basse (inferiori a 1µg/100g di s.s.), anche per elevate concentrazioni di PAH nel terreno (Genevini, 1989).
Resta comunque difficile stabilire l’influenza dell’applicazione di fanghi sull’aumento di agenti mutageni naturali come sono appunto i
PAH che vengono sintetizzati dalla pianta stessa (US EPA, 1985).
Tra le diverse colture studiate è emerso che i tuberi di patata e le radici di carote accumulano più dei cereali da granella, benchè le sostanze rimangano sugli strati esterni e vengano asportate prima del
consumo alimentare (Genevini, 1989).
Molecole di questo tipo, ad esempio, sono state ritrovate nei rifiuti
urbani e nelle radici, ma non nelle micorrize di carote cresciute su terreni ammendati con fanghi compostati (Genevini et al., 1986). In ogni
caso, in una sperimentazione sulle carote si è potuto osservare che il
livello di benzopirene diminuiva con il succedersi delle applicazioni
di fango.
L’immissione di PAH nella catena alimentare deriva comunque più
dai vegetali da foglia che da quelli da radice (Genevini et al., 1986,
Hansen and Chaney, 1984). La maggior contaminazione è per deposizione aerea (irreversibile) sulla cuticola vegetale, soprattutto per ortaggi a foglia larga e foraggere, perciò, ai fini del consumo, sembre-
200
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
rebbe opportuno limitare l’impiego dei fanghi alla fertilizzazione dei
cereali da granella in pieno campo (Genevini, 1989).
In suoli trattati con fanghi, da altri autori, sono stati rilevati aumenti trascurabili in bietole da zucchero, patate, carote, ecc., pari a a circa
1 ppm s.f. (Jones et al., 1989d; Harms and Sauerbeck, 1983). Grano, paglia, trifoglio, lattuga non mostravano alcuna traslocazione rispetto ai
controlli, dal che si deduce che la contaminazione aerea è la principale causa di inquinamento in PAH e non i fanghi (Kampe, 1989).
Anche l’irrigazione di vegetali in parcelle con acque di scarico contaminate non ha mostrato alcun accumulo in PAH, nemmeno in benzopirene (US EPA, 1985).
In contraddizione con le affermazioni precedenti, invece, è stato osservato un accumulo nelle radici di carota cresciute in suoli trattati,
ma il livello di benzopirene diminuiva con la successiva coltivazione
del suolo ammendato.
In vegetali coltivati per la commercializzazione non è stato rilevato
un contenuto in PAH. Solo nelle foglie è stato osservato un incremento molto ridotto in seguito a un trattamento di 500 t/ha (Witte, 1989).
I risultati sperimentali mostrano quindi quanto sia più importante
la contaminazione per via aerea di quella attraverso le radici (tabella
7.13 e 7.14, Witte, 1989).
Dosi di fango (t s.s./ha)
Fluorantrene
Benzo(k)fluorantrene
Benzo(b)fluorantrene
Benzo(a)pirene
Indenopirene
Benzo(ghi)perilene
0
0.77
0.05
0.05
0.05
0.06
0.05
5
0.39
0.05
0.08
0.04
0.05
0.05
50
0.32
0.06
0.07
0.2
0.08
0.87
500
1.03
0.05
0.08
0.03
0.05
0.04
Tabella 7.13 - Sperimentazione in vaso: contenuto medio di PAH
nel cibo dopo diverse dosi di fango, concentrazioni espresse
in g/kg s.s. ( da Witte, 1989).
201
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Dosi di fango (t s.s./ha)
Fluorantrene
Benzo(k)fluorantrene
Benzo(b)fluorantrene
Benzo(a)pirene
Indenopirene
Benzo(ghi)perilene
0
17.51
1.21
2.44
0.76
1.13
1.11
5
16.84
1.2
2.21
0.91
1.31
1.19
50
14.37
1.03
2.09
0.77
1.29
0.99
500
18.57
1.29
2.90
1.23
1.74
1.71
Tabella 7.14 - Sperimentazione in vaso: contenuto medio di PAH
nelle foglie dopo diverse dosi di fango ( g/kg s.s.) (da Witte, 1989).
Non c’è comunque correlazione tra suolo e pianta alle concentrazioni che si rilevano nel suolo, esistono quindi altre fonti (figura 2,
Witte, 1989).
Il contenuto di PAH nelle carote può variare da 50 a 200 ppb (s.s.),
soprattutto PAH a basso peso molecolare e si rilevano concentrazioni
decrescenti andando dall’esoderma all’interno della radice.
In Inghilterra la media di PAH consumati con le carote è stimata essere circa di 110 ppb, che si riduce del 60 % dopo la cottura (Wild and
Jones, 1991). Di solito ci si limita alla verifica della presenza del benzo(a)pirene, ma nelle carote è un errore perchè è più facile che ci siano
composti a basso peso molecolare (Wild and Jones, 1991). Sono stati
rilevati valori di 185 ppb (s.s.) nell’esoderma, 54.98 ppb nel cuore della carota, e circa 980 ng di media, come somma di PAH. I PAH più abbondanti risultano essere naftalene, acenaftilene, fluorene, fenantrene e pirene.
È difficile stabilire il meccanismo con cui alcuni PAH entrano nei
tessuti radicali della superficie, se ci fosse un trasporto preferenziale,
infatti, ci sarebbero delle differenze, che però non sono state rilevate
nelle sezioni esaminate, per cui si ipotizzano tre spiegazioni:
I) i PAH sono assorbiti dalle radici laterali e trasportati nella radice
principale;
II) i PAH incorporati nei tessuti fogliari dall’atmosfera vanno dalle
foglie alle radici;
III) i PAH possono essere sintetizzati nelle radici (Wild and Jones,
1991).
202
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
Figura 2 - Relazione tra contenuto in fluorantrene nel suolo
e nella pianta, calcolato sulla base rispettivamente di 115 e 79 analisi
(concentrazioni in ppb s.s.).
203
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Concentrazioni di benzo(a)pirene nelle piante vengono riportate
nella tabella 7.15 (US EPA, 1986).
Pianta/tessuti
carota (radice)
Tipo di
suolo
Concentra- Concentra- Curva di assorbimento*
zioni
zioni
( g/g)
( g/g)
sabbioso
nr
nr
0.75-1.8 (0.09-0.22)
carota (radice)
compost
carota (fogliame)
sabbioso
carota (fogliame)
compost
ravanello (radice)
nr
ravanello (fogliame)
nr
spinaci (foglie)
nr
nr
nr
nr
nr
nr
nr
nr
nr
nr
nr
nr
nr
0.08 (0.01)
0.08 (0.01)
0.08 (0.01)
0.08-0.016 (0.01-0.02)
0.08 (0.01)
0.16-0.42 (0.02-0.05)
Autori
Connor,
1984
ibid.
ibid.
ibid.
ibid.
ibid.
ibid.
Nota: * I valori corrispondono al rapporto tra concentrazione nella pianta e nel suolo (peso fresco:
peso fresco), nel riferimento originale i dati sono tra parentesi, i valori sono stati convertiti
in peso secco dividendo per 0.12 (Connor , 1984).
Tabella 7.15 - Assorbimento di Benzo(a)pirene da parte delle piante
(da US EPA, 1986).
Da studi molto recenti su carote allevate in suoli trattati con fanghi
contenenti 17.2 ppm di PAH (concentrazione tipica di aeree agricole) e
apportati in dosi di 15, 55 e 180 t/ha, è emerso che: le foglie di carote
non erano assolutamente contaminate, pur assorbendo PAH dall’atmosfera, ma la concentrazione dei PAH nell’epidermide radicale (radichette, ecc.) aumentava in corrispondenza all’aumento delle concentrazioni dei PAH nel suolo, soprattutto PAH a basso peso molecolare.
Nel cuore delle carote non sono stati rilevati PAH, il che implica che
non c’è trasferimento, il 70% dei PAH erano nella parte esterna. Le
concentrazioni di PAH nelle carote (p.f.) erano tutte al di sotto dei 4.2
ppb, i rischi di una contaminazione della dieta quindi sono minimi (fi gura 3, Wild and Jones, 1992).
Infine in studi sul contenuto in PAH di cariossidi ed erba da pascolo è stato osservato un aumento di PAH di 4 o 5 volte nello strato superficiale del terreno (0-23 cm), dovuto a depositi atmosferici; i campioni vegetali presentavano un range di PAH da 110 a 6900 ppm s.s.,
dove fuorantrene, pirene, benzofluorantrene (b + J + K), crisene e trifenilene erano i più abbondanti, ma anche Benz(a)antracene, benzoghiperilene, benzo(a)pereilene e indeno (1,2,3-cd) pirene erano presenti in dosi elevate (Jones et al., 1989d).
204
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
Figura 3 - Concentrazioni di PAH nelle carote (ppb) (Wild and Jones, 1992).
7.6 Animali
A conferma di quanto detto a proposito dei vegetali da radice, generazioni di topi alimentati con carote cresciute su terreno trattato
non hanno mostrato alcun accumulo in PAH (Hansen and Chaney,
1984; Genevini et al., 1986).
D’altro canto in suoli trattati con fanghi contenenti derivati del petrolio e prodotti per preservare il legno, si è potuto osservare un effetto mutageno (saggiato con Salmonella) che scompariva prima dell’applicazione al suolo del fango nel primo caso e un aumento notevole
diretto e indiretto della mutagenesi nel secondo caso, rilevabile anche dopo 350 gg (Barbee et al., 1992).
In merito ai nitro-PAH e specialmente per i nitropireni, si è osservato che sono dei forti mutageni nel test con Salmonella typhirum e in cellule di mammiferi; sono da ritenersi quindi cancerogeni negli animali. In ogni caso la flora intestinale, soprattutto quella anaerobica, è in
grado di metabolizzare i nitro-PAH e ridurli ad ammine aromatiche
attraverso attività nitroriduttasica (Rafii, 1991). Alcuni di questi batteri sono stati isolati, come Clostridium leptum, Clostridium paraputrifi cum, Clostridium clostridiiforme, altri Clostridium sp., e Eubacterium sp
ed è stata riscontrata una diminuzione dell’attività mutagenica di
205
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
questi composti, in particolare di 1 nitropirene, 1,3 dinitropirene e 1,6
dinitropirene (Rafii,1991).
Conclusioni
Le concentrazioni di background nel suolo sono dovute ai PAH presenti nei depositi atmosferici e sono molto variabili (da 1 a diverse migliaia di ppb), valori maggiori si rilevano in corrispondenza ad un intensa urbanizzazione dell’area, alla vicinanza di fonti di emissioni, ad
un elevato contenuto in S.O. del suolo, o, talvolta, in suoli ammendati con fanghi.
La media dei PAH presenti nei fanghi si attesta sui 10 ppm, una
quantità quindi non trascurabile nell’ipotesi di un accumulo nei suoli agricoli trattati, data la scarsa degradabilità di questi composti (soprattutto per i PAH ad alto peso molecolare).
Lo scarso leaching (tranne per il naftalene) e la lipofilia che li caratterizza permettono loro di associarsi fortemente alla S.O. del terreno,
comportando così la possibilità di contaminazione a livello animale
per ingestione del suolo; basso invece è il rischio di ingestione fogliare, sempre ad eccezione del naftalene. Infatti, per i PAH è elevata la ritenzione a livello di superficie radicale, ma bassi risultano l’assorbimento e la traslocazione tranne per i PAH a basso peso molecolare,
come appunto il naftalene.
A livello di contaminazione alimentare risulta perciò più pericolosa quella aerea, in particolare quella di ortaggi a foglia larga e foraggere, rispetto alle colture da radice, a causa della volatilità dei PAH a
2 o 3 anelli di carbonio (anche se sono facilmente degradabili). È opportuno perciò limitare l’applicazione dei fanghi ad alcune colture,
come ad esempio i cereali da granella. I PAH rilevati in tuberi, quali
patate e carote, rimangono di solito negli strati esterni, ad eccezione
di qualche PAH a basso peso molecolare che, in ogni caso, è presente
in quantità trascurabile (pochi ppb).
I fanghi, in conclusione, non sono l’unica fonte di immissione di
questi composti nel terreno e neppure la più degna di nota.
206
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
Bibliografia
AICHBERGER K., REIFENAUER D .,
(1983): Determination of PAH in sewage
sludg. In: Processing and use of sewage
sludge, proceeding of the third Inter.
Symp., Brighton, Sept 27-30.
ANNOKKEE G.J., (1990): MT-TNO re search into the biodegradation of soils and
sediments contaminated with oils and
polyaromatic hydrocarbons (PAHs). In:
Contaminated Soil 1990 (K. Wolf, J. Van
den Brink, F.J. Colon, ed.), p. 941.
APRILL W., SIMS R.C., (1990): Evalua tion of the use of prairie grasses for stimu lating PAH treatment in soil. Chemosfere,
20, n.1-2, 253-265.
APRILL W., SIMS R.C., SIMS J . L . ,
MATTHEWS J.E., (1990): Assessing de toxification and degradation of wood pre serving and petroleum wastes in contami nated soil. Waste Manag. Res. , 8, 45.
ARONSTEIN B., CALVILLO Y . M . ,
ALEXANDER M., (1991): Effect of sur factants at low concentrations on the de -
sorption and biodegradation of sorbed aro matic compounds in soil. Environ. Sci. Te chnol., 25, 1728.
ATLAS R.M., (1991): Microbial hydrocar bon degradation - Bioremediation of oil spil ls. J. Chem. Technol. Biotechnol., 52, 149.
AUST S.D., (1990): Degradation of envi ronmental pollutants by Phanerochaete
chrysosporium. Microb. Ecol., 20, 197.
BARBEE G.C., BROWN K.W., D O NNELLY K.C., (1992): Fate of mutagenic
chemicals in soil amended with petroleum
and wood preserving sludges. Waste Ma nagement and Research, 10, 73-85.
BARNSLEY E.A., (1975): Bacterial de gradation of fluoranthene and benzo(a)py rene. Can. J. Microbiol , 21, 1004.
BARNSLEY E.A., (1976a): Role and re gulation of the ortho and meta pathways of
catechol metabolism in Pseudomonas me tabolizing naphthalene and salicylate. J.
Bacteriol., 125, 404.
207
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
BARNSLEY E.A., (1976b): Naphthalene
metabolism by Pseudomonas: the oxida tion of 1,2-dihydroxynaphthalene to 2-hy droxychromene-2-carboxylic acid and the
formation of 2-hydroxybenzalpyruvate.
Biochem. Biophys. Res. Comm., 72, 1116.
BAUER J.E., CAPONE D.G., (1985): De gradation and mineralization of the polycy clic aromatic hydrocarbons anthracene and
naphthalene in intertidal marine sedi ments. Appl. Environ. Microbiol., 50, 81.
BAUER J.E., CAPONED.G., (1988): Ef fects of co-occurring aromatic hydrocar bons on degradation of individual polycy clic aromatic hydrocarbons in marine sedi ment slurries. Appl. Environ. Microbiol.,
54, 1649.
BERTRAND J.C., CAUMETTE P., MILLE G., GILEWICZ M., DENIS M.,
(1989): Anaerobic biodegradation of hydro carbons. Sci. Progr. (Oxford), 73, 333.
BEWLEY R., ELLIS B., THEILE P., VINEY I., REES J., (1989): Microbial clean up
of contaminated soil. Chem Ind., 23, 778.
BLACKBURN J.W., JAIN R.K., SAYL E R G.S., (1987): Molecular microbial
ecology of a naphthalene-degrading ge notype in activated sludge. Environ. Sci.
Technol., 21, 884.
BOSSERT I., KACHEL W.M., BARTHA
R., ( 1 9 8 4 ): Fate of hydrocarbons during
oily sludge disposal in soil. Appl. Environ.
Microbiol., 47, 763.
BRADFORD
M.L.,
KRISHNAMOORTHY R., (1 9 9 1 ): Consider biore mediation for waste site clean up. Chem.
Engin. Progr., 87, 80.
208
BRODKORB T.S., LEGGE R.L., (1992):
Enhanced biodegradation of phenanthrene
in oil tar-contaminated soils supplemented
with Phanerochaete chrysosporium.
Appl. Environ. Microbiol., 58, 3117.
BRUSSEAU G.A., H S I E N - C H Y A N G
T., HANSON R.S., WACKETT L . P . ,
(1990): Optimization of trichloroethylene
oxidation by methanotrophs and the use of
a colorimetric assay to detect soluble
methane monooxygenase activity. Biode gradation, 1, 19.
BRYNIOK D., EICHLER B., KOHLER
A., CLEMENS W., M A C K E N B R O C K
K., FREIER-SCHRODER D., KNACKMUSS H.J., (1990): Development of a bio logical process for the decontamination of
coking-plant sites: microbial degradation of
polycyclic aromatic hydrocarbons. In: Con taminated Soil 1990 (K. Wolf, J. Van den
Brink, F.J. Colon, ed.), p. 1037. Kluwer
Academic Publishers.
BULMAN T.L., LESAGE S., F O W L E S
P.J.A., WEBBER M.D., (1985): The persi stence of PAH in soil. PACE Report N.
85-2, Petroleum Assoc. for Conservation of the Canadian Environment, Ottawa.
BUMPUS J.A., (1989): Biodegradation of
polycyclic aromatic hydrocarbons by Phanerochaete chrysosporium. Appl. Envi ron. Microbiol. , 55, 154.
BUMPUS J.A., TIEN M., WRIGHT D.,
AUST S.D., (1985): Oxidation of persi stent environmental pollutants by a white
rot fungus. Science , 228, 1434.
CASTALDI F.J., FORD D.L., (1992):
Slurry bioremediation of petrochemical
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
wastes sludges. Wat. Sci. Tech. , 25,
207.
7,8-epoxides. Proc. Natl. Acad. Sci. USA,
77, 4554.
CATALLO W.J., PORTIER R.J., (1992):
Use of indigenous and adapted microbial
assemblages in the removal of organic che micals from soils and sediments. Wat. Sci.
Tech., 25, 229.
CERNIGLIA C.E., GIBSON D.T., VAN
BAALEN C., (1980b): Algal oxidation of
naphthalene. J. Gen. Microbiol., 116, 495.
CERNIGLIA C.E., (1984): Microbial me tabolism of polycyclic aromatic hydrocar bons. In: Advances in Applied Microbio logy (A. Laskin, ed.), 30, p. 31. Academic Press, New York.
CERNIGLIA C.E., (1992): B i o d e g r a d a tion of polycyclic aromatic hydrocarbons.
Biodegradation, 3, 351.
CERNIGLIA C.E., ALTHAUS J . R . ,
EVANS F.E., FREEMAN J.P., M I TCHUM R.K., YANG S.K., (1983): Stereo chemistry and evidence for an arene-oxideNIH shift pathway in the fungal metaboli sm of naphthalene. Chem. Biol. Interact.,
44, 119.
CERNIGLIA C.E., CAMPBELL W.L.,
FU P.P., FREEMAN J.P., EVANS F.E.,
(1990): Stereoselective fungal metabolism
of methylated anthracenes. Appl. Environ.
Microbiol., 56, 661.
CERNIGLIA C.E., GIBSON D . T . ,
(1980a): Fungal oxidation of ben zo(a)pyrene and (±)-trans-7,8-dihydro benzo(a)pyrene: evidence for the formation
of a benzo(a)pyrene 7,8-diol-9,10-epoxide.
J. Biol. Chem. , 255, 5163.
CERNIGLIA C.E., GIBSON D . T . ,
(1980b): Fungal oxidation of (±)-9,10dihydroxybenzo(a)pyrene: formation of
diastereomeric benzo(a)pyrene 9,10-diol
CERNIGLIA C.E., HEITKAMP M . A . ,
(1989): Microbial degradation of polycyclic
aromatic hydrocarbons in the aquatic envi ronment. In: Metabolism of Polycyclic
Aromatic Hydrocarbons in the Aquatic
E n v i r o n m e n t (U. Varanasi, ed.), p. 41.
CRC Press, Boca Raton, FL.
CERNIGLIA C.E., SUTHERLAND J.B.,
CROW S.A., (1992): Fungal metabolism
of aromatic hydrocarbons. In: Microbial
Degradation of Natural Products ( G .
Winkelmann, ed.), p. 193. VCH Press,
Weinheim.
CERNIGLIA C.E., VAN BAALEN C.,
GIBSON D.T., (1980a): Metabolism of
naphthalene by the blue-green alga, Oscil latoria sp., strain JMC. J. Gen. Microbiol.,
116, 485.
CHAPMAN P.J., (1979): D e g r a d a t i o n
mechanisms. In: Proceedings of the Work shop: Microbial Degradation of Pollutants
in Marine Environments (A.W. Bourquin, P.H. Pritchard, ed.)., p. 28. U.S.
Environmental Protection Agency,
Gulf Breeze, FL.
CODY T.E., RADIKE M.J., WARSHAWSKY D., (1984): The phytotoxicity
of benzo(a)pyrene in the green alga, Selenastrum capricornutum. Environ. Res.,
35, 122.
COLBY J., DALTON H., (1976): S o m e
properties of a soluble methane monooxy -
209
genase from Methylococcus capsulatus
strain (Bath). Biochem. J. , 157, 495.
monooxygenase system from Methylococcus capsulatus. J. Chem. Soc. Chem.
Comm., 1981, 482.
COLBY J., STIRLING D.I., DALTON
H., (1977): The soluble methane monooxy genase of Methylococcus capsulatus
(Bath): its ability to oxygenate n-alkanes,
n-alkenes, ethers and alicyclic, aromatic
and heterocyclic compounds. Biochem. J.,
165, 395.
DEKREUK J.F., ANNOKKEE G . J . ,
(1988): Applied biotechnology for deconta mination of polluted soils: possibilities and
problems. In: Contaminated Soil 1988 (K.
Wolf, J Van den Brink, F.J. Colon, ed.),
p. 679. Kluwer Academic Publishers.
COLBY J., STIRLING D.I., DALTON
H., (1978): Resolution of the methane mo nooxygenase of Methylococcus capsulatus (Bath) into three components. Purifica tion and properties of component C, a fla voprotein. Biochem J. , 171, 461.
DIERCXSENS P., TARRADELLAS J . ,
(1987): Soil contamination by some orga nic micropollutants related to sewage
sludge spreading. International J. of Envi ronmental Analytical Chemistry, 28, 143159.
COOVER M.P., SIMS R.C., (1987): The
rate of benzo(a)pyrene degradation in a
manure amended sandy loam soil. Haz.
Waste Haz. Materials, 4, 151-158.
EDWARDS D.A., LUTHY R.G., LIU Z.,
(1991): Solubilization of polycyclic aroma tic hydrocarbons in micellar non-ionic sur factant solutions. Environ. Sci. Technol.,
25, 127.
CRATHORNE B., DONALDSON K.,
JAMES H.A., ROGERS H . R ., ( 1 9 8 9 ) :
The determination of organic contami nants in UK sewage sludges. In: Organic
contaminants in wastewater, sludge and
sediment. Ed. by D.Quaghebeur, I. Temmerman and G. Angeletti. Elsevier Applied Science.
DAGLEY S., (1971): Catabolism of aro matic compounds by microorganisms.
Adv. Microb. Physiol. , 6, 1.
ELLIS B., HAROLD P., KRONBERG H.,
(1991): Bioremediation of a creosote conta minated site. Environ. Technol., 12, 447.
EVANS W.C., FERNLEY H.N., GRIFFITHS E., (1965): Oxidative metabolism
of phenantrene and anthracene by soil
Pseudomonas; the ring fission mechani sm. Biochem. J., 95, 819.
DAGLEY S., (1975): A biochemical ap proach to some problems of environmental
pollution. Essays Biochem., 11, 81.
FOGHT J.M., WESTLAKE D.W.S . ,
(1988): Degradation of polyciclic aromatic
hydrocarbons and aromatic heterocycles by
a Pseudomonas species. J.Can. Microbiol., 34, n.10, Oct., 1135-1141.
DALTON H., GOLDING B.T., WATERS B.W., HIGGINS R., TAYLOR
J.A., (1981): Oxidations of cyclopropane,
methylcyclopropane, and arenes with the
GENEVINI P., ZACCHEO P., MANSTRETTA M., (1989): Presenza di inqui nanti organici ed inorganici nel compost.
Da Simposio Internazionale Produzio-
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
ne ed impiego del compost. S. Michele
all'Adige 20-23 giu.1989.
GENEVINI P.L., VISMARA L., MEZZANOTTE V., (1986): Utilizzo agricolo
dei fanghi di depurazione. Ingegneria Am bientale, n.5, 134.
GIBSON D.T., KOCH J.R., KALLIO
R.E., (1968): Oxidative degradation of aro matic hydrocarbons by microorganisms.
Enzymatic formation of catechol from ben zene. Biochemistry, 7, 2653.
GIBSON D.T., SURAMANIAN V . ,
(1984): Microbial degradation of aromatic
hydrocarbons. In: Microbial Degradation
of Organic Compounds (D.T. Gibson,
ed.), p.181. Marcel Dekker, New York.
GIBSON D.T., ZYLSTRA G.J.,
C H A U H A N S., (1990): B i o t r a n s f o r m a tion catalyzed by toluene dioxygenase from
Pseudomonas putida F 1. In: Pseudomonas: Biotransformations, Pathogenesis,
and Evolving Biotechnology ( S . S i l v e r ,
A.M. Chakrabarty, B. Iglewski, S. Kaplan, ed.), p. 121. American Society for
Microbiology, Washington, DC.
GOLD M.H., WARIISHI H., VALLI K.,
(1989): Extracellular peroxidases involved
in lignin degradation by the white rot basi diomycete Phanerochaete chrysosporium. In: Biocatalysis in Agricultural Bio technology (J.R. Whitaker, P.E. Sonnet,
ed.), p. 127. American Chemical Society, Washington, DC.
GOLUEKE C.G., DIAZL.F., (1989): Bio logical treatment for hazardous wastes.
Biocycle, 30, 58.
GRAVES D.A., CRAIG A.L., MAU-
REEN E.L., (1991): Respirometric analy sis of the biodegradation of organic conta minants in soil and water. Appl. Biochem.
Biotechnol., 28, 813.
GRUND A.D., GUNSAULUS I . C . ,
(1983): Cloning of genes for naphthalene
metabolism in Pseudomonas putida. J.
Bacteriol., 156, 89.
GUERIN W.F., JONES G.E., (1989):
Estuarine ecology of phenanthrene-degra ding bacteria. Estuarine Coastal Shelf Sci.,
29, 115.
HAEMMERLI S.D., LEISOLA M.S.A.,
SANGLARD D., FIECHTERA., (1986):
Oxidation of benzo(a)pyrene by extracellu lar ligninases of Phanerochaete chrysosporium: veratryl alcohol and stability of
ligninase. J. Biol. Chem., 261, 6900.
HAMMEL K.E., (1989): Organopollutant
degradation by ligninolytic fungi. Enzyme
Microb. Technol. , 11, 776.
HAMMEL K.E., KALYANARAMAN
B., KENT-KIRK T., (1986): Oxidation of
polycyclic aromatic hydrocarbons and di benzo(p)dioxins by Phanerochaete chrysosporium ligninase. J. Biol. Chem., 261,
16948.
HAMMEL K.E., GAI Z.G., GREEN B.,
MOEN M.A., (1992): Oxidative degrada tion of phenanthrene by the ligninolytic
fungus Phanerochaete chrysosporium.
Appl. Environ. Microbiol., 58, 1831.
HANSEN R., CHANEY L., (1984): En vironmental and food chain effects of the
agricultural use sewage sludges. Re views in Environmental Toxicology 1 ,
103-171.
211
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
HARMS H., SAUERBECK D.R., (1983):
Toxic compounds in town waste materials:
their origin, concentration and turnover in
waste composts, soils and plants. In: R.D.
Davis, G. Hucker and P.L. L'hermite
(Eds), Environmental Effects of organic
and inorganic contaminants in sewage
sludge. D. Reidel, Dordrecht, 38-51.
HEITKAMP M.A., CERNIGLIA C . E . ,
(1987): Effects of chemical structure and
exposure on the microbial degradation of
polycyclic aromatic hydrocarbons in fre shwater and estuarine ecosystems. Envi ron. Toxicol. Chem. , 6, 535.
HEITKAMP M.A., CERNIGLIA C . E . ,
(1988): Mineralization of polycyclic aro matic hydrocarbons by a bacterium isolated
from sediment below an oil field. Appl. En viron. Microbiol. , 54, 1612.
HEITKAMP M.A., CERNIGLIA C . E . ,
(1989): Polycyclic aromatic hydrocarbon
degradation by a Mycobacterium sp. in
microcosms containing sediment and wa ter from a pristine ecosystem. Appl. Envi ron. Microbiol., 55, 1968.
HEITKAMP M.A., FRANKLIN W. ,
CERNIGLIA C.E., (1988): Microbial me tabolism of PAH: isolation and characteri zation of a pyrene-degrading bacterium.
Appl. Environ. Microbiol. 54, 2549-2555.
HEITKAMP M.A., FREEMAN J.P.,
CERNIGLIA C.E., (1987): Naphthalene
biodegradation in environmental microco sms: estimates of degradation rates and
characterisation of metabolites. Appl. En viron. Microbiol. , 53, 129.
HEITZER A., WEBB O.F., THONNARD J.E., SAYLER G.S., (1992): Speci -
212
fic and quantitative assessment of naphtha lene and salicylate bioavailability by using
a bioluminescent catabolic reporter bacte rium. Appl. Environ. Microbiol., 58, 1839.
HERBES S.E., SCHWALL L.R., (1978):
Microbial transformation of polycyclic aro matic hydrocarbons in pristine and petro leum contaminated sediments. Appl. Envi ron. Microbiol., 35, 306.
HILBERTS B., EIKELBOOMD.H.,
VERHEUL J.H.A.M., HEINIS F . S . ,
(1985): In situ techniques. In: Contamina ted Soil 1985 (K. Wolf, J. Van den Brink,
F.J. Colon, ed.), p. 679. Kluwer Academic Publishers.
HOWARD P.H., (1989): Handbook of
Environmental Fate and Exposure Data
for organic chemicals, Vol.I, Large produc tion and Priority Pollutants. Lewis Pub.,
Michigan, USA.
HUTCHINS S.R., SEWELL G.W., KOVACS D.A., SMITHG.A., (1991): Biode gradation of aromatic hydrocarbons by
aquifer microorganisms under denitrifying
conditions. Environ. Sci. Technol., 25, 68.
JAFVERT C.T., (1991): Sediment- and sa turated-soil-associated reactions involving
an anionic surfactant (dodecylsulfate).
Partition of PAH compounds among pha ses. Environ. Sci. Technol., 25, 1039.
JONES K.C, STRATFORD J.A., WATERHOUSE K.S., VOGT N.B., (1989b):
Organic contaminants in Welsh soils:
PAH. Environ. Sci. Technol. , 23, 540-550.
JONES K.C, STRATFORD J.A., WATERHOUSE K.S., FURLONG E.T., GIGER W., HITES R.A., SCHAFFNER C.,
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
JOHNSTON A.E., (1989a): Increases in
the PAH content of an agricultural soil
over the last century. Environ. Sci. Tech nol., 23, 95-101.
JONES K.C., (1989): PCB in Welsh soils:
a survey of typical levels. Chemosphere, 18,
n.7/8, 1665-1672.
JONES K.C., GRIMMER G., JACOB J.,
JOHNSTON A.E., (1989d): Changes in
the PAH content of wheat grain and pastu re grassland over the last century from one
site in the UK. Sci. Total Environ., 78,
117-130.
KAMPE W., (1989): Organic substances
in soils and plants after intensive applica tions of sewage sludge. In: Organic conta minants in wastewater, sludge and sedi m e n t. Ed. by D.Quaghebeur, I. Temmerman and G. Angeletti. Elsevier Applied Science.
KECK J., SIMS R.C., COOVER M.P.,
PARK K.S., SYMONSB., (1989): Eviden ce for cooxidation of polynuclear aromatic
hydrocarbons in soil. Wat. Res., 23, 1467.
LESTER S.N., (1983): Presence of organic
micropollutants in sewage sludges. In:
Processing and use of sewage sludge. Proceeding of the third Inter. Symp., Brighton, Sept 27-30.
LIN J.E., WANG H.Y., HICKEY R . F . ,
( 1 9 9 1 ) : Use of co-immobilised biological
systems to degrade toxic organic com pounds. Biotechnol. Bioengineer., 38, 273.
LINDQUIST B., WARSHAWSKY D . ,
(1985): Identification of the 11,12-dihy droxybenzo(a)pyrene as a major metabolite
produced by the green alga, Selenastrum
capricornutum. Biochem. Biophys. Res.
Commun., 130, 71.
LIU Z., LAHA S., LUTHY R.G., (1991):
Surfactant solubilisation of polycyclic aro matic hydrocarbon compounds in soil-wa ter suspensions. Wat. Sci. Technol., 23,
475.
MADSEN E.L., (1991): Determining in
situ biodegradation. Environ. Sci. Tech nol., 25, 1663.
KELLEY I., CERNIGLIA C.E., (1991):
The metabolism of fluoranthene by a species
of Mycobacterium. J. Ind. Microbiol., 7, 19.
MANILAL V.B., ALEXANDER M . ,
(1991): Factors affecting the microbial de gradation of phenanthrene in soil. Appl.
Microbiol. Biotechnol., 35, 401.
KELLEY I., FREEMAN J.P., EVANS
F.E., CERNIGLIA C.E., (1991): Identifi cation of a carboxylic acid metabolite from
the catabolism of fluoranthene by a Mycobacterium sp. Appl. Environ. Microbiol.,
57, 636.
MARKS R.E., FIELD S.D., W O I T ANOWICZ A.K., BRITEMBECK G . A . ,
(1992): Biological treatment of petrochemi cal wastes for removal of hazardous PAH
constituents. Wat. Sci. Tech. , 25, n.3, 213220.
LAHA S., LUTHY R.G., (1991): Inhibi tion of phenanthrene mineralization by no nionic surfactants in soil-water systems.
Environ. Sci. Technol. , 25, 1920.
MCFARLAND M.J., QIU X.J., APRILL
W.A., SIMS C., (1989): Biological compo sting of petroleum waste organics using
the white root fungus P h a n e r o c h a e t e
213
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
chrysosporium. Technology Symposium on Gas, Oil, Coal, and Environmen tal Biotechnology, Institute of Gas, November 1989.
MEANS J.C., WOOD S.G., HASSETT
J.J., BANWORT W.L., (1980): Sorption
of polynuclear aromatic hydrocarbons by
sediments and soils. Environ. Sci. Tech nol., 14, 1524.
MENN F.M., APPLEGATE B.M., SAYLER G.S., (1993): NAH plasmid-mediated
catabolism of anthracene and phenanthre ne to naphthoic acids. Appl. Environ. Mi crobiol., 59, 1938.
MIHELCIC J.R., LUTHY R.G., (1987):
Degradation of polycyclic aromatic hydro carbon compounds under various redox
conditions in soil-water systems. Appl.
Environ. Microbiol., 53, 1182.
MIHELCIC J.R., LUTHY R.G., (1988):
Microbial degradation of acenaphtene and
naphthalene under denitrification condi tions in soil-water systems. Appl. Environ.
Microbiol., 54, 1188.
MORGAN P., LEE S.A., LEWIS S.T.,
SHEPPARD A.N., WATKINSON R.J.,
(1993): Growth and biodegradation by
white-rot fungi inoculated into soil. Soil
Biol. Biochem. , 25, 279.
MORGAN P., WATKINSON R . J . ,
(1989): Hydrocarbon degradation in soils
and methods for soil biotreatment. CRC
Critical Rev. Biotechnol., 8, 305.
MORGAN P., WATKINSON R . J .
(1990): Assessment of the potential for insitu biotreatment of hydrocarbon-contami nated soils. Wat. Sci. Technol., 22, 63.
214
MUELLER J.G. CHAPMAN P.J.,
BLATTMANN B.O., PRITCHARD
P.H., (1990): Isolation and characteriza tion of a fluoranthene-utilizing strain of
Pseudomonas paucimobilis. Appl. En viron. Microbiol. , 56, 1079.
MUELLER J.G., CHAPMAN P.J., PRITC H A R D P.H., (1989): Action of a fluo ranthene-utilizing bacterial community on
polycyclic aromatic hydrocarbon compo nents of creosote. Appl. Environ. Micro biol., 55, 3085.
NARRO M.L., CERNIGLIA C.E., VAN
BAALEN C., GIBSON D.T., (1992a):
Evidence of NIH shift in naphthalene oxi dation by the marine C y a n o b a c t e r i u m
Oscillatoria species, strain JCM. Appl.
Environ. Microbiol., 58, 1360.
NARRO M.L., CERNIGLIA C.E., VAN
BAALEN C., GIBSON D.T., (1992b):
Metabolism of phenanthrene by the marine
cyanobacterium Agmenellum quadrup l i c a t u m, strain PR-6. Appl. Environ.
Microbiol., 58, 1351.
NOCENTINI M., TAMBURINI D.,
PASQUALI G., (1995): Biodegradazione
di idrocarburi policiclici aromatici in reat tori in fase semisolida. Ing. Abient., 25,
475.
OGUNSEITAN O.A., DELGADO I.L.,
TSAI Y.L., OLSONB.H., (1991): Effect of
2-hydroxybenzoate on the maintenance of
naphthalene-degrading Pseudomonas in
seeded and unseeded soil. Appl. Environ.
Microbiol., 57, 2873.
PARK K.S., SIMS R.C., DUPONT R.R.,
DOUCETTE W.J., MATTHEWS J . E ,
(1990): Fate of PAH compounds in two soil
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
types: influence of volatilization, abiotic
loss and biological activity. Environ. Toxi col. Chem., 9, 187.
RYAN J.R., LOEHR R.C., RUCKER E.,
(1991): Bioremediation of organic conta minated soils. J.Haz. Mat. , 48, 159.
PATEL T.R., GIBSON D.T., (1974): Pu rification and properties of (+)- c i snaphthalene dihydrodiol dehydrogenase of
Pseudomonas putida. J. Bacteriol., 119,
879.
SANGLARD D., LEISOLA M.S.A., FIECHER A., (1986): Role of extracellular li gninases in biodegradation of benzo(a)py rene by Phanerochaete chrysosporium.
Enz. Microbiol. Technol., 8, 209.
PICCOLO A., (1991): Contenuto e dina mica nel suolo di composti xenobiotici ap plicati con fanghi e compost. In: Riciclo di
biomasse di rifiuto e di scarto e di fertiliz zazione organica del suolo. Patron Editore, 279-286
SANSEVERINO J., APPLEGATE B.M.,
KING J.M.H., SAYLER G.S., (1993):
Plasmid-mediated mineralization of
naphthalene, phenanthrene, and anthrace ne. Appl. Environ. Microbiol., 59, 1931.
POTHULURI J.V., FREEMAN J.P.,
EVANS F.E., CERNIGLIA C.E., (1990):
Fungal transformation of fluoranthene.
Appl. Environ. Microbiol., 56, 2974.
POTHULURI J.V., HEFLICH R.H., FU
P.P., CERNIGLIA C.E. (1992): F u n g a l
metabolism and detoxification of fluo ranthene. Appl. Environ. Microbiol., 58,
937.
RAFII F., FRANKIN W., HEFLICH
R.H., CERNIGLIA C.E., (1991): Reduc tion of Nitroaromatic compounds by anae robic bacteria isolated from the human ga strointestinal tract. Applied and Environ.
Microbiol. Apr. , 962-968.
RITTMAN B.E., JOHNSON N. M.,
(1989): Rapid biological clean up of soils
contaminated with lubricating oil. Water
Sci. Technol., 21, 209.
RYAN J.A., BELL R.M., DAVIDSON
J.M., O'CONNOR G.A., (1988): P l a n t
uptake of non-ionic organic chemicals from
soils. Chemosphere, 17, 2299-2323.
SAYLER G.S., HOOPER S.W., LAYTON A.C., KING M.H., (1990): Catabo lic plasmids of environmental and ecologi cal significance. Microb. Ecol., 19, 1.
SHERMAN D.F., STROO H.F., BRATINA J., (1990): Degradation of PAHs in
soils utilising enhanced bioremediation. In:
Gas, Oil and Coal Technology I (C. Akin
& J. Smith, ed.), p. 417. Institute of Gas
technology, Chicago, IL, USA.
SHIARIS M.P., (1989): Phenanthrene mi neralization along a natural salinity gra dient in an urban estuary, Boston Harbor, Massachusetts. Microb. Ecol., 18,
135.
SIMS J.L., SIMS R.C., MATTHEWS J.E.,
(1990): Approach to bioremediation of con taminated soil. Haz. Waste Haz. Mater. , 7,
117.
SIMS R.C., (1986): Loading rates and fre quencies for land treatment systems. In:
Land Treatment- A Hazardous Waste Ma nagement Alternative. Univ. of Texas
Press.
215
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
SIMS R.C., OVERCASH M.R., (1983):
Fate of PAH in soil- plant systems. Resi due Reviews, 88, 1-68.
SIMS R.C., DOUCETTE W.J.,
M CLEAN J.E., DUPONT R.R., (1987):
Soil treatability of hazardous substances,
Vol.1. Final report of cooperative
agreement CR-810979 between Utah
State University and the U.S. Environmental Protection Agency, December.
SIMS
R.C.,
DOUCETTE
W.J.,
MCLEAN J.E., GRENNEY W.J., DUPONT R.R., (1988): Treatment potential
for 56 EPA-listed hazardous chemicals in
s o i l. EPA/600/6-88/001. Robert Kerr
Environmental Research laboratory,
Ada, Ok, USA.
SIMS R.C., OVERCASH M.R., (1983):
Fate of polynuclear aromatic compounds in
soil-plant systems. Residue Rev., 88, 1.
SOCZO E.R., STAPS J.J.M., (1988): Re view of biological soil treatment techniques
in the Netherlands. In: Contaminated Soil
1988 (K. Wolf, J. Van den Brink, F.J. Colon, ed.), p. 663. Kluwer Academic Publisher.
SONG H.G., WANG X., BARTHA R . ,
(1990): Bioremediation potential of terre strial fuel spills. Appl. Environ. Micro biol., 56, 652.
SRIVASTAVA V.J., KILBANE J.J.,
KELLY R.L., AKIN C., HAYES T.D.,
LINZ D.G., (1990): Biodegradation of old
town gas site wastes. In: Gas, Oil and Coal
Technology I (C. Akin and J. Smith, ed.),
p. 389. Institute of Gas Technology,
Chicago, IL, USA.
216
STROH D., NIEMEYER T., VIEDT H.,
(1990): Experience in microbiological soil
remediation. In: Contaminated Soil
(K.Wolf, J. Van den Brink, F.J. Colon,
ed.), p. 947. Kluwer Academic Publishers.
STRUP P.E., (1982): Determination of
PAH in industrial and municipal wa stewaters. US EPA, sept. 1982.
SUTHERLAND J.B., (1992): Detoxifica tion of polycyclic aromatic hydrocarbons
by fungi. J. Ind. Microbiol. , 9, 53.
SUTHERLAND J.B., SELBY A.L.,
FREEMAN J.P., EVANS F.E., CERNIGLIA C.E., (1991): Metabolism of phe nanthrene by Phanerochaete chrysosporium. Appl. Environ. Microbiol., 57, 3310.
THOMAS J.M., LEE M.D., SCOTT M.J.,
WARD C.H., (1989): Microbial ecology of
the subsurface at an abandoned creosote
waste site. J. Industr. Microbiol., 4, 109.
US EPA., (1983): Hazardous waste land
treatment, Revised ed. U.S. Environmen tal Protection Agency, Office of solid
Waste and Emergency Response, Washington, D.C.
US EPA, (1985): Health effects of land ap plication of municipal sludge . September,
1985.
US EPA, (1986): Land application and di stribution and marketing of sewage sludge.
Technical support document.
VALLS M., FERNANDEZ P., BAYONA
J.M., ALBAIGÉS J., (1989): Broad spec trum analysis of organic contaminants in
urban wastewaters and coastal receiving sy -
Capitolo 7 IDROCARBURI P OLICICLICI AROMATICI (PAH)
stems. In: Organic contaminants in wa stewater, sludge and sediment. Ed. by
D.Quaghebeur, I. Temmerman and G.
Angeletti. Elsevier Applied Science.
VAN DEN MUNCKHOF G . P . M . ,
VEUL M.F.X., (1990): P r o d u c t i o n - s c a l e
trials on the decontamination of oil-pollu ted soil in a rotating bioreactor at field ca p a c i t y . In: Contaminated Soil 1990 (K.
Wolf, Van den Brink, F.J. Colon, ed.), p.
993. Kluwer Academic Publishers.
VOGT N.B., BRAKSTAD F., THARE
K., NORDENSON S., KRANE J., KOLSET E., ESBENSEN, K., STEINES E . ,
(1987): PAH in soil and air: statistical
analysis and classification by the SIMCA
method. Environmental Science and Tech nology, 21(1), 35-44.
WANG X., BARTHA R., (1990): Effects
of bioremediation on residues, activity and
toxicity in soil contaminated by fuel spills.
Soil, Biol. Biochem. , 22, 501.
WANG X., YU X., BARTHA R. (1990),
Effects of bioremediation on polycyclic aro matic hydrocarbon residues in soil. Envi ron. Sci. Technol., 24, 1086.
WARSHAWSKY D., KEENAN T . M . ,
REILMAN R., CODY T.E., RADIKE
M.J., (1990): Conjugation of benzo(a)pire ne metabolites by the freshwater green alga
Selenastrum capricornutum. Chem.Biol. Interact., 73, 93.
WARSHAWSKY D., RADIKE M.,
JAYASIMHULU K., CODY T., (1988):
Metabolism of benzo(a)pyrene by a dioxyge nase enzyme system of the freshwater green
alga Selenastrum capricornutum. Bio chem. Biophys. Res. Commun., 152, 540.
WEISSENFELS W.D., BEYER M.,
KLEIN J., (1990a): Degradation of phe nanthrene, fluorene and fluoranthene by
pure bacterial cultures. Appl. Microbiol.
Biotechnol., 32, 479.
WEISSENFELS W.D., BEYER M.,
KLEIN J., (1990b): Rapid testing system
for assessing the suitability of the biological
reclamation for PAH-contaminated soil.
In: Fifth European Congress on Biotechnology, Copenhagen, 8-13 July, 2,
931.
WEISSENFELS W.D., BEYER M.,
KLEIN J., REHM H.J., (1991): Microbial
metabolism of fluoranthene: isolation and
identification of ring fission products. Ap pl. Microbiol. Biotechnol., 34, 528.
WERNER P., BRAUCH H.J., (1988):
Aspects on the in-situ and on-site removal
of hydrocarbons from contaminated sites
by biodegradation. In: Contaminated Soil
1988 (K. Wolf, J. Van den Brink, F.J. Colon, ed.), p. 695. Kluwer Academic Publishers.
WILD S.R., JONES K.C., (1991): Studies
on the PAH content of carrots (Daucus carota). Chemosphere, Vol.23, n.2, 243-251.
WILD S.R., JONES K.C., (1989): The ef fect of sludge treatment on the organic con taminant content of sewage sludges. Che mosphere, 19, 1765-1777.
WILD S.R., JONES K.C., (1992): Orga nic chemicals in the Environment. PAH
uptake by carrots grown in sludge-amen ded soils. J. Environ. Qual. 21, 217-225.
WILD S.R., BERROW M.L., JONES
K.C., (1991a): The persistence of polynu -
217
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
clear aromatic hydrocarbons (PAHs) in
sewage sludge amended agricultural soils.
Environ. Pollut. , 72, 141.
WILD S.R., JONES K.C., (1993): Biologi cal and abiotic losses of polynuclear aroma tic hydrocarbons (PAHs) from soils freshly
amended with sewage sludge. Environ.
Toxicol. Chem., 12, 5.
WILD S.R., MCGRATH S.P., J O N E S
K.C., (1990): The PAH content of archived
sewage sludges. Chemosphere, 20, n.6,
703- 716.
WILD S.R., OBBARD J.P., MUNN C.I.,
BERROW M.L., JONES K.C., (1991b):
The long-term persistence of polynuclear
aromatic hydrocarbons (PAHs) in an agri cultural soil amended with metal-contami nated sewage sludges. Sci. Total Environ.,
101, 235.
WILD S.R., WATERHOUSE K.S., MCGRATH S.P., JONESK.C., (1990): Orga nic contaminants in an agricultural soil
with a history of sewage sludge amend ments: PAH. Environ. Sci. and Tech., 24,
1706-1711.
WILLIAMS P.A., (1981): Genetics of bio degradation. In: Microbial Degradation of
218
Xenobiotics and Recalcitrant Compounds
(T. Leisinger, R. Hutter, A.M. Cook, J.
Nuesch, ed.), p. 97. Academic Press,
New York.
WILSON S.B., BROWN R.A., (1989): In
situ bioreclamation: a cost-effective tech nology to remediate subsurface organic
contamination. Groundwat. Monitor.
Rev., 9, 173.
WILSON S.C., JONESK.C., (1993): Bio remediation of soil contaminated with
polynuclear aromatic hydrocarbons
(PAHs): a review. Environ. Pollut., 81,
229.
WITTE H., (1989): Investigations of the
entry of selected organic pollutants into
soils and plants by use of sewage sludge
in agriculture . In: Organic contami nants in wastewater, sludge and sedi m e n t. Ed. by D.Quaghebeur, I. Temmerman, G. Angeletti. Elsevier Applied Science.
ZYLSTRA G.J., GIBSON D.T., (1991):
Aromatic hydrocarbon degradation: a mo lecular approach. In: Genetic Enginee ring: Principles and Methods (J.K. Setlow, ed.), 13, p. 183. Plenum Press,
New York.
Capitolo 8
Bifenili
policlorurati
(PCB)
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
A
lcuni autori hanno individuato le seguenti vie come probabili fonti di immissione dei PCB nell’ambiente: l’evaporazione durante la produzione industriale di vernici, impregnanti per il legno, plastificanti, ecc.; l’evaporazione legata alle fuoriuscite dai trasformatori, sistemi idraulici e lubrificanti, contenitori di
stoccaggio; l’emissione da parte degli inceneritori; l’emissione da motori o forni che bruciano liquidi o gas contaminati; la rievaporazione
dall’acqua e dalla terra dopo il fall-out atmosferico (Bush and Barnard, 1982), (i PCB sono stati ritrovati anche nell’acqua piovana (Lester, 1989)).
Da quando sono stati individuati i primi effetti ambientali negativi ne è stata bandita la produzione (1972), ma la stabilità di questi
composti è tale che i livelli ambientali non diminuiranno per molti
decenni.
In ogni caso la complessità delle miscele di PCB crea diversi problemi di identificazione e formulazione di ipotesi di degradazione degli
stessi: infatti, tra le molte sostanze presenti nei rifiuti dell’industria
chimica o nei processi di sintesi controllata vi è la formazione di molti isomeri.
Per i PCB si possono avere fino a 209 isomeri (Ana et al., 1991) tra i
quali pochissimi sono quelli studiati (MacKay et al., 1980; Opperhuizen et al., 1988, Opperhuizen, 1988). Inoltre, a causa della scarsa solubilità dei PCB ad alto peso molecolare, aumentano i problemi nell’individuare dei coefficienti di distribuzione tra acqua e suolo (Di Toro
and Horzempa, 1982; Di Toro et al., 1985; Winters and Lee, 1987).
8.1 Suolo
I PCB presenti nel suolo mostrano concentrazioni medie da 0.001 a
0.004 ppm s.s. (Kampe, 1989).
220
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
In 49 campioni di terreno (0-5 cm) i valori dei PCB variavano da meno di 0.2 a 12.2 ppb con una media di 3.1 e mediana di 2.5 che in campioni urbani aumentava fino a 7.2.
La media delle concentrazioni di PCB in aree urbane USA è di 2 ppb
(valore in gran parte dovuto a deposizioni atmosferiche).
Nei suoli inglesi si rilevano delle concentrazioni da 1.7 fino a 1199
ppb (media 6.5 e mediana 31.8), con un sottogruppo, comprendente il
93% dei campioni, caratterizzato da una media di PCB totali pari a 9.5
ppb.
Da quanto detto finora la concentrazione tipica sembra oscillare da
1 a 10 ppb (Jones, 1989).
Valori riportati su 6 isomeri tra cui araclor 1242,1254,1260, vanno da
0.48 a 22.77 ppb (media 3.53, mediana 1.05); presenti in maggior misura risultano i clorobifenili tetra ed esa, corrispondenti a 52,153,138,
cioè composti a pochi atomi di Cl (Ana et al., 1989).
In altri lavori si è osservato che il contenuto in PCB varia da 2.3 a 444
ppb, ma l’80% dei campioni è tra 2-3 e 20-30 ppb (Creaser et al., 1989).
In suoli gallesi si è rilevato un contenuto da 1.9 ppb a 1298 (con media di 86 e mediana di 23). Il 60% però denuncia valori tra 1.9 e 36 ppb;
le concentrazioni maggiori si rilevano nelle regioni industriali o vicino ai siti di smaltimento di rifiuti (Edulijee et al., 1987).
In un rapporto sulla situazione dei suoli giapponesi, il contenuto in
PCB variava da un minimo di 0.01 ppb (40%) a 100 ppb (5%) (Kimbrough, 1980).
Dati recenti sul contenuto in PCB nei suoli mostrano un contenuto
che va da 6.4 a 95 µg/kg (somma di 6 congeneri), media 14.2 µg/kg;
presenti soprattutto i PCB più clorurati probabilmente perchè meno
suscettibili di trasporto e degradazione atmosferica (Weiss et al.,
1994).
221
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
8.2 Acque
Concentrazioni di PCB in acque di scarico vengono riportate in ta bella 8.1 (Valls et al., 1989)
PCB
log Kow
n. 28
n.52
n.101
n.138
n.180
5.7
6.1
7.1
7.4
-
Acque di scarico ( g/L)
Costiere (ng/L)
Sedimenti
( g/g s.s.)
D
P
P/D
D
P
P/D
------
0.018
0.009
0.012
0.010
0.018
------
0.061
0.007
0.017
0.011
0.007
0.018
0.005
0.022
0.040
0.030
0.3
0.7
1.3
3.6
4.3
2-177 10 - 3
1-70 10 - 3
2-66 10 - 3
4-104 10 - 3
2-103 10 - 3
Tabella 8.1 - Concentrazioni di inquinanti nelle acque di scarico
( D=diciolto P= particolato), acque marine e sedimenti (da Valls et al., 1989).
8.3 Fanghi
In fanghi derivanti dal trattamento di acque reflue contenenti da 1 a
30 ppb, i valori di PCB rilevati vanno da 0.1 a 10 ppm. Nella tabella 8.2
PCB
Autori
0.05-10
0.7-5.15
1.2-105
1.1-185
0.004-1.4
0.02-0.46
0.1-10
8.8
0.01-20
2.8-8.3
0.9-9
16-54
0. 004-2.68
nd-4.6
Genevini et al., 1986
Genevini et al., 1986
Genevini et al., 1986
Genevini et al., 1986
Genevini et al., 1986
Genevini et al., 1986
Genevini et al., 1986
Genevini et al., 1986
Hansen e Chaney, 1984
Witte,1989
Tarradellas et al.,1989
Burgermeister et al., 1989
Lester,1989
Gutenmann et al., 1994
Tabella 8.2 - Concentrazioni di PCB nei
fanghi secondo diversi autori (mg/kg s.s.).
222
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
(Genevini et al., 1986) sono riportate le concentrazioni (mg/kg s.s.) di
PCB nei fanghi secondo diversi Autori.
Su 14 fanghi la media stimata era di 5 ppm, mediana 4 ppm, con un
range da 0.01 a 20 ppm (Hansen and Chaney, 1984), mentre in altri
(Witte, 1989) il contenuto medio era di 28-83 ppb, in relazione alle regioni di provenienza (tabella 8.3, Hansen and Chaney, 1984).
PCB
min
max
mediana
media
n.28
n.52
n.101
n.138
n.153
n.180
nn
nn
nn
nn
nn
10
280
250
220
220
280
150
22.0
20.0
40.0
70.0
70.0
43.0
40.7
28.4
51.5
81.5
83.5
53.4
Nota: Contenuto in PCB di 57 fanghi provenienti da 38 impianti di trattamento dell'area indagata.
Concentrazioni espresse in µg/kg s.s.; n.n.< µg/kg s.s.
Tabella 8.3 - Concentrazioni di PCB nei fanghi di diversa provenienza (ppb)
(da Hansen and Chaney, 1984).
In particolare, da uno studio svizzero, risulta che la contaminazione
di PCB aumenta vicino agli impianti di depurazione (160-540 ppb)
(Burgermeister et al., 1980). Altre concentrazioni di PCB nei fanghi sono riportate nella figura 1 (Tarradellas et al., 1989).
In Italia sono state rilevate concentrazioni medie superiori ai 96
ppm, con punte superiori ai 200 ppm nei fanghi, e ai 300 ppm nei suoli trattati (Piccolo, 1991).
Nei fanghi si osservano valori di PCB fino a 352 ppm, a causa della
facilità con cui si adsorbono sulle particelle sospese o precipitate (Genevini et al.,1989). Infatti, in fanghi sottoposti a trattamento a caldo e
disidratazione, con due processi (filtrazione a vuoto e a pressione) e
condizionatori (alluminio cloroidrato e polielettroliti), si trovano concentrazioni da 0.95, 1.50 e 0.34 ppm.
In Inghilterra sono state individuate concentrazioni medie di 0.16
ppm su 40 fanghi, con variazioni da 0.004 a 2.68 ppm e in Giappone
medie di 0.15 ppm (Lester, 1989).
In fanghi anaerobici si rilevano concentrazioni medie di 1 ppm
(Marcomini et al., 1989).
In compost la concentrazione media dei PCB varia da 1 a 15 ppm
s.s., con punte più elevate quanto più il compost è maturo (concentra-
223
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Figura 1 - Concentrazioni di
micro-inquinanti
nei fanghi Svizzeri
(mg/kg s.s.)
(Tarradellas et al., 1989).
224
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
zione conseguente alla diminuzione della componente organica fermentescibile) (Genevini et al., 1989).
In ogni caso, le concentrazioni sono andate diminuendo nel tempo
dal momento che il loro uso industriale è stato ristretto ad applicazioni a ciclo chiuso (Genevini et al., 1986; Witte, 1989), come conferma
una ricerca svedese (Sjoquist, 1989): su 31 impianti è risultata una diminuzione dei PCB nei fanghi dal 1976 al 1981 legata appunto alle restrizioni legislative del 1972 (cfr. figura 2). Dal che ne consegue che i
PCB nei fanghi derivano da fonti domestiche (Genevini et al., 1986).
Analisi recenti sul contenuto di PCB in fanghi di depurazione di 16
grandi città americane riportano concentrazioni da nd (<0.25 ppm) a
4.6 ppm s.s. che è abbondantemente al di sotto del limite di 10 ppm
stabilito dall’US EPA per l’impiego dei fanghi in agricoltura (Gutenmann et al. 1994), ma al di sopra ad esempio, del limite tedesco di 0.2
ppm. Sperimentazioni tedesche mostrano come i PCB, (presenti in
quantità da 232 a 288 µg/kg nei fanghi testati) siano insolubili e persistenti nel fango anche dopo il trattamento termico di stabilizzazione effettuato sul fango stesso e come la formazione di isomeri meno
clorurati durante questo processo sia minima (Balzer e Pluschke,
1994).
Il contenuto in PCB in fanghi essiccati varia da 200 fino a 1700 ppm
(Bergh and Peoples, 1977), con un valore tipico di 0.01-23 ppm e una
mediana di 4 ppm. In America in terreni trattati con fanghi le concentrazioni di PCB variavano da 0 a più di 50 ppm, mentre in Giappone si
sono rilevati fino a 1200 ppm (Fujiwara, 1975).
In terreni trattati si è osservato che i PCB sono aumentati da 5 a 17
volte dopo l’applicazione del fango (distribuito alla dose di 5 t s.s./ha
per 3 anni).
PCB K28 = 0.005 ppm
PCB K52 = 0.017 ppm
PCB K101, K138, K153, K180 = 0.04, massimo 0.3 ppm
rispetto ai 0.001 e 0.004 ppm dei controlli (Kampe, 1989).
A confronto con la letteratura olandese (0.05 ppm) non si sono avuti superamenti, il valore più alto è pari a 0.3 contro un limite di 10
ppm; si tratta quindi di aumenti non pericolosi (Kampe, 1989).
225
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Figura 2 - Distribuzione di PCB nei fanghi provenienti da 31 impianti, tra il
1976 e il 1981 (Sioquist, 1989).
Da una sperimentazione americana (Burgermeister et al., 1980) risulta che dopo lo spandimento di fanghi contenenti 7.4 ppm di PCB il
suolo mostrava nell’orizzonte superficiale valori da 7 a 10 ppb.
Aumenti del contenuto in PCB del terreno venivano riscontrati dopo trattamenti a lungo termine (dal 1969) con fanghi, letame, fanghi+compost, paglia e torba (Konig et al., 1987).
Nella tabella 8.4 vengono riportati i valori dei PCB nei fanghi, nei
suoli trattati e nei vegetali (Kimbrough, 1980).
226
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
Tipo di campione
n.
impianto
reflui (affluenti)
fanghi
suoli trattati con fanghi
suoli non trattati
vegetali/radici
vegetali/foglia
6
3
14
28
5
5
4
Concentrazione in PCB (ppm)
media
range
3.0
0.2
479.1
17.1
0.2
0.15
0.14
1.25-5.5
0.03-0.47
0.1-1700
0.1-107.3
0-0.9
0-0.6
0-0.3
Nota: * Le concentrazioni di PCB sono di Araclor 1242;** Dati da Bergh e Peoples (1977)
Tabella 8.4 - Concentrazioni di PCB in campioni di diversi comparti
ambientali, Bloomington, Indiana, 1976 (da Kimbrough, 1980)
8.4 Degradazione
Questi composti sono caratterizzati da una grande resistenza alla
degradazione, ed il tempo di dimezzamento nel suolo aumenta con il
numero di atomi di cloro (Piccolo, 1991; USEPA 1985). Ad esempio il
pentaclorobifenile ha un tempo di dimezzamento superiore ad un anno, ma l’emivita media di miscele di differenti PCB nei suoli è maggiore ai 4 anni. (Piccolo, 1991)
Per quanto riguarda il decadimento si può dire che approssimativamente in 20 anni si scende da 4 fino a 8 volte il valore iniziale (Witte, 1989).
Dal momento che i PCB sono fortemente adsorbiti dal suolo, proprio
il tipo di suolo, il contenuto in sostanza organica, il contenuto in cloro
e/o l’idrofobia di alcuni isomeri di PCB determinano l’adsorbimento
che aumenta all’aumentare di questi fattori (US EPA, 1985).
In particolare, i PCB diminuiscono all’aumentare della frazione organica del suolo e della sua capacità adsorbente, conseguente al trattamento con fanghi.
Da sperimentazioni si è osservato che i coefficienti di distribuzione
suolo-acqua (Kd) per 6 isomeri indagati, erano linearmente correlati
con il carbonio organico (Foc) del suolo, con un Kd da 25 a 23.000 e un
Foc da 0.03 a 1.87%. Da questi dati emerge, soprattutto per i PCB policlorurati, che esistono altri parametri coinvolti nell’adsorbimento
(quali Koc, ecc.) che comunque diminuisce in suoli a basso tenore in
sostanza organica (Ana et al., 1991).
227
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
In merito alla percolazione, uno studio su colonne mostra come nel
peggiore dei casi venga rilasciato meno dello 0.5% di un singolo isomero di PCB (US EPA, 1985). Altri invece sostengono che i PCB rimangono fortemente adsorbiti ai suoli trattati, con minimo passaggio
nell’acqua presente nel terreno (US EPA, 1985).
PCB determinati in suoli trattati con fanghi, dopo un anno dal trattamento (2.5 t/ha) e dopo 30 anni di deposito nei serbatoi, non mostravano alcuna o poca degradazione, circa 0.2 ppm. A parte il possibile asporto da parte degli animali l’unico meccanismo di rimozione
dei PCB nel suolo è la volatilizzazione, rilevante per le molecole di bifenile con 4 o meno atomi di Cl, mentre il più alto contenuto in PCB
nei fanghi è di composti con più di 4 Cl fino a 8 (Witte, 1989). I serbatoi che servivano da deposito da 30 anni (cfr. tabella 8.5) mostravano
contenuti inferiori all’ 1% del 3-2 clorobifenile totale dei PCB mentre i
4-8 clorobifenili appaiono i più persistenti.
La figura 3 mostra la diminuzione di un fattore 4 dall’1986 al 1973 da
attribuire solo al minore impiego dei PCB. Si sottolinea come l’arricchimento dei PCB fosse 150 volte più alto degli altri composti analizzati (LAS ecc.) (Marcomini et al., 1989).
La volatilizzazione e la degradazione sono importanti meccanismi
di perdite di PCB dal suolo; tuttavia, pur essendo state svolte diverse
ricerche sul destino dei PCB nel suolo e del loro metabolismo (Parsons
et al., 1983) esistono delle lacune sulla misura in cui ad esempio AraLocalità, tempo di
conservazione
(anni antecedenti al 1986)
Menden-Bosperde
Menden-Bosperde
Edewechterdam
Essen -Werden
Essen-Eickennsheidt
15
30
0.5
2
5
10
13
13
0.5
2
20
1970/71
1950-64
1985/86
1983-85
1979-83
1975-79
1972-75
1972-75
1986
1984
1966
tipo di fango
PCB
(mg/kg s.s.)
refluo
refluo
digerito
digerito
digerito
digerito
digerito
digerito
digerito
digerito
digerito
14.2
10.2
1.7
2.6
1.9
4.4
7.7
3.1
0.8
5.7
7.6
Tabella 8.5 - Concentrazioni di PCB in campioni provenienti
da vari serbatoi di fango tedeschi (da Witte, 1989).
228
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
Figura 3 - Concentrazioni di PCB, LAS e NP nei campioni provenienti
da Edewechterdam (Marcomini et al., 1989).
clor 1254 si mineralizza e si volatilizza a livello di suolo e di sistema
suolo-fango.
Per le motivazione addotte è stato condotto uno studio sulla mineralizzazione e la volatilizzazione dei PCB in suoli trattati con fanghi
(in concentrazioni rispettivamente di 5, 50, 500 ppm). Le perdite di
PCB totali andavano dall’8 al 33%, una percentuale dal 50 al 95%
scompariva rispettivamente da 2.5 ai 5.9 anni, e da 6.1 a 26.3 anni.
La volatilizzazione andava dal 5 al 31% ed era maggiore nei suoli
non ammendati e trattati con 500 ppm di PCB.
Si assisteva ad una diminuzione con l’aggiunta del fango attraverso
una maggior volatilizzazione verificatasi nei suoli sabbiosi rispetto a
quelli argillosi (Fairbanks et al., 1987). Per Araclor 1242, 1254, 1260 la
volatilizzazione in pratica diminuisce con l’aumento della S.O. nel
suolo, mentre aumenta con l’evaporazione (Edulijee, 1987): confrontando le concentrazioni, la volatilizzazione era massima a 50 ppm e
minima a 500 ppm. La degradazione di Araclor 1254 a CO 2 p a s s a v a
dall’1 all’11% .
La detossificazione, dunque, aumenta con l’aggiunta del fango e diminuisce con l’aumento della concentrazione di PCB.
La mineralizzazione supera la volatilizzazione in suoli trattati con 5
ppm. Durante i primi 60 gg di incubazione la mineralizzazione aumenta nei trattamenti con 5 e 50 ppm. In nessun caso l’applicazione di fango
aumenta il rischio ambientale di Araclor 1254 (Fairbanks et al., 1987).
229
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
In merito alla volatilizzazione dei PCB (Araclor 1242, 1254, 1260) dal
suolo è stato osservato che esisteva una proporzionalità inversa tra
flusso di volatilizzazione e contenuto in sostanza organica; proporzionalità diretta, al contrario, si verificava con la quantità di acqua
evaporata (Edulijee, 1987).
Da una sperimentazione sul comportamento dei PCB negli impianti di trattamento delle acque non è stata rilevata alcuna perdita per
volatilizzazione e si è notato che i PCB con pochi atomi di Cl sono degradati microbicamente mentre i PCB a tanti atomi di Cl restano nel
fango; concentrazioni da 0.8 ppb a 0.1 ppm si ritrovano nell’effluente,
mentre il resto rimane nel fango (Emmrich et al., 1988 I, II).
In lavori sugli effetti a lungo termine dei PCB nei fanghi agricoli è
stata ulteriormente confermata la lunga degradazione degli stessi e il
forte adsorbimento da parte del suolo perchè i PCB vengono assimilati nel ciclo del C molto lentamente (Chang and Page, 1990). In suoli
con 2 ppm di concentrazione si sono comunque osservate percentuali degradative del 99.99% ( Wentz et al., 1989).
Anche la fotodegradazione, infine, attraverso successive declorurazioni, ha un’importanza non trascurabile nella decomposizione dei
PCB e può modificare il rapporto dei vari isomeri presenti nelle miscele (Leoine et al., 1992) .
8.4.1 Biodegradazione
A partire dagli anni ’70 la degradazione dei PCB è stata investigata
in numerose ricerche con colture microbiche pure e con colture miste
utilizzando isomeri puri a diverso grado di sostituzione o miscele
commerciali. I microrganismi che si sono dimostrati in grado di degradare i PCB appartengono a numerosi generi; tra questi Acinetobac ter, Alcaligenes, Pseudomonas, Arthrobacter sono i maggiormente rappresentati.
Alcuni autori (Bedard and Haberl, 1990) hanno proposto una classificazione dei ceppi capaci di degradare i PCB in quattro classi sulla
base dell’influenza della posizione dei clorosostituenti sugli anelli
aromatici. È noto infatti che la degradabilità dei PCB dipende dal numero e dalla posizione dei clorosostituenti, diminuendo con l’aumentare di questi e con la presenza degli stessi sugli anelli in posizione or to. Sono inoltre più degradabili i PCB che presentano i clorosostituenti su un solo anello (Furukawa et al., 1978).
230
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
L’utilizzazione dei clorobifenili come substrati di crescita è stata osservata solo per i congeneri a bassa sostituzione dove di norma l’anello non sostituito funge da fonte di carbonio e di energia. Ad esempio, 3-cloro, 4-cloro e 3,5-diclorobifenile possono essere degradati totalmente da ceppi in cocultura (Sylvestre et al., 1985, Fava and Marchetti, 1991), mentre il solo 4-clorobifenile risulta essere mineralizzato da colture pure (Schields et al., 1985).
La mineralizzazione di monoclorobifenili è stata anche osservata in
condizioni naturali da parte di popolazioni microbiche ottenute da sedimenti di fiume (Kong and Sayler, 1983). Per contro la degradazione
dei PCB ad alto contenuto in cloro si verifica mediante processi di
coossidazione in cui il bifenile rappresenta la fonte di carbonio utilizzabile e l’induttore degli enzimi implicati (Kimbara et al., 1988). Al riguardo si è osservato che il metabolismo dei PCB nel suolo è favorito
dall’aggiunta di bifenile (Focht and Brunner, 1985), che d’altra parte è
tossico per l’uomo e scarsamente solubile.
La principale via metabolica di degradazione dei PCB implica l’attacco del bifenile 2,3-diossigenasi di solito sull’anello meno clorurato
a dare un 2,3-diidrossiderivato che viene scisso in meta nella posizione 1,2 a dare i corrispondenti acidi clorobenzoici (Ahmed and Focht,
1973; Massè et al., 1984). Generalmente gli acidi clorobenzoici non
vengono degradati dai ceppi capaci di metabolizzare i PCB: quando
essi si accumulano nel mezzo di crescita vengono convertiti in metaboliti non produttivi che rallentano la degradazione dei PCB (Sondossi et al.,1992; Parsons et al., 1988). L’accumulo di tali metaboliti
può essere prevenuto-con l’introduzione di ceppi capaci di trasformare clorobenzoati e clorocatecoli (Havel and Reineke, 1992) innalzando così la mineralizzazione dei PCB (Hickey et al., 1993).
Uno schema degradativo alternativo è stato osservato in un ceppo di
Alcaligenes eutrophus che metabolizza tetra-, penta- ed esa-clorobifenili, che hanno il sito 2,3 sostituito, ai corrispondenti di- e tri-cloroacetofenoni: ciò suggerisce l’esistenza di una nuova via metabolica in cui sono coinvolti per l’attacco iniziale enzimi diversi dalla 2,3 diossigenasi
(Bedard et al., 1987). Il 4’-cloroacetofenone è stato anche isolato in
grandi quantità da 4-clorobifenile da parte di uno Pseudomonas (Kong
and Sayler, 1983). È stato suggerito che la formazione di cloroacetofenoni sia il risultato di una diossigenazione in posizione 3,4.
Furukawa and Chakrabarty ( 1982) hanno per primi riportato che la
degradazione del 4-clorobifenile da parte di Acinetobacter M6 e Arth robacter M5 a clorobenzoato è codificata da geni plasmidici. Successi-
231
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
vamente la presenza di un altro plasmide catabolico (pSS50) è stata
osservata in numerosi ceppi di Alcaligenes e Acinetobacter isolati da
una popolazione microbica in grado di mineralizzare completamente il 4-clorobifenile (Shields et al., 1985). Tali osservazioni suggeriscono che in ambienti stressati i batteri possono evolvere capacità metaboliche nuove di grande interesse ai fini della decontaminazione del
suolo e delle acque.
Recenti studi di genetica microbica hanno permesso di costruire
ceppi che hanno acquisito interessanti capacità nei riguardi dei
PCB: mono- e di-clorobifenili vengono degradati da ceppi ibridi di
Pseudomonas che si sono dimostrati capaci di trasformare anche alcuni congeneri di Aroclor 1221 (Havel and Reineke, 1991; Havel
and Reineke, 1993; Mokross et al., 1990).
La degradazione dei PCB in sistemi di suolo è stata esaminata in numerosi studi (Pal et al., 1980; Skarew and Girvin, 1987). Ai fini della
potenziale “bioremediation” dei suoli contaminati sono da citare le ricerche di Brunner et al. (Brunner et al.,1985; Focht and Brunner, 1985)
che hanno studiato l’effetto dell’inoculo di un Acinetobacter capace di
cometabolizzare i PCB e dell’aggiunta di bifenile sulla mineralizzazione di Aroclor 1242, mentre Hickey et al. (1993) hanno riportato che
la degradazione dei PCB nel suolo viene esaltata dall’inoculo di ceppi
capaci di degradare i clorobenzoati.
Se la degradazione aerobica dei PCB è limitata, salvo poche eccezioni, ai congeneri poco sostituiti, la degradazione anaerobica dei PCB,
studiata più recentemente, implica la dealogenazione riduttiva dei
composti anche ad alto contenuto di cloro, non suscettibili d’attacco
in aerobiosi. Questo processo è perciò di grande interesse ai fini dello
sviluppo di sistemi di trattamento dei PCB, che, con la rimozione di
alcuni clorosostituenti per dealogenazione riduttiva, diventano meno
tossici e più degradabili aerobicamente.
Le prime evidenze sono state ottenute da analisi di sedimenti di acque di fiume contaminate con miscele di PCB (Brown et al., 1987).
Consorzi di diversa provenienza mostravano differenze di specificità
nella declorurazione dei diversi congeneri. Quensen et al. (1990) hanno riportato che Aroclor 1242, 1248, 1254 e 1260 potevano essere declorurati da inoculi ottenuti da sedimenti contaminati da PCB con
perdita prevalente dei clorosostituenti in posizione meta e para d e i
congeneri più altamente clorurati, mentre si accumulavano i congeneri sostituiti in orto (2-cloro, 2,2’-dicloro e 2,6-diclorobifenile) originariamente presenti nelle miscele in minor percentuale.
232
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
Circa i gruppi fisiologici implicati nella declorurazione dei PCB si
è osservato che gli sporigeni anaerobi sono parzialmente responsabili di tale processo (Ye et al., 1992) e che una coltura di arricchimento fototrofa era in grado di declorurare il 2,3,5,6-tetraclorobifenile con rimozione preferenziale dei clorosostituenti in orto e accumulo di tri- e di-clorobifenili (Montgomery and Vogel, 1992). Sembra comunque che la declorurazione non sia un processo strettamente anaerobio in quanto consorzi microbici ottenuti da fanghi aerobici si sono dimostrati in grado di declorurare i 4,4’-diclorobifenile (Mavoungou et al., 1991).
8.5. Piante
I PCB, come tutti i composti alogenati insolubili in acqua, sono adsorbiti dall’aria del suolo e dall’aria ad esso sovrastante e si è osservato (Genevini et al., 1986) che in fase gassosa raggiungono le parti aeree
delle piante. Quindi, sebbene la tossicità dei PCB per le piante si manifesti a concentrazioni nel suolo maggiore a 200 ppm (Piccolo, 1991), la
volatilità ne permette l’assimilazione anche attraverso le parti aeree.
I PCB sono composti cosiddetti semivolatili. Caratterizzati da un log
Kow> 4 generalmente non sono assorbiti dal suolo nè traslocati, tuttavia essendo volatili possono acumularsi nella cuticola fogliare. In
una sperimentazione su aghi di pino (Picea Abies) ( Umlauf et al.,
1994) si è appunto osservato che per i composti ad alto peso molecolare, come i PCB, DDT,ecc., i lipidi della cuticola, oltre a legarsi fortemente a queste molecole, agiscono da barriera alla loro diffusione,
mentre i composti con peso molecolare inferiore, come ad esempio i
CB, riescono rapidamente a penetrare all’interno.
Sperimentazioni effettuate su piantine di soia allevate su sabbia trattata con ingenti quantità di PCB a basso numero di atomi di cloro hanno evidenziato uno scarso adsorbimento e traslocazione (Genevini et
al., 1986).
Sensibili alla contaminazione gassosa sono risultate le colture da radici quali le carote (ricche in lipidi), meno le altre, bietole, cipolle, rape, cavolo (Genevini et al., 1986) e soia (Hansen and Chaney, 1984).
In ogni caso si è osservato in campo che la somministrazione di fango urbano (0.93 ppm di PCB) in dosi fino a 224 t/ha non induceva au-
233
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
menti di PCB nelle carote (Genevini et al., 1986). I più pericolosi per le
piante comunque restano i PCB a più di 5 atomi di Cl.
Sempre su carote trattate con elevate concentrazioni di PCB (50100 ppm) si sono osservati aumenti dal 3 al 50%, con aumento proporzionale alla diminuzione del numero di atomi di Cl. Il 97% di
Araclor 1254 era ritenuto dalle radichette della carota mentre quello
presente nelle foglie era dovuto all’assorbimento di polvere contaminata (US EPA, 1985; Hansen and Chaney, 1984; Baker et al.1980;
Qiuping et al., 1991; Iwata and Gunther, 1976; Buckey, 1987). Pochissima traslocazione è avvenuta nel tessuto vegetale, effetto confermato anche da sperimentazioni su patate (US EPA, 1985). Ancora
nelle carote si ha un maggior asporto di diclorobifenile che in bietola da zucchero, fatto ascrivibile alla maggior lipofilia delle carote i
PCB dalla superficie radicale tendono ad accumularsi nella cuticola
(Qiuping et al., 1991).
Nella soia si è osservato un asporto fino a 0.15 ppm in suoli trattati
con 100 ppm di Aroclor 1242 e 1254. Anche nel riso e nel cavolo si è notata traslocazione (Nakanishi et al., 1974; Moza et al., 1976; Suzuki et
al., 1977; Fries and Marrow, 1981), mentre aumenti trascurabili sono
stati rilevati anche in cariossidi di segale e paglia (Konig et al., 1987).
In piante di soia si è potuta notare la perdita di Araclor 1254 marcato dalle foglie e, dopo 12 gg dal trattamento, si contava solo il 6.7 %
della concentrazione iniziale in PCB (Weber et al., 1979).
In giovani piante di pomodoro (Wallnofer et al., 1973) i PCB andavano fino a 10 ppb, ma nelle piante mature diminuivano fino a non essere misurabili e non si rilevavano neppure nei frutti o in altre parti
della pianta.
L’asporto di PCB da bietole da zucchero da un suolo contenente 0.3
ppm di Araclor 1254 è stato osservato durante 60-70 gg: l’accumulo di
PCB fu di 0.05 ppm nelle radichette delle radici di bietole, 0.01-0.15
nella pianta intera e 0.03 ppm nelle foglie (Wallnofer et al., 1975).
Sempre in merito alle asportazioni da parte di grano allevato in suoli trattati si è visto che Araclor veniva prontamente assorbito. Le concentrazioni nelle foglie erano intorno a 45-81 µg/kg (Lawrence and
Tosine, 1977).
Anche su bietola e rapa (Sawney and Hankin, 1984) si è notato un
maggior accumulo nelle foglie rispetto alle radici.
In piante di fagioli, le foglie e i baccelli mostravano un contenuto in
PCB maggiore rispetto ai fusti, mentre basse erano le concentrazioni
dei semi (Qiuping et al., 1991).
234
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
Proprio per la contradditorietà delle affermazioni esistenti in letteratura è stato studiato l’asporto di PCB da parte di piante di orzo e pomodoro, i PCB sono stati rilevati in tutte le parti della pianta, più nelle foglie e meno nei frutti. Da meno di 100 ppt a 19 ppb.
Le concentrazioni nelle foglie variavano da 8 ppb per 2,4,5 triclorobifenile, a 16 ppt per 2.2’ 3, 3’ 4, 4 ’ 5, 6 octaclorobifenile e 2.2, 3 3’4, 5. 5’, 6, 6
nona clorobifenile. Nei fusti le concentrazioni di PCB erano minori di
quelle nelle foglie (Qiuping et al., 1991). Le piante di controllo cresciute vicino alle parcelle trattate presentavano tracce di PCB assorbito come gas. Nella figura 4 su pomodoro si nota una correlazione inversa tra
il numero dei Cl sostituiti e la concentrazione di PCB.
La pressione di vapore di PCB cala con il numero di Cl sostituiti,
confermato dal fatto che nelle radici delle piante di controllo non c’erano PCB.
Figura 4 - Concentrazioni di PCB nelle foglie di pomodoro rispetto
al numero di Cl sostituiti (Qiuping et al., 1991).
235
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
I campioni di suolo analizzati mostrano perdite di PCB fino a 5 mm
in superficie, meno dell’8% dei PCB totali viene perso durante i 6 mesi. Modesti risultavano quindi il trasporto e traslocazione nelle piante.
Comunque le piante intercettano i contaminanti lipofili aerei ed è stata osservata una migrazione di PCB dalla corteccia al tessuto corticale (Qiuping et al.,1991).
Dopo trattamenti di 5 t/ha s.s. per 3 anni, pur avendo rilevato aumenti di PCB nel terreno, non è stata osservata alcuna traslocazione
alle colture su specie diverse (grano, trifoglio, bietola, patate), a livello di ppm. I valori osservati erano di 0.001 ppm s.f. (cfr. tabella 8.6,
Kampe, 1989).
K 28
K52
controllo
max
nd <0.001 0.002
min
nd
nd 0.001
media
nd <0.001 0.001
applicazione
di fango
max
0.001 <0.001 0.123
min
0.001 nd 0.001
media
0.005 <0.001 0.017
fattore
di accumulo
max
11
1
61
min
1
1
1
media
5
1
17
K101
K138
K153
K180
<0.001 0.008 0.002 0.009 0.002 0.008 0.002 0.006 <0.001
nd 0.001
nd 0.001
nd 0.001
nd 0.001 nd
<0.001 0.003 <0.001 0.004 <0.001 0.003 <0.0010.003 <0.001
<0.001 0.299 0.002 0.339 0.002 0.303 0.003 0.197 <0.001
nd 0.001 <0.001 0.001 nd 0.001 nd 0.001 nd
<0.001 0.036 <0.001 0.049 <0.001 0.044 0.001 0.031 <0.001
1
1
1
37
1
12
1
1
1
38
1
12
1
1
1
38
1
14
1
1
1
33
1
10
1
1
11
Note : Fattore di accumulo = applicazione del fango/controllo
*Stazioni : Bonn, Braunschweig, Bremen, Gieben, Munich e Speyer
Tabella 8.6 - PCB in suoli arabili dopo l’applicazione del fango (somma
di 133 rilevamenti da 6 stazioni * nell’1985; mg/kg di suolo s.s.
o mg/kg di materiale dell’impianto).
Foraggi cresciuti in suoli contaminati mostrano un contenuto in PCB
residuo pari a circa 1/10 della concentrazione nel suolo, al I° anno di
coltura.
Attuando l’esercizio del pascolo dopo 30 gg dall’applicazione del
fango e fornendo altri alimenti nei periodi di scarsa disponibilità di
foraggio, si può ridurre l’ingestione di fango in modo tale che si arrivi a una soglia di 10 ppm di PCB per un fango applicato in dosi di 10
t/ha/anno (US EPA, 1985). L’iniezione sottosuperficiale dei fanghi, in
ogni caso, potrebbe ridurre materialmente il rischio.
236
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
Pare comunque che la presenza e l’assorbimento di PCB nelle piante sia molto bassa e che ci siano delle fonti diverse dai fanghi (Witte,
1989).
Da una sperimentazione con 57 fanghi e 38 piante e un contenuto medio dei fanghi di 28-83 ppb si sono avuti i seguenti risultati (tabella 8.7).
campionamento
controllo
dopo il fango
dopo il raccolto
dopo l'impiego del fango m i n
max
x
dopo il raccolto
min
5 t s.s.
max
x
dopo l'impiego del fango m i n
10 t s.s.
max
x
dopo il raccolto
min
10 t s.s
max
x
fattore d'incremento
5 t s.s.
dopo l'impiego del fango 10 t s.s.
fattore d'incremento
5 t s.s.
dopo il raccolto
10 t s.s.
trattamenti in campo
n. 28
1,0
0,5
nn
1,0
0,6
nn
nn
0,5
nn
nn
0,5
nn
nn
0,5
0,6
0,5
1,0
1,0
n.52
1,4
0,6
nn
1,0
0,6
nn
nn
0,5
nn
nn
0,5
nn
nn
0,5
0,4
0,4
0,8
0,8
n.101 n.138
1,0
1,4
0,9
1,4
nn
nn
1,0
2,5
0,7
1,5
nn
nn
1,0
1,0
0,7
1,4
nn
1,0
2,0
4,0
1,0
1,7
nn
nn
1,0
3,0
0,8
1,4
0,7
1,1
1,0
1,2
0,8
1,0
0,9
1,0
n.153 n.180
1,2
0,9
1,4
1,0
nn
nn
2,0
1,0
1,3
0,9
nn
nn
2,0
2,0
1,4
0,9
1,0
nn
4,0
2,0
1,7
1,2
nn
nn
3,0
2,0
1,3
0,9
1,2
1,0
1,4
1,3
1,0
0,9
0,9
0,9
Tabella 8.7 - Risultati di una ricerca in campo. Il contenuto in PCB
del suolo dopo l'utilizzo del fango e dopo il raccolto. Media di 7
campioni di suolo ( g/kg di s.s., n.n.<10 g/kg di s.s.) (da Witte, 1989).
Le differenze rilevate sono in relazione alle regioni di provenienza e
non c’era correlazione tra piante e contenuto di PCB del fango. Non si
è osservato un aumento in campo, ma in contenitore. Una riduzione
dei PCB nel suolo è stata notata tra il tempo di spandimento e il raccolto (50%), ma non è spiegabile. L’influenza nel lungo periodo è in
relazione alla quantità di fango apportata. In conclusione l’ influenza
dei PCB del suolo è risultata inferiore al 13% rispetto alla quantità totale di PCB rilevata (su grano, patate, carote, fagioli, foraggio, segale,
avena, orzo, rape), il che implica la presenza di altri fonti di inquinamento (Witte, 1989).
237
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Da una sperimentazione americana con fanghi contenenti da 7 a 10
ppb, si sono riscontrati valori pari a 28 ppb nella granella dei cereali
coltivati (Burgermeister, 1980)
In esperimenti in vaso su Festuca arundinacea, Daucus carota e Lactu ca sativa cresciute su terreni trattati con fanghi contenenti 52 ppm di
PCB (in dosi di 0.5, 1 e 2.5 ppm) ed in prove in pieno campo con fanghi con meno di 1 ppm di PCB in dosi corrispondenti a quelle in vaso,
i PCB risultavano sempre al di sotto del limite di indagine (20 ppb),
eccetto che nelle radichette delle carote che raggiungevano una concentrazione di 3 ppb s.f. con un contenuto iniziale nel suolo di 0.75
ppm (Konig et al., 1987).
La presenza dei PCB varia nelle diverse specie vegetali (Thomas et
al., 1984; Thomas and Simon, 1985; Strek and Weber, 1982) si sono
identificati fino a 83 isomeri, (Genevini et al., 1986; Sjoquist, 1989).
L’assorbimento dei PCB presenti nell’ambiente a basse concentrazioni è stato osservato nelle foglie di 4 specie coltivate: soia, grano, fagioli e fagiolini, e nei rispettivi frutti. Tutte le specie accumulano gli
stessi isomeri, ma non nel medesimo grado. Nella soia le concentrazioni rilevate sono di 12-15 ppb ed anche i fagioli e i fagiolini non mostrano aumenti significativi, mentre il grano è fisiologicamente in grado di ridurre i PCB a causa della conformazione delle foglie che prima accumulerebbero questi composti per poi eliminarli per traspirazione. Il grano cresciuto in suoli con alte concentrazioni di PCB (1001000 ppb), infatti, ha mostrato lo stesso comportamento. La media totale dei PCB in ciascuna pianta va da 1 a 50 ppb, ma generalmente è di
25 ppb, dove le variazioni sono correlate all’entità delle precipitazioni atmosferiche durante il periodo di coltivazione e, quindi, a una
maggiore mobilità dei PCB verso le radici.
I frutti erano 100 volte meno contaminati delle foglie esaminate, ma
l’accumulo aumenta all’aumentare del contenuto in PCB del suolo,
per cui l’uso dei fanghi è consigliato solo se l’insilato da somministrare al bestiame viene confezionato col grano raccolto prima della spigatura, altrimenti le dosi di fango applicate al terreno devono essere
attentamente valutate (Lana et al., 1989).
Nella tabella 8.8 vengono riportate le quantità di PCB asportate dalle piante (USEPA, 1986):
Essendo l’ambiente ormai contaminato dai PCB, benchè dal 1972
l’utilizzo di questi composti sia stato vietato da disposizioni legislative, persiste il rischio di contaminazione della catena alimentare.
238
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
Tabella 8.8 - Assorbimento di PCB da parte delle piante (US EPA, 1986).
Pianta/
tessuto
tipo di
suolo
forma
chimica
conc.
nel suolo
( g/g s.s.)
conc. nei
tessuti
( g/g s.s.)
nr
2 -PCB
nr
nr
nr
nr
nr
4- PCB
6-PCB
PCB
nr
nr
nr
nr
nr
0.06-0.12 c
0.02- 0.12 c
<0.03 c
nr
argillolimoso
vario
sabbia
di lago
sabbia
di lago
sabbia
di lago
sabbia
di lago
agricolo
PCB
PCB
fango
PCB fango
PCB
nr
0.013
nr
0.026
0.01 - 0.11
2.0
agricolo
PCB
carote /
agricolo
radice
carote /
acido
pianta
carote/
acido
pianta
ravanello/
acido
pianta
ravanello /
sabbia
radice
nera
ravanello/
acido
pianta
barbabietola agricolo
da zucchero
/pianta
barbabietola agricolo
da zucchero/
radice
barbabietola
nero
da zucchero/
pianta
soia
sabbioso
PCB
carote/radici
radici
lattuga /
cespo
soia /pianta
avena /
pianta
mais/pianta
barbabietola/
colletto
sorgo/apice
arachide/
apice
mais/apice
carote/
radice
mais (foglie)
0.111-0.453 0.027-0.053
20
0.815
curva di
assorbimento*
0.19
Autori
d
c
0.08-0.38
0.041 d
Walllnofer et
al., '82
ibid.
ibid.
Hafner, '82
ibid.
Webber et al.,
'83
ibid.
Strek et al.,
'80
ibid.
PCB
20
0.058
0.003
d
PCB
20
0.473
0.024
c
ibid.
PCB
20
0.002
0.001 c
ibid.
PCB
100
7-16
0.16 o meno Pal et al. '80
92-144 µg/l
nel fango 0.045-0.081
<1
100
7-16
0.16 o meno
ibid.
ibid.
PCB
0.05-0.5
0
0
ibid.
PCB
5
0.081
0.16
ibid.
PCB
0.05-0.5
0
0
ibid.
PCB
0.2
0.01
0.02
ibid.
PCB
5
0.025
0.005
ibid.
PCB
0.24
0.007
0.03
ibid.
PCB
0.24
0.004
0.07
ibid.
PCB
0.3
0.01-0.15
0.01-0.5
Pal et al., '80
PCB
100.0
0.15
0.002
ibid.
segue
239
LA TOSSICITÀ D E IF A N G H ID I
Pianta/
tessuto
tipo di
suolo
soia /
argillopianta
sabbioso
festuca /
sabbioso
foglie
mais/grani
limoso
mais/paglia
limoso
patate/polpa
nr
patate/pelle
nr
sudangrass
nr
DEPURAZIONE
forma
chimica
conc.
nel suolo
( g/g s.s.)
conc. nei
tessuti
( g/g s.s.)
curva di
assorbimento*
PCB
0-3
nr
0
PCB
20.0
PCB
PCB
PCB
PCB
PCB
2.5 - 250
2.5- 250
0.38 - 0.83
0.38-0.83
0-50
Autori
Fries e
Marrow, '81
Strek e
nr
0.25 c (0.04) e
Weber, 1980
0
0
Taylor, 1983
3.22 - 12.45
0.02
ibid.
0.028
0.02 (0.05) c Naylor, 1983
c
0.04-0.061 0.01 (0.07)
ibid.
Peterson e
0.012-0.073
0.0005 c
Corey '85
Nota: *curva di assorbimento j/x dove y=concentrazione nel tessuto (peso fresco) e x=concentrazione
nel suolo (peso secco).
c)=p.f.; d)=p.s.; e)=p.s./p.s. basato su una mistura di festuca contenente il 31%.
Le sperimentazioni condotte sull’asporto dei PCB da parte delle
piante danno spesso risultati contradditori, in quanto si tratta spesso
di miscele di PCB non meglio identificate (Pal et al., 1980). Altri autori hanno osservato che non c’è relazione tra suolo e PCB nelle foglie
delle piante. L’asporto e la traslocazione dal suolo alle radici è minimo e trascurabile rispetto all’apporto atmosferico sulle foglie. L’assorbimento di PCB volatili dalla superficie del suolo e trattenuti sulla
cuticola fogliare è significativo per alcuni composti a basso peso molecolare che poi inquinano la catena alimentare (Jones, 1989).
Comunque la contaminazione della catena alimentare è possibile attraverso il foraggio (Piccolo, 1991) per cui in USA la legge stabilisce
un valore di max 10 ppm per l’uso agricolo dei fanghi.
8.6 Animali
Più serio rispetto alla contaminazione delle colture foraggere è l’inquinamento del suolo stesso, dal momento che i composti lipofili organici possono concentrarsi nel grasso animale (US EPA, 1985; Hansen and Chaney, 1984).
Sperimentazioni su PCB indicano concentrazioni di 5 volte maggiori alla dieta nel grasso del latte, che risulta di 0.7 ppm per ogni ppm di
PCB nel suolo, lo stesso si può verificare per il grasso corporeo.
240
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
Basandosi sulle tolleranze di 1.5 mg PCB/kg grasso del latte, si è arrivati alla conclusione che è accettabile una soglia di 2 mg/kg di fango secco per i PCB, se il pascolo su terreni trattati è quotidiano.
È stata osservata la contaminazione di PCB in animali alimentati con
cavoli cresciuti su terreni trattati, che ha causato degenerazioni nel fegato e nella tiroide delle pecore (US EPA, 1985) effetto non sempre rilevato all’aumentare dei PCB nella dieta (Hansen and Chaney, 1984).
I PCB come induttori microsomiali possono quindi essere esaltati, o
ridotti, attraverso il passaggio dei sistemi biologici (cfr. tabella 8.9).
D’altra parte alcune crucifere, quali cavolo e cavolfiore, hanno mostrato di indurre ossidasi e incrementi relativi del peso del fegato in
dosi di dieta minori di quelle prima descritte (Hansen and Chaney,
1984). Il basso livello di PCB sia nel controllo, che nella razione trattata, per pecora e maiale era sufficiente per l’induzione di alcuni enzimi microsomiali (tabella 8.9), ma altri fattori sembrano giocare un
ruolo predominante.
Il fatto è difficile da attribuire a specifici composti, dato che il cavolo era cresciuto su un cumulo di fango di 1.2 m (Hansen and Chaney,
1984).
Nella tabella 8.10 infine sono riportate le quantità di PCB asportate
da animali diversi.
241
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
trattamento
PCB
(ppm)
Aroclor 1254
Aroclor 1254
45% cavolo
45% CF f c a v o l o
30% cavolo
0 . 0 0 3 pollo fegato
0 . 0 7 4 pollo fegato
0 . 0 8 1 GP intest.
0 . 2 0 2 GP. intest.
0.227
pecora,
fegato
0.445
pecora,
fegato
0 . 5 6 pollo, fegato
8 . 0 2 pollo, fegato
20.0
pecora,
fegato
n d ratto, fegato
30% CF f c a v o l o
Aroclor 1254
Aroclor 1254
Aroclor 1254
10% cavolfiore
foglie
25% cavolfiore
foglie
45% FF f l a t t u g a g
45% FF f l a t t u g a h
79% FF f m a i s
FF f mais-soia,
8 settimane
F F f mais-soia,
80 settimane
Sint. dieta, lettiera
filtri carta
Sint. dieta, lettiera
filtri d'abete
Com.dieta, filtri
carta
Com. dieta, filtri
d'abete
Specie,
tessuto
pNPE
b
% di controllo a
AHC c
peso del
fegato
con d
100
nd
nd
nd
con
237
con
229*
nd
con
98
nd
nd
con
nd
nd
129
122*
181*
160
1389*
11263*
nd
104
110
115
120*
nd
119*
nd
ratto, fegato
140*
nd
121*
nd
nd
nd
topo, fegato
topo, fegato
maiale,
fegato
pollo, fegato
95
136*
58*
nd
nd
nd
nd
107
110
107
nd
114
102
nd
108
nd
gallina,
fegato
topo, fegato
con
nd
con
nd
topo, fegato
375*
nd
110
nd
topo, fegato
200*
nd
114
nd
topo, fegato
238*
nd
114*
nd
nd
a) I dati con* indicano percentuali calcolate da diversi dati significativi (p<.05)
b) 0-dealchilazione di p-nitrofenil- eteri (pNPE) p-nitrofenetolo o p-nitro-anisolo.
c) etossiresorufina per il pollo e benzo-a-pirene per i maiali
d) i controlli sperimentali per dieta, Cd, PCB ecc., variavano così tanto da non poter essere considerati
del tutto validi ; e) non determinato; f ) CF = cresciuto sul fango, FF = concimato col fango
g ) 2.5 ppm Cd, 307 ppm Zn; N demetilasi era 88% del controllo
h ) 26.4 ppm Cd, 187 ppm Zn; N- demetilasi era 134% del controllo e significativamente più alto di g
Tabella 8.9 - Influenza della dieta, in relazione all'impiego dei fanghi in
agricoltura, alle piante coltivate e ai PCB contenuti nei fanghi, sui fattori
legati all'attività di monoossigenasi microsomiali (da Hansen and Chaney, 1984).
242
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
specie
bestiame
vacca
Formula
chimica
tessuto
analizzato
PCB
grasso del
latte
Aroclor 1254
grasso
corporeo
grasso del
latte
Araclor 1254 grasso del
latte
grasso
corporeo
conc.
conc.
nell'alinei tessuti
mentazione
testati
( g/g p.s.) ( g/g p.s.)
curva
di assorbimento *
Autori
Connor, '84
nr
nr
4.5-4.9
nr
nr
3.5-5.5
12.4
60.9
4.9
0.87
0.43
0.22
12.4
3.7
1.8
1.0
56.6-70.6
(m.g. = 58.3)
25.3-60.2
(m.g.. 40.1)
4.3
4.2
4.5
4.7 a
12.4
Fries, '82
Fries et al.,
'73
3 . 2a
Nota:.*)
curva di assorbimento y/x dove y= concentrazione nel tessuto animale e x= concentrazione negli alimenti.
nr =non rilevato, a= basato sulla media delle concentrazioni nel tessuto testato; m.g.= media geometrica.
Tabella 8.10 - Assorbimento di PCB da parte di animali domestici e non
(da US EPA, 1986).
Conclusioni
Da quando sono stati individuati i primi effetti ambientali negativi
causati dai PCB (policlurarati bifenili) ne è stata bandita la produzione (1972), ma la stabilità di questi composti è tale che i livelli ambientali non diminuiranno per molti decenni. In ogni caso la complessità
delle miscele di PCB, data la presenza di numerosi isomeri, crea diversi problemi di identificazione e formulazione di ipotesi di degradazione degli stessi.
Il contenuto in PCB dei suoli varia da 1 a 10 ppb, (dovuto in parte alle deposizioni atmosferiche) e può aumentare nelle regioni a carattere industriale o in vicinanza di siti di smaltimento dei rifiuti. Nei fanghi i valori dei PCB si attestano intorno a 0.1-10 ppm (da acque reflue
contenenti 1-30 ppb).
La caratteristica negativa di questi composti è la grande resistenza
alla degradazione. Scarso è anche il leaching, in quanto la lipofilia dei
PCB determina un forte adsorbimento al suolo. Le indagini riguardo
243
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
ad una possibile contaminazione della catena alimentare hanno dato
spesso risultati contradditori a causa della difficoltà di identificazione
delle miscele dei PCB. È stata osservata una elevata ritenzione radicale e un possibile assorbimento fogliare, trascurabili invece sono l’assorbimento e la traslocazione (eccetto Araclor 1016).
In merito al possibile asporto da parte degli animali ed ai conseguenti rischi di contaminazione attraverso l’ingestione diretta del terreno i più tossici risultano Araclor 1232, 1248 e 1260.
La capacità di questi composti lipofili di concentrarsi nel grasso animale ha imposto dei limiti all’utilizzo dei fanghi: basandosi sulle tolleranze di 1.5 mg di PCB per kg di grasso del latte, si è arrivati ad accettare una soglia di 2 mg/kg di fango secco per i PCB, se il pascolo su
terreni trattati non è quotidiano.
Altro meccanismo importante di rimozione del suolo è la volatilizzazione. La volatilità è maggiore per le molecole di bifenile con 4 o
meno atomi di C, responsabili dell’inquinamento della catena alimentare attraverso l’assorbimento fogliare, anche se il più alto contenuto in PCB nei fanghi è rappresentato da composti con più di 4 Cl fino a 8 (Witte, 1989). L’inquinamento del foraggio e la contaminazione
alimentare sono comunque possibili quindi, in USA, la legge stabilisce un valore massimo di 10 ppm per l’uso agricolo dei fanghi.
244
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
Bibliografia
AHMED A.E., FOCHT D.D., (1973):
Degradation of polychlorinated biphenyls
by two species of Achromobacter. Can. J.
Microbiol., 19, 47-52.
ANA B. PAYA-PEREZ, RIAZ M., LARSEN B.R. , (1991): Soil sorption of 20 PCB
congeners and six Chlorobenzenes. Eco toxicology and environmetal safety, 21, 117 .
BAKER E.L. JR, LANDRIGAN P.J.,
GLUECK C.J., ZACK JR. M. M., LIDDLE J. A., BURSE V. W., JERE HOUSWORTH W. , NEEDHAM L.L., (1980):
Metabolic consequences of exoposure to
PCB in sewage sludge. American J. of Epi demiology, 112, n.4, 553-563.
phenyls by eight bacterial strains, Microb.
Ecol., 20, 87-102.
BEDARD D.L., HABERL M.L., MAY
R.J., BRENNAN M.J., (1987): Evidence
for novel mechanism of polychlorinated
biphenyl metabolism in Alcaligenes eutrophus H850. Appl. Environ. Microbiol.,
53, 1103-1112.
B E R G H A. K., PEOPLES R.S., (1977):
PCB distribution in sewage wastes and
their environmental and community ef fects. p.4-6. Proc. of the National Conf.
on treatment and disposal of Industrial
Wastewaters and Residues, Houston,
TX.
BALZER W., PLUSCHKE P., (1994): Se condary formation of PCDD/F during the
thermal stabilization of sewage sludge. Che mosphere, 29, n. 9-11, 1889-1902.
BROWN J.F., BEDARD D.L., BRENNAN M.J., CARNAHAN J.C., FENG
H.,WAGNER R.E., (1987): Polychlorina ted biphenyl dechlorination in aquatic sedi ments. Science 236, 709-712.
BEDARD D.L., HABERL M.L., (1990):
Influence of chlorine substitution pattern
on the degradation of polychlorinated bi -
BRUNNER W., SUTHERAND F.H.,
FOCHT D.D., (1985): Enhanced biode gradation in soil by analog enrichment and
245
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
bacterial inoculation. J. Envir. Qual., 14,
324-328.
BUCKLEY E.H., (1987): PCBs in the At mosphere and their accumulation in foliage
and Crops. In: Recent Advances Pyto chem., 21, Phytochemical effects of Envi ronmental Compounds, J.A. Saunders,
Lynn Kosak-Channing and E.E.Conn,
Eds., Plenum Publishing Corporation.
BURGERMEISTER G., AMMAN P.,
TARRADELLAS J., (1980): PCB dans les
boues de quelques stations d'epuration de
S u i s s e. In: Characterization, Treatment
and Use of Sewage Sludge Proceeedings
of the Second European Symposium
held in Vienna, Oct. 21-23, 1980 D.Reidel Publishing Company.
BUSH B., BARNARD E.L., (1982): De termination of nonpolar chlorinated hydro carbons and PCB in microsamples. Anal.
Lett., 15 (A20), 1643.
CHANG A.C., PAGE A.L., (1990): Longterm environmental effects associated with
land application of municipal sludges: A re v i e w. Presented at 1989 International
Symposium on Solid/Liquid Separation: Waste Management and Productivity
Enhancement, Dec 1989. Publ. by: Battelle Press, 505 King Av. Columbus, Oh
43201 (USA), 1990, 439-454.
DI TORO D.M., JERLS J.S., CLARCLA
D., (1985): Diffusion and partitioning of
hexachlorobiphenyl in sediments. Envi ron. Sci Technol., 19, 1169-1176.
EDULIJEE G.H., K.S. BADSHA, K.J.
MUNDY, ( 1987): PCB concentrations in
soil from central and southern Wales. Che mosphere, 16, n.7, 1583-1598.
EDULJIEE G., (1987): Volatility of
TCDD and PCB from soil. Chemosphere,
16 (4) 907-920.
EMMRICH M., NEUMANN H.,
BOETTCHER C., PETERS M., RUED E N H., (1988): The behaviour of PCB
in wastewater treatment plants. I. Communication: Calculation in a model
plant. Pollution Abstracts, 20, n.4, 8905229P.
EMMRICH M., NEUMANN H., RUEDEN H., (1988): The behaviour of PCB in
wastewater treatment plants. II. Communication: Calculation in a municipal sewa ge treatment plant. Pollution Abstracts 20,
n.4, 89-05232P.
FAIRBANKS B.C., O'CONNOR G.A.,
SMITH S.E., (1987): Mineralization and
volatilization of PCB in sludge-amended
soils. J. Environ. Qual., 16, n.1, 18-24.
CREASER C.S., FERNANDES A.R., S.J.
HARRAD, HURST T ., ( 1 9 8 9 ): B a c k ground levels of PCB in British soils.II.
Chemosphere, 19, n.8/9, 1457-1466.
FAVA F., MARCHETTI L., (l991): De gradation and mineralization of 3-chloro biphenyl by a mixed aerobic bacterial cul ture. Appl.Microbiol.Biotechnol. 36, 240245.
DI TORO D.M., HORZEMPA L.M.,
(1982): Reversible and resistant components
of PCB adsorption-desorption: Isotherms.
Environ. Sci. Technol., 16, 594-602.
FOCHT D.D., BRUNNER W., (1985):
Kinetics of biphenyl and polychlorinated
biphenyl matabolism in soil. Appl. Envi ron. Microbiol., 50, 1058-1063.
246
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
FRIES, G.F., MARROW G . S ., ( 1 9 8 1 ):
Chlorobiphenyl Movement from soil to
Soybean plants. J. Agric. Food Chem., 29,
757-759.
FUJIWARA K., (1975): E n v i r o n m e n t a l
and food contamination with PCB's in Ja pan. Sci. Total Environ., 4, 219-247.
FURUKAWA K., C H A K R A B A R T Y
A.M., (1982): Involvement of plasmids in
total degradation of chlorinated biphenils.
Appl. Environ. Microbiol., 44, 619-626.
FURUKAWA K., TONOMURA K.,
KAMILAYASHI A., (1978): Effect of
chlorine substitution on the biodegradabi lity of poychorinated biphenyls. Appl. En viron. Microbiol., 35, 223-227.
GENEVINI P.L., ZACCHEO P., MASTRETTA M., (1989): Presenza di inqui nanti organici ed inorganici nel compost.
Da Simposio Internazionale Produzione ed impiego del compost. S. Michele
all'Adige 20-23 giu.
GENEVINI P.L., VISMARA L., MEZZANOTTE V., (1986): Utilizzo agricolo
dei fanghi di depurazione. Ingegneria Am bientale, n.5, 134.
GUTENMANN H.W., RUTZKE M.,
KUNTZ H.T., LISK D. J, (1 9 9 4 ): E l e ments and PCB in sewage sludges of large
cities in the United States. Chemosphere,
28, n.4, 725-728.
HANSEN L.G., CHANEY L.R., (1984):
Environmental and food effects of the agri cultural use of sewage sludges. Reviews in
Environ. Toxicol. , 1, 103-171.
HAVEL J., REINEKE W., (1992): Degra -
dation of Aroclor 1221 and survival of
strains in soil microcosms. Appl. Micro biol. Biotechnol. 38, 129-134.
HAVEL J., REINEKE W., (1993): Degra dation of Aroclor 1221 in soil by a hybrid
Pseudomonas. FEMS Microbiol. Lett.
108, 211-218.
HAVEL.J., REINEKE W., (l991): T o t a l
degradation of various chlorobiphenyls by
cocultures and in vivo constructed hybrid
Pseudomonas. FEMS Microbiol. Lett.,
78, 163-170.
HICKEY W.J., SEARLES D.B., FOCHT
D.D., (1993): Enhanced mineralization of
polichlorinated biphenyls in soil inocula ted with chlorobenzoate-degrading bacte ria. Appl. Environ. Microbiol., 59, 11941200.
IWATA U., GUNTHER F . A ., (1 9 7 6 ) :
Traslocation of the PCB Araclor 1254 from
soil into carrots under field conditions. Ar ch. Environ. Contam. Toxicol., 4, 44-59.
JONES K.C., (1989): PCB in Welsh soils:
a survey of typical levels. Chemosphere, 18,
n. 7-8, 1665-1672.
KAMPE W., (1989): Organic substances
in soils and plants after intensive applica tions of sewage sludge. In: Organic conta minants in wastewater, sludge and sedi ment, by Comm. of the Europ. Commun. edited by D. Quaghebeur, I. Temmerman and G.Angeletti. Elsevier Applied Science.
KIMBARA K., HASHIMOTO T.,
FUKUDA M., KOANA T., TAKAGI
M., OISHI M., YANO K., (1988): Isola tion and characterization of a mixed cultu -
247
TOSSICITÀ D E IC O M P O S T IO R G A N I C I
XENOBIOTICI
PRESENTI N E IF A N G H ID I DEPURAZIONE
re that degrades polychlorinated biphenyls,
Agric. Biol. Chem., 52, 2885-2891.
KIMBROUGH R.D., (1980): E n v i r o n mental pollution of air, water and soil. In:
Halogenated biphenyls, terphenyls,
naphthalenes, dibenzodioxins and related
products.Elsevier/ North-Holland Biomedical Press.
KONG H.Y., SAYLER G.S., (1983):
Degradation and total mineralization of
monohalogenated biphenyls in natural
sediment and mixed microbial culture.
Appl. Environ. Microbiol., 46, 666672.
KONIG W., WITTKOTTER U., HEMBROCK A., (1987): Contents of inorganic
and organic pollutants in soils and plants
in the Berrenrath organic matter enrich ment trial after long-term manuring with
sewage sludge and refuse/sewage sudge
compost. Soils and Fertilizers, 52, n. 8,
9339.
LANA SHANE A., BUSH B ., ( 1 9 8 9 ):
Accumulation of PCB congeners and p,p'DDE at Environmental Concentrations by
corn and beans. Ecotoxicology and Envi ron. Safety, 17, 38-46.
LAWRENCE J., TOSINE H.M., (1977):
PCB concentration in sewage and sludge of
some Waste Treatment Plants in Southern
Ontario. Bull. Environ. Contam. Toxicol. ,
17, 49.
LEOINE F., MILOT S., VINCENT N . ,
(1992): Formation of toxic PCB congeners
and PCB-solvent adducts in a sunlight ir radiated cyclohesane solution of Aroclor
1254. Bull. Environ. Contam. Toxicol., 48,
152-156 .
248
LESTER S.N., (1989): Presence of organic
micropollutants in sewage sludges. Proces sing Use of sewage sludge. Proceeding of
the third Int. Symp. Brighton, Sept. 27-30.
MACKAY D., MASCARENMAS R.,
SHIU W.Y., (1980): Aqueous solubility of
PCBs. Chemosphere, 9, 257-264.
MARCOMINI A., CAPEL P.D., LICHTENSTEIGER TH., BRUNNER P.H.,
GIGER W., (1989): Fate of organic pollu tants in sludge amended soil and sludgeonly landfills: LAS, NP and PCB. In: Or ganic contaminants in wastewater, sludge
and sediment by Comm. of the Europ.
Commun. edited by D. Quaghebeur, I.
Temmerman and G.Angeletti. Elsevier
Applied Science.
MASSÈ R., MESSIER F., PELOQUIN
L., AYOTTE C., SYLVESTRE M . ,
(1984): Microbial biodegradation of 4-chlo robiphenyl, a model compound of chlorina ted biphenyls. Appl. Environ. Microbiol.,
47, 947-951.
MAVOUNGOU R., MASSÈ R., SYLVESTRE M., (l991): Microbial dehalogena tion of 4,4’-dichorobiphenyl under anaero bic conditions. Sci. Total Environ., 1 0 1 ,
263-268.
MOKROSS H., SCHMIDT E., REINEKE W., (1990): Degradation of 3-chlo robiphenyl by in vivo constructed hybrid
Pseudomonas. FEMS Microbiol. Lett.,
71, 179-186.
M O N T G O M E R Y L., VOGEL T . M . ,
(1992): Dechlorination of 2,3,5,6-tetrach lorobiphenyl by a phototrophic enrichment
culture. FEMS Microbiology Letters., 94,
247-250.
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
MOZA P., WEISBERGER I., KLEIN W.,
(1976): Fate of 2,2'Dichloropheyl 1 4C in
Carrots, Sugar Beets and Soil under out door conditions. J. Agric. Food Chem., 24,
881.
NAKANISHI H., SHIYOUICHI N.,
MSAO T., SHIGA-KENRITSU EISEI
KENKYUSHO HO, (1974): Chem. Ab stract, 91, 187516S.
OPPERHUIZEN A., (1987): Relationshi
ps between octanol/ water partition coeffi
cients, aqueous activity coefficients and re
verse phase HPLC capacity factors of alkyl
benzenes, chlorobenzenes, chloronaphatha
lenes and chlorobiphenyl. Toxicol. Envi
ron. Chem., 15, 249-264.
-
OPPERHUIZEN A., GOBAS F.A, VAN
DER STEEN M.D., HUTZINGER O . ,
(1988): Aqueous solubility of PCBs related
to molecular structure. Environ. Sci. Tech nol., 22, 638-646.
PAL D., WEBER J.B., OVERCASH M.R.,
(1980): Fate of polychlorinated biphenyls in
soil-plant systems.Residue Rev., 74, 45-98.
PARSONS J., VEERKAMP W.,
(1983): Microbial metabolism of cloro biphenyls. Toxicol. Environ. Chem., 6 ,
327- 350.
PARSONS J.R., SIJM D.T.H.M., VAN
LAAR A., HUTZINGERO., (1988): Bio degradation of chorinated biphenyls and
benzoic acids by a Pseudomonas species,
Appl. Microbiol. Biotechnol., 29, 82-84.
PICCOLO A., (1991): Contenuto e dina mica nel suolo di composti xenobiotici ap plicati con fanghi e compost. In: Riciclo di
biomasse di rifiuto e di scarto e fertilizza -
zione organica del suolo. Patron Editore,
279-286.
QIUPING YE, PURI R.K., KAPILA S.,
LOWER W.R., YANDERS A.F., (1991):
Studies on uptake of PCBs by Hordeum
Vulgare (Barley) and L y c o p e r s i c o n
esculentum (Tomato). Chemosphere, 23,
n. 8-10, 1397-1406.
QUENSEN III J.F., BOYD S.A., TIEDIE
J.M., (1990): Dechlorination of four com mercial plychlorinated biphenyl mixtures
(Aroclors) by anaerobic microorganisms
from sediments. Appl. Environ. Micro biol., 56, 2360-2369.
SAWHNEY B.L., HANKIN L., (1984):
Plant contamination by PCBs from amen ded soils. J Food Prot., 47, 232.
SHIELDS M.S., HOOPER S.W., SAYLER G.S., (1985): Plasmid-mediated mi neralization of 4-chorobiphenyl. J. Bacte riol., 163, 882-889.
SJOQUIST T., (1989): Trends in heavy
metal; PCB and DDT contents of sludges
in Sweden. In: Utilisation of sewage slud ge on land: Rates of application and long term effects o metals, Proc. of a seminar
held at Uppsala june 7-9, 1983 D. Reidel Pub. Company p.194.
SKAREW D.S., GIRVIN D.C., (1987):
Attenuation of polychorinated biphenyls in
soils. Rev. Contam. Toxicol., 981-41.
SONDOSSI M., SYLVESTRE M., AHMED D., (1992): Effect of chlorobenzoate
transformation on the Pseudomonas tes t o s t e r o n i biphenyl and chlorobiphenyl
degradation pathways.Appl. Environ. Mi crobiol., 58, 485-495.
249
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
STREK H.J., WEBER J.B., (1982): Beha viour of polychlorinated biphenyls (PCBs)
in soils and plants. Environ. Pollut. Ser. A
28, 291.
SUZUKI M. , AIZAWA N ., OKANO
G., TAKAHASHI T., (1977): Transloca tion of PCB in soil into plants: a study by a
method of culture of soybean sprouts. Ar ch. Environ. Contam. Toxicol., 5, 343.
SYLVESTRE M., MASSÈ R., AYOTTE
C., MESSIER F., FAUTEUX J., (1985):
Total biodegradation of 4-chlorobiphenyl (4CB) by a two membered bacterial culture.
Appl. Microbiol. Biotecnol., 21, 192-195.
TARRADELLAS J., MUNTAU H., LESCHBER R., (1989): Interlaboratory com parisons on the determination of PCBs as a
model cas for organic substances in slud g e s. In: Organic contaminants in wa stewater, sludge and sediment , by Comm.
of the Europ. Commun. edited by D.
Quaghebeur, I. Temmerman and
G.Angeletti. Elsevier Applied Science.
THOMAS W., RHULING A., SIMON
H., (1984): Accumulation of airborne pollu tants (PAH, chlorinated hydrocarbons,
heavy metals) in various plant species and
humus. Environ. Pollut. Ser. A. 36, 295.
THOMAS W., SIMON H., (1985): Clas sification of plant species by their organic
(PAH, PCB, BHC) and inorganic (heavy
metals) trace pollutant concentrations. Sci.
Total Environ., 46, 83.
UMLAUF G., HAUK H., REISSINGER
M., (1994): The distribution of semivolati le organic compounds in conifer n e e d l e s
following gas phase contamination. Che mosphere, 28, 9, 1689-1699.
250
US EPA, (sept.1985): Health effects of
land application of municipal sludge. EPA.
US EPA, (1986): Land application and di stribution and marketing of sewage sludge.
Technical Support Document.
VALLS M., FERNANDEZ P., BAYONA J. M., ALBAIGÉS J ., (1 9 8 9 ): B r o a d
spectrum analysis of organic contaminants
in urban wastewaters and coastal receiving
systems. In: Organic contaminants in wa stewater, sludge and sediment , by Comm.
of the Europ. Comm. edited by D. Quaghebeur, I. Temmerman and G.Angeletti. Elsevier Applied Science. pp. 1933.
WALLNOFER P.R., ENGELHARDT
G., SAFE S., HUTZINGER O ., (1 9 7 3 ):
Microbial Hydroxylation of 4-chloro biphenyl and 4,4'- dichlorobiphenyl. Che mosphere, 2, 69.
WALLNOFER P.R., KONIGER M.,
ENGERLHARDT G., (1975): The beha viour of xenobiotic chlorinated hydrocar bons (HCB 6 PCBs) in cultivated plants
and soil. Z. Pflanz Pflanzenschutz, 8 2 ,
91.
WEBER J.B., MROZEK Jr. E., (1979):
PCBs - Phytotoxicity, Absorption and tra slocation by plants and inactivation by
inactivated carbon. Bull. Environ. Con tam. Toxicol., 23, 412.
WEISS P., RISS A., GSCHMEIDLER E.,
SCHENTZ H., (1994): Investigation of
heavy metal, PAH, PCB patterns and
PCDD/F profiles of soil samples from an
industrialized urban area (Linz, upper Au stria) with multivariate statistical
methods. Chemosphere, 29, 9-11, 2223.
Capitolo 8 BIFENILIPOLICLORURATI (PCB)
WENTZ J.A., TAYLOR M.T., GALLAGHER W.E., CHAN D.B., ROGERS C.
J., (1989): Results of a field test of an Apeg
reactor for chemically degrading PCB's in
contaminated soil. Presented at 82th. Annual Meeting of the Air and Waste management Association, Anaheim, CA
(USA), 25-30 Jun 1989, p.105.
entry of selected organic pollutants into
soils and plants by use of sewage sludge in
agricolture. In: Organic contaminants in
wastewater, sludge and sediment, by
Comm. of the Europ. Commun. edited
by D. Quaghebeur, I. Temmerman
and G.Angeletti. Elsevier Applied
Science.
WINTERS S.L., LEE, D.R., (1987): In si tu retardation of trace organics in
groundwater discharge to a sand stream
bed. Environ. Sci. Technol., 21, 1182.
YE D., QUENSEN III J.F., TIEDJIE J.M.,
BOYD S.A., (1992): Anaerobic dechorina tion of polychorobiphenyls (Aroclor 1242)
by pasteurized and ethano-treated microor ganisms from sediments. Appl. Environ.
Microbiol., 58, 1110-1114.
WITTE H., (1989): Investigations of the
251
Capitolo 9
Pesticidi
LA TOSSICITÀ D E IF A N G H ID I
I
DEPURAZIONE
pesticidi sono utilizzati nel settore agricolo per la difesa e la conservazione delle derrate alimentari, nel campo della sanità pubblica per la lotta contro gli insetti vettori di malattie, per la difesa dei manufatti più diversi, ecc.
Gli alimenti di consumo possono contenere residui di queste sostanze, anche per fenomeni di contaminazione indiretta, quali l’uso
di acque di scarico per irrigazioni (anche se esiste la regolamentazione della legge Merli n. 915 del 1982) o l’applicazione dei fanghi in
agricoltura derivanti sia da reflui industriali che domestici.
Sul comportamento dei pesticidi nel suolo sono state condotte numerose ricerche soprattutto sulla affinità delle diverse componenti
del suolo per i pesticidi. L’assorbimento dei pesticidi organici tende
ad aumentare con la concentrazione dei gruppi funzionali tipo ammine, ammidi, carbossili, fenoli.
Sia sperimentazioni in campo, che in laboratorio, hanno mostrato
che a causa dell’adsorbimento sulle particelle del suolo, la maggior
parte dei residui rimane in superficie durante i trattamenti al terreno
(US EPA, 1985).
Tuttavia, in genere, è difficile rilevare elevate concentrazioni di pesticidi nei fanghi impiegati in agricoltura; può accadere, talvolta, per
alcuni insetticidi ed erbicidi organo-clorurati molto persistenti, il cui
passato impiego ha fatto sì che si debbano ormai considerare degli inquinanti ubiquitari. Per gli erbicidi clorurati, comunque, si raggiungono difficilmente dei valori pericolosi, data l’elevata solubilità degli
stessi, specialmente se poco clorurati. In ogni caso da tempo prevale
l’impiego di nuovi composti ampiamente degradabili (solfofeniluree,
ecc.) che è molto improbabile ritrovare dei fanghi.
Inoltre, le concentrazioni di alcuni erbicidi ed insetticidi cloroderivati sono andate diminuendo con il calo della produzione verificatosi a partire dal ’70, (conseguente ai limiti di legge) come dieldrin e
lindano, DDT (Sjoquist, 1989), e più recentemente atrazina; quindi il
DDE e il DDT derivano quasi certamente da fonti domestiche piuttosto che da processi industriali (Genevini et al.,1986).
Per le motivazioni addotte anche lo studio della degradazione microbica presentato in questo capitolo, fondamentale per accertare la
persistenza e prevedere l’impatto ambientale di questi composti, tratterà in modo approfondito solo alcuni pesticidi, prevalentemente di
origine domestica che è più probabile rilevare nei fanghi.
254
Capitolo 9 P ESTICIDI
9.1 Suoli
In suoli non trattati sono state rilevate quantità di Dieldrin e HCB
pari a 0.01 e 0.04 ppm s.s, mentre DDT era pari a 0.03 e 0.09 ppm.
Dopo l’applicazione del fango i valori differivano pochissimo dai
controlli, i fattori di accumulo riscontrati erano di 1 (non c’è accumulo) per Dieldrin e HCB e di 2 per DDT (Kampe, 1989). Dieldrin e HCB
erano in media 1/10 e DDT 1/2 rispetto al valore Olandese di 0.1 ppm
s.s. Solo il valore massimo di DDT (0.18 ppm) eccedeva questo limite,
ma differiva dal valore richiesto (0.05 ppm) (Kampe, 1989).
9.2 Acque
Concentrazioni di pesticidi nelle acque sono riportate in tabella 9.1
(US EPA, 1985).
Composto
eptacloro
BHC-G (lindano)
BHC-D
Dieldrin
BHC-A
DDT
DDD
Aldrin
Endosulfan-B
De Walle et al. 1981
Frequenza di C o n c e n t r a z i o n e
rilevamento %
range ( g / l )
77
71
63
63
60
60
54
51
51
0.30-37.00
0.05-11.20
0.01-5.10
0.02-4.40
0.01-2.90
0.10-24.00
0.05-10.00
0.02-2.00
0.20-8.80
Burns and Roe 1982
Frequenza di C o n c e n t r a z i o n e
rilevamento %
range ( g / l )
5
26
3
1
8
<1
1
1
-
0.08-0.50
0.02-3.9
0.10-1.4
0.03-0.04
0.02-4.4
1.2
0.31-0.77
0.03-5
-
Tabella 9.1 - Alcuni dei pesticidi più frequentemente presenti
nelle acque reflue ( USEPA, 1985 ).
255
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
9.3 Fanghi
Concentrazioni comuni di pesticidi nei fanghi sono di 10 ppm, con
dosi di 2 t/ha quindi non si apporterebbe al terreno più di 20 g/ha, il
che implica una tossicità trascurabile (in accordo con la letteratura in
cui la quantità massima di pesticidi distribuibile col fango è intorno ai
20 g) (Genevini et al.1986). Nella tabella 9.2 sono riportate le concentrazioni di alcuni pesticidi nei fanghi (Genevini et al.,1986).
DDE
DDT
HCH (BHC)
Dieldrin
0.05-2.02
0.001-0.4
0.003-0.006
-
tr.- 0.93
0.025
0.21
0.41
0.01-0.2
0.03-3.9
0.3-2.2
tr.- 1.26
0.018
0.28
0.50
0.01
Clordano
3-30
Tabella 9.2 - Concentrazioni di pesticidi e clorurati organici nei fanghi
secondo diversi autori (mg/kg s.s.) (Genevini et al., 1986; Lester 1989).
Concentrazioni di DDT in fanghi provenienti da 31 impianti svedesi
(analizzati tra il 1976 e il 1981) sono riportate in figura 1 (Sjoquist, 1989).
Un elevato livello di HCH è stato trovato in fanghi provenienti da
impianti vicini ad industrie della lana e del cuoio (Fieggen, 1981),
sempre il HCH e il DDT sono stati trovati nei fanghi di risulta di impianti di trattamento delle acque di scarico e dei depuratori (Epstein
et al., 1978; Leoni and Grella, 1980).
9.4 Degradazione
La persistenza ambientale dei composti organici in generale, e dei
pesticidi in particolare, è sempre di difficile valutazione.
È interessante in questa sede considerare 2 classi di fitofarmaci: erbicidi ed insetticidi organo-clorurati. Un discorso a parte meritano
poi insetticidi fosforganici e carbammati.
256
Capitolo 9 P ESTICIDI
Figura 1 - Concentrazioni di DDT nei fanghi ( Sioquist, 1989).
Erbicidi
Gli erbicidi clorurati risultano meno persistenti degli insetticidi organo-clorurati in quanto la maggior parte si degrada rapidamente nel
suolo (in ordine decrescente: cianazina, simazina, atrazina, prometrina), sebbene alcuni possano persistere per più di un anno (Edward,
1975; Tremolada et al., 1992; Gustafson, 1989; Pelizzetti et al., 1990).
257
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Gli erbicidi clorurati comunque sono sempre meno impiegati e sostituiti da nuove classi di composti (solfoniluree, ecc.) caratterizzati
da una spiccata degradabilità e scarsa persistenza (emivita anche di
pochi giorni), quindi difficilmente ritrovabili nei fanghi.
Per altri composti quali le dicloroaniline, risulta evidenziata la maggior resistenza della 3,4 dicloroanilina (Tremolada et al., 1992) anche
rispetto al linuron (da 3-5 fino 12 mesi), (Elefterohorinos and Koutula, 1991) e al propanil. La dinitramina persiste nel suolo per meno di 3
mesi (Elefterhohorinos and Koutula, 1991) mentre altri autori riportano da 5,6 a 8 mesi dopo l’applicazione.
Insetticidi organoclorurati
Gli insetticidi organo-clorurati (DDT, HCH, lindano, endosulfan,
clordano, eptacloro, aldrin , dieldrin, ecc.), invece, sono molecole altamente stabili, ovvero poco degradabili; vengono difatti adsorbiti su
particelle solide e, dato l’elevato peso molecolare, tendono ad accumularsi nei fanghi.
I tempi di dimezzamento della loro concentrazione vanno da una
settimana a diversi anni. E’ stato osservato che insetticidi clorurati (aldrin, DDT, dieldrin, endrin, lindano) aggiunti al terreno agricolo in
quantità di 1.1-3.4 kg/ha (Baldi et al., 1991) hanno tempi di trasformazione e di scomparsa del 95% molto elevati (da 3 anni per aldrin a
8-10 per dieldrin e DDT).
L’impiego del DDT è ormai abbandonato in Italia da una ventina
d’anni, i decreti ministeriali che vietano la maggior parte di questi insetticidi sono in vigore dagli anni ’70, ma i suoi metaboliti (DDE, DDD
e DDMU) vengono ritrovati comunque a livello di ecosistema.
Il DDT (il DDE è ancora più stabile del DDT, Tremolada et al., 1992)
in condizioni ossidative aerobiche ha un tempo di dimezzamento di
più di un anno, mentre in anaerobiosi la velocità degradativa è maggiore. Comportamento analogo caratterizza il lindano (γ −HCH), il
pentacloronitrobenzene, l’esaclorobenzene, gli erbicidi fenossiacetici
(Piccolo, 1991).
Durante la produzione dell’HCH si formano i diversi isomeri (α, β,
γ, δ), sulla degradabilità dei quali sono stati effettuati diversi studi che
riportano la totale scomparsa a basse concentrazioni (15 ppm) in 50
giorni a 27-30°C in condizioni anaerobiche (più rapida degradazione
di α e γ, rispetto a β e δ) (Doelman et al., 1988). Anche in condizioni aerobiche è stata osservata la degradazione di α−HCH ad alte concentrazioni (5300 ppm) (Doelman et al., 1985).
258
Capitolo 9 P ESTICIDI
Il β-BHCH (β-esaclorocicloesano), dopo 23 settimane diminuiva da
400 ppm a 120 (Doelman et al.,1990). La degradazione microbica è
principalmente dovuta a Clostridium, ma anche a Bacillus e Pseudomo nas (Doelman et al.,1990).
Da altre sperimentazioni si è visto che Pseudomonas paucimobilis è in
grado di deidroclorurare γ−BHC (γ-esaclorocicloesano) a 1, 2, 3, 4, 5, 6γ−PCCH (pentaclorocicloesene) utilizzandolo come unica fonte di carbonio (Imai et al.1989). La degradazione batterica di Lindano e 2,4 D è
testimoniata anche in reattori aerobici (McTerman and Pereira , 1991).
La biodegradazione aerobica dei pesticidi organo-clorurati è senza
dubbio il più comune processo degradativo ambientale ed è stata indagata da numerosi ricercatori. Al contrario, i processi di biodegradazione anaerobici non sono stati molto approfonditi. In Giappone
sono state individuate le costanti di biodegradazione aerobica e
anaerobica di 10 pesticidi clorurati e le emivite risultavano nel range
di 0.4-50 gg la prima, e tra 1.5h e 100 gg per la biodegradazione anaerobica.
La biodegradazione era influenzata da idrofobia e presenza di gruppi funzionali facilmente attaccabili dai microrganismi, cfr. tabella 9.3
(Kawamoto and Urano, 1990).
Kow
Koc
k
Kb 1 / g c o s t .
( g/g)1-1/n ( g/g)1-1/n
di
degrad.
aerob.
t 1/2
(gg)
Ka b1/g cost.
di
degrad.
anaerob.
t 1/2
(gg)
non
degrad.*
1.5
1.7
0.015
0.055
0.16
nd
0.20
0.25
non
degrad.*
-
Tiobencarb
9.55 x10 3
5.0 x10 3
0
0.057
12
Clorpicrin
Clorothalonil
Clornitrofen
Fenvalerate
Quintozene
Triclorfon
Diclorvos
Tetracloroftalide
DCIP
1.08
4.37 x10 2
9.33 x10 4
1.78 x10 6
1.51 x10 5
5.75
1.45
1.23 x10 3
3.02 x10 2
81
1.8 x 10 3
3.5 x 10 4
2.0 x 10 4
79
47
2.0 x 10 3
47
0
20
0
30
0
0
80
0
1.5
1.7
0.015
0.055
0.16
0.28
0.20
0.25
non
degrad.*
0.46
0.41
46
13
4.3
2.5
3.5
2.8
0.46
0.41
46
13
4.3
nd
3.5
2.8
-
* non degradabile
Tabella 9.3 - Correlazione tra le proprietà chimico-fisiche di 10
pesticidi e la loro biodegradabilità (Kawamoto and Urano, 1989 e1990).
259
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Figura 2 -Relazione tra contenuto in C.O. del suolo e isoterme
d'assorbimento (valori di k) (Kawamoto and Urano, 1989)
260
Capitolo 9 P ESTICIDI
Dei suddetti 10 pesticidi clorurati è stato anche studiato l’adsorbimento sui colloidi attraverso le isoterme di assorbimento (crf. figura 2,
Kawamoto and Urano, 1989).
La costante di adsorbimento per grammo di carbonio organico nel
suolo era nel range di 10-10 4, correlata col Kow (cfr.tabella 9.3 sopra riportata, Kawamoto and Urano, 1989).
Nel caso dell’esaclorobenzene (Kampe and Leschber, 1989), in seguito a un esperimento ventennale di immissione di fanghi nel terreno, si è osservato che, sebbene queste molecole fossero presenti nei
suoli trattati, non si verificavano fenomeni di accumulo, probabilmente non a causa della biodegradabilità dell’HCB, ma della sua volatilizzazione continua.
In ogni caso dalla letteratura dell’ultimo decennio si perviene alla
conclusione di utilizzare in agricoltura i fanghi o le acque reflue contenenti pesticidi a basso livello di concentrazione (Leach et al., 1980;
Leoni and Marchese, 1985).
Per dieci pesticidi (lindano, esaclorobenzene, captano, atrazina, simazina, deltametrina, clorpirifos-etile, guthion metile, bromofos e
malathion) è stata osservata biodegradazione in un impianto di depurazione a fanghi attivi. Per tempi compresi tra 3 e 9 ore, la biodegradazione è stata massima per il captano (100%) ed il malathion
(90%) e minima per il lindano (4%) e l’esaclorobenzene (14%) (cfr. ta bella 9.4, Leoni et al., 1991).
Sul comportamento degli insetticidi organoclorurati durante il condizionamento chimico e la disidratazione dei fanghi, con dei processi meccanici ed agenti condizionanti, si è osservato che DDE e lindano
erano adsorbiti sulla parte solida, mentre il dieldrin restava nel filtrato, probabilmente a causa della maggior solubilità del dieldrin rispetto a DDE, oppure per il fatto che il dieldrin è spesso formulato con
detergenti anionici e xilene per la sua solubilizzazione. HCH non mostra una tendenza simile (Lester, 1989).
Lindano, aldrin, dieldrin, eptacloro, eptacloro epossido e DDT si degradano più rapidamente in condizioni anaerobiche, con l’eccezione
di eptacloroepossido e dieldrin, particolarmente persistenti.
La degradazione è primariamente biologica ed in parte chimica. In
ogni caso, sono state studiate delle quantità (pari a 10-100 ppm) maggiori di quelle che solitamente si trovano nei fanghi (Lester, 1989).
261
LA TOSSICITÀ D E IF A N G H ID I
Principio attivo
HCB
Lindano
Captano
Deltametrina
Simazina
Atrazina
Guthion metile
Bromophos
Clorpirifos-etile
Malathion
DEPURAZIONE
tempo di contatto
col fango attivo (ore)
%
degradazione
3
6
9
3
6
9
3
6
9
3
6
9
3
6
9
3
6
9
3
6
9
3
6
9
3
6
9
3
6
9
8.4
10.2
14.2
4.0
4.0
4.0
100.0
100.0
100.0
51.4
59.8
63.4
4.4
4.4
432.8
10.8
10.8
25.2
15.0
15.0
30.1
6.6
25.7
33.1
12.8
26.2
26.2
74.0
91.5
93.1
Tabella 9.4 - Valutazione della biodegradabilità di
10 pesticidi da parte di fanghi attivi (concentrazione
iniziale in acqua dei vari p.a. 0.05 ppm)
(Leoni et al., 1991).
262
Capitolo 9 P ESTICIDI
Insetticidi organofosforici
In una sperimentazione recente sui tappeti erbosi e sul compost si
sono analizzati gli eventuali residui di alcuni insetticidi organofosforici (diazinone, clorpirifos e isophenfos) che risultarono degradarsi
rapidamente con residui di 1 ppm dopo 14 gg dal trattamento. Solo un
erbicida, la pendimetalina, era presente in tracce (0.30 ppm) in campioni di erba dopo 22 gg, la degradazione comunque si completava in
4 settimane (cfr. tabella 9.5, Lemmon and Pylypiw, 1992).
Settimane
dal trattamento
1
3
4
5
6
7
10
12
13
14
16
17
18
20
Diazinone
(ppm)
0.55
0.02
<0.01
<0.01
<0.01
<0.01
<0.01
<0.01
<0.01
0.09
0.03
<0.01
<0.01
<0.01
Clorpirifos
(ppm)
0.30
0.60
0.10
<0.01
<0.01
<0.01
<0.01
<0.01
<0.01
0.08
0.02
<0.01
<0.01
<0.01
Isophenfos
(ppm)
3.50
0.35
0.10
0.04
0.10
0.10
0.09
0.08
0.10
0.07
0.09
<0.01
<0.01
<0.01
Pendimetalina
(ppm)
3.20
0.60
1.00
0.20
0.90
0.89
0.10
0.07
0.09
0.09
<0.01
<0.01
<0.01
Tabella 9.5 - Concentrazione residua di 4 pesticidi nel suolo trattato con
compost ottenuti da tagli di erba estivi (Lemmon and Pylypiw, 1992).
Tra gli insetticidi organo-fosforici merita una discussione più ampia
la biodegradazione del clorpirifos, uno dei prodotti più usati.
La biodegradazione del clorpirifos è stata studiata nel suolo, nelle
acque e nei sedimenti, in condizioni di aerobiosi e di anaerobiosi. Essa avviene principalmente attraverso meccanismi cometabolici, che
comportano la parziale degradazione di un composto organico senza
un beneficio netto per i microrganismi (Racke, 1993).
La persistenza del clorpirifos nel suolo dipende dal tipo di suolo e
dalle condizioni ambientali, per cui la emivita è variabile (Racke,
1993). Varie ricerche hanno rilevato che la persistenza in suolo sterilizzato è decisamente più alta che in condizioni naturali (non sterilizzato); questo ha portato a concludere che, almeno nel suolo, i microrganismi hanno un ruolo attivo nella degradazione del clorpirifos
263
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
(Thiegs, 1964; Getzin and Rosefield, 1968; Miles et al., 1979, 1983,
1984; Getzin, 1981; Shaaban et al., 1981). Tuttavia, alcuni ricercatori
hanno osservato differenze piccole nella degradazione del clorpirifos
tra suoli sterili e suoli non sterili e hanno suggerito che non sempre
l’attività dei microrganismi è importante (Jones and Hastings, 1981;
Yoshioka et al., 1991). Nel suolo, diversamente da quanto avviene per
altri insetticidi fosforganici, non sono stati rilevati adattamenti della
microflora al catabolismo del clorpirifos (Racke and Coats, 1988, 1990;
Racke et al., 1990), per cui qualunque forma di metabolismo è di natura accessoria (cometabolismo). In alcuni casi, è stato osservato che
la presenza di un metabolita di un pesticida nel suolo può indurre
una più rapida degradazione microbica del pesticida stesso. Ciò sembra non verificarsi per il clorpirifos; Somasundaram et al. (1989) hanno trattato campioni di suolo con 3,5,6-tricloro-2-piridinolo (TCP), il
principale metabolita del clorpirifos, trovando che la persistenza di
quest’ultimo aumentava.
Varie ricerche condotte nel suolo indicano che la rottura e la mineralizzazione dell’anello eterociclico presente nel clorpirifos sono dovute all’attività microbica (Bidlack, 1979; Getzin, 1981; Somasundaram et al., 1987; Racke et al., 1988, 1990); il ruolo più importante dei
microrganismi è rappresentato dalla ulteriore degradazione dei metaboliti TCP (3,5,6-tricloro-2-piridinolo) e TMP (3,5,6-tricloro-2-metossipiridina) derivati dal clorpirifos (il piridinolo viene prodotto per
idrolisi del clorpirifos). In generale, le reazioni idrolitiche costituiscono il passaggio iniziale più significativo nel metabolismo microbico
dei pesticidi (Matsumura, 1980).
In vari studi sul metabolismo del clorpirifos in coltura pura non è
stata osservata biodegradazione (Hirakoso,1969; Lal et al. ,1987a,b;
Racke and Coats ,1988) in contrasto con quanto visto per parecchi altri composti fosforganici, che venivano attivamente degradati da varie colture batteriche.
Alcune ricerche hanno rilevato una certa attività metabolica nei riguardi del clorpirifos, ma le condizioni sperimentali non hanno permesso di valutare in modo definitivo la biodegradazione. Alcuni Autori (Jones and Hastings, 1981) hanno studiato il metabolismo di varie
colture di eumiceti provenienti da suoli forestali (Trichoderma harzia num, Penicillium multicolor, Penicillium vermiculatum, Mucor) in presenza di 50 ppm di clorpirifos. Dopo 28 giorni di incubazione, il clorpirifos e il suo metabolita TCP erano presenti in tutte le colture a livelli
compresi, rispettivamente, tra il 2 e il 5% e tra l’1 e il 14% della quantità
264
Capitolo 9 P ESTICIDI
aggiunta. Tuttavia, in una prova parallela con suolo sterile è stata osservata una perdita significativa di clorpirifos dovuta a volatilizzazione (30% in 7 giorni). Questo ha reso difficile l’interpretazione dei risultati.
A differenza del clorpirifos, i suoi metaboliti TCP e TMP vengono
rapidamente degradati e mineralizzati dalla microflora del suolo
(Bidlack, 1976; Laskowski et al., 1977; Bidlack, 1980; Racke et al., 1988;
Racke and Robbins, 1991). Racke et al. (1988) riportano che approssimativamente il 65-85% del TCP applicato (5 ppm) a vari suoli veniva
mineralizzato in 14 giorni. L’iniziale accelerazione della velocità degradativa osservata in questi suoli era indice dell’induzione enzimatica microbica o adattamento. Alcuni ricercatori (Racke and Robbins,
1991) hanno investigato su una serie di suoli per evidenziare la eventuale presenza di microrganismi capaci di metabolizzare il TCP. Dei
25 suoli presi in considerazione, solo 2 mostravano una degradazione
significativa in 21 giorni di incubazione in un mezzo di coltura minerale contenente come unica fonte di carbonio 5 ppm di TCP. Le prove
preliminari proposte in questo studio indicano dunque che, almeno in
alcuni suoli, sono presenti microrganismi capaci di utilizzare il TCP
come substrato di crescita.
È stato osservato che alcuni enzimi microbici possono idrolizzare il
clorpirifos in condizioni controllate. Munnecke and Hsieh (1975) riportano per primi che la parathion idrolasi, un enzima che idrolizza
gli esteri fosforganici isolato da una coltura mista, è in grado di idrolizzare il clorpirifos. Havens and Rase (1991) hanno fatto passare una
soluzione acquosa di clorpirifos allo 0,25% attraverso una colonna
contenente parathion idrolasi immobilizzate, ottenute da Pseudomo nas diminuta. Circa il 25% della quantità iniziale veniva degradata dopo 3 ore di costante ricircolo attraverso la colonna.
Uno studio più definitivo è stato effettuato da Bidlack (1979), che ha
esaminato la biodegradazione in sette suoli diversi. Il metabolita più
comune in condizioni aerobiche è risultata l’anidride carbonica (26,688,5% della quantità di clorpirifos aggiunta all’inizio), insieme al TCP
(picco tra il 6,1 e il 32,5%) e alla TMP (picco tra lo 0,1 e il 10,7%). In cinque suoli il picco della concentrazione di TCP si aveva tra 14 e 60 giorni poi la quantità diminuiva, mentre in altri due il picco veniva raggiunto tra 270 e 360 giorni. Si formavano anche residui non estraibili
(≤ 20,6%), la maggior parte dei quali era incorporata nel materiale
umico del suolo. E’ stata proposta una via metabolica degradativa il
cui primo passaggio implica l’idrolisi del clorpirifos con formazione
265
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
di TCP, che a sua volta viene trasformato in TMP, mineralizzato ad
anidride carbonica o ulteriormente degradato con incorporazione nella materia organica del suolo. Bidlack (1979) ha anche esaminato il
metabolismo nel suolo in condizioni anaerobiche e riporta che mentre
il TCP veniva prodotto in quantità considerevoli, la CO2 trovata era
assai scarsa e non si aveva produzione di TMP. In aggiunta al TCP,
Afifi and Kansouh (1980) e Zidan et al. (1981) hanno rinvenuto altri
metaboliti in suoli di diverso tipo (argillosi e sabbiosi). I metaboliti
identificati mediante cromatografia su carta comprendevano O-dietil
O-(3,5,6-tricloro-2-piridil) fosfato (clorpirifos oxon), O-etil O-(3,5,6tricloro-2-piridil) fosfato e O-etil O-(3,5,6-tricloro-2-piridil) fosforotioato (desetil clorpirifos).
Insetticidi carbammati
Anche in merito alla biodegradazione dei carbammati si è scelto un
p.a. rappresentativo, quale il propoxur, da trattare esaurientemente.
I dati sulla biodegradazione del propoxur (principio attivo p.es. del
Baygon) si riferiscono al suolo. La via degradativa primaria nel suolo,
come per altri pesticidi della classe dei carbammati, passa attraverso
una reazione di idrolisi (Kazano et al., 1972; Venkateswarlu and
Sethunathan, 1978; Ou et al., 1982) che, nel caso del propoxur, porta
alla formazione di 2-isopropossifenolo (2-IPF).
La biodegradazione del propoxur è stata analizzata in presenza di
colture microbiche sia pure che miste. Kuseske et al. (1974) hanno studiato gli effetti del propoxur sull’attività microbica nel suolo osservando, mediante conte in piastra, che il propoxur alla concentrazione
di 5 ppm non aveva una grande influenza sulle popolazioni microbiche, mentre ad una concentrazione di 500 ppm determinava un aumento marcato del numero di eumiceti e attinomiceti. L’applicazione
di propoxur granulare (formulato), cioè la forma commerciale adsorbita ad un carrier, inibiva fortemente la nitrificazione, specialmente
alla concentrazione di 500 ppm. Al contrario, il propoxur in forma cristallina aveva un effetto inibitorio molto ridotto. La differenza riscontrata era dovuta alla biodegrazione del carrier, che determinava l’immobilizzazione dell’azoto e l’apparente inibizione della nitrificazione. Con una concentrazione di propoxur pari a 5 ppm, l’inibizione osservata era molto ridotta. L’analisi in coltura pura di Nitrobacter agilis
e Nitrosomonas europea ha evidenziato che il propoxur è tossico per entrambi gli organismi e che la tossicità per Nitrosomonas è più alta in
coltura pura che nel suolo. L’aggiunta di 500 ppm di propoxur granu-
266
Capitolo 9 P ESTICIDI
lare determinava un aumento dell’attività respiratoria, dovuto principalmente alla degradazione del carrier, mentre l’insetticida in forma
cristallina influenzava poco la respirazione.
Harris et al. (1984) hanno condotto una ricerca sulla degradazione
del carbofurano e di altri pesticidi, tra cui il propoxur, in un suolo
franco sabbioso pre-trattato con carbofurano (il suolo non era mai stato trattato in precedenza con pesticidi). Il numero di eumiceti e di batteri non è stato modificato dal trattamento preliminare, ma la riduzione drastica della degradazione osservata nei campioni sterili ha
suggerito che i microrganismi fossero attivi dal punto di vista degradativo. In generale è risultato che, per alcuni pesticidi (tra cui il propoxur), nel suolo attivato con carbofurano la velocità di degradazione aumentava. L’attività indotta era funzione della quantità di carbofurano applicata e/o del tempo trascorso dal pre-trattamento. Inoltre,
processi fisici quali il rimescolamento dei campioni acceleravano la
degradazione, evidentemente distribuendo in modo più omogeneo
nel suolo gli agenti attivi (i microrganismi). Read (1986) ha effettuato
per vari anni uno studio in campo in due stazioni con pH diverso (6,4
e 5,7) allo scopo di verificare l’influenza delle condizioni climatiche e
dell’attività microbica sulla persistenza nel suolo di alcuni insetticidi,
tra cui il propoxur. Quest’ultimo è risultato meno persistente durante
le stagioni piovose rispetto ai periodi secchi. Dopo ripetuti trattamenti con propoxur, nell’area sperimentale in cui il suolo aveva un pH pari a 6,4 la biodegradazione del composto è aumentata, mentre nel sito
con pH uguale a 5,7 essa risultava fortemente ritardata; test di laboratorio hanno indicato che questo carbammato può essere stato degradato dai microrganismi che degradano il carbofurano (rapporto non
pubblicato).
Ou et al. (1992) hanno studiato l’andamento degradativo in un suolo
erboso (turfgrass) trattato preliminarmente con una singola dose di
propoxur marcato con 14C. La sperimentazione è durata 12 mesi. Sebbene i campioni di suolo raccolti nel luogo dell’esperimento prima e
dopo l’aggiunta di propoxur avessero caratteristiche chimiche, fisiche
e biologiche simili, la mineralizzazione (evoluzione di 14CO2) è risultata più alta nei campioni prelevati dopo il pre-trattamento, specialmente dopo un intervallo di tempo relativamente lungo da quest’ultimo (68 mesi). I risultati suggeriscono che l’aggiunta di una singola dose di
propoxur abbia stimolato l’attività degradativa dei microrganismi che
sono in grado di degradare questo composto. Nel corso della ricerca è
stato isolato un ceppo di Arthrobacter capace di utilizzare il propoxur
267
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
come unica fonte di carbonio e di energia. L’unico composto chimico
individuato nei campioni è risultato il 2-IPF, cioè il prodotto di idrolisi che viene poi trasformato in catecolo attraverso una O-dealchilazione ed in seguito rapidamente mineralizzato a CO 2 e H2O.
Anche durante altre ricerche sono stati identificati ceppi microbici
puri capaci di degradare il propoxur. Topp et al. (1993) hanno isolato
da un suolo agricolo e caratterizzato un batterio metilotrofo (ceppo
ER2) molto simile nelle proprietà biochimiche e genetiche all’Achromo b a c t e r ceppo WM111 descritto da altri autori (Tomasek and K a r n s ,
1989; Karns and Tomasek, 1991). Il ceppo ER2 è capace di idrolizzare
gli insetticidi appartenenti alla classe degli N-metilcarbammati, con
formazione dei corrispondenti fenoli. Behki et al. (1994) hanno osservato che Rhodococcus TE1, un batterio del suolo che precedentemente
si era dimostrato capace di metabolizzare vari pesticidi, può degradare il propoxur in un mezzo di coltura definito. Il propoxur non viene
utilizzato nè come fonte di carbonio nè come fonte di azoto per la crescita, ma la degradazione avviene attraverso meccanismi cometabolici.
La degradazione può avvenire solo in presenza di ossigeno e porta alla produzione di 2-IPF, attraverso una reazione di idrolisi.
Fotodegradazione
Alcuni pesticidi sono sensibili alla fotodegradazione. In particolare
si è osservato che la fotoossidazione nel suolo, pur avendo una velocità inferiore a quella osservata nelle acque, agisce fino a 0.5 cm di
profondità, soprattutto su disulfutan e altri solfuri dialchilici e alchilarilici (Piccolo, 1991).
La fotodegradazione è inoltre stimolata quando i composti sono adsorbiti su un supporto solido (ad esempio l’adsorbimento di aldrin su
gel di silice aumenta la fotodegradazione del 30%) (Piccolo, 1991).
268
Capitolo 9 P ESTICIDI
9.5 Piante
Anche sperimentalmente si è constatato che la bioconcentrazione
nella pianta dipende dal rapporto Kow e Koc.
In particolare l’assorbimento di DDT, atrazina, dieldrin ecc. è stato
studiato su piante di orzo. I composti chimici nelle radici di orzo erano in equilibrio con quelli del suolo e quelli nelle foglie con quelli dell’aria (Trapp et al. 1990). L’assorbimento era maggiore con un alta
Kow e una alta costante di Henry. Con una Kow media c’era comunque traslocazione (Trapp et al. 1990).
Diversi autori comunque hanno potuto accertare che numerosi vegetali ipogei (patate, carote, cipolle, barbabietole, rape, ecc.) hanno la
capacità di assorbire dal terreno e traslocare tali composti alogenati
(DDT, DDE) (Salvo et al., 1985-87).
Da sperimentazioni è anche emersa la diversa biodisponibilità di residui di DDT e HCH presenti nel suolo in forma legata, nei confronti
di grano, mais e riso, benchè l’accumulo osservato non fosse comunque elevato. Infatti, grano e mais in 14 gg e riso in 20 gg accumulavano rispettivamente lo 0.61, 0.13 e 0.05% di DDT e 0.95, 0.11 e 0.04 % di
HCH dei residui presenti inizialmente nel suolo. Le piante accumulavano da 12-24 volte in più e da 4-10 volte in più in suoli contenenti sia
residui estraibili che legati; in particolare HCH tendeva ad accumularsi più nelle radici delle varie piante in esame, mentre il DDT nei fusti (Verna and Pillai, 1991).
pianta/
tessuto
patata
(tubero)
ravanello
barbabietola
da zucchero
tipo di suolo
concentraz.
nel suolo
( g/g s.s.)a
quantità
applicata
kg/hab
concentraz.
nei tessuti
( g/g s.s.) c
curva
di
assorbimento d
sabbiosolimoso
"
"
1.68
3.36
1.35 (0.3)
0.88
1.68
1.68
3.36
3.36
6.25 (4)
3.36 (3)
3.72
1.40
a) La concentrazione nel suolo è stata calcolata partendo da una dose di applicazione di 3.36 kg/ha, assumendo che il toxafene fosse distribuito in 2.000 mt di terreno nei primi 15 cm.
b) fattore di conversione 1.1209
c) i valori fra parentesi sono gli originali, il dato sul secco è calcolato su un contenuto di acqua per la
patata di 79.8%.
d) la curva di assorbimento y/x dove y= µg/g di tessuto vegetale s.s. e x= µg/g di suolo s.s.
Tabella 9.6 - Toxafene assorbito dalle piante ( US EPA, 1986 ).
269
LA TOSSICITÀ D E IF A N G H ID I
pianta/
tessuto
DEPURAZIONE
tipo di suolo
grano/grani
loess
mais/grani
"
grano/grani
"
mais/grani
"
mais /semi
argillo/limoso
avena/ semi
"
arachide/semi
"
barbabietola
"
da zucchero/
pianta
medica /
argilloso
pianta
avena/pianta
"
mais/pianta
"
barbabietola
da zucc./fusto
"
patate /pianta
"
carote/pianta
"
barbabietola
"
da zucc./radici
medica
"
medica/
sabbioso/
pianta
limoso
medica/pianta
"
carota /pianta
"
carota/pianta
"
carota
nr
arachide/
nr
mallo
p.a.
concentraz.
nel suolo
( g/g s.s.)
dieldrin
dieldrin
aldrin
aldrin
aldrin/dieldrin
aldrin/dieldrin
aldrin/dieldrin
aldrin/dieldrin
0.52
0.55
1.09
0.78
0.4-3.0
0.4-3.0
0.4-3.0
0.01-0.97
<0.01
<0.01
<0.01
<0.01
0.003-0.008
0.1-1.0
0.1-1.0
<0.01-0.96
<0.01
<0.01
<0.01
<0.01
<0.01
0.25-0.33
0.33-<1.0
0.33-<1.0
dieldrin
1.2
0.02
0.02
dieldrin
dieldrin
1.2
1.2
0.02
0.020
0.02
0.020
dieldrin
dieldrin
dieldrin
dieldrin
1.2
1.2
1.2
1.2
0.03
0.03
0.04
0.07
0.03
0.03
0.03
0.46
aldrin
dieldrin
0.14-0.37
0.57
<0.01
<0.01
aldrin
dieldrin
0.06
0.57
0.06
0.05-0.26
0.08-0.20
0
0.03
0
0.01-0.14
0.08-0.13
aldrin/dieldrin
aldrin/dieldrin
concentraz.
curva di
nei tessuti assorbimento*
( g/g s.s.)
0
0
0
0.05
0
0.48
0.75
Note: La concentrazione nel tessuto vegetale è sul secco. Fattore di conversione basato sul contenuto in
acqua della barbabietola da zucchero di 87.3% e 13.8 per il mais.
* La curva di assorbimento è = concentrazione nel tessuto/ concentrazione nel suolo
Tabella 9.7 - Assorbimento di adrin/ dieldrin da parte delle piante
(US EPA, 1986 ).
In ogni caso è sempre difficile distinguere, a livello di asporto di
composti organici, quello che è attribuibile all’assorbimento radicale
da quello delle parte aerea della pianta, dipendente dall’evaporazione del suolo (Scroll and Scheunert, 1991), come testimoniano le esperienze di altri ricercatori (US EPA 1985).
In altri studi non sono state trovate tracce di questi composti nelle
piante nel 60% dei casi, il resto dei campioni erano simili a quelli con
270
Capitolo 9 P ESTICIDI
residui di 0.001 ppm p.f.; non c’erano quindi nè una traslocazione
evidente, nè aumenti del contenuto di pesticidi nelle colture trattate
(Kampe, 1989).
Altri autori riportano che i composti che tendono ad accumularsi
maggiormente sono Eptacloro, dieldrin e clordano che sono adsorbiti
a bassi livelli nel suolo (US EPA 1985). Nelle tabelle che seguono si riportano le quantità di toxafene (tabella 9.6) e aldrin /dieldrin (tabella
9.7) assorbite dalle piante (US EPA, 1986).
9.6 Animali
Il rischio di contaminazione degli organismi viventi attraverso la catena trofica ed il loro possibile accumulo si riscontra selettivamente
nei grassi in cui i pesticidi clorurati sono altamente solubili (ad esempio il DDT, Baldi et al., 1991; Di Bella et al., 1992). Per tutti questi composti comunque (HCH, DDT, HCB, aldrin, dieldrin, ecc.) si fa riferimento alle concentrazioni consentite dalla FAO.
Anche per le quantità ingerite dagli animali di aldrin/dieldrin, DDT
e clordano si fa riferimento alle tabelle US EPA (1986).
In conclusione i pesticidi più utilizzati sono stati indagati e catalogati dall’US EPA (US EPA, 1986) in base alla loro potenziale tossicità.
Ad esempio il potenziale cancerogeno di DDT/DDE/DDD è di
0.34 mg/kg/die, per il clordano è di 1.3, per aldrin/dieldrin è di
17 mg/kg/die.
271
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Bibliografia
AFIFI F.A., KANSOUH A.S.H., (1980):
Dissipation and fate of chlorpyrifos and
aldicarb in clay soil under laboratory con ditions. Ain Shams Univ. Fac. Agric. Res.
Bull., 1401, 1.
BALDI M., COPPI S., DAVÌ L., BENEDETTI S, BOVOLENTA A., PENAZZI
L., PREVIATI M., (1 9 9 1 ): V a l u t a z i o n e
del carico di microinquinanti nella sacca
di Goro nel 1988. Inquinamento, 9, 7481.
BEHKI R.M., TOPP E.E., BLACKWELL
B.A., (1994): Ring hydroxilation of Nmethylcarbamate insecticides by Rhodococcus TE1. J. Agric. Food Chem., 4 2 ,
1375.
BIDLACK H.D., (1976): Degradation of
14
C-labeled 3,5,6-trichloro-2-pyridinol in
15 select agricultural soils. DowElanco,
Indianapolis, IN (unpublished report).
BIDLACK H.D., (1979): Degradation of
chlorpyrifos in soil under aerobic, aero -
272
bic/anaerobic, and anaerobic conditions.
DowElanco, Indianapolis, IN (unpublished report).
BIDLACK H.D., (1980): Aerobic degra dation rate of 3,5,6-trichloro-2-pyridinol
in various soils as affected by concentra tion or by the use of acetone as a solvent.
DowElanco, Indianapolis, IN (unpublished report).
DI BELLA G., DUGO G., SAITTA M.,
(1992): Contaminazione di terreni agrico li. Nota 1. Acqua-aria, 6, 525-528.
DOELMAN O., HAANSTRA L., RUITER E., SLANGE J., (1985): Rate of mi crobial degradation of high concentrations
of a l p h a-HCH in soil under aerobic and
anaerobic conditions. Chemosphere, 1 4 ,
565-570.
DOELMAN P., HAANSTRA L., VOS
A., (1 9 8 8 ): Microbial sanitation of soil
with and HCH under aerobic glas shouse conditions. Chemosphere, 17, 489492.
Capitolo 9 P ESTICIDI
DOELMAN P., HAANSTRA L., LOONEN H., VOS A ., ( 1 9 9 0 ): D e c o m p o s i tion of and HCH in soil under field
conditions in a temperate climate. Soil
Biol. Biochem., 22, 629-634.
EDWARD C.A., (1975): Persistent Pe sticides in the environment. CRC Press
Inc., Ohio, USA.
ELEFTHEROHORINOS I.G., KOTOULA-SYKA E ., (1 9 9 1 ): Field persistence
bioassay of soil applied herbicides in irri gated and non irrigated sunflower crops.
Agr. Med. 121, 333-339.
EPSTEIN E., CHANEY R.L., (1978):
Land disposal of toxic substances and wa ter related problems. J.W.P.C.F., 50,
2037- 2042.
FIEGGEN W., (1981): Report on the sur vey into pesticides in sewage sludge.
Commission of the European Communities Treatment and use of sewage
sludge. Cost Project 68bis. Final Report
III Technical Annexes.
GENEVINI P.L., VISMARA L., MEZZANOTTE V., (1986): Utilizzo agricolo
dei fanghi di depurazione. Ingegneria
Ambientale, 5, 134.
GETZIN L.W., (1981): Degradation of
chlorpyrifos in soil: influence of autocla ving, soil moisture, and temperature. J.
Econ. Entomol., 74, 158.
GETZIN L.W., ROSEFIELD I., (1968):
Organophosphorus insecticide degrada tion by heatlabile substances in soil. J.
Agric. Food Chem., 16, 598.
GUSTAFSON D.I., (1989): Groundwater
ubiquity score: a simple method for asses sing pesticide leachability. Environmental
Toxicology and Chemistry, 8, 339-357.
HARRIS C.R., CHAPMAN R.A.,
HARRIS C., TU C.M., (1984): Biodegra dation of pesticides in soil: rapid induc tion of carbamate degrading factors after
carbofuran treatment. J. Environ. Sci
Hlth, B19, 1.
HAVENS P.L., RASE H.F., (1991): De toxification of organophosphorus pesticide
s o l u t i o n s. In: Emerging Technologies in
Hazardous Waste Management II (D.W.
Tedder, F.G. Pohland, ed.), p. 261.
ACS, Washington, DC.
HIRAKOSO S., (1969): Inactivating ef fects of microorganisms on insecticidal ac tivity of Dursban. Jap. J. Exp. Med., 39,
17.
IMAI R., NAGATA Y ., SENOO K.,
H.WADA, FUKUDA M., TAKAGI M.,
YANO K., (1989): Dehydrocholrination
of gamma BHC by gamma BHC-assimila ting Pseudomonas paucimobilis.
Agric. Biol. Chem., 53, Jul, 2015-2017.
JONES A.S., HASTINGS F.L., (1981):
Soil microbe studies, in Field and Labora tory Evaluations of Insecticides for
Southern Pine Beetle Control (F.L. Hastings, J.E. Coster, ed.), p. 13. U.S.
Dept. Agriculture, Southern Forest
Experiment Station, Forest Service,
SE-21.
KAMPE W., (1989): Organic substances
in soils and plants after intensive applica tions of sewage sludge. In: Sewage sludge
treatment and use. Comm. of the Europ.
Communities, edited by A.H.
273
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Dirkzwager and P. L'Hermite. Elsevier Applied Science.
romyces cerevisiae. Arch. Environ.
Contam. Toxicol., 16, 753.
KAMPE W., LESCHBER R., (1989):
Occurence of organic pollutants in soil
and plants after intensive sewage sludge
application. In: Organic contaminants in
waste water, sludge and sediment. Occu rence, Fate and Disposal. Commission of
the European Communities. Ed. Quaghebeur D., Temmerman I. and Angeletti G., 35-41.
LAL S., LAL R., SAXENA D . M . ,
(1987b): Bioconcentration and metaboli sm of DDT, fenitrothion and chlorpyrifos
by the blue-green algae Anabaena sp.
and Aulosira fertilissima. Environ. Pol lut., 46, 187.
KARNS J.S., TOMASEK P.H., (1991):
Carbofuran hydrolase-purification and
properties. J. Agric. Food Chem. , 39,
1004.
KAWAMOTO K., URANO K., (1989):
Parameters for predicting fate of organo chlorine pesticides in the environment (II)
adsorption constant to soil. Chemosphere,
19, 1223-1231.
KAWAMOTO K., URANO K., (1990):
Parameters for predicting fate of organo chlorine pesticides in the environment
(III) biodegradation rate constants. Che mosphere, 21, 1141-1152.
KAZANO H., KEARNEY P.C., KAUFMAN D.D., (1972): Metabolism of
methylcarbamate insecticides in soils. J.
Agric. Food Chem., 20, 975.
KUSESKE D.W., FUNKE B.R.,
SCHULZ J.T., (1974): Effects and persi stence of Baygon (propoxur) and Temik
(aldicarb) insecticides in soil. Plant and
Soil, 41, 255.
LAL S., LAL R., (1987a): Bioaccumula tion, metabolism, and effects of DDT, fe nitrothion, and chlorpyrifos on S a c c h a-
274
LAL S., SAXENA D.M., LAL R.,
(1987a): Uptake, metabolism and effects
of DDT, fenitrothion and chlorpyrifos on
Tetrahymena pyriformis. Pestic. Sci.,
21, 181.
LASKOWSKI D.A., COMEAUX L.B.,
BIDLACK H.D., (1977): Aerobic soil de composition of 1 4C-labeled 3,5,6-trichloro2-methoxypyridine. DowElanco, Indianapolis, IN (unpublished report).
LEACH L.E., ENFIELD C.G., HARLIN C.C., (1980): Summary of long-term
rapid infiltration system studies. U . S .
Env. Prot. Agency, Technical report
EPA 600/2-80-165, Oklahoma 1-49.
LEMMON C.R., PYLYPIW H.M. Jr.,
(1992): Degradation of diazinon, chlorpy rifos, isofenphos and pendimethalin in
grass and compost. Bull. Environ. Con tam. Toxicol., 48, 409-415.
LEONI V., PUCCETTI G., GIOVINAZZO R., GASBARRO M., SEBASTIANII L., ANNICHIARICO, FORTINI P., GENTILINI F., MOSCONI
M., (1991): Biodegradazione di dieci pe sticidi con fanghi attivi. Inquinamento,
10, 98-104.
LEONI V., GRELLA A., (1980): Proble mi tossicologici dello smaltimento dei ri -
Capitolo 9 P ESTICIDI
f i u t i, Atti del XIX Congr. Naz. della
Soc. Ital. di Microbiol, 237-286, Catania, 5-8 giu 1980.
sphorus insecticides in sterile and nonsterile mineral and organic soils. Bull.
Environ. Contam. Toxicol., 22, 312.
LEONI V., MARCHESE E., (1985): L a
presenza di pesticidi nelle acque reflue.
Agricoltura e Ambiente, 28, 44-53.
MUNNECKE D.M., HSIEH D . P . H .
(1975): Development of microbial systems
f o r the disposal of concentrated pesticide
suspensions. Med. Facul. Landbouww.
Rijksuniv. Gent, 40, 1237.
LESTER N., (1989): Presence of organic
micropollutants in sewage sludges. Pro cessing Use of sewage sludge. Proc. of
the third Int. Symp., Brighton, Sept.,
27-30.
MATSUMURA F., (1980): Toxicology of
insecticides, p 335. Plenum Press, New
York.
MACTERNAN W.F., PEREIRA J . A . ,
(1991): Biotransformation of Lindane and
2,4D in batch enrichment cultures.
Wat.Res. 25, n. 11, 141-1423.
MACTERMAN, PEREIRA J.A., (1991):
Biotransformation of Lindane and 2,4,-D
in batch enrichment cultures. Wat Res. ,
25, 1417-1423.
MILES J.R.W., HARRIS C.R., TU C.M.,
(1983): Influence of temperature on the
persistence of chlorpyrifos and chlorfen vinphos in sterile and natural mineral and
organic soils. J. Environ. Sci. Hlth., B18,
705.
MILES J.R.W., HARRIS C.R., TU
C.M., (1984): Influence of moisture on
the persistence of chlorpyrifos and chlor fenvinphos in sterile and natural mineral
and organic soils. J. Environ. Sci. Hlth.,
B19, 237.
MILES J.R.W., TU C.M., HARRIS C.R.,
(1979): Persistence of eight organopho -
OU L.T., GANCARZ D.H., WHEELER
W.B., RAO P.S.C., DAVIDSON J . M . ,
(1982): J. Environ. Qual., 11, 293.
OU L.T., NKEDI-KIZZA P., C I S A R
J.L., SNYDER G.H., (1992): M i c r o b i a l
degradation of propoxur in turfgrass soil.
J. Environ. Sci. Hlth., B27, 545.
PELIZZETTI E., MAURINO W., MINERO C., CARLIN V., PRAMAURO
E., ZERBINATI O., TOSATO M. L . ,
(1990): Photocatalytic degradation of atra zine and other s-triazine herbicides. Envi ron. Sci. Technol., 24, 1559-1565.
PICCOLO A., (1991): Contenuto e dina mica nel suolo di composti xenobiotici ap plicati con fanghi e compost. In: Riciclo di
biomasse di rifiuto e di scarto e fertilizza zione organica del suolo . Patron Ed. ,
279-286.
RACKE K.D., (1993): Environmental fa te of chlorpyrifos. In: Reviews of Envi ronmental Contamination and Toxicology
(G.W. Ware, ed.), 131, p. 1. SpringerVerlag, New York.
RACKE K.D., COATS J.R., (1988):
Comparative degradation of organopho sphorus insecticides in soil: specificity of
enhanced microbial degradation. J. Agric.
Food Chem., 36, 193.
275
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
RACKE K.D., COATS J.R., (1990):
Enhanced biodegradation of insecticides
in Midwestern corn soils. In: E n h a n c e d
Biodegradation of Pesticides in the Envi ronment, (K.D. Racke, J.R. Coats, ed.),
p. 68. ACS Symp Series 426, Washington, DC.
RACKE K.D., COATS J.R., TITUS
K.R., (1988): Degradation of chlorpyrifos
and its hydrolisis product, 3,5,6-trichlo ro-2-pyridinol, in soil. J. Environ. Sci.
Hlth, B 23, 527.
RACKE K.D., LASKOWSKI D.A.,
SCHULTZ M.R., (1990): Resistance of
chlorpyrifos to enhanced biodegradation
in soil. J. Agric. Food Chem., 38, 1430.
RACKE K.D., ROBBINS S.T., (1991):
Factors affecting the degradation of 3,5,6trichloro-2-pyridinol in soil. In: Pesticide
Transformation Products: Fate and Signi ficance in the Environment (L. Somasundaram, J.R. Coats, ed.), p. 93. ACS
Symp Series 459, Washington, DC.
READ D.C., (1986): Influence of
weather conditions and microorganisms
on persistence of insecticides to control
root maggots (Diptera: Anthomyiidae)
in rutabagas. Agric. Ecosyst. Environ.,
16, 165.
SALVO F., ALFA M., DUGO G., (198587): Determinazione di aldrina e dieldrina
in Daucus carota L. ed in loro terreni di
c o l t u r a, Atti della Soc. Peloritana di
Scienze. Nuova Serie, 31, 89-92.
SHAABAN A.M., ZIDAN Z.H., SOBEIHA A.M.K., EL-ZEMAITY M . S . ,
(1981): Some factors influencing the per sistence of certain pesticides in soil and
276
water. Bull. Entomol. Soc. Egypt, Econ.
Ser., 12, 137.
SOMASUNDARAM L., COATS J.R.,
RACKE K.D., ( 1989): Degradation of pe sticides in soil as influenced by the pre sence of hydrolysis metabolites. J. Envi ron. Sci. Hlth, B24, 457.
SOMASUNDARAM L., RACKE K.D.,
COATS J.R., (1987): Effect of manuring
on the persistence and degradation of soil
insecticides. Bull. Environ. Contam.
Toxicol., 39, 579.
SJOQUIST T., (1989): Trends in heavy
metal; PCB and DDT contents of sludges
in Sweden . In: Utilisation of sewage slud ge on land: Rates of application and long term effects of metals, Proc. of a seminar
held at Uppsala, June 7-9, 1983, D.Reidel Pub. Company p.194.
THIEGS B.J., (1964): Decomposition and
leaching of Ethel 36Cl in soil. DowElanco, Indianapolis, IN (unpublished report).
TOMASEK P.H., KARNS J.S., (1989):
Cloning of a carbofuran hydrolase gene
from Achromobacter sp. strain WM111
and its expression in gram-negative bacte ria. J. Bacteriol., 171, 4038.
TOPP E., HANSON R.S., R I N G E LBERG D.B., WHITE D.C., W H E A TCROFT R., (1993): Isolation and charac terization of an N-methylcarbamate insec ticide-degrading methylotrophic bacte rium. Appl. Environ. Microbiol., 59,
3339.
TRAPP S., MATTHIES M., SCHEUNERT I., TOPP E. M., (1990): Modeling
Capitolo 9 P ESTICIDI
the biocencentration of organic chemicals
in plants. Environmental Science and Te chnology, 24 (6), 1246- 1252.
TREMOLADA P., DI GUARDO A.,
CALAMARI D., DAVOLI E., FANELLI R., (1 9 9 2 ): Ipotesi per una previsione
della persistenza delle molecole organiche
per mezzo della spettrometria di massa.
Ingegneria Ambientale, XXI, n.1, 8-17 .
US EPA, (1985): Health effects of land
application of municipal sludge. EPA.
US EPA, (1986): Land application, distri bution and marketing of sewage sludge.
Technical Support Document.
VERNA A., PILLAI M . K . K ., ( 1 9 9 1 ):
Bioavailability of soil- bound residues od
DDT and HCH to certain plants. Soil
Biol. Biochem., 23, n.4, 347-351.
VENKATESWARLU K., SETHUNATHAN N., ( 1 9 7 8 ): Degradation of
carbofuran in rice soils as influenced by
repeated applications and exposure to ae robic conditions following anaerobiosis. J.
Agric. Food Chem., 26, 1148.
YOSHIOKA S., FUSE G., ENOKI A . ,
(1991): Termiticidal efficacy of orga nophosphates (I): degradation of orga nophosphates in soil. Mem. Fac. Agric.
Kinki Univ., 24, 29.
ZIDAN Z.H., SHAABAN A.M., SOBEIHA A.K., EL-ZEMAITY M . S . ,
(1981): Degradation of Dursban and Te mik in water, soil extracts and soils under
laboratory conditions. Bull. Entomol.
Soc. Egypt, Econ. Ser., 12, 179.
277
Capitolo 10
Organoclorurati
volatili (VOC)
LA TOSSICITÀ D E IF A N G H ID I
I
DEPURAZIONE
VOC sono composti volatili organoclorurati ampiamente usati
in varie attività industriali. Questo termine comprende diverse
categorie chimiche (trialometani, organoalogenati aromatici ed
alifatici, ecc.).
Gli organoclorurati alifatici sono impiegati principalmente per la
pulitura a secco dei tessuti (percloroetilene o tetracloroetilene) e la
pulitura dei metalli (tricloroetilene, 1,1,1-tricloroetano, percloroetilene e freon 113), nei processi di lavorazione della plastica, della gomma, della carta, per la produzione di aerosols (cloruro di metilene in
combinazione con clorofluorocarburi), adesivi, vernici (1,2 dicloropropano, tri e tetracloroetilene), per la sintesi di altre sostanze chimiche, tra le quali i fumiganti.
A causa delle loro modalità d’impiego e della loro, in genere, elevata volatilità, risultano essere contaminanti dell’aria e da ricerche effettuate sulla contaminazione delle acque di falda, in Italia, è risultato che i composti più frequentemente presenti sono il tetracloroetilene (PER), il tricloroetilene (TCE) e 1,1,1 tricloroetano.
A causa della vastità di questa categoria di composti nel presente
capitolo si accennerà solo brevemente ad alcune loro proprietà, rimandando ad un altra sede una trattazione più esaustiva.
Il tricloroetilene è soprattutto impiegato (86%) come solvente nei
processi di sgrassaggio industriali, per la pulitura a freddo dei metalli, per la preparazione di insetticidi e fungicidi.
L’1,1- dicloroetilene è un intermedio chimico per la produzione di
copolimeri di polivinilidene per avvolgere gli alimenti.
L’1,2 -dicloroetilene è un intermedio chimico; il cloruro di vinile è
usato per la produzione di policloruro di vinile (PVC)
L’esacloroetano è un intermedio chimico e pesticida, mentre il pentacloroetano viene utilizzato nella ricerca e come intermedio chimico.
L’1,1,2,2- tetracloroetano viene usato come intermedio, solvente per
grassi, smalto, olio, cera, resina, ecc, come fumigante, erbicida e nematocida, per la preparazione di vernici e antiruggine.
L’1,1,2 tricloroetano viene utilizzato solo come intermedio ed in
piccole dosi; così pure l’1,2 dicloroetano.
Il metilcloroformio (1,1,1- tricloroetano) viene impiegato per la pulitura di tubi di scarico, pulitura a spruzzo, di metalli, come solvente ecc.
Il cloroformio viene usato principalmente per adesivi, gomme, olii,
ecc., intermedio di sintesi e come pesticida.
L’1,2 dicloropropano è utilizzato soprattutto come fumigante e poi
come solvente. Il tetracloruro di carbonio viene impiegato per la pro-
280
Capitolo 10 ORGANOCLORURATIVOLATILI (VOC)
duzione di clorofluorocarburi usati come refrigeranti, schiumogeni e
solventi, è anche usato per produrre fumiganti, vernici, plastica, ecc.
Il cloruro di metilene (diclorometano) è utilizzato soprattutto per aerosols, l’1,3 dicloropropene come fumigante e così il 2,3 dicloropropene.
L’esaclorobutadiene infine è usato come solvente, intermedio chimico e fumigante.
Nella tabella 10.1 sono riportate le proprietà fisico-chimiche di alcuni di questi composti per ipotizzare la loro possibile destinazione ambientale (Funari et al., 1992).
sostanza
diclorometano
cloroformio
tetracloruro di carbonio
solubilità tensione
kHc
log Kow log Koc*
in acqua
di
( k P a . m3 /
(25 °C)
vapore
mole)
(ppm)
(25°C)
kPa
19400
7900
800
(20°C)
1,2-dicloroetano
8700
1,1,1-tricloroetano
720
1,1,2- tricloroetano
4420
1,1,2,2-tetracloroetano
3000
pentacloroetano
480
esacloroetano
8
cloruro di vinile
2700
1,1-dicloroetilene
400
(20°C)
1,2-dicloroetilene c i s
3500
1,2-dicloroetilene t r a n s
6300
tricloroetilene
1100
tetracloroetilene
140
1,2 dicloropropano
2700
(20°C)
1,3 dicloropropilene c i s
2700
1,3 dicloropropilene t r a n s
2800
(20°C)
2,3 dicloropropilene
2150
esaclorobutadiene
2.5
58.40
25.60
12.13
(20°C)
10.93
16.53
4.04
0.867
0.60
0.044
353.78
66.0
(20°C)
27.46
43.47
9.87
2.48
5.58
5.75
4.53
(20°C)
7.06
0.012
0.256
0.387
2.89
1.25
1.90
2.73
1.04
1.69
2.52
0.124
3.06
0.122
0.0485
0.253
1.302
2.35
16.06
1.45
2.47
2.42
2.39
2.89
3.82
1.38
1.48
1.24
2.26
2.21
2.18
2.68
3.61
1.17
1.27
1.48
2.42
2.53
2.28
1.27
2.21
2.32
2.07
0.236
0.18
1.36
1.41
1.15
1.20
1.04
4.78
4.57
0.761
0.669
1.179
2.94
log BCF
0.78
0.30
0.95
1.23
0.90
1.83
2.14
1.23
1.69
* calcolato dal Kow con l'equazione log Koc = 1.00 x log Kow - 0.21
Tabella 10.1 - Proprietà chimico-fisiche ed ambientali di alcuni composti
organoalogenati alifatici riportate da vari autori (Funari et al., 1992 ).
281
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
10.1 Acque e suoli
La contaminazione delle acque sotterranee da composti organoclorurati alifatici è un fenomeno riscontrato in molti casi in aree ad intensa industrializzazione e urbanizzazione mentre le cause sono in
genere associate a modalità scorrette nello smaltimento di reflui industriali. La densità di questi composti in genere è più alta di quella
dell’acqua mentre la viscosità è minore, proprietà che favoriscono il
movimento verticale verso la falde acquifere. La resistenza dei suoli
al movimento verticale degli organoclorurati alifatici è in relazione
alla loro capacità di ritenzione, che varia dipendentemente dalla loro
natura.
Si ritiene che il rischio di contaminazione delle falde sia associato a
valori di Hc inferiori a 10-2 atm.m3/mole e ad un valore di Koc (ripartizione tra C.O. e acqua) inferiore a 300- 500.
Il tetracloroetilene (PER) è presente nell’acqua in concentrazioni al
di sotto di 1 ppb (Bauer, 1991) perchè i processi di trattamento delle
acque con la filtrazione a carbone attivo sono sufficienti ad eliminare
il PER in eccesso, grazie alla grandezza e alla lipofilia delle molecole.
Nel suolo il PER va da 0.5 a 10 ppb, mentre in aree produttive risulta tra i 10 e i 100 ppb e in siti contaminati la concentrazione sale a 1000
ppb (Bauer, 1991).
10.2 Aria
Il valore medio di PER rilevato in aree per lo più urbane è di 6.6
µg/m3, altri dati oscillano da 1 a 5, con valori minori nelle aree rurali.
10.3 Fanghi
Quantità di VOC rilevate nei fanghi di un impianto di trattamento
municipale sono riportate nella tabella 10.2 (Melcer et al., 1992):
282
Capitolo 10 ORGANOCLORURATIVOLATILI (VOC)
Aromatici non clorurati
toluene
p-xilene
4-etil toluene
1,3,5-trimetilbenzene
Aromatici clorurati
1,4.diclorobenzene
Alifatici clorurati
diclorometano
cloroformio
1,1,1-tricloroetano
tricloroetilene
tetracloroetilene
30
30
20
30
15
70
25
10
25
5
Tabella 10.2 - Concentrazioni di VOC rile vate nei fanghi ( g/l) ( Melcer et al., 1992 ).
Nella tabella 10.3, invece, sono riportate le percentuali di strippaggio e biotrasformazione di questi composti in un modello che prevede il destino dei VOC nei fanghi trattati e una distribuzione tra atmosfera, fango, effluente finale, e biodegradazione.
Composto
diclorometano
cloroformio
1,1,1-tricloroetano
tricloroetilene
tetracloroetilene
1,4-diclorobenzene
toluene
p-e m-xilene
% di
% di strippaggio
% di
% di
strippaggio
osservata
biotrasformazione biotrasformazione
prevista
prevista
osservata
3.2
7.8
6.0
3.1
64.2
17.2
0.4
0.6
2.6
7.4
10.5
10.7
58.7
19.1
1.2
1.3
91.9
71.9
89.1
91.3
0.0
54.8
98.3
97.9
92.4
73.6
79.7
82.7
15.8
54.7
98.6
98.1
Tabella 10.3 - Rimozione degli inquinanti indagati (ipotizzata e ossevata)
(Melcer et al., 1992 ).
Nella figura 1 si ipotizza che il p-xilene sia principalmente biodegradato mentre per l’1,4 diclorobenzene prevale lo strippaggio (Melcer et
al., 1992).
283
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Figura 1 - Ipotetica destinazione ambientale dei VOC (%).
284
Capitolo 10 ORGANOCLORURATIVOLATILI (VOC)
Altre concentrazioni di VOC in fanghi di diversa origine sono riportate nella tabella 10.4 (Crathorne et al.,1989).
composto
benzene
toluene
m e p-xilene
o-xilene
cloroformio
metilcloroformio
tetracloruro di carbonio
tricloroetilene
tetracloroetilene
tetracloroetano
fango A
1
5
58
103
37
<0.1
0.7
<0.1
6.7
1.8
<0.1
2
14
137
164
73
1.3
0.3
0.2
22.5
5.5
<0.1
3
8
55
25
39
2
0.5
0.2
6.4
12.0
5.0
fango B
1
2
nd
5
nd
23
nd
14
nd
16
1
1
0.3
0.4
<0.1
<0.1
<0.1
0.9
0.1
1.4
<0.1
<0.1
3
3
16
11
4
1
<0.1
<0.1
0.6
1.5
<0.1
4
4
33
53
<5
2.2
0.7
0.1
2.0
20
3.0
Tabella 10.4 - Concentrazioni di VOC nei fanghi ( g/l) (Crathorne et al.1989).
10.4 Degradazione
L’adsorbimento dei VOC nel suolo è molto influenzato dalla tessitura del terreno, (contenuto in argilla), dal livello di S.O. e dal contenuto d’acqua del suolo. Alcuni autori ipotizzano che l’adsorbimento
sui minerali del suolo possa ritardare significativamente il trasporto
dei VOC in terreni secchi. In generale il contenuto di acqua del terreno determina se l’argilla o il C.O. domini l’adsorbimento. Nei suoli
secchi domina la frazione di argilla del terreno, nei suoli umidi il contenuto in C.O. La relazione tra il coefficiente di ripartizione vapore/solido, Kd, ed il contenuto d’acqua del suolo non è lineare nei suoli secchi, diventa lineare, seguendo la legge di Henry, in suoli umidi.
Nei terreni secchi quindi l’adsorbimento dei VOC è fortemente legato al tipo di suolo (Petersen et al., 1995).
10.4.1 Biodegradazione
La biodegradazione di alcuni di questi composti è già stata esaurientemente discussa nel capitolo specifico (cloro-benzeni, ecc.), ai restanti composti sarà solo brevemente accennato.
285
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
La biodegradazione di alifatici alogenati da parte di batteri è testimoniata in varie ricerche effettuate su Nitrosomonas europea (batteri
nitrificanti che vivono nel terreno e nelle acque, aerobi autotrofi obbligati, che operano la riduzione dell’ammonio).
Il TCE è degradato dai batteri in un processo che richiede toluene o
metano. Nitrosomonas europaea catalizza l’ossidazione di CO2, metano,
metanolo, etilene, propilene, bromoetano e tricloroetilene così come
molti composti alifatici (catalizzati dalla ammonio monoossigenasi) su
6 dei quali è stata effettuata una indagine con concentrazioni di 1 ppm,
eccezion fatta per il cloruro di vinile. Dai risultati delle sperimentazione si può affermare che sospensioni di Nitrosomonas europaea catalizzano trasformazioni aerobiche ammonio-stimolate di composti alogenati alifatici quali diclorometano, dibromometano, triclorometano (cloroformio), bromoetano, 1,2-dibromoetano, 1,1,2-tricloroetano, 1,1,3 tricloretano, monocloroetilene, cis-dibromoetilene, tricloroetilene e
1,2,3- tricloropropano. Tutti i composti venivano dunque degradati
eccetto il tetraclorometano, il tetracloretilene e il trans dibromoetilene.
In merito alla biodegradazione di TCE i pareri sono comunque contradditori, alcuni studiosi hanno notato una certa biodegradazione in
aerobiosi, ma acclimatamento lento, per altri non c’era alcuna degradazione. In condizioni anaerobiche si è osservata una biodegradazione da tracce al 40% in 8-12 settimane. In sperimentazioni su sedimenti acquiferi in laboratorio si è notata una percentuale di rimozione dopo 40 settimane dal 70% al 99% (Howard, 1989).
Cloroformio: esistono dati contadditori riguardo alla biodegradazione, poca o nessuna in aerobiosi, per alcuni invece dal 49-100% dopo 7 - 28 gg, anche se la maggior parte viene persa per volatilizzazione. In anaerobiosi pare che avvenga una lenta biodegradazione dopo
un periodo di acclimatamento (Howard, 1989).
PER: non si osserva biodegradazione nemmeno in aerobiosi in 25
settimane in batch con reflui inoculati, o pochissima in studi su colonne acclimatate per 1 anno. Solo il 3.75% del PER durante il trattamento di fanghi attivi si ritrova nell’effluente, la maggior parte viene
perso per volatilizzazione. In anaerobiosi si è osservata una lenta biodegradazione. Nel suolo la degradazione viene invece attribuita alla
volatilizzazione e all’adsorbimento (14gg) (Howard, 1989).
Tricloroetano: non si è osservata alcuna biodegradazione nè in acqua nè nel suolo. In un digestore anaerobico si è notata la formazione
di vinil-cloruro durante il trattamento delle acque reflue precedentemente inoculate (Howard, 1989).
286
Capitolo 10 ORGANOCLORURATIVOLATILI (VOC)
Diclorometano: si osserva una completa biodegradazione in aerobiosi in fanghi attivi da 6 ore a 7 gg. L’89-92% passa a CO2 con digestione anaerobica in acque reflue, previo acclimatamento (Howard,
1989).
La detossificazione di questi composti all’interno della pianta, tuttora oggetto di studio, si ipotizza che avvenga in 3 fasi: I) ossidazione,
riduzione e idrolisi; II) coniugazione (zuccheri, glutatione); III) metabolismo e trasporto. Il TCA principale prodotto di degradazione dei
VOC , potrebbe già essere un prodotto di detossificazione ( Plumacher J., P. Schroder, 1994).
In merito alla bioremedation si è osservato come la copertura vegetale possa essere utilizzata per promuovere attivamente l’efficienza
della flora microbica. La degradazione microbica del TCE, ad esempio, è risultata molto alta a livello di rizosfera in suoli contaminati
(Walton and Anderson, 1990).
I singoli VOC hanno infine un’emivita molto variabile e la degradazione fotochimica atmosferica in genere è poco significativa, ad eccezione del PER.
10.5. Piante
L ’u p t a k e di questi composti all’interno della pianta avviene attraverso gli stomi o dopo l’accumulo nella cuticola (Gaggi e Bacci, 1985)
Dati sperimentali recenti confermano come per TCE e per CB l’uptake dominante sia quello fogliare. Il TCA si muove invece in entrambe le direzioni. Le bioconcentrazioni sono riportate nella tabella
10.5 (Schroll et al., 1994)
Elevate concentrazioni di VOC sono state rilevate in foglie di piante sempreverdi (Gaggi e Bacci, 1985), scarsi invece sono i dati sulla fitotossicità di questi composti. Le conifere possono dunque essere
bioindicatori della situazione inquinante così come il TCA, principale prodotto di degradazione, diventa il composto più idoneo ad essere testato. Indagando sul contenuto di alcuni VOC (TCM, TCE, TET,
TRI, PER e TCA) negli aghi di conifere (Picea Abies e Pinus Sylvestris)
si è osservato che le concentrazioni di TCA nelle piante risultano più
287
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
elevate durante l’inverno in quanto probabilmente, la degradazione
atmosferica o la supposta metabolizzazione all’interno dagli aghi sarebbe ridotta. Si sono rilevate concentrazioni simili a quelle di altri
autori (0.1-2.3 µg/kg in aree urbane) eccetto per il TCA, presente intorno ai 7 µg/kg contro i 34 µg/kg di altri studi (riferiti ad aree urbane) (Plumacher J., P. Schroder, 1994).
Composto
TCE
TCA
Clorobenzene
Specie
vegetale
carote
ravanello
orzo
avena
lattuga
carota
ravanello
piante in suoli trattati
radici
fusti
15.2
49.8
660
518
24.4
45.1
33.1
4.4
63.9
970
760
40.9
90.6
40.3
piante in suoli non trattati
radici
9.8
n.a.
330
335
13.9
71.7
53.8
fusti
19.5
16.0
753
606
49.7
100.7
39.9
Tabella 10.5 - Fattori di bioconcentrazione di 14 C in un sistema chiuso
suolo-pianta 7 giorni dopo l'applicazione di composti organici marcati
al terreno (concentrazione nella pianta s.s./concentrazione nel suolo s.s.).
10.6 Animali
A causa della sua pressione di vapore, punto di ebollizione (121°C)
e carattere lipofilo, il tetracloroetilene (PER) è ormai un inquinante
ubiquitario ambientale, inclusi i tessuti umani (livelli di bakground antropogenico sono intorno ai 10 ppb).
Contaminazioni della catena alimentare al di sopra del valore soglia
dei 10 ppb sono state osservate in indagini sul contenuto di PER (> 1
ppm) nelle uova e nella carne di animali alimentati con foraggi contaminati, in olio d’oliva e cibi ricchi in grasso provenienti da aree in
prossimità dei luoghi di produzione o utilizzo di PER. Dal 1990 il
contenuto in PER del cibo è limitato da regolamentazioni legislative
in Germania a 100 ppb (Bauer, 1991).
I composti clorurati a corta catena sono stati per almeno 70 anni
utilizzati nella produzione industriale, negli ultimi 20 anni sono stati attentamente presi in esame e sono tuttora oggetto di studio a cau-
288
Capitolo 10 ORGANOCLORURATIVOLATILI (VOC)
sa della loro attività tossicologica a lungo termine quali mutagenicità
e carginogenicità. I più pericolosi risultano 1,2 dicloroetano, dicloroacetilene, cloruro di allile, 1,3 dicloropropene, 2,3 dicloropropene
(Eder, 1991).
Conclusioni
A causa delle modalità d’impiego e della loro, in genere, elevata
volatilità, i VOC risultano essere contaminanti dell’aria e da ricerche
effettuate sulla contaminazione delle acque di falda, in Italia, è risultato che i composti più frequentemente presenti sono il tetracloroetilene, il tricloroetilene e 1,1,1 tricloroetano.
Il tetracloroetilene (PER) è presente nell’acqua in concentrazioni al
di sotto di 1 ppb; nel suolo il PER va da 0.5 a 10 ppb, mentre in aree
produttive risulta tra i 10 e i 100 ppb e in siti contaminati la concentrazione sale a 1000 ppb.
Il valore medio di PER rilevato nell’atmosfera in aree per lo più urbane è di 6.6 µg/m3, altri dati oscillano da 1 a 5, con valori minori nelle aree rurali.
La degradazione dei VOC è variabile, il leaching è medio come pure
l’assorbimento radicale e la traslocazione. Pericoloso, data l’estrema
volatilità di questi composti, è invece l’assorbimento fogliare che può
dar luogo ad una possibile contaminazione del foraggio (molto tossico, ad esempio, è il metilcloruro).
La tossicità di questi composti, alcuni dei quali ormai ubiquitari (come il PER) è nota ormai da molti anni, ma limitazioni e misure preventive sono state adottate solo recentemente e soltanto da alcuni
Paesi (Germania 1990, dove la max concentrazione nel cibo di PER è
uguale a 100 ppb).
A causa della tossicità di queste molecole l’impiego agricolo dei fanghi dovrebbe tenere conto di questi limiti e adottare delle tecnologie
adeguate che garantiscano una rimozione efficiente durante il trattamento degli stessi (attraverso lo strippaggio, ecc.) e delle tecniche di
spandimento atte a limitare la volatilizzazione, quali l’iniezione sottosuperficiale dei fanghi .
289
LA TOSSICITÀ D E IF A N G H ID I
DEPURAZIONE
Bibliografia
BAUER U., (1991): Occurence of tetrach loroethylene in the Federal Republic of
Germany. Chemosphere, 23, n.11/12,
1777-1781.
CRATHORNE B., DONALDSON K . ,
JAMES H . A ., ROGERS H . R ., ( 1 9 8 9 ):
The determination of organic contami nants in UK sewage sludges. In: Organic
contaminants in wastewater, sludge and
s e d i m e n t, Ed. by D.Quaghebeur, I.
Temmerman and G. Angeletti. Elsevier Applied Science.
EDER E., (1991): Toxicology of C1-C3
chlorinated hydrocarbons. Chemosphere,
23, n. 11/12, 1783-1801.
FUNARI E., BASTONE A., BOTTONI
P ., DE DONNO D ., DONATI L ., PAGLIASOTTO M ., COCCINO S ., MOROSSI G., BRUN F., SALAMANA M.,
(1992): La contaminazione da organoclo rurati alifatici delle acque di falda in Ita lia. Acqua-Aria, 6, 529-540.
GAGGI C., BACCI E., (1985): Accumu lation of chlorinated hydrocarbons vapours
in pine needles. Chemosphere, 14, 451-456.
HOWARD P.H., (1989): Handbook of
Environmental Fate and Exposure Data
for organic chemicals , Vol. II, Lewis
Pub., Michigan, USA.
290
MELCER H., BELL J., T H O M P S O N
D., (1992): Predicting the fate of volatile
organic compounds in municipal wa stewater treatment plants. Wat. Sci. Tech.
25, n. 4/5, 383-389.
PETERSEN L.W., MOLDRUP P ., ELFARHAN Y.H., JACOBSEN O.H., YAMAGUCHI T ., ROLSTON D . E .,
(1995): The effect of moisture and soil tex ture on the adsorption of organic vapors.J.
Environ. Qual., 24, 752-759.
PLUMACHER J., SCHRODER P .,
(1994): Accumulation and fate of C1/C2chlorocarbons and trichloroacetic acid in
spruce needles from an Austrian moun tain site. Chemosphere, 29, 9-11, 24672476.
SCHROLL R., BIERLING B. , CAO G.,
DORFLER U., LAHANIATI M., LANGENBACH T., SCHEUNERT I.,
WINKLER R ., (1 9 9 4 ): Uptake patways
of organic chemicals from soil by agricul tural plants. Chemosphere, 28, 2, 297303.
WALTON B.T., ANDERSON T . A .,
(1990): Microbial degradation of trichlo roetylene in the rhizosphere: Potential ap plication to biological remedation of waste
sites. Appl. Environ. Microbiol., 56, n.4,
1012-1016.
La Fondazione Lombardia per
l’Ambiente è stata istituita
dalla Regione Lombardia nel 1986
come ente di carattere
morale e scientifico per valorizzare
l’esperienza e le competenze
tecniche acquisite in seguito al
noto incidente di Seveso del 1976.
La Fondazione ha come compito
statutario lo svolgimento di attività
di studi e ricerche volte a tutelare
l’ambiente e la salute dell’uomo con
particolare attenzione
agli aspetti relativi all’impatto
ambientale di sostanze inquinanti.
A tal fine collabora, nei
propri programmi di ricerca e
formazione, con le università
lombarde – rappresentate nel
consiglio di amministrazione – il
CNR, il Centro Comune
di Ricerca di Ispra e gli organismi
tecnici dei principali enti
di ricerca nazionali e regionali.
Il reimpiego in agricoltura dei fanghi di risulta de gli impianti di depurazione è ormai divenuta prati ca agronomica comune. L'ipotesi di riutilizzo fu for mulata circa 20 anni or sono e trovò la sua giustifi cazione nella necessità di ricuperare risorse carbo niose ed elementi di fertilità e favorire una più facile
ed economica gestione del problema rifiuti.
L'origine dei fanghi alimenta periodicamente dis cussioni che di volta in volta fanno riferimento al l'eccessivo apporto di metalli pesanti, alla diffusione
di patogeni e all'apporto di sostanze organiche xeno biotiche, nonché alla scarsa o nulla stabilizzazione
della componente organica.
In questi anni la ricerca scientifica ha prodotto sul l'argomento una considerevole mole di studi con l’in tento di conoscere nel modo più puntuale possibile
la composizione chimica dei fanghi stessi in modo
da poter quantificare i rischi e attuare le strategie
più idonee per minimizzare l'apporto di sostanze
estranee o comunque non compatibili con il siste ma suolo.
La redazione di un testo che raccolga le più impor tanti informazioni sulla presenza di molecole orga niche potenzialmente tossiche vuole colmare un vuo to esistente nella letteratura specifica e proporsi come
mezzo di rapida consultazione per chi è preposto al l'opera di controllo e/o di gestione.
Per tali ragioni l'opera è precipuamente rivolta ai
funzionari delle USSL, alle pubbliche amministra zioni, agli analisti che operano, a vari livelli, sia ne gli enti pubblici che presso le società di recupero e a
tutti gli operatori del settore che vogliono affrontare
in termini più circostanziati gli aspetti ambientali
del riutilizzo dei fanghi.
ISBN 88–8134–020–8
Scarica