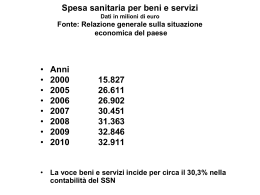
AGGIORNAMENTO NOTE LIMITATIVE AIFA Nota n. 1 Farmaco Gastroprotetori: Misoprostolo esomepromazolo lansoprazolo omeprazolo pantoprazolo misoprostolo+diclofenac G.U. N. 238 del 13/10/2009 Nota n. 3 Farmaco Farmaci per la terapia del dolore G.U. 4 Farmaco duloxetina gabapentin pregabalin N. 182 del 05/08/2008 e N. 286 del 9/12/2009 Nota n. 5 Farmaco Enzimi pancreatici: pancrelipasi G.U. Nel primo aggiornamento sono state estese le indicazioni di utilizzo al dolore post-ictus o da lesione midollare e alle mono-poli-multi neuropatie in base a specifici criteri diagnostici indicati dal tavolo neurologico dell’AIFA e riportati nel testo della nota (sez. evidenze disponibili) L’ultimo aggiornamento consiste nell’aver specificato, nel box della nota, che la duloxetina è rimborsabile in regime SSN, senza i vincoli della nota, per il trattamento del disturbo d’ansia generalizzato (GAD). Infatti a giugno 2009 il farmaco ha avuto un’estensione delle indicazioni È stata abolita. Gli enzimi pancreatici sono pertanto prescrivibili in regime SSN, senza limitazioni, in accordo alle indicazioni riportate in scheda tecnica N. 180 del 05/08/2009 Nota n. 10 Farmaco Ac. Folico, cianocobalamina, idrossicobalamina G.U. È stata abolita. Il tramadolo è pertanto prescrivibile in regime SSN, senza limitazioni, in accordo alle indicazioni riportate in scheda tecnica N. 238 del 13/10/2009 Nota n. G.U. L'aggiornamento consiste nell'esclusione del rabeprazolo tra i medicinali prescrivibili con nota 1 e nel riportare le avvertenze relative alla possibile interazione tra clopidogrel e IPP È stata abolita. Acido Folico, cianocobalamina, idrossicobalamina sono pertanto prescrivibili in regime SSN, senza limitazioni, in accordo alle indicazioni riportate in scheda tecnica N. 105 del 07/05/2011 Nota n. 13 Farmaco Ipolipemizzanti Fibrati: bezafibrato, fenofibrato, gemfibrozil Statine: atorvastatina, fluvastatina, lovastatina, pravastatina, rosuvastatina, simvastatina Altri: omega 3 etilesteri, ezetimibe Tolti sequestranti acidi biliari nell’ultima versione di aprile 2013 Da luglio 2011 sono state apportate delle modifiche: suddivisione delle statine in 1° e 2° livello, con indicazioni sulla loro utilizzazione in funzione del rischio individuale del paziente e dei valori target di LDL da raggiungere; introduzione di ezetimibe; ipercolesterolemia poligenica, dislipidemie familiari, iperlipidemie in pazienti con IRC e iperlipidemie indotte da farmaci sono le nuove indicazioni d’impiego; sostituzione delle Carte di Rischio Cuore con i criteri delle LG AHA/ACCe, ESC/EASD. Con il provvedimento di novembre 2012 sono state reintrodotte le carte del rischio CV e non è più prevista la suddivisione delle statine in primo e secondo livello. Tra gli ipolipemizzanti sono stati introdotti anche i sequestranti degli acidi biliari limitatamente al trattamento di 3° livello nelle dislipidemie familiari G.U. N. N. N. N. 72 del 27/03/2007 163 del 15/07/2011 277 del 27/11/2012 83 del 9/04/2013 Nota n. Farmaco 36 Testosterone G.U. N. 270 del 22/11/2010 Nota n. Farmaco 39 Ormone della crescita (somatropina) G.U. N. 238 del 13/10/2009 N. 286 del 9/12/2009 N. 270 del 18/11/2010 La Determina AIFA 26 marzo 2013 ha apportato alcune modifiche: - nei livelli di rischio oltre a quello moderato, alto e molto alto è stato inserito quello medio, per il quale il target terapeutico è LDL <130 e il trattamento di 1° livello è la modifica dello stile di vita per almeno 6 mesi, mentre quello di 2° livello è rappresentato dall’assunzione di statine, esclusa la rosuvastatina. - Nelle tabelle riportanti i trattamenti di 1° livello per le diverse patologie, sono state aggiunte a simvastatina, pravastatina e atorvastatina, la fluvastatina e la lovastatina. - Sono state introdotte delle modifiche relative ai PUFA N3: - non sono più prescrivibili a carico del SSN per i pazienti in trattamento con statine con HDL basse e/o trigliceridi elevati: il farmaco di prima scelta è il fenofibrato; - sono prescrivibili a carico del SSN nei pazienti con IRC moderata e grave con valori di trigliceridi ≥500 mg/dl; - sono prescrivibili a carico del SSN analogamente ai fibrati, per le iperchilomicronemie e le gravi ipertrigliceridemie; - la loro prescrizione per la prevenzione secondaria in soggetti post-infartuati non è più a carico del SSN. - Eliminato il principio attivo metiltestosterone - Specificata la tipologia di ipogonadismi primitivi e secondari che devono essere caratterizzati da “ridotte concentrazioni di testosterone totale (< 12 nmoli/L o 350 mg/dl), in presenza di sintomi tipici (riduzione desiderio e potenza sessuale, osteoporosi, riduzione forza muscolare, obesità viscerale, alterazioni del tono dell’umore)” - Eliminata la condizione di pubertà ritardata Nella prima revisione sono state estese le indicazioni dell’età evolutiva includendo i bambini nati piccoli per l’età gestazionale (GSA) con età ≥ a 4 anni (autorizzazione al trattamento per 2 anni e relativo monitoraggio) ed è stata introdotta l’età di transizione Nella seconda revisione sono state riportate modifiche al testo in riferimento al trattamento dei soggetti prepuberi affetti dalla sindrome di Prader Willi (PWS). Nella terza revisione è stata inserita l’età neonatale, in individui con evidenza neuroradiologica di malformazioni/lesioni ipotalamo-ipofisarie e segni clinici laboratoristici compatibili con la diagnosi di panipopituitarismo congenito Nota n. 42 Farmaco Bifosfonati: acido etidronico acido clodronico G.U. N. 238 del 13/10/2009 Nota n. 55 Farmaco Antibiotici iniettabili per uso extraospedaliero: ceftazidime cefepime mezlocillina piperacillina ampicillina-sulbactam piperacillina+tazobactam amikacina gentamicina netilmicina tobramicina G.U. L’aggiornamento consiste nell’aver aggiunto, nella sezione particolari avvertenze, la seguente frase: “Di recente, l’Advisory Committee dell’FDA ha pubblicato un warning circa l’eventuale insorgenza di dolore severo, talora disabilitante, a livello osseo, articolare o muscolare associato alla assunzione di bifosfonati. Tale sintomatologia differisce dalla sindrome acuta similinfluenzale (acute-phase reaction APR) caratterizzata da febbre, raffreddore, dolore osseo, artralgia e mialgia che comunemente si osserva in seguito a somministrazione endovenosa dei bifosfonati iniettabili" Sono state tolte tutte le cefalosporine di II generazione e tra quelle di III/IV sono rimaste solo ceftazidime e cefepime La prescrizione a carico del SSN è limitata alle seguenti condizioni: -trattamento iniettivo di infezioni gravi delle vie respiratorie, delle vie urinarie, dei tessuti molli, intraaddominali, ostetrico-ginecologiche, ossee e articolari; -trattamento iniettivo delle infezioni causate da microrganismi resistenti ai più comuni antibiotici, particolarmente nei pazienti immunocompromessi N. 238 del 13/10/2009 Nota n. 56 Farmaco Antibiotici per continuità ospedale-territorio Aztreonam imipinem+ cilastatina rifabutina teicoplanina La variazione è di tipo formale; nella sezione "evidenze disponibili" al punto 2) è stato riportato: monobattami (aztreonam); efficaci verso i soli gramnegativi “difficili” anzichè farmaci efficaci verso i soli gram-negativi “difficili", simili, nei riguardi di questi, alle cefalosporine di III e IV generazione (aztreonam) N. 268 del 17/11/2009 N. 150 del 30/06/2011 La seconda variazione ha riguardato: • l'esclusione dalla nota dei principi attivi ertapenem e meropenem • la possibilità per il MMG di iniziare il trattamento con gli antibiotici, senza che questo sia iniziato in ospedale. La nota specifica che la decisione da parte del MMG di intraprendere il trattamento debba essere sostenuta da un'adeguata indagine microbiologica, documentata efficacia del farmaco e assenza di alternative terapeutiche G.U. Nota n. Farmaco G.U. n. 57 Antiemetici (antagonisti dei recettori serotoninegici) N.180 del 05/08/2009 È stata abolita. Gli antagonisti dei recettori serotoninergici sono pertanto prescrivibili in regime SSN , senza limitazioni, in accordo alle indicazioni riportate in scheda tecnica Nota n. 59 Farmaco Lattilolo, lattulosio G.U. n. N.104 del 07/05/2011 Nota n. 65 Farmaco Farmaci per la sclerosi multipla: glatiramer acetato interferoni beta 1a e beta 1b ricombinanti Fingolimod cloridrato G.U. Nota n. Farmaco G.U. N. 182 del 05/08/2008 N. 75 del 31/03/2009 N. 194 del 22/08/2012 66 Antinfiammatori non steroidei N. 194 del 21/08/2012 Nota n. 74 Farmaco Farmaci per l’infertilità femminile e maschile: follitropina α ricombinante follitropina β ricombinante lutropina α menotropina urofollitropina follitropina α + lutropina α coriogonadotropina α G.U. Nota n. Farmaco G.U. N. 81 del 05/04/2008, N. 156 del 08/07/2009, N.113 del 17/05/2010 75 Farmaci per la disfunzione erettile: alprostadil sildenafil vardenafil tadalafil N. 279 del 29/11/2010 È stata abolita. Lattulosio e lattilolo sono pertanto prescrivibili in regime SSN, senza limitazioni, in accordo alle indicazioni riportate in scheda tecnica Nella prima revisione è stato specificato che la sclerosi multipla recidivante-remittente è diagnosticata secondo i criteri di Polman (Polman, 2005) con punteggio sull’Expanded Disability Status Scale (EDSS) tra 1.0 e 5.5 Nella seconda revisione sono state apportate delle modifiche alle sezioni evidenze disponibili e bibliografia. Nella terza revisione è stato introdotto il farmaco fingolimod per i pazienti con sclerosi multipla recidivante - remittente (SMRR) grave ad evoluzione rapida, definita da due o più recidive disabilitanti in un anno, e con 1 o più lesioni captanti gadolinio alla RM cerebrale o con un aumento significativo del carico lesionale in T2 rispetto ad una precedente RM recentemente effettuata La prescrizione della sola nimesulide è limitata al trattamento di breve durata del dolore acuto nell'ambito delle seguenti patologie: • Artropatie su base connettivitica; • Osteoartrosi; • Dolore neoplastico; • Attacco acuto di gotta Rispetto alla nota originaria, sono soggetti alla nota 74 anche l’associazione follitropina α + lutropina α (Pergoveris) entrata in commercio nel 2008 e la coriogonadotropina α (Ovitrelle) che è stata riclassificata in fascia A a luglio 2009 L’ultima modifica riguarda l'integrazione dell'indicazione all'utilizzo dei farmaci per il trattamento dell'infertilità maschile. Nella nota è specificato che il trattamento va effettuato "in maschi con ipogonadismo-ipogonadotropo con livelli di gonadotropine bassi o normali o comunque con FSH non superiore a 8 mUI/ml." La prescrizione di alprostadil a carico del SSN è limitata ai pazienti con disfunzione erettile da lesioni permanenti e complete del midollo spinale o del plesso pelvico iatrogene, traumatiche o infiammatorie/degenerative. La prescrizione di inibitori della PDE5 (sildenafil, tadalafil, vardenafil) a carico del SSN è limitata ai pazienti con disfunzione erettile da danno transitorio o parziale del midollo spinale o del plesso pelvico secondo un piano terapeutico specialistico (andrologo, endocrinologo, neurologo o urologo) Nota n. 76 Farmaco Ferrico gluconato, ferromaltoso, ferroso gluconato, ferroglicinalsolfato G.U. Nota n. G.U. N. 106 del 09/05/2011 78 N.284 del 04/12/2010 Nota n. 79 Farmaco Bifosfonati: ac. alendronico ac. risedronico ac. ibandronico ac. Alendronico vitamina D3 ac. zoledronico raloxifene bazedoxifene ranelato di stronzio teriparatide ormone paratiroideo G.U. N. 150 del 01/07/2009 N. 180 del 05/08/2009 N. 137 del 15/06/2011 N.220 19/09/2013 N. 295 17/12/2013 Nota n. 83 Farmaco Sostituti lacrimali G.U. Nota n. È stata abolita. Ferrico gluconato, ferromaltoso, ferroso gluconato, ferroglicinalsolfato sono pertanto prescrivibili in regime SSN , senza limitazioni, in accordo alle indicazioni riportate in scheda tecnica N. 286 del 09/12/2009 85 E’ stata abolita dal 5/12/2010 I colliri antiglaucoma di cui alla ex nota 78 sono pertanto prescrivibili in regime SSN , senza limitazioni, in accordo alle indicazioni riportate in scheda tecnica Nella prima revisione sono state estese le indicazioni della teriparatide: Soggetti di età superiore a 50 anni in trattamento da più di 12 mesi con dosi > 5 mg/die di prednisone o dosi equivalenti di altri corticosteroidi e che si presentano con una frattura vertebrale severa o due fratture vertebrali moderate. La nota si applica su diagnosi e piano terapeutico, della durata di 6 mesi prolungabile di ulteriori periodi di 6 mesi per non più di altre due volte (per un totale complessivo di 18 mesi), di centri specializzati, Universitari o delle Aziende Sanitarie, individuate dalle Regioni e dalle Province autonome di Trento e Bolzano Nella seconda revisione è stato eliminato l'acido zolendronico dall'elenco dei principi attivi, erroneamente inserito nella precedente versione Nella terza revisione è stato introdotto il principio attivo bazedoxifene ed è stata prolungata la durata della terapia con teripararatide ed ormone tiroideo a due anni (il PT può essere rinnovato 3 volte anziché solo 2) Introduzione del piano terapeutico AIFA, da rinnovare ogni 6 mesi, per la prescrizione del Ranelato di Stronzio. Individuazione dei centri abilitati alla redazione del PT: - Endocrinologia e Malattie Ricambio - Geriatria - Malattie metaboliche e Diabetologia - Medicina generale - Medicina interna - Medicina mal. metaboliche dell'osso - Recupero e rieducazione funzionale - Reumatologia Abolizione del piano terapeutico AIFA per la prescrizione del Ranelato di Stronzio È stata aggiunta, nella sezione background, la frase: "Il carbopol è un polimero che ha dimostrato una certa efficacia nel trattamento della xeroftalmia di pazienti affetti da malattia di Sjögren” Nella prima revisione è stata introdotta la memantina tra i farmaci rimborsabili per la terapia della malattia di Alzheimer limitandola al trattamento di grado moderato con MMSE tra 10 e 20. Donepezil, rivastigmina, galantamina rimangono prescrivibili nei pazienti con malattia di Alzheimer di grado lieve, ma sono specificati i valori di MMSE (tra 21 e 26) e di grado moderato con MMSE tra 10 e 20 Farmaco Inibitori dell'acetilcolinesterasi: donezepil galantamina rivastigmina La seconda revisione è di tipo formale in quanto hanno aggiunto la classe farmacologica di appartenenza della memantina ovvero gli antagonisti del recettore del glutammato Antagonisti del recettore per il glutammato: memantina G.U. N. 65 del 19/03/2009 e N. 238 del 13.10.2009 Nota n. 90 Farmaco Metilnaltrexone G.U. N. 141 del 20/06/2009 Nota n. 91 Farmaco Febuxostat G.U. N. 265 del 12/11/2010 Nota n. 92 Farmaco Benzilpenicillina benzatinica G.U. Nota n. N. 128 del 04/06/2012 93 La prescrizione di metilnaltrexone a carico del SSN è limitata alle seguenti condizioni: Costipazione indotta da oppiacei in soggetti con malattia in stato terminale che rispondano contemporaneamente alle seguenti caratteristiche: - terapia continuativa con oppiacei della durata di almeno di 2 settimane; - resistenza al trattamento con lassativi ad azione osmotica per più 3 giorni. La prescrizione di febuxostat a carico del SSN è limitata alla seguente condizione: trattamento dell’iperuricemia cronica con anamnesi o presenza di tofi e/o di artrite gottosa in soggetti che non siano adeguatamente controllati con allopurinolo o siano ad esso intolleranti La prescrizione e la dispensazione della benzilpenicillina benzatinica o benzatilpenicillin, a carico del SSN, è limitata alle seguenti condizioni: 1. profilassi della malattia reumatica in soggetti con infezioni delle prime vie respiratorie sostenute da streptococchi del gruppo A. Profilassi delle recidive della malattia reumatica; 2. sifilide Il farmaco deve essere prescritto e dispensato, a carico del SSN, direttamente dai Centri specialistici delle Aziende sanitarie regionali o a Direzione universitaria, degli Istituti di Ricovero e Cura a carattere scientifico e delle strutture accreditate con il SSR La prescrizione del farmaco Buccolam a carico del SSN è Farmaco G.U. Midazolam N. 99 del 29/04/2013 Nota n. 94 Farmaco N3 PUFA con contenuto di EPA+DHA esteri etilici 85% minimo pari a 850 mg/g G.U. N. 285 del 05/12/2013 limitata alle seguenti condizioni patologiche: 1. trattamento acuto delle crisi nelle epilessie dell'età pediatrica con elevato rischio di occorrenza di crisi prolungate (durata maggiore di 5 minuti) o di stato di male epilettico: Forme idiopatiche; Sindrome di Dravet; Sindrome di Panayiotopoulos 2. Trattamento acuto delle crisi nelle altre epilessie dell'età pediatrica, dopo un precedente episodio di crisi prolungata (durata maggiore di 5 minuti) o di stato di male epilettico: Forme idiopatiche;Forme sintomatiche a varia eziologia La nota è valida limitatamente a Midazolam oromucosale siringhe pre-riempite da 2,5, 5, 7,5 e 10 mg. La prescrizione è soggetta a diagnosi e PT da parte di centri ospedalieri/specialisti in pediatria, neurologia, neuropsichiatria infantile. La prescrizione di N3 PUFA è a carico del SSN solo se rispondente a una delle seguenti condizioni: - ricovero per sindrome coronarica acuta con o senza innalzamento del tratto ST (sindrome coronarica acuta SCA-STE, sindrome coronarica acuta SCA-NSTE) - sofferta sindrome coronarica acuta con o senza innalzamento del tratto ST (sindrome coronarica acuta SCA-STE, sindrome coronarica acuta SCA-NSTE) nei precedenti 90 giorni. Nei pazienti con SCA-STE è necessaria la presenza di: - sopraslivellamento del tratto ST di almeno 0,1 mV in almeno due derivazioni contigue o blocco di branca sinistra di recente (<24 ore) insorgenza - alterazioni di biomarcatori indicativi di danno miocardico. Nei pazienti con SCA-NSTE è necessaria la presenza di: - alterazioni di biomarcatori indicativi di danno miocardico. La durata del ciclo di trattamento rimborsabile è di: - 12 mesi nei pazienti con frazione di eiezione alla dimissione ospedaliera > 40% - 18 mesi nei pazienti con frazione di eiezione < 40% alla dimissione ospedaliera. [ultimo aggiornamento aprile 2014, le ultime revisioni sono riportate in rosso]
Scarica