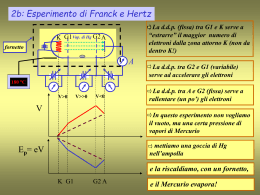
5) Modello atomico di BOHR (pag.92 par.3 - parziale- ) PREMESSA: LIMITI DEL MODELLO DI RUTHERFORD Il “modello planetario dell’atomo” sostenuto da Rutherford si adattava bene a molti dati sperimentali ma presentava anche dei grossi limiti. Ciò che venne contestato a Rutherford non era il suo modello, ovvero il fatto che l’atomo fosse costituito da un nucleo attorno al quale ruotavano gli elettroni, ma le motivazioni che egli sosteneva per giustificare il fatto che gli elettroni non cadevano sul nucleo cioè che forza di attrazione elettrostatica fosse bilanciata dalla forza centrifuga determinata dal moto di rotazione. In base alle leggi dell’elettromagnetismo infatti, una particella dotata di carica elettrica che percorre una traiettoria chiusa emette radiazioni elettromagnetiche perdendo continuamente energia cinetica. Come conseguenza, gli elettroni, a differenza dei pianeti che non sono carichi, perdendo via via energia cinetica, dovrebbero rallentare il loro moto circolare ma ciò comporterebbe una progressiva diminuzione della forza centrifuga che, pertanto, non sarebbe più sufficiente a controbilanciare l’attrazione esercitata dal nucleo. Gli elettroni quindi, contrariamente a quanto sostenuto da Rutherford, dovrebbero percorrere orbite sempre più piccole, cioè una traiettoria a spirale sempre più stretta, fino a cadere in un decimilionesimo di secondo sul nucleo. In realtà invece gli atomi sono stabili e i loro elettroni non cadono sul nucleo. LA TEORIA QUANTISTICA Per giustificare questa contraddizione, Niels Bohr sostenne che le leggi della fisica classica ricavate dallo studio dei corpi macroscopici non potevano essere applicate al movimento di particelle microscopiche e dotate di carica come l’elettrone e che il modello atomico doveva essere invece interpretato utilizzando una nuova teoria fisica, proposta nel 1900 dal fisico tedesco Max Planck, la teoria quantistica. Secondo la teoria quantistica, in qualunque processo fisico, l’energia (E) non è emessa in modo continuo, cioè in quantità piccole a piacere, ma sotto forma di pacchetti costituiti da quantità determinate, definite, di E, dette “quanti”. Per comprendere questo concetto, si può pensare ai gradini di una scala: per poter salire un gradino, è necessario utilizzare una quantità di E ben precisa, una quantità minore non ci consentirebbe mai di alzare il piede di un’altezza sufficiente: la quantità di E necessaria per salire il gradino, può essere considerata un quanto di E. Questa teoria, riguardando ogni forma di E, fu applicata anche alla luce (E luminosa), il “mezzo” utilizzato da Bohr per studiare la struttura atomica (ancora oggi, quasi tutto quello che sappiamo sulla struttura elettronica degli atomi proviene dall’analisi della luce emessa o assorbita dalle sostanze). LA DOPPIA NATURA DELLA LUCE (pag.86-90 par.1) La teoria quantistica ha permesso di attribuire alla luce una doppia natura: natura ondulatoria e natura corpuscolare, superando le ipotesi precedenti, secondo cui i fenomeni luminosi venivano spiegati considerando la luce talvolta in base ad un modello (ondulatorio) e talvolta in base all’altro (corpuscolare). La diffrazione e l’interferenza sono fenomeni luminosi (derivati dall’interazione di due raggi luminosi) che si interpretano facilmente utilizzando il modello ondulatorio. I fenomeni che derivano dall’interazione della luce con la materia, si interpretano invece agevolmente scegliendo il modello corpuscolare. La natura ondulatoria della luce La luce è un tipo di radiazione elettromagnetica (Maxwell, metà 1800) La radiazione elettromagnetica è una forma di E che si propaga nello spazio sotto forma di onde (rapidissima oscillazione di cariche elettriche). L’insieme delle onde elettromagnetiche costituisce lo spettro elettromagnetico. I parametri che caratterizzano le onde elettromagnetiche sono la velocità, la lunghezza d’onda () e la frequenza (). La velocità è il parametro che accomuna le onde: nel vuoto esse viaggiano con v = 300.000 km/s (= c). La lunghezza d’onda = distanza tra due picchi (massimi o minimi) successivi, si esprime in metri, nanometri (nm) o in ångstrom (Å). La frequenza = numero di oscillazioni (max o min) al secondo, si misura in Hertz (Hz) (1Hz = 1 s-1) La lunghezza d’onda e la frequenza sono in relazione tra loro (inversamente proporzionali: = c /) Il fenomeno della diffrazione è la prova più evidente della natura ondulatoria della luce. Se un fascio di luce attraversa fenditure molto piccole (dimensioni confrontabili con la dell’onda luminosa), dopo la fenditura esso non si propaga più in linea retta ma si allarga a ventaglio (invadendo anche la zona d’ombra) formando zone chiare e scure alternate dette frange di interferenza. (interferenza positiva) scura si forma dove le onde sono in opposizione di fase (interferenza negativa) La natura corpuscolare della luce L’effetto fotoelettrico, scoperto dal fisico tedesco Philipp Lenard nel 1902, è la prova che la luce ha anche natura corpuscolare. Tale fenomeno consiste nell’espulsione di elettroni dalla materia quando interagisce con la luce. Dispositivo di rilevamento dell’effetto fotoelettrico P. Lenard, nei suoi esperimenti misurò sia il numero di elettroni emessi in un secondo che la loro velocità. Notò che se utilizzava una radiazione più intensa il numero di e- emessi aumentava ma non aumentava la loro velocità. Per aumentare la velocità occorreva utilizzare una radiazione a frequenza maggiore. Notò anche che, al di sotto di una frequenza minima, l’effetto fotoelettrico non si manifestava, anche se la radiazione era particolarmente intensa. Un tale comportamento non trova spiegazioni in termini ondulatori. Si spiega, invece, se ciascun raggio di luce viene considerato un insieme di “pacchetti” di E , tanto più grandi quanto più alta è la frequenza del raggio e tanto più numerosi quanto più il raggio è intenso. Affinché gli e- possano essere espulsi dal metallo colpito dalla luce, devono acquistare l’E necessaria a vincere la forza attrattiva che li lega al metallo stesso: -se i “pacchetti” di E che arrivano uno dopo l’altro sul metallo, seppur numerosi, sono troppo deboli, non si ha emissione di e-, -se l’elettrone, invece, riceve un pacchetto di E abbastanza grande, ne utilizza una parte per allontanarsi dal metallo e la parte restante per acquisire velocità. Tanto più è grande il pacchetto di E, cioè maggiore è la frequenza del raggio, tanto più grande è la velocità con cui l’e- esce dal metallo. A questi “pacchetti “ di E elettromagnetica è stato dato il nome di fotoni o di quanti di E luminosa. La luce e tutte le radiazioni elettromagnetiche sono composte da fotoni capaci di cedere la loro E agli e- con cui interagiscono. Secondo la relazione di Planck-Einstein, E e ν sono direttamente proporzionali: E=h·ν dove: E = energia del fotone ν = frequenza elettromagnetica h = costante di Planck ( = 6,63 · 10 -34 J · s) All’aumentare della frequenza, aumenta l’E trasportata dalla radiazione elettromagnetica: un fotone di luce rossa ha E minore di un fotone di luce violetta. Poichè = c /: E = h · c / ovvero all’aumentare della lunghezza d’onda, diminuisce l’E trasportata dal fotone. Queste due formule evidenziano i due aspetti della natura della luce: - nella propagazione e nell’aggiramento di piccoli ostacoli, la luce evidenzia il suo comportamento ondulatorio, caratterizzato da una certa ν e da una determinata λ - nell’interazione con la materia (ed i suoi e-) emerge il suo aspetto corpuscolare: un raggio di luce si comporta come un insieme di fotoni a ciascuno dei quali corrisponde una precisa E. I fotoni sono privi di massa e devono essere considerati “pacchetti di E” e non “particelle di materia”. Il termine corpuscolare indica quindi soltanto che la luce ha natura discontinua. SINTESI teoria quantistica Secondo la teoria quantistica, la luce e ogni radiazione elettromagnetica sono costituite da pacchetti di energia, detti quanti di energia o fotoni. Ad ogni fotone è associata una determinata quantità di E. Radiazioni con frequenza maggiore sono formate da fotoni con E maggiore. LO STUDIO DELLO SPETTRO ATOMICO (pag.91 par.2) Ciò che suggerì a Bohr di utilizzare la teoria quantistica per interpretare la struttura dell’atomo fu lo studio dello spettro dell’atomo di idrogeno e di alcuni altri elementi. Lo spettro è il risultato della scomposizione della luce visibile nelle sue componenti a differente frequenza (corrispondenti a colori diversi): l’arcobaleno è uno spettro della luce solare ottenuto quando questa attraversa le goccioline di acqua presenti nell’atmosfera (fig.3.6 pag.91). In laboratorio lo spettro è ottenuto facendo passare un raggio luminoso attraverso un prisma di vetro: - lo spettro della luce solare, ma anche quello della luce emessa da solidi, liquidi e gas compressi portati all’incandescenza (quando gli atomi sono sollecitati da una scarica elettrica o da una fiamma, si eccitano, cioè acquistano energia che poi rilasciano sotto forma di radiazioni luminose), è uno spettro continuo, cioè costituito da una serie continua di radiazioni di tutti i colori (come l’arcobaleno); - lo spettro dei gas e dei vapori a bassa pressione, se portati ad elevata temperatura o sottoposti ad una scarica elettrica, è invece uno spettro a righe, cioè discontinuo, costituito da una successione di righe di colore diverso, ben separate tra loro. Lo spettro continuo è una serie di colori che si susseguono senza discontinuità, tipico dei solidi, dei liquidi e dei gas compressi (alta pressione) portati all’incandescenza. Lo spettro a righe, tipico dei gas rarefatti sottoposti a scarica elettrica, è formato da righe colorate discontinue (righe di emissione). La luce emessa dagli atomi non è continua e presenta soltanto alcune frequenze, caratteristiche per ciascun tipo di atomo. Poiché i gas o i vapori di ogni elemento presentano uno spettro a righe specifico, diverso da quello di ogni altro elemento, Bohr ipotizzò che ogni spettro fosse determinato dalla struttura intima dell’atomo che lo produce (lo spettro di ogni atomo è detto anche spettro atomico), ovvero dal contenuto energetico degli elettroni in esso presenti. Inoltre, poiché l’E emessa dagli elettroni è discontinua (come dimostra lo spettro a righe), Bohr ipotizzò che il contenuto energetico dell’elettrone, allo stesso modo del contenuto energetico della luce (come formulato dalla teoria quantistica), fosse quantizzato, cioè potesse avere solo determinati livelli di energia e non altri. Per comprendere questo fenomeno si può paragonare l’elettrone ad una pallina che si sposta da una quota più alta ad una più bassa. Se tale caduta avvenisse per rotolamento lungo un piano inclinato, l’energia della pallina diminuirebbe gradualmente in modo continuo, se invece la pallina (ed è ciò che accade all’e-) è costretta a scendere lungo dei gradini, la sua energia diminuisce in maniera discontinua. Il MODELLO ATOMICO DI BOHR (pag. 92-93 par.3) In base a queste considerazioni, Bohr elaborò un modello atomico che si basa sui seguenti postulati: 1) Gli e- percorrono solo determinate orbite circolari a distanze fisse dal nucleo, chiamate “orbite stazionarie”, ad ognuna delle quali corrisponde un preciso contenuto energetico: le orbite sono cioè quantizzate. 2) Il valore in pm (1 pm = 10-12 m) dei raggi delle orbite descritte dagli e- è ricavabile dalla seguente formula: r = 53 · n2 dove n è un numero chiamato numero quantico principale che può assumere tutti i valori interi e positivi da 1 a infinito (n = 1, 2, 3, 4, 5, 6, 7, ecc.) Risolvendo risulta: per n = 1 r = 53 pm ; per n = 2 r = 212 pm; per n = 3 r = 477 pm, ecc. All’aumentare di n aumenta la distanza degli elettroni dal nucleo e, di conseguenza, il contenuto energetico degli e- : il valore di E più basso si ha quando n = 1, cioè quando l’elettrone occupa l’orbita più vicina al nucleo (all’aumentare della distanza dell’e- dal nucleo aumenta la sua E potenziale). L’atomo di Bohr Le orbite degli elettroni in un atomo sono quantizzate. Il numero quantico principale n indica il livello energetico associato a ogni orbita. Il livello più basso di energia è detto stato fondamentale. I livelli a energia superiore dello stato fondamentale si chiamano stati eccitati. 3) Quando l’elettrone ruota su un’orbita stazionaria non assorbe e non emette energia. 4) Un elettrone può passare da un’orbita stazionaria all’altra (transizione energetica) solo assumendo o perdendo un valore quantizzato di E: 1 fotone per ogni livello, con E corrispondente alla differenza di energia tra le due orbite. Non è mai possibile all’elettrone acquistare o perdere quantità di energia frazionarie e quindi occupare orbite intermedie. Se l’elettrone acquista E (si dice che passa dallo stato fondamentale a quello eccitato) si trasferisce su livelli più esterni, se perde E si trasferisce su livelli più interni ma non potrà mai cadere sul nucleo in quanto l’orbita corrispondente al livello di E più basso è comunque distante 53 pm dal nucleo 5) Quando l’elettrone perde E, l’atomo emette una luce caratteristica che, se appartiene alla parte visibile dello spettro elettromagnetico, compare come riga colorata nello spettro a righe: nello spettro si vedranno tante righe quanti sono i salti di livello compiuti. L’emissione di E per ogni specifico salto di livello corrisponde ad un fotone avente determinata frequenza: a un salto energetico maggiore corrisponde l’emissione di un fotone avente frequenza maggiore (vedi anche fig.slide 18). Ogni transizione dell’elettrone da uno stato eccitato a un livello energetico inferiore è caratterizzata da una riga nello spettro di emissione: si registrano quindi tante righe quante sono le transizioni. L’insieme delle righe che compaiono nella porzione visibile dello spettro dell’atomo di H è detto serie di Balmer. Conclusione atomo di Bohr Attraverso i suoi studi, Bohr riuscì a spiegare l’emissione degli spettri a righe e perché soltanto certe radiazioni possono interagire con gli atomi: l’elettrone può assorbire e poi riemettere solo quantità definite di E. L’emissione di luce dei gas rarefatti si ha in seguito al trasferimento di energia dalla luce, dal calore o dalla scarica elettrica, agli atomi che costituiscono il gas: un fotone che viene assorbito da un atomo, cede tutta la sua energia a uno dei suoi elettroni che passa a uno stato energetico più elevato. L’atomo si trova così in uno stato eccitato che è instabile. Dopo un intervallo di tempo molto breve (10-8 s), l’elettrone torna allo stato fondamentale cedendo l’energia acquistata, sotto forma di fotoni. Ad ogni “salto d’orbita” corrisponde l’emissione di un fotone (transizione energetica). Il passaggio di un elettrone tra livelli energetici diversi (il passaggio può essere diretto, es da E5 a E1 oppure graduale, es. da E5 a e4, da E4 a E3 ecc) comporta l’emissione di fotoni con E diversa e quindi con frequenza e colore diversi. Nel modello atomico di Bohr le orbite sono rappresentate da circonferenze concentriche con centro nel nucleo e con raggio crescente al crescere di n. La configurazione elettronica, cioè la rappresentazione della distribuzione elettronica dell’atomo di H (Z = 1) allo stato fondamentale, secondo il modello di Bohr è pertanto la seguente: l’elettrone si trova al suo livello di E più basso, cioè alla minima distanza dal nucleo, ovvero nell’orbita corrispondente a n=1 (l’elettrone si trova a livelli superiori quando l’atomo è eccitato) Estensione del modello di BOHR: Modello atomico a livelli (o a strati) Un’estensione del modello di Bohr, detta anche Modello atomico a livelli o a strati, permette di rappresentare la configurazione, allo stato fondamentale, di tutti gli atomi appartenenti ai gruppi A (le prime due e le ultime sei colonne) della Tavola periodica, applicando le seguenti regole: - nell’orbita con n = 1 possono essere presenti al massimo due elettroni - nelle successive orbite possono essere presenti al massimo otto elettroni - a partire dall’elemento con Z = 31 (Gallio) la configurazione deve essere disegnata tenendo solo conto del periodo (riga o sequenza orizzontale) e del gruppo (colonna o sequenza verticale) cui appartiene l’atomo e non del numero effettivo dei suoi elettroni: il numero del periodo corrisponde al numero delle orbite (livelli energetici), il numero del gruppo corrisponde al numero degli elettroni sull’ultima orbita. Es. Gallio: 4° periodo = 4 orbite (4 livelli energetici) III gruppo = 3 elettroni nell’orbita esterna
Scaricare