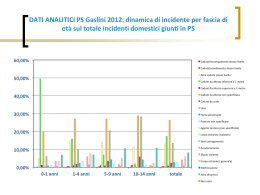
Volume 40 - Numero 2 - Agosto 2008 GASLINI Rivista di Pediatria e di Specialità Mediche RICERCA CLINICA APPLICATA Le cellule staminali mesenchimali: nuove protagoniste nell’immunoregolazione Due nuovi farmaci per il trattamento dell’artrite idiopatica giovanile La genetica delle epilessie e le epilessie genetiche Un’esperienza di percorso di miglioramento: fast track in chirurgia La prevenzione degli eventi traumatici accidentali del minore in ospedale Miglioramento continuo delle cure in neonatologia: la gestione del rischio iatrogeno CASO CLINICO FORUM: QUALITÀ DELLE CURE Cos’è Joint Commission International Un ragazzo con febbre e pericardite L’accreditamento secondo Joint Commission: una opportunità di crescita per le organizzazioni sanitarie QUIZ RADIOLOGICO Istituto Giannina Gaslini - Genova QUIZ DERMATOLOGICO Edizioni Minerva Medica GASLINI RIVISTA DI PEDIATRIA E SPECIALITÀ PEDIATRICHE Vol. 40 Agosto 2008 N. 2 INDICE 67 91 EDITORIALE Un ragazzo con febbre e pericardite Il Gaslini ha 70 anni Filocamo G., Parodi A., Sorrentino S., Damasio M. B., Buoncompagni A., Picco P., Martini A. 71 IN MEMORIA 97 In ricordo di Cesare Romano FORUM: QUALITÀ DELLE CURE Lorini R. 97 73 Cos’è Joint Commission Giuliano C. RICERCA CLINICA APPLICATA Le cellule staminali mesenchimali: nuove protagoniste nell’immunoregolazione Pistoia V., Uccelli A., Moretta L. 101 L’accreditamento secondo Joint Commission: una opportunità di crescita per le organizzazioni sanitarie Rosati U., Cavanenghi F., Giuliano C., Lasero A., Scali R. 79 Due nuovi farmaci per il trattamento dell’artrite idiopatica giovanile Ruperto N., Martini A. 107 Un’esperienza di percorso di miglioramento: fast track in chirurgia 83 La genetica delle epilessie e le epilessie genetiche Striano P., Bianchi A., Minetti C., Zara F. Vol. 40 - N. 2 Palomba L., Mattioli G., Tamburini S., Callegari M., Kokkattil C., Vaccaro A., Penco E., Viacava R., Sanfilippo F., Fratino G., Mazzola C., Faranda F., Buffa P., Ammi C., Dellarocca M., Mameli L., Montobbio G., Gandullia P., Rosati U., Jasonni V. GASLINI V INDICE 115 133 La prevenzione degli eventi traumatici accidentali del minore in ospedale QUIZ RADIOLOGICO Sperlinga M. L. Damasio M. B., Renna S. 119 135 Miglioramento continuo delle cure in neonatologia: la gestione del rischio iatrogeno QUIZ DERMATOLOGICO Ligi I., Tardieu S., Jouve E., Sambuc R., Simeoni U. Viglizzo G., Nemelka O., Bleidl D., Occella C. Patologia infiammatoria acuta Un’insolita placca al cuoio capelluto 127 FARMACOLOGIA PEDIATRICA Principi di farmacologia applicati alla pediatria: assorbimento, distribuzione, metabolismo, ed escrezione (ADME) dei farmaci nei bambini Della Casa Alberighi O. VI GASLINI Agosto 2008 EDITORIALE GASLINI 2008;40:67-9 Il Gaslini ha 70 anni L ’Istituto Gaslini ha iniziato la sua attività nel 1938: una storia esemplare, forse irripetibile nella sua genesi e nel suo sviluppo, oltre settanta anni di storia, di sacrifici, di dedizione, sempre all’avanguardia nel campo dell’assistenza e della ricerca e senza mai tradire gli ideali del Fondatore. L’Istituto fu fatto progettare, costruire ed arredare interamente a proprie spese dai coniugi Gaslini dotandolo delle più moderne strutture sanitarie, per ricordare la loro figlioletta Giannina morta in giovanissima età, allo scopo di assicurare all’infanzia la migliore assistenza, sempre sorretta dall’apporto fondamentale della ricerca. Nel 1948 Gerolamo Gaslini si spogliò di tutti i suoi beni (società, stabilimenti, immobili, partecipazioni azionarie, titoli e persino la propria dimora) facendoli confluire nell’omonima Fondazione da lui stesso costituita e presieduta, disponendo che le risorse del suo patrimonio dovessero essere devolute al potenziamento della ricerca scientifica e alla promozione di specifiche competenze terapeutiche e assistenziali, a favore dell’infanzia. L’Istituto venne riconosciuto Ospedale Pediatrico di prima categoria nel 1939, poi Ente Morale, quale istituzione pubblica di assistenza e beneficenza, nel 1940 e ottenne il riconoscimento di Istituto di ricovero e cura a carattere scientifico nel 1959, riconoscimento sempre riconfermato negli anni successivi. Il Gaslini si sviluppa in 17 edifici ben collegati tra loro, occupando parte di una collina a picco sul mare, per un’estensione di 50 mila metri quadrati, due terzi dei quali destinati a parco e giardini. Il Gaslini venne pensato, costruito e sviluppato per introdurre, grazie alla presenza di tutte le singole Vol. 40 - N. 2 discipline pediatriche, un concetto nuovo, quello di offrire al bambino ammalato un’assistenza pediatrica specializzata, con tutte le competenze ed i servizi specifici, indispensabili per un vivere che deve essere sempre il più vicino possibile al normale. Gerolamo Gaslini intendeva fare acquisire in tal modo, a coloro che vi avrebbero operato, cognizioni sempre più vaste dell’universo bambino e predisporre affinché l’istituto fosse il punto di riferimento per i piccoli pazienti che necessitano di una elevata specializzazione. Il Fondatore aveva ben presente che l’insegnamento, lo studio e la ricerca sono indispensabili per qualunque progresso e fanno parte indissolubile della medicina e dell’assistenza. Ricordiamo le sue parole: “Io non sono un uomo di scienza ma so perfettamente che solo partendo dalla ricerca scien- Dipartimenti PEDIATRIA E SPECIALITÀ PEDIATRICHE OSTETRICO NEONATALE CHIRURGIA E SPECIALITÀ CHIRURGICHE CARDIOVASCOLARE EMATO ONCOLOGIA NEUROSCIENZE E RIABILITAZIONE EMERGENZA ACCETTAZIONE DIAGNOSTICA PER IMMAGINI MEDICINA SPERIMENTALE Figura 1. — I Dipartimenti. GASLINI 67 IL GASLINI HA 70 ANNI SERVIZI DI RICERCA SPERIMENTALE E LABORATORI SCIENTIFICI AUTONOMI • • • • • Laboratorio di Biologia Molecolare Laboratorio di Genetica Molecolare e Laboratorio di Citogenetica* Laboratorio di Oncologia Laboratorio di Medicina Molecolare Laboratorio di Immunologia Clinica e Sperimentale* * a Direzione Universitaria SERVIZI DI RICERCA SPERIMENTALE E LABORATORI SCIENTIFICI AGGREGATI A DIVISIONI O SERVIZI • • • • • • • • Laboratorio Sperimentale per le Tecniche Prenatali (U.O. Ostetricia) Laboratorio di Fisiopatologia dell’Uremia (U.O. Nefrologia) Laboratorio di Diagnosi Pre e Post-natale delle Malattie Metaboliche (Dipartimento di Neuroscienze e Riabilitazione) Unità di Ricerca Sperimentale di Neuroscienza dello Sviluppo (U.O. Neuropsichiatria Infantile) Laboratorio di Patologia Muscolare (U.O. Malattie Muscolari e Neurodegenerative) Laboratorio di Ematologia ed Emofilia (Dipartimento Ematologia e Oncologia) Laboratorio per la Standardizzazione e Verifica degli Screening delle Malattie Endocrine e Metaboliche (U.O. Clinica Pediatrica) Servizio per lo Studio Ultrastrutturale (U.O. Anatomia Patologica) Figura 2. 1 400 1 000 1 000 800 600 400 200 2000 2001 2002 2003 2004 2005 2006 2007 Figura 3. — Impact factor realizzato dell’Istituto Giannina Gaslini negli ultimi 8 anni. tifica i medici possono organizzare con coscienza la loro difficile missione”. Sono trascorsi settanta anni di sforzi, fatiche, successi, difficoltà, che hanno accomunato il personale medico, infermieristico, tecnico nel fine comune di combattere le malattie infantili. Generazioni di pazienti sono passate nei viali del nostro istituto, con dolo- 68 re o con la gioia della salute recuperata, ma sempre consapevoli dell’impegno che ha animato questo struttura. Oggi a distanza di tempo potremmo raccontare la storia del Gaslini, ricordare i medici che hanno contribuito a farlo importante sul piano dell’assistenza e della ricerca, ma rimandiamo a quanto scritto da Paolo Durand sul numero speciale per il cinquantenario dell’Istituto e preferiamo volgere l’attenzione al presente e al futuro. Oggi l’Istituto Gaslini si pone come missione i seguenti obiettivi, mutuati in parte dalle tavole della fondazione e in parte imposti dall’evoluzione della scienza medica: — funzionare come istituto di ricovero e cura a carattere scientifico e ospedale di eccellenza con bacino d’utenza nazionale ed internazionale; — perseguire finalità di assistenza, ricerca, didattica e formazione del personale; — operare quale ospedale di riferimento per il trattamento delle malattie complesse neonatali e pediatriche, disponendo di tutte le discipline specialistiche mediche e chirurgiche; GASLINI Agosto 2008 IL GASLINI HA 70 ANNI — avere la ricerca clinica e traslazionale come obiettivo strategico e strettamente integrate con l’assistenza; — collaborare con le altre istituzioni di eccellenza in ambito nazionale ed impegnarsi in programmi di assistenza a favore dei paesi in via di sviluppo — perseguire il miglioramento continuo della qualità delle cure. Gli strumenti, ossia i reparti di assistenza e i laboratori di ricerca, con cui cerca di raggiungere i fini sopraelencati, si articolano su una struttura di ordine dipartimentale, che vede rappresentate tutte le diverse specialità e sottospecialità pediatriche sia mediche che chirurgiche, sorrette da un network di laboratori scientifici. Di questi alcuni sono indipendenti con una direzione autonoma, altri sono aggregati alle strutture assistenziali. In questi ultimi anni é stato formulato un piano per la qualità delle cure , come meglio presentato e specificato nel forum di questo stesso numero della rivista. Nelle figure 1 e 2 é riassunta l’organizzazione dipartimentale e viene presentato l’elenco dei laboratori attualmente attivi. Il Gaslini del domani vuole confermarsi quale centro pediatrico di elevato livello , e a questo scopo é stato preparato un piano di sviluppo (2008-2011) i cui elementi caratterizzanti prevedono: — potenziare i settori strategici e a maggiore attrazione; — differenziare ogni qualvolta possibile i percorsi dei pazienti ricoverati da quelli ambulatoriali; — incrementare l’attività di day hospital e di day surgery; — migliorare l’offerta dei servizi ambulatoriali da accentrare in un nuovo edificio in via di realizzazione; — centralizzare tutti i servizi del Dipartimento di Neuroscienze in un’unica struttura con attivazione di posti letto per la riabilitazione; — potenziare il Dipartimento di Emergenza e Accettazione con una nuova struttura per la terapia intensiva neonatale e pediatrica; — centralizzare i laboratori di ricerca. Noi siamo convinti che la sfida per il futuro richieda che maggiore spazio sia dato alla ricerca clinica e di base. Nella figura 3 sono riportati i risultati in termini di impact factor della ricerca nel corso degli ultimi anni. Ci sembra particolarmente confortante non solo il progressivo incremento del dato ma anche che vi sia uno sviluppo abbastanza armonico ed omogeneo nei diversi campi di attività. Concludiamo queste brevi considerazioni con un ringraziamento a tutti quanti collaborano sia all’interno sia all’esterno dell’Istituto per mantenere elevato il livello, consci che solo dall’azione comune è possibile raggiungere le mete prefissate. La Redazione della Rivista Gaslini Vol. 40 - N. 2 GASLINI 69 IN MEMORIA GASLINI 2008;40:71-2 In ricordo del Prof. Cesare Romano R. LORINI Clinica Pediatrica-Università di Genova, IRCCS G. Gaslini, Genova C on profonda commozione ho accolto l‘invito a ricordare il Professor Cesare Romano, uno dei più importanti Maestri della Pediatria Italiana, scomparso il 23 aprile scorso. Nei miei dieci anni di responsabilità della Clinica Pediatrica dell’Università di Genova, già diretta dal Professor Romano, ho avuto l’onore e la fortuna di meglio conoscere ed apprezzare il Professor Romano, clinico attento e scrupoloso, maestro e guida lucida e carismatica di tanti allievi e collaboratori. Il Professor Cesare Romano, nato a Voghera il 5 luglio 1924, compì gli studi in Medicina e Chirurgia presso l’Università di Pavia, laureandosi con lode nel 1951; fu, allo stesso tempo, alunno del Collegio Ghislieri di Pavia, ente di alta qualificazione culturale, fondato nel 1567 dal Papa S. Pio V e, sotto l’alto Patronato del Presidente della Repubblica, riservato (mediante concorso pubblico per esami) a studenti dell’Università di Pavia di particolare ingegno ed impegno. Quindi il Professor Romano si trasferì a Genova, per frequentare la Scuola di Specialità in Pediatria, diretta dal Professor Giovanni de Toni. Si specializzò nel 1954, svolgendo una tesi dal titolo “Patologia del pancreas nell’età infantile con particolare riguardo alla fibrosi cistica del pancreas”. Divenne assistente presso la Clinica Pediatrica diretta dal Professor de Toni nel 1958 e, nel 1961, conseguì la libera docenza in Clinica Pediatrica. A partire dal 1956, come vincitore della prima borsa di studio Guigoz in endocrinologia e diabetologia pediatrica, frequentò per due anni l’Hopital des Enfants Malades di Parigi sotto la direzione del Professor Royer. Vol. 40 - N. 2 Dal 1958 diresse la sezione di ormonologia e cardiologia della Clinica Pediatrica e, dal 1960, anche la sezione per lo studio del diabete infantile. Nell’ambito della sua attività clinico-scientifica in cardiologia pediatrica, descrisse per primo nel 1963 una nuova sindrome di aritmia congenita familiare, con una pubblicazione nella prestigiosa rivista internazionale “The Lancet”. La sindrome prenderà il Suo nome e sarà universalmente riconosciuta come la Figura 1. — Prof. Cesare Romano. GASLINI 71 LORINI IN MEMORIA “Sindrome di Romano-Ward”. Nello stesso periodo segnalò per la prima volta nella letteratura medica internazionale (in “The Lancet”) un nuovo segno elettrocardiografico presente nell’ipotiroidismo congenito. L’esperienza acquisita in 12 anni di studio della fibrosi cistica si concretizzò in numerose pubblicazioni a carattere clinico-scientifico e permise la realizzazione del Primo Simposio Italiano sulla fibrosi cistica del pancreas, organizzato a Genova nel febbraio del 1961 sotto la Presidenza del Suo Maestro, il Professor Giovanni de Toni. Nel 1966 contribuì alla costituzione dell’Associazione Italiana per la Lotta contro la fibrosi cistica, del cui Comitato di Consulenza Medico-Scientifica divenne il primo Segretario. Nel 1968 realizzò la prima monografia sulla fibrosi cistica, che fu per molti anni un punto di riferimento fondamentale per tutti i pediatri con interesse per questa patologia. Sotto la Sua direzione, il “Centro Regionale della Fibrosi Cistica” di Genova mantenne sempre un elevato livello assistenziale fino alla realizzazione, nel 1990, del primo trapianto di polmone in una paziente Italiana. Sin dal 1965 diresse anche la Sezione per la Malattia Fenilchetonurica della Clinica Pediatrica, avviando un’esperienza assistenziale sul piano clinico, dietetico e biologico che ha permesso di valorizzare quella che , ancora oggi, è la più estesa casistica di malattie metaboliche in Italia. Nell’ambito delle malattie metaboliche, il Professor Romano si adoperò tenacemente e con grande determinazione per realizzare uno degli interventi di pediatria preventiva e sociale più importanti della medicina moderna. Nel 1973, su ispirazione responsabile del Professor Romano, la Regione Liguria, prima in 72 Italia, promulgò la Legge sullo screening neonatale di massa della fenilchetonuria. Nel 1986 lo screening neonatale di massa fu esteso per legge anche all’ipotiroidismo congenito. In Endocrinologia Pediatrica, fu intenso e affettuoso il Suo rapporto con il Professor Zvi Laron di Tel Aviv, che permise di realizzare, anche in collaborazione con il Professor Silvano Mastragostino, il Primo Convegno Internazionale sull’allungamento degli arti ad Herzelia (Israele) nel 1984 e la pubblicazione di un libro. Nel 1976 fu nominato Direttore della Clinica Pediatrica II dell’Università di Genova, Istituto Giannina Gaslini, che diresse fino al 1996, formando un’intera generazione di pediatri. Negli ultimi anni della Sua attività professionale, diede vita al Suo ultimo sogno, quello di costruire la Pediatria d’Urgenza, istituendo il Corso di Perfezionamento post-universitario di Pediatria d’Urgenza e pubblicando nel 2005 il testo di “Pediatria d’urgenza”, in collaborazione con di Renata Lorini, Pasquale Di Pietro. Una vita professionale così intensa e produttiva non impedì mai al Professor Romano di restare sempre molto vicino all’ adorata moglie Maria Grazia e alla famiglia tutta, che fu sempre al suo fianco nelle sue fatiche e punto di riferimento irrinunciabile. Per la Signora Maria Grazia, per i Figli, i Nipoti, i Collaboratori, gli Allievi, i Pazienti e tutti coloro che hanno avuto la fortuna di incontrarLo ed apprezzarLo, la vita del Professor Cesare Romano rimarrà d’esempio e la Sua figura indimenticabile. Il vuoto che lascia a chi con Lui e grazie a Lui è cresciuto, potrà essere colmato solo dal ricordo della Sua gentilezza, della sua Signorilità e dei Suoi insegnamenti. GASLINI Agosto 2008 RICERCA CLINICA APPLICATA GASLINI 2008;40:73-8 Le cellule staminali mesenchimali: nuove protagoniste nell’immunoregolazione V. PISTOIA 1, A. UCCELLI 2, 3, 4, L. MORETTA 1, 3, 5 1IRCCS G. Gaslini, Genova 2Dipartimento di Neuroscienze, Oftalmologia e Genetica, Università di Genova, Genova 3Centro di Eccellenza per la Ricerca Biomedica, Università di Genova, Genova 4Centro di Biotecnologie Avanzate (CBA), Genova 5Dipartimento di Medicina Sperimentale (DIMES), Università di Genova, Genova L e cellule staminali mesenchimali (MSC), così denominate per la prima volta da Caplan 1, sono una popolazione eterogenea di cellule stromali multipotenti definite in base a 1) capacità di crescere in vitro aderendo alla piastra di coltura, 2) morfologia fibroblastica e 3) potenziale differenziativo in diversi tessuti mesodermici come osso, cartilagine, tessuto adiposo e stroma connettivale2. Nonostante la definizione delle MSC come cellule staminali, esse sono prive delle caratteristiche di staminalità, cioè autorinnovamento e multipotenzialità in vivo. Tali caratteristiche si ritrovano solo in una piccola popolazione di cellule subendoteliali dello stroma del midollo osseo che esprime il marcatore CD146 e differenziano in osteoblasti 3. Per questi motivi una recente Consensus Conference ha proposto di denominare le MSC “mesenchymal stromal cells” 2; tuttavia la denominazione “mesenchymal stem cells” continua ad essere utilizzata in maniera prevalente, anche se meno corretta dal punto di vista concettuale. Sebbene isolate inizialmente dal midollo osseo, le MSC sono virtualmente ubiquitarie, rappresentando una componente dello stroma di molti tessuti. La caratterizzazione immunofenotipica delle MSC con anticorpi monoclonali non ha consentito di identificare marcatori specifici, con la relativa eccezione del ganglioside GD2 e dell’antigene embrionale SEA-1, la cui espressione in altre linee cellulari è molto ristretta. Le MSC umane non esprimono i marcatori ematopoietici CD45, CD34 e CD14, molecole co-stimolatorie come CD80 e CD86 o il marcatore endoteliale CD31, mentre sono positive per CD105, CD73, CD44, CD90, CD71 e Stro-1 4, 5. Ruolo fisiologico delle MSC nel midollo osseo Lo spazio intra-osseo contiene midollo ematopoietico e vasi sanguigni sinusoidali. Le cellule staminali ematopoietiche (HSC) in via di sviluppo sono trattenute all’interno del midollo osseo fino al termine della loro maturazione e poi liberate nel sistema vascolare. Nel midollo osseo le HSC e la loro progenie sono circondate da cellule stromali comprendenti osteoblasti, fibroblasti, cellule reticolari avventiziali e cellule endoteliali, che contribuiscono alla formazione della cosiddetta “nicchia” ematopoietica 6-8. In modelli murini sono stati descritti due tipi di nicchia, entrambi coinvolti nella regolazione dell’ematopoiesi, la nicchia endosteale 7, 8 e quella vascolare 9. La prima è costituita da osteoblasti che rivestono la superficie endosteale dell’osso trabecolare, mentre la seconda è composta dalle cellule endoteliali sinusoidali e dalle cellule stromali subendoteliali CD146+ 3. La nicchia endosteale fornisce un microambiente protettivo che supporta il mantenimento e l’autorinnovamento delle HSC isolandole da stimoli differenziativi e proapoptotici che ridurrebbero la riserva di cellule staminali 7, 8. D’altro canto la nicchia vascolare controlla la differenziazione delle HSC e la liberazione di cellule ematopoietiche mature nel sistema vascolare9. L’equilibrio tra mantenimento della quiescenza Autore di contatto: V. Pistoia, IRCCS G. Gaslini, Genova. Vol. 40 - N. 2 GASLINI 73 PISTOIA LE CELLULE STAMINALI MESENCHIMALI (fase G0 del ciclo cellulare) delle HSC nella nicchia endosteale e differenziazione e reclutamento delle HSC nella nicchia vascolare è il risultato finale di complesse interazioni molecolari tra HSCs e cellule stromali associate alle nicchie. L’analisi del trascrittoma delle MSC ha dimostrato l’espressione di numerose molecole come angiopoietina-1, osteopontina, trombospondina e fibronectina-1, secrete anche dagli osteoblasti e dallo stroma midollare e capaci di mantenere le HSC quiescenti nella fase G0 del ciclo cellulare e di preservarne la vitalità 10. MSC e medicina rigenerativa La capacità delle MSC di differenziare in diversi tipi di cellule mesodermiche mature ne ha stimolato l’utilizzo clinico a fini di ricostruzione tessutale. Ad esempio, in considerazione della localizzazione delle MSC nell’osso del ricevente in seguito a somministrazione per via sistemica, le MSC sono state infuse a bambini affetti da osteogenesi imperfetta con significativi risultati clinici: accelerazione della velocità di crescita, aumento del contenuto in minerali del corpo e riduzione delle fratture spontanee. Inaspettatamente numerosi studi hanno dimostrato che le MSC possono trans-differenziare, soprattutto in vitro, in cellule appartenenti ad altre linee germinali, ad esempio neuroni, cellule endoteliali ed epatociti. Tuttavia il fenomeno della trans-differenziazione in vivo delle MSC appare scarsamente riproducibile 11 e l’ipotesi che le MSC costituiscano una sorta di cellule staminali multipotenti capaci di “riparare” qualunque tessuto indipendentemente dalla sua linea di origine appare poco probabile. Attività immunosoppressive delle MSC Esiste un consenso generale sul fatto che le MSC esercitino una potente attività immunosoppressiva attraverso una complessa rete di interazioni con cellule dell’immunità sia innata, sia adattativa. Effetti sulle cellule dell’immunità innata Le cellule dendritiche (DC) mieloidi svolgono un ruolo fondamentale nella presentazione dell’antigene ai linfociti T naive in seguito a differenziazione delle 74 DC immature in mature, caratterizzate dall’acquisizione delle molecole costimolatorie CD80 e CD86, l’up-regolazione sulla superficie cellulare delle molecole HLA di classe I e II e di altri marcatori come CD11c, CCR7 e CD83. La maturazione delle DC è indotta da citochine pro-infiammatorie (TNF, IL-1 e IL6) e/o molecole associate a patogeni (es. LPS). Le MSC inibiscono la maturazione in vitro delle DC derivate da monociti riducendo l’espressione di superficie di molecole HLA di classe II, CD11c, CD83, CD80, CD86, e la produzione di IL-12 indotta dalla stimolazione via Toll-like receptors (TLR) 12. In seguito all’interazione con le MSC, le DC mieloidi down-regolano la loro capacità di produrre TNF, mentre le DC plasmocitoidi up-regolano la produzione di IL-10 13. Complessivamente, il cross-talk delle MSC con le DC si traduce in un potente effetto anti-infiammatorio ed immunoregolatorio. Le cellule natural killer (NK) sono i principali effettori dell’immunità innata e hanno un ruolo importante nelle risposte immuni a virus e tumori grazie alla loro attività citotossica ed alla produzione di citochine pro-infiammatorie. Le funzioni delle cellule NK sono finemente regolate da una serie di recettori che trasducono segnali attivatori od inibitori 14, 15. L’espressione di ligandi riconosciuti da recettori attivanti la citotossicità e la bassa o assente espressione di molecole HLA di classe I (riconosciuti dai recettori inibitori specifici per HLA di classe I) su una cellula bersaglio sono i requisiti essenziali perché questa possa essere lisata dalle cellule NK 14, 15. La proliferazione dei linfociti NK appena isolati, indotta da IL-2, è fortemente inibita dalla co-cultura con le MSC, che bloccano anche la generazione della citotossicità NK e la produzione di citochine 16. Tale inibizione dipende dalla capacità delle MSC di down-regolare l’espressione dei recettori attivatori della citossicità NKp30 e NKG2D e di inibire l’espressione ex novo di NKp44, recettore attivatorio assente su cellule NK resting ed indotto in seguito ad attivazione 16. Le attività inibitorie esercitate dalle MSC sulle cellule NK fresche sono dimostrabili anche su cellule NK attivate, ma in misura molto minore; anzi, queste ultime cellule sono in grado di uccidere efficacemente MSC autologhe ed allogeniche 17. La suscettibilità delle MSC alla lisi dipende dal basso livello di molecole HLA di classe I e dall’espressione di diversi ligandi riconosciuti dai recettori attivatori delle cellule NK, come gli ULBP, PVR e nectin-2 17. La pre-incubazione delle GASLINI Agosto 2008 LE CELLULE STAMINALI MESENCHIMALI PISTOIA MSC con IFN-γ protegge in parte le MSC dalla citotossicità NK attraverso l’up-regolazione di molecole HLA di classe I sulla superficie delle MSC 17. La rilevanza in vivo di questi risultati ottenuti mediante modelli in vitro è difficile da stabilire; si può ipotizzare che, in seguito all’incontro di cellule NK attivate con MSC in vivo, l’inibizione delle funzioni NK mediata dalle MSC sia relativamente modesta e non tale da compromettere significativamente l’attività citotossica delle cellule NK stesse. In un microambiente ricco in IFN-γ le MSC sarebbero protette almeno parzialmente dalla azione citotossica delle cellule NK, mentre in assenza di IFN-γ la lisi delle MSC verrebbe facilitata. Queste speculazioni, tuttavia, devono tener conto del fatto che le MSC sono cellule poco numerose e localizzate in nicchie dove potrebbero essere protette dall’attacco dei linfociti NK. I granulociti neutrofili sono rapidamente mobilizzati nel corso di infezioni batteriche ed attivati a fagocitare ed uccidere i patogeni. In seguito ad interazione con particelle o prodotti batterici, i neutrofili aumentano fortemente la loro attività metabolica con incremento del consumo di ossigeno e generazione di anioni superossido e acqua ossigenata. Questo processo, che potenzia la reazione infiammatoria, è noto come burst ossidativo. Le MSC ritardano l’apoptosi spontanea dei granulociti neutrofili umani sia “resting”, sia attivati e down-regolano il burst ossidativo dei neutrofili mediante un meccanismo dipendente dalla produzione costitutiva di IL-6 18. Altre funzioni dei neutrofili, come fagocitosi, espressione di molecole di adesione e chemiotassi stimolo-specifica non vengono modificate dall’incubazione con MSC 18. L’attività delle MSC sui neutrofili può essere interpretata come un meccanismo di limitazione del processo infiammatorio; inoltre il mantenimento della vitalità dei neutrofili mediato da MSC può essere fisiologicamente importante in quelle sedi come polmone e midollo osseo dove esiste un pool “marginato” di neutrofili resting e pienamente funzionali pronti ad essere mobilizzati in caso di infezioni (Figura 1). Effetti sulle cellule dell’immunità adattativa Le MSC inibiscono la proliferazione dei linfociti T stimolati con mitogeni policlonali, cellule allo geniche o antigeni 19-22. Questa inibizione non è ristretta per antigeni del locus maggiore di istocompatibilità (MHC) e non dipende dall’induzione di apoptosi delle cellule T; il meccanismo responsabile dell’effetto anti-pro- Vol. 40 - N. 2 MSCs _ Proliferation _ Cytotoxicity _ Cytokine production _ Proliferation _ Antibody production Killing NK ImDCS accunulation mDC T B Figura 1. — La figura riassume le principali attività immunosoppressive delle MSC sulle cellule dell’immunità innata ed adattativa. Le MSC inibiscono proliferazione, citotossicità e produzione di citochine da parte di cellule NK resting. Inibendo la differenziazione delle cellule dendritiche mieloidi (DC) le MSC favoriscono l’accumulo di cellule dendritiche immature e non funzionanti in termini di presentazione antigenica ai linfociti T. Inoltre le MSC esercitano un’azione anti-proliferativa diretta sui linfociti T. L’inibizione di proliferazione e produzione di anticorpi da parte dei linfociti B è in parte diretta, in parte T-mediata. liferativo è il blocco di queste ultime cellule nella fase G1 del ciclo cellulare 22. Nonostante il loro effetto soppressivo sulla proliferazione dei linfociti T, le MSC ne supportano la sopravvivenza in seguito a stimolazione via T cell receptor (TCR), un processo che si associa fisiologicamente a morte cellulare indotta da attivazione e mediata dall’interazione FAS/FAS ligando 23. L’inibizione della proliferazione T indotta da MSC comporta anche diminuita produzione di IFN-γ e aumentato rilascio di IL-4, suggerendo che l’attività immunomodulante delle MSC si traduca nella deviazione di risposte Th1 a Th2 12, 13. I linfociti T citotossici CD8+ lisano cellule allogeniche o cellule autologhe infettate da virus in maniera ristretta per MHC di classe I. Le MSC inibiscono la citotossicità CTL contro cellule allogeniche 24. MSC pulsate con peptidi virali o trasfettate con mRNA tumorale sono protette dalla lisi da parte di CTL specifici e ristretti. Il pre-trattamento delle MSC con IFN-γ aumenta l’espressione di HLA di classe I ma non rende le MSC suscettibili alla citotossicità CTL. Complessivamente questi studi dimostrano che le MSC bloccano la citotossicità CTL ma non vengono lisate dagli stessi 25, 26. Le cellule T regolatorie (Treg) sono specializzate nel sopprimere l’attivazione del sistema immunitario e mantenerne l’omeostasi e la tolleranza ad antigeni self. Le MSC aumentano la generazione di Treg attra- GASLINI 75 PISTOIA LE CELLULE STAMINALI MESENCHIMALI TABELLA I. — Gruppi di lavoro sulle MSC. Le cellule staminali mesenchimali stanno riscuotendo un crescente interesse da parte di ricercatori e clinici in virtù delle loro numerose attività immunoregolatorie che ne delineano l’utilizzo clinico per il trattamento di patologie caratterizzate da iper-attivazione del sistema immunitario. I gruppi di Lorenzo Moretta e Vito Pistoia al Gaslini e quello di Antonio Uccelli presso la Clinica Neurologica dell’Università di Genova hanno pubblicato negli ultimi anni una serie di importanti lavori che hanno molto contribuito a chiarire le interazioni delle MSC con cellule dell’immunità innata ed adattativa ed il potenziale terapeutico delle MSC in modelli pre-clinici. Per questi motivi i tre autori del presente articolo, che hanno già collaborato in precedenti occasioni, sono stati invitati a scrivere una review sistematica sulle MSC dalla prestigiosa rivista “Nature Reviews in Immunology”. L’articolo è attualmente in corso di stampa. verso un meccanismo indiretto mediato da IL-10 rilasciata da DC plasmocitoidi 13 (vedi sopra) ed uno diretto legato al rilascio di HLA-G5 solubile (sHLAG5) da parte delle stesse MSC 27. Gli studi condotti sui rapporti tra linfociti B e MSC hanno prodotto diversi risultati presumibilmente dipendenti da variabili sperimentali come i rapporti numerici reciproci tra i due tipi di cellule, i tipi di stimoli impiegati, tecniche di coltura delle MSC, ecc. La maggior parte degli studi ha dimostrato che le MSC inibiscono la proliferazione di cellule B purificate. È stato inoltre dimostrato che anche la differenziazione plasmacellulare e l’espressione di alcuni recettori per chemochine (CXCR4, CXCR5 e CCR7) sui linfociti B vengono diminuite dalle MSC 28. Questi risultati sono stati ottenuti a rapporti cellule B/MSC elevati e non fisiologici, mentre a rapporti inferiori le MSC possono stimolare proliferazione e differenziazione plasmacellulare delle cellule B purificate 29. Va inoltre sottolineato che, in vivo, la maggioranza delle risposte B sono T-dipendenti ed è probabile che la funzione dei linfociti B venga inibita indirettamente dalle MSC attraverso gli effetti sopra descritti sulle cellule T. MECCANISMI DELLA IMMUNOSOPPRESSIONE MSC-MEDIATA Gli effetti immunosoppressivi delle MSC possono essere mediati da contatto diretto con le cellule bersaglio, rilascio di fattori solubili o una combinazione dei due meccanismi. Inoltre i fattori solubili dotati di attività immunoregolatoria possono essere secreti dalle MSC a seguito di interazione con le cellule target (cross-talk) oppure costitutivamente. 76 Non potendo entrare in dettaglio, è sufficiente ricordare che molte molecole solubili sono state implicate nelle funzioni immunosoppressive delle MSC: prostaglandina-E2 (PGE-2) e indoleamine 2,3-diossigenasi (IDO) sono quelle più frequentemente coinvolte in vari modelli sperimentali. Seguono transforming growth factor-β1 (TGF-β1), interleuchina-10 (IL-10), hepatocyte growth factor (HGF), IL-6, ossido nitrico (NO) ed eme-ossigenasi-1. PGE-2 è sintetizzata costitutivamente dalle MSC che esprimono cicloossigenasi-1 e 2, ma la sua produzione viene fortemente incrementata dall’interazione con citochine pro-infiammatorie come TNF e IFN-γ 12. IDO costituisce invece l’esempio di una molecola non sintetizzata costitutivamente dalle MSC ma espressa in seguito ad esposizione a IFN-γ 30. Nonostante siano stati fatti grandi progressi nell’identificazione dei mediatori solubili coinvolti nelle proteiformi attività immunosoppressive delle MSC, molto lavoro rimane da svolgere per comprendere i fini meccanismi che ne regolano sintesi e rilascio. STUDI PRE-CLINICI ED APPLICAZIONI CLINICHE DELLE MSC Le complesse attività immunosoppressive delle MSC costituiscono un ottimo razionale per il loro utilizzo nel trattamento di patologie caratterizzate da abnorme attivazione del sistema immunitario. Un ulteriore argomento a favore di questa ipotesi è la scarsa immunogenicità delle MSC in seguito ad infusione in vivo; questa caratteristica consente di utilizzare in maniera intercambiabile MSC autologhe od allogeniche senza rischi apparenti per il ricevente. In seguito a somministrazione per via venosa le MSC si distribuiscono in molti tessuti e dimostrano un particolare tropismo per le sedi di lesioni infiammatorie o neoplastiche. Le MSC sono state utilizzate con successo in modelli pre-clinici di malattie immunopatologiche come, ad esempio, sclerosi multipla (MS), artrite reumatoide e diabete. Le MSC somministrate endovena dopo l’induzione di encefalomielite sperimentale autoimmune (EAE), modello murino di MS, hanno migliorato significativamente il decorso della malattia migrando negli organi linfoidi secondari e riducendo l’infiltrazione del sistema nervoso centrale da parte di linfociti T, B e macrofagi 31. In un altro modello murino di EAE è stato dimostrato che le MSC inibiscono in vivo la produzione di anticorpi patogenetici e migrano nel sistema nervoso centrale senza transdifferenziare in GASLINI Agosto 2008 LE CELLULE STAMINALI MESENCHIMALI PISTOIA cellule neurali. Qui le MSC riducono infiammazione, demielinizzazione e perdita degli assoni 32. L’attività terapeutica delle MSC nell’EAE sembra pertanto bifasica, con una fase precoce di migrazione negli organi linfoidi secondari associata ad immunosoppressione ed una fase tardiva caratterizzata dal passaggio nel sistema nervoso centrale e da effetti paracrini. Questi studi sono preliminari ad un trial clinico per valutare il ruolo terapeutico delle MSC nella MS. L’efficacia delle MSC come cellule immunoregolatorie è stata dimostrata con successo nel trattamento della graft versus host (GVH) acuta a seguito di trapianto allogenico di HSC 33, 34. In uno studio europeo recentemente pubblicato, l’infusione di MSC prevalentemente allogeniche in pazienti affetti da GVH acuta ha prodotto una risposta clinica completa in circa la metà dei pazienti con ridotta mortalità da trapianto dopo 1 anno e più elevata overall survival dopo due anni dal trapianto di HSC 34. Infine le MSC sono state somministrate ai riceventi di trapianti di HSC aplo-identici dimostrando che esse modulano l’alloreattività dell’ospite e favoriscono l’attecchimento delle HSC allogeniche 35. Conclusioni In questa breve rassegna abbiamo delineato le principali caratteristiche funzionali delle MSC, soffermandoci sulle attività immunoregolatorie. Gli studi condotti hanno dimostrato che le MSC esercitano funzioni immunosoppressive agendo a diversi livelli della risposta immune e coinvolgendo immunità innata ed adattativa. I primi studi clinici indicano chiaramente che le MSC possono essere somministrate in clinica senza effetti collaterali apprezzabili e con evidente efficacia, ad esempio nel trattamento della GVH acuta. Rimangono tuttavia alcuni rischi potenziali che riguardano 1) la trasformazione neoplastica delle MSC coltivate per lungo tempo in vitro; questo fenomeno è stato descritto per le MSC murine 36, mentre non sembra applicabile a MSC umane 37; 2) la possibilità che le MSC infuse possano favorire la crescita di un tumore latente. Si tratta di un’ipotesi basata su dati sperimentali che indicano come, nella maggioranza dei modelli sperimentali, le MSC stimolino la crescita e/o la disseminazione di diversi tumori. Bibliografia 1. Caplan AI. Mesenchymal stem cells. J Orthop Res 1191;9:641-50. 2. Horwitz EM, Le Blanc K, Dominici M, Mueller I, Slaper-Cortenbach I, Marini FC et al.; the International Society for Cellular Therapy. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy 2005;7:3935. 3. Sacchetti B, Funari A, Michienzi S, Di Cesare S, Piersanti S, Saggio I et al. Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment. Cell 2007;131:324-36. 4. Uccelli A, Moretta L, Pistoia V. Immunoregulatory function of mesenchymal stem cells. Eur J Immunol 2006;36:2566-73. 5. Uccelli A, Pistoia V, Moretta L. Mesenchymal stem cells: a new strategy for immunosuppression? Trends Immunol 2007;28:219-26. 6. Schofield R. The relationship between the spleen colony-forming cell and the haemopoietic stem cell. Blood Cells 1978;4:7-25. 7. Calvi LM, Adams GB, Weibrecht KW, Weber JM, Olson DP, Knight MC et al. Osteoblastic cells regulate the haematopoietic stem cell niche. Nature 2003;425:841-6. 8. Zhang J, Niu C, Ye L, Huang H, He X, Tong WG et al. Identification of the haematopoietic stem cell niche and control of the niche size. Nature 2003;425:836-41. 9. Kiel MJ, Yilmaz OH, Iwashita T, Yilmaz OH, Terhorst C, Morrison SJ. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell 2005;121:1109-21. 10. Pedemonte E, Benvenuto F, Casazza S, Mancardi G, Oksenberg JR, Uccelli A et al. The molecular signature of therapeutic mesenchymal stem cells exposes the architecture of the hematopoietic stem cell niche synapse. BMC Genomics 2007;8:65. 11. Phynney DG, Prockop DJ. Coincise review: mesenchymal stem/multipotent stromal cells (MSCs): The state of trasndifferentiation and modes of tissue repair-current views. Stem Cells 2007;25:2896-902. 12. Aggarwal S, Pittenger MF. Human mesenchymal stem cells modulate allogeneic immune cell responses. Blood 2005;105:1815-22. 13. Maccario R, Podestà M, Moretta A, Cometa A, Comoli P, Montagna D et al. Interaction of human mesenchymal stem cells with cells involved in alloantigen-specific immune response favors the differentiation of CD4+ T-cell subsets expressing a regulatory/suppressive phenotype. Haematologica 2005;90:516-25. 14. Moretta A, Bottino C, Vitale M, Pende D, Biassoni R, Mingari MC et al. Receptors for HLA class-I molecules in human natural killer cells. Annu Rev Immunol 1996;14:619-48. 15. Moretta A, Bottino C, Vitale M, Pende D, Cantoni C, Mingari MC et al. Activating receptors and coreceptors involved in human natural killer cell-mediated cytolysis. Annu Rev Immunol 2001;19:197-223. 16. Spaggiari GM, Capobianco A, Becchetti S, Mingari MC, Moretta L. Mesenchymal stem cell-natural killer cell interactions: evidence that activated NK cells are capable of killing MSCs, whereas MSCs can inhibit IL-2-induced NK-cell proliferation. Blood 2006;107:1484-90. 17. Spaggiari GM, Capobianco A, Abdelrazik H, Becchetti F, Mingari MC, Moretta L. Mesenchymal stem cells inhibit natural killer-cell proliferation, cytotoxicity, and cytokine production: role of indoleamine 2,3-dioxygenase and prostaglandin E2. Blood 2008;111:1327-33. Vol. 40 - N. 2 GASLINI 77 PISTOIA LE CELLULE STAMINALI MESENCHIMALI 18. Raffaghello L, Bianchi G, Bertolotto M, Montecucco F, Busca A, Dallegri F et al. Human mesenchymal stem cells inhibit neutrophil apoptosis: a model for neutrophil preservation in the bone marrow niche. Stem Cells 2008;26:151-62. 19. Di Nicola M, Carlo-Stella C, Magni M, Milanesi M, Longoni PD, Matteucci P et al. Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or non-specific mitogenic stimuli. Blood 2002;99:3838-43. 20. Meisel R, Zibert A, Laryea M, Göbel U, Däubener W, Dilloo D. Human bone marrow stromal cells inhibit allogeneic T-cell responses by indoleamine 2,3-dioxygenase mediated tryptophan degradation. Blood 2004;103:4619-21. 21. Krampera M, Glennie S, Dyson J, Scott D, Laylor R, Simpson E et al. Bone marrow mesenchymal stem cells inhibit the response of naive and memory antigen-specific T cells to their cognate peptide. Blood 2003;101:3722-9. 22. Glennie S, Soeiro I, Dyson PJ, Lam EW, Dazzi F. Bone marrow mesenchymal stem cells induce division arrest anergy of activated T cells. Blood 2005;105:2821-7. 23. Benvenuto F, Ferrari S, Gerdoni E, Gualandi F, Frassoni F, Pistoia V et al. Human mesenchymal stem cells promote survival of T cells in a quiescent state. Stem Cells 2007;25:1753-60. 24. Rasmusson I, Ringden O, Sundberg B, Le Blanc K. Mesenchymal stem cells inhibit the formation of cytotoxic T lymphocytes, but not activated cytotoxic T lymphocytes or natural killer cells. Transplantation 2003;76:1208-13. 25. Rasmusson I, Uhlin M, Le Blanc K, Levitsky V. Mesenchymal stem cells fail to trigger effector functions of cytotoxic T lymphocytes. J Leukoc Biol 2007;82:887-93. 26. Morandi F, Raffaghello L, Bianchi G, Meloni F, Salis A, Millo E et al. Immunogenicity of Human Mesenchymal Stem Cells in HlLA-Class I Restricted T Cell Responses Against Viral or Tumor-Associated Antigens. Stem Cells 2008;26:1275-87. 27. Selmani Z, Naji A, Zidi I, Favier B, Gaiffe E, Obert L et al. Human leukocyte antigen-G5 secretion by human mesenchymal stem cells is required to suppress T lymphocyte and natural killer function and to induce CD+4cd35highFOXP3+ regulatory T cells. Stem Cells 2008;26:212-22. 28. Corcione A, Benvenuto F, Ferretti E, Giunti D, Cappiello V, Cazzanti F et al. Human mesenchymal stem cells modulate B-cell functions. Blood 2006;107:367-72. 29. Traggiai E, Volpi S, Schena F, Gattorno M, Ferlito F, Moretta L et al. Bone Marrow-derived Mesenchymal Stem Cells Induce Both Polyclonal Expansion and Differentiation of B Cells Isolated Form Healthy Donors and Systemic Lupus Erythematosus Patients. Stem Cells 2008;26:562-9. 30. Krampera M, Cosmi L, Angeli R, Pasini A, Liotta F, Andreini A et al. Role for interferon-gamma in the immunomodulatory activity of human bone marrow mesenchymal stem cells. Stem Cells 2006;24:386-98. 31. Zappia E, Casazza S, Pedemonte E, Benvenuto F, Bonanni I, Gerdoni E et al. Mesenchymal stem cells ameliorate experimental autoimmune encephalomyelitis inducing T cell anergy. Blood 2005;106:1755-61. 32. Gerdoni E, Gallo B, Casazza S, Musio S, Bonanni I, Pedemonte E et al. Mesenchymal stem cells effectively modulate pathogenic immune response in experimental autoimmune encephalomyelitis. Ann Neurol 2007;61:219-27. 33. Le Blanc K, Rasmusson I, Sundberg B, Götherström C, Hassan M, Uzunel M et al. Treatment of severe acute graft-versus-host disease with third party haploidentical mesenchymal stem cells. Lancet 2004;363:1439-41. 34. Le Blanc K, Frassoni F, Ball L, Locatelli F, Roelofs H, Lewis I et al.; Developmental Committee of the European Group for Blood and Marrow Transplantation. Mesenchymal stem cells for treatment of steroid-resistant, severe, acute graft-versus-host disease: a phase II study. Lancet 2008;371:1579-86. 35. Ball LM, Bernardo ME, Roelofs H, Lankester A, Cometa A, Egeler RM et al. Cotransplantation of ex vivo expanded mesenchymal stem cells accelerates lymphocyte recovery and may reduce the risk of graft failure in haploidentical hematopoietic stem-cell transplantation. Blood 2007;110:2764-7. 36. Rubio D, Garcia-Castro J, Martín MC, de la Fuente R, Cigudosa JC, Lloyd AC et al. Spontaneous human adult stem cell transformation. Cancer Res 2005;65:3035-39. 37. Bernardo ME, Zaffaroni N, Novara F, Cometa AM, Avanzini MA, Moretta A et al. Human bone marrow derived mesenchymal stem cells do not undergo transformation after long-term in vitro culture and do not exhibit telomere maintenance mechanisms. Cancer Res 2007;67:9142-9. 78 GASLINI Agosto 2008 GASLINI 2008;40:79-82 Due nuovi farmaci per il trattamento dell’artrite idiopatica giovanile N. RUPERTO 1, 2, A. MARTINI 1, 2 1Dipartimento di Pediatria, Università di Genova, Genova 2Pediatria II, Istituto G. Gaslini, Genova L ’artrite idiopatica giovanile (AIG) 1 non costituisce una malattia ma una diagnosi di esclusione che si applica a tutte le artriti che durano più di 6 settimane, sono di causa sconosciuta e insorgono prima dei 16 anni. Sotto questo termine è perciò compreso un eterogeneo gruppo di artriti croniche che, in assenza di conoscenze eziopatogenetiche, si è cercato di classificare sulla base di criteri clinici con lo scopo di identificare singole entità che potessero rappresentare malattie differenti. La eziologia, sia dell’artrite reumatoide (AR) dell’adulto che delle varie forme di AIG, è ignota e quindi non è possibile attuare una terapia causale. Si ritiene che il processo infiammatorio inizi con il riconoscimento di autoantigeni (la cui natura è sconosciuta) da parte dei linfociti T. I linfociti T a loro volta attiverebbero altre cellule, come i linfociti B ed i macrofagi, con produzione di citochine proinfiammatorie come tumor necrosis factor (TNF), interleuchina-1 (IL-1) e interleuchina-6 (IL-6). Queste citochine aumentano il reclutamento delle cellule infiammatorie nell’articolazione ed inducono i fibroblasti della sinovia, i condrociti e gli osteoclasti a secernere una varietà di molecole infiammatorie, comprese molte proteasi, che causano la distruzione della cartilagine e dell’osso. La membrana sinoviale, normalmente formata da un sottile strato di cellule, va così incontro ad una importante ipertrofia fino a trasformarsi in una struttura villosa (villi sinoviali) che protrude nello spazio articolare. Nella terapia dell’AR dell’adulto sono oggi disponibili numerosi, potenti farmaci che inibiscono selettivamente le principali citochine proinfiammatorie o alcuni dei principali attori della risposta immune (linfociti T e linfociti B). Questi farmaci, definiti farmaci biologici, sono rappresentati da anticorpi monoclonali o da versioni ottenute con la moderna ingegneria biologica di molecole presenti in natura. Grazie all’adozione da parte della Food and Drug Administration (FDA) (1998) e della European Medicines Agency (EMEA) (2007) di opportune misure legislative ed alla disponibilità di larghe reti di sperimentazione come PRINTO (Pediatric Rheumatology International Trial Organization) con sede a Genova presso l’Istituto Gaslini e PRCSG (Pediatric Rheumatology Collaborative Study Group) con sede a Cincinnati negli USA 2, è stato possibile condurre studi clinici controllati con i farmaci biologici anche nell’AIG. Due di questi studi sono stati condotti di recente 3, 4 e porteranno alla registrazione di due nuovi potenti farmaci per la terapia dell’AIG, Adalimumab (Box I), un inibitore del TNF, e Abatacept (Box I), un inibitore dell’attivazione dei linfociti. BOX I. Lovell DJ*, Ruperto N*, Goodman S, Reiff A, Jung L, Jarosova K et al. (*Equally contributed to this paper). Adalimumab with or without methotrexate in juvenile rheumatoid arthritis. N Engl J Med 2008;359:810-20. Pazienti di età compresa tra 4 e 17 anni con AIG attiva (con o senza concomitante terapia con MTX) sono stati trattati in aperto con 24 mg/m2 di Adalimumab (dose massima 40 mg) per 16 settimane. Il 74% (64 su 86) dei pazienti che avevano ricevuto adalimumab da solo e 94% di quelli che avevano ricevuto adalimumab in combinazione con il MTX avevano risposto al trattamento secondo i criteri pediatrici (ACR30) alla fine della XVI settimana. Questi pazienti sono stati poi randomizzati a ricevere adalimumab o placebo. L’efficacia del trattamento è stata valutata sulla base delle ricadute della malattia osservate nei due bracci dello studio. Nei pazienti non trattati con MTX una ricaduta è stata osservata nel 43% dei pazienti trattati con adalimumab e nel 71% di quelli trattati con placebo; nei pazienti trattati con MTX una ricaduta è stata osservata nel 37% di quelli che ricevevano adalimumab e nel 65% di quelli trattati con placebo. Alla XLVIII settimana di terapia il 63% dei pazienti trattati con adalimumab e MTX aveva raggiunto, secondo i criteri ACR, un miglioramento del 70% ed il 42% un miglioramento del 90%. Autore di contatto: A. Martini, Dipartimento di Pediatria, Università di Genova, Genova. Vol. 40 - N. 2 GASLINI 79 RUPERTO ARTRITE IDIOPATICA GIOVANILE: NUOVI FARMACI BOX II. Neutralizzazione del TNF Ruperto N*, Lovell DJ*, Quartier P, Paz E, Rubio-Pérez N, Silva CA et al. (*Equally contributed to this paper). Efficacy and safety of abatacept in patients with polyarticular juvenile idiopathic arthritis: a randomized, double-blind, placebo-controlled withdrawal trial. Lancet 2008;372:383-91. TNF Pazienti con AIG attiva di età compresa tra 6 e 17 anni sono stati trattati in aperto per via endovenosa con 10 mg/kg di abatacept per 4 mesi e la risposta al trattamento è stata valutata secondo i criteri pediatrici ACR30. Alla fine dei 4 mesi 123/190 (64,7%) pazienti avevano risposto. La risposta è stata del 75,9% per i pazienti che in precedenza non avevano ricevuto farmaci anti-TNF e del 38,6% per quelli che in precedenza avevano già fallito una terapia con farmaci anti-TNF. I pazienti sono stati poi randomizzati a ricevere abatacept o placebo. L’efficacia del trattamento è stata valutata sulla base delle ricadute della malattia osservate nei due bracci dello studio. Una ricaduta è stata osservata nel 53.2% dei pazienti randomizzati a placebo e nel 20% di quelli randomizzati ad abatacept. Dopo 10 mesi di trattamento con abatacept il 40% dei pazienti aveva avuto un miglioramento del 90% secondo i criteri ACR. Anticorpo monoclonale Recettore solubile Recettore di membrana Figura 1. — Rappresentazione schematica di come i farmaci anti-TNF bloccano l’azione della citochina. I recettori del TNF, una volta che hanno interagito con la citochina, trasmettono un segnale proinfiammatorio. Questi stessi recettori tuttavia possono avere un ruolo antinfiammatorio. Si possono infatti staccare dalla membrana e legare in soluzione il TNF impedendogli così di interagire con il recettore di membrana. è questo principio che viene sfruttato nella terapia con etanercept. L’altra modalità di neutralizzare il TNF è usare un anticorpo monoclonale che lo leghi con alta affinità. Ricordiamo che i pazienti con AIG che non rispondono in maniera soddisfacente alla terapia con farmaci anti-infiammatori non steroidei e con iniezioni intraarticolari di triamcinolone esacetonide (e che presentano in genere un’artrite a esordio o ad evoluzione poliarticolare) vengono trattati con methotrexate (MTX) la cui efficacia 5 e le cui dosi ottimali 6 sono state stabilite in studi controllati “non for profit”. I pazienti che non mostrano una soddisfacente risposta o che risultano intolleranti al MTX sono candidati ad una terapia con agenti biologici. Adalimumab: un inibitore del TNF Negli anni Novanta studi nell’animale avevano mostrato come il TNF svolgesse un ruolo centrale nell’infiammazione a livello articolare e come la sua inibizione avesse un rilevante valore terapeutico. Queste osservazioni, poi confermate nell’uomo, hanno portato, a partire dal 1998, alla registrazione degli inibitori del TNF nella terapia dell’AR dell’adulto. Attualmente esistono in commercio tre inibitori del TNF (Figura 1). Il primo, etanercept, è una molecola ricombinante in cui la porzione costante di una immunoglobulina è associata a due molecole di un recettore del TNF. Gli altri due sono anticorpi monoclonali: infliximab, che è un anticorpo chimerico (cioè con la 80 componente variabile, che lega il TNF, di origine murina), e adalimumab, che è invece interamente umano. Nell’adulto si è ormai accumulata una vasta esperienza con parecchie centinaia di migliaia di pazienti trattati. L’inibizione del TNF si è rivelata efficace in una percentuale elevata di pazienti ed è anche capace di ridurre la progressione radiologica del danno articolare. Non sono state rilevate differenze significative di efficacia tra i tre differenti inibitori. Tutti e tre i farmaci anti-TNF hanno dato risultati migliori se abbinati al MTX. Poiché il TNF è una molecola molto importante nelle difese dell’organismo si temeva che la terapia con anti-TNF potesse avere come effetto collaterale un aumento rilevante di infezioni severe e di tumori. Invece, almeno fino ad oggi, questi farmaci sono risultati molto ben tollerati. L’incidenza di infezioni severe è bassa ma esiste un significativo rischio di riattivazione di una infezione tubercolare. Per questo motivo i pazienti, prima della terapia devono essere esaminati per la presenza di una tubercolosi latente. Anche se vi sono state alcune segnalazioni la possibilità che la terapia aumenti la frequenza di tumori e di malattie diemielinizzanti è ancora discussa. L’esperienza nell’AIG con farmaci anti-TNF è molto più limitata. Fino ad oggi solo etanercept è stato registrato per uso nell’AIG. Lo studio controllato che, GASLINI Agosto 2008 ARTRITE IDIOPATICA GIOVANILE: NUOVI FARMACI RUPERTO grazie alla regola pediatrica, portò alla sua registrazione fu pubblicato dal PRCSG nel 2000 7. Questo studio impiegò un disegno innovativo, volto a ridurre il più possibile l’esposizione al placebo e che è stato in seguito utilizzato in altri studi nell’AIG. Secondo questo disegno tutti i pazienti vengono trattati in aperto con il farmaco da testare. Solo quelli che rispondono, secondo criteri standardizzati sviluppati dal PRCSG e da PRINTO 8, vengono poi randomizzati a ricevere in doppio cieco il farmaco o il placebo; l’efficacia del farmaco rispetto al placebo è valutata sulla percentuale di pazienti che ricadono. Ai pazienti che ricadono sotto placebo viene immediatamente risomministrato il farmaco attivo, riducendo così al minimo il tempo di esposizione al placebo. CTLA4 Ad oggi alcune migliaia di bambini sono stati trattati con etanercept ed i risultati ottenuti in termini di CD80/CD86 efficacia e di sicurezzaCD28 si sono dimostrati simili a quelli osservati nell’adulto. Dopo avere studiato l’efficacia e la APC sicurezza di cell 9, PRINTO e PRCSG hanno di infliximabTnell’AIG recente condotto anche lo studio controllato che ha TCRdi adalimumab MHC portato alla registrazione nell’AIG negli USA e, si spera, presto anche in Europa 3 (Box 1). Anche A in questo caso è stato adottato un disegno simile a quello impiegato nel caso di etanercept. Lo studio ha mostrato una efficacia di adalimumab paragonabile a quella osservata con etanercept e infliximab. Per la prima volta in questo trial sono stati inclusi non solo pazienti trattati con MTX ma anche pazienti che non lo avevano mai ricevuto. Nonostante lo studio non fosse stato concepito con un potere sufficiente per mostrare differenze significative tra i due bracci, i risultati suggeriscono che anche nel bambino, come nell’adulto adalimumab sia più efficace se somministrato in associazione con il MTX. L’efficacia, oltre che significativa, è stata molto buona perché dopo 48 settimane di terapia il 63% dei pazienti trattati con adalimumab e MTX aveva raggiunto, secondo i criteri pediatrici dell’American College of Rheumatology (ACR) 8, un miglioramento del 70% e il 42% un miglioramento del 90%. Grazie a questo studio adalimumab sarà il secondo agente anti-TNF disponibile nel trattamento dell’AIG. Ciò rappresenta un progresso poiché si sa, dalla letteratura dell’adulto, che pazienti che si sono rivelati resistenti ad uno degli inibitori del TNF possono rispondere positivamente se trattati con un altro inibitore. Inoltre adalimumab, essendo un anticorpo interamente umano, è meglio tollerato perché scarsamente immunogenico. Vol. 40 - N. 2 CTLA4 CD80/CD86 CD28 APC T cell T TCR MHC A B Abatacept CD CD28 80 /C D 86 CTLA4 APC T cell TCR MHC B Figura 2. — A) Il linfocita T per essere attivato deve ricevere dalla cellula che presenta l’antigene due segnali. Uno viene dal riconoscimento dell’antigene nel contesto del sistema maggiore di istocompatibilità (MHC). Il secondo (segnale co-stimolatorio) è fornito dall’interazione tra il recettore CD28 ed i suoi ligandi CD80 e CD86. B) Abatacept lega CD80 e CD86 con avidità maggiore rispetto a CD28 ed inibisce quindi la trasmissione del segnale costimolatorio impedendo così al linfocita T di attivarsi (vedi testo per maggiori spiegazioni). Abatacept: un inibitore della costimolazione linfocitaria I linfociti T hanno bisogno di due segnali per essere attivati. Il primo è quello antigene specifico ed è generato dall’interazione del recettore dei T linfociti con il complesso formato dal peptide antigenico e dalle molecole del sistema maggiore di istocompatibilità sulla superficie della cellula che presenta l’antigene (APC). Questo segnale da solo non è in grado di attivare la cellula ma anzi induce energia. Perché la cellula T venga attivata è necessario un secondo segnale da parte dell’APC che è detto “costimolatorio” e che può essere veicolato attraverso diversi meccanismi. Uno dei più rilevanti è rappresentato dall’interazione tra due molecole presenti sulla superficie dell’APC (CD80/86) ed una molecola presente sulla superficie del GASLINI 81 RUPERTO ARTRITE IDIOPATICA GIOVANILE: NUOVI FARMACI linfocita T (CD28) (Figura 2). La cellula T, una volta attivata da questi due segnali, esprime sulla superficie cellulare un’altra molecola, il CTLA4, che è strutturalmente simile al CD28 ma che, rispetto a quest’ultimo, ha una maggiore avidità per CD80 e CD86; inoltre, a differenza del CD28, una volta che ha interagito con CD80/86 dà alla cellula T un segnale inibitorio e non attivatorio. Rappresenta quindi un meccanismo coinvolto nello “spegnimento” dell’attivazione linfocitaria. Abatacept è una proteina di fusione in cui la porzione costante (Fc) di una immunoglobulina (IgG1) è stata legata alla porzione extracellulare di CTLA4. Il farmaco blocca il secondo segnale sfruttando la maggiore avidità di CTLA4 (rispetto a CD28) per CD80/86 (Figura 2). CD80/86, bloccato da abatacept, non è più così in grado di interagire con CD28. Abatacept rappresenta quindi il primo di una nuova categoria di farmaci allo studio che sono volti ad inibire l’attivazione dei T linfociti (che, come accennato più sopra, si presume stia alla base della patogenesi dell’artrite cronica) ed ha un meccanismo di azione completamente diverso da quello degli inibitori del TNF. Studi pubblicati a partire dal 2005 hanno portato all’approvazione di Abatacept per il trattamento dell’AR dell’adulto. La percentuale di risposta si è dimostrata simile a quella osservata con gli inibitori di TNF. Inoltre una discreta proporzione di pazienti che non avevano risposto agli anti-TNF hanno risposto ad abatacept, evento comprensibile vista la diversità dei meccanismi di azione. Come per gli anti-TNF gli effetti collaterali del trattamento si sono rilevati fino ad ora modesti con un leggero incremento delle infezioni. Nella pratica corrente abatacept viene preferenzial- mente impiegato nei pazienti che si sono dimostrati resistenti agli anti-TNF. PRINTO e PRCSG hanno condotto lo studio clinico controllato che porterà alla registrazione di abatacept per l’uso anche nell’AIG 4 (Box 2). Come nel caso dell’adalimumab e dell’etanercept tutti i pazienti sono stati trattati inizialmente con il farmaco in aperto. Un aspetto interessante dello studio è che per la prima volta sono stati inclusi pazienti che avevano fallito una precedente terapia non solo con MTX ma anche con anti-TNF. La percentuale di risposta è stata del 75,9% per i pazienti che erano stati in precedenza trattati con MTX (simile a quella osservata negli altri studi con i farmaci anti-TNF). Tuttavia una buona percentuale di risposta (38,6%) si è anche osservata nei pazienti che in precedenza avevano fallito una terapia con farmaci anti-TNF. La successiva randomizzazione a abatacept e placebo ha poi confermato la significativa efficacia della terapia. Anche in questo caso è interessante notare come, dopo 10 mesi di trattamento con abatacept, il 40% dei pazienti presentasse un miglioramento del 90% secondo i criteri ACR. Conclusioni Grazie a questi studi controllati effettuati da PRINTO, due nuovi tipi di farmaci, che agiscono con meccanismi diversi, saranno presto disponibili in commercio per il trattamento dell’AIG e contribuiranno ad un ulteriore miglioramento della prognosi di questa malattia. Bibliografia 1. ) Ravelli A, Martini A. Juvenile idiopathic arthritis. Lancet 2007;369:767-78. 2) Ruperto N, Martini A. International research networks in pediatric rheumatology: the PRINTO perspective. Curr Opin Rheumatol 2004;16:566-70. 3) Lovell DJ, Ruperto N, Goodman S, Reiff A, Jung L, Jarosova K et al. Adalimumab with or without methotrexate in juvenile rheumatoid arthritis. N Engl J Med 2008;359:810-20. 4) Ruperto N, Lovell DJ, Quartier P, Paz E, Rubio-Pérez N, Silva CA, Abud-Mendoza C et al. Efficacy and safety of abatacept in patients with polyarticular juvenile idiopathic arthritis: a randomized, double-blind, placebo-controlled withdrawal trial. Lancet 2008;372:38391. 5) Giannini EH, Brewer EJ, Kuzmina N, Shaikov A, Maximov A, Vorontsov I et al. Methotrexate in resistant juvenile rheumatoid arthritis. Results of the U.S.A.-U.S.S.R. double-blind, placebo-controlled trial. N Engl J Med 1992;326:1043-9. 6) Ruperto N, Murray KJ, Gerloni V, Wulffraat N, Knupp Feitosa de Oliveira S, Falcini F et al. A randomized trial of parenteral methotrexate in intermediate versus higher doses in children with juvenile idiopathic arthritis who failed standard dose. Arthritis Rheum 2004;50:2191-201. 7) Lovell DJ, Giannini EH, Reiff A, Cawkwell GD, Silverman ED, Nocton JJ et al. Etanercept in children with polyarticular juvenile rheumatoid arthritis. N Engl J Med 2000;342:763-9. 8) Giannini EH, Ruperto N, Ravelli A, Lovell DJ, Felson DT, Martini A. Preliminary definition of improvement in juvenile arthritis. Arthritis Rheum 1997;40:1202-9. 9) Ruperto N, Lovell DJ, Cuttica R, Wilkinson N, Woo P, Espada G et al. A randomized, placebo-controlled trial of infliximab plus methotrexate for the treatment of polyarticular course juvenile rheumatoid arthritis. Arthritis Rheum 2007;56:3096-106. 82 GASLINI Agosto 2008 GASLINI 2008;40:83-90 La genetica delle epilessie e le epilessie genetiche P. STRIANO 1, 2, A. BIANCHI 3, C. MINETTI 1, F. ZARA 1 1Unità Operativa Malattie Muscolari e Neurodegenerative, Università di Genova e Istituto “G. Gaslini”, Genova 2Centro Epilessia, Università “Federico II”, Napoli 3Commissione Genetica Lega Italiana contro l’Epilessia Centro Epilessia Unità Operativa di Neurologia, Ospedale Civile, Arezzo L ’importanza di una predisposizione familiare nel determinare l’insorgenza del cosiddetto “morbo sacro” è nota fin dai tempi di Ippocrate (400 a.C.): “Essa (cfr. l’epilessia) ha origine, come anche altre malattie, dall’ereditarietà [...] Se fosse infatti una malattia più divina delle altre dovrebbe colpire tutti allo stesso modo, senza distinguere i flegmatici dai biliosi”. In realtà, le epilessie costituiscono un eterogeneo gruppo di patologie multifattoriali, in gran parte determinate dall’interazione di fattori genetici ed ambientali. Tra le epilessie sono dunque comprese numerose sindromi, diverse per caratteristiche cliniche e prognostiche. Tra queste vi sono forme in cui l’insorgenza delle crisi è riconducibile ad un danno cerebrale strutturale o metabolico acquisito o geneticamente determinato (epilessie sintomatiche) e forme in cui l’epilessia si manifesta in un quadro neurologico apparentemente normale, probabilmente in seguito a difetti funzionali dell’attività cerebrale geneticamente determinati (epilessie idiopatiche). Una quota di epilessie, infine, pur sospette di essere secondarie ad una patologia organica/strutturale del sistema nervoso centrale, ha un’eziologia non definibile con gli strumenti diagnostici attualmente a disposizione; tale gruppo, pur numericamente consistente, è quello delle epilessie criptogenetiche. La ricerca genetica nell’epilessia rappresenta al momento una frontiera di studio altamente suggestiva e promettente di risultati. Nelle ultime due decadi, la cosiddetta rivoluzione molecolare in medicina ha avuto un importante impatto anche nella diagnosi e nel trattamento delle epilessie, in particolare quelle idiopatiche. Le epilessie idiopatiche riguardano circa lo 0,4% della popolazione generale e costituiscono il 30% di tutte le epilessie 1. Clinicamente tale gruppo include un insieme eterogeneo di sindromi epilettiche e di pattern elettroencefalografici (EEG) correlati che possono avere origine focale o generalizzata. Dal momento che l’eziologia delle epilessie idiopatiche è verosimilmente geneticamente determinata, studi di genetica molecolare su queste forme rappresentano un approccio promettente anche per l’approfondimento delle conoscenze sulla patogenesi dell’epilettogenesi in generale. Infatti dati genetici ottenuti da rare forme monogeniche di epilessie idiopatiche hanno permesso di chiarire il ruolo patogenetico di canali ionici voltaggio- o ligando-dipendente in numerose forme di epilessia. Studi di linkage, inoltre, hanno permesso l’individuazione di decine di loci genici per diverse forme di epilessie idiopatiche. Bisogna tuttavia sottolineare che tali dati spesso non sono stati replicati né sono state identificate mutazioni in tali loci suggerendo che la genetica delle epilessie idiopatiche è in realtà molto più complessa ed eterogenea di quanto ci possa in un primo momento attendere. Studi di sequenziamento di geni candidati possono teoricamente essere molto utili a tale riguardo, anche se il genoma umano, contenendo centinaia di geni che codificano per subunità di canali ionici, rende lo screening di tali geni altamente impegnativo sia per la quantità di lavoro che per il costo economico. Attualmente una nuova tecnologia come la “microarray comparative genomic hybridization (array-CGH)” permette l’identificazione di alterazioni numeriche Autore di contatto: P. Striano, Unità Operativa Malattie Muscolari e Neurodegenerative, Università di Genova e Istituto “G. Gaslini”, Genova, Italia. Vol. 40 - N. 2 GASLINI 83 STRIANO LA GENETICA DELLE EPILESSIE della copia genomica presenti a livello submicroscopico basandosi sull’ibridazione di DNA del paziente con quello di controllo su specifiche sonde. Tale metodica ha il vantaggio di poter testare centinaia di geni in un unico esperimento. Dati recenti indicano che riarrangiamenti submicroscopici (da 1 kb a 10 Mb) costituiscono fino al 15% di tutte le mutazioni alla base di malattie genetiche umane. Inoltre, anomalie cromosomiche sono frequentemente associate ad epilessia e specifici fenotipi epilettici sono stati descritti in associazione a riarrangiamenti cromosomici come nella “6 q terminal deletion” e la “inv dup”(15). La recente identificazione di delezioni coinvolgenti in parte o del tutto il gene SCN1A che codifica per la subunità α1 del canale del sodio vdp in una quota di pazienti con Epilessia mioclonica severa dell’infanzia (o sindrome di Dravet) suggerisce che riarrangiamenti sunbmicroscopici coinvolgenti canali ionici possono avere un ruolo importante nell’eziologia di specifiche sindromi epilettiche. Studi di genetica clinica Negli ultimi anni numerosi studi clinici su coppie di gemelli, su famiglie con epilessia e su specifici trait EEG hanno cercato di definire la modalità di trasmissione genetica delle epilessie e la valutazione del rischio individuale di crisi epilettiche 1, 2. Studi su gemelli È da tempo noto che il tasso di concordanza per epilessia é nettamente più alto nei gemelli monozigoti rispetto ai gemelli di zigoti 3. Se combiniamo i maggiori studi sui gemelli troviamo un tasso medio di concordanza del 60% per i monozigoti e del 13% nei dizigoti. Nella sua casistica di gemelli monozigoti, Lennox segnala una più alta incidenza nelle epilessie con crisi di “grande male” (82%) e “piccolo male” (75%) rispetto alle forme con crisi psicomotorie (39%) 4. Gli studi successivi, e tra questi si segnala il contributo della casistica della Lega Italiana contro l’epilessia (LICE) 5, hanno confermato la prevalente importanza del fattore genetico nelle epilessie idiopatiche, con evidenza nei gemelli monozigoti di una concordanza anche per l’età di inizio e per il tipo di sindrome. Nelle convulsioni febbrili si conferma un alto tasso di concordanza nei gemelli monozigoti (68%) rispetto ai dizigoti 84 (13%). Se prendiamo inoltre in esame anche il tratto EEG, osserviamo nei gemelli monozigoti una concordanza superiore al 90% (vedi oltre). I gemelli monozigoti rappresentano, inoltre, un utile modello per definire l’autonomia sindromica di nuove sottoforme cliniche come ad esempio l’epilessia con mioclonie palpebrali con assenze e l’epilessia familiare del lobo temporale. Studi di popolazione e familiari Gli studi familiari si caratterizzano per una notevole disomogeneità nel disegno dello studio e nelle casistiche considerate. La stessa definizione di epilessia non appare univoca e possiamo trovare studi dove vengono considerati solo parenti con forme sindromiche definite ed altri ove vengono considerati affetti anche casi con qualsiasi tipo di crisi epilettiche o con sole anomalie EEG. Inoltre, per l’analisi di rischio, la valutazione degli altri casi affetti familiari emerge talora solo dalle interviste dei probandi, con tutte le difficoltà interpretative che questo dato comporta, soprattutto di sottostima del fenomeno. Tuttavia alcuni dati emersi negli ultimi anni forniscono utili strumenti per l’applicazione nella consulenza genetica clinica. In particolare, gli studi familiari e di popolazione della scuola di Rochester 6 che si caratterizzano per un maggior rigore nell’analisi epidemiologica e nel disegno metodologico, hanno permesso di evidenziare la presenza di un maggiore rischio nei parenti di un paziente affetto da epilessia rispetto alla popolazione generale dove si assume un rischio dell’1%. Così, nei fratelli di un caso affetto da epilessia si osserva un maggior rischio del 3-5%; nei figli di un genitore con epilessia il rischio è nell’ordine del 4-6%. Il rischio nei fratelli aumenta al 5-6% se il probando con epilessia ha un pattern EEG di punta-onda generalizzato ed all’8% se è presente anche una risposta fotoparossistica, diminuisce al 2-3% se il probando ha crisi focali o ha un inizio delle crisi dopo i 25 anni di età. Il rischio è dell’8% se è affetto da epilessia oltre il probando anche un genitore ed è del 12 % se è presente nel genitore un tratto EEG generalizzato. Nei figli di un genitore affetto da epilessia il rischio di crisi epilettiche é nettamente diverso se a presentare l’epilessia è la madre (8,7%) rispetto al padre (2,4%). Il rischio nei figli è differente se uno dei genitori ha crisi di assenza (9%) rispetto alla presenza di crisi focali (2,7%). GASLINI Agosto 2008 LA GENETICA DELLE EPILESSIE STRIANO Le convulsioni febbrili vanno considerate separatamente per alcune peculiari caratteristiche. La loro prevalenza in Europa e negli Stati Uniti è del 2-4% sotto i 5 anni di età; il rischio nei fratelli e nei figli aumenta di circa tre volte, ma se uno dei genitori oltre il probando ha avuto convulsioni febbrili il rischio per il nuovo nato arriva al 22%, e se entrambi i genitori hanno avuto convulsioni febbrili il rischio supera il 50%. In questa forma vi sono differenze in rapporto alla razza: in Giappone troviamo una prevalenza nella popolazione intorno all’8%. Elettroencefalogramma Se prendiamo in considerazione gli studi su patters EEGgrafici familiari si rilevano anomalie specifiche epilettiche nei parenti, in particolare della prima generazione, con una incidenza nettamente più alta, circa 2-3 volte, rispetto al rischio di sviluppare l’epilessia. In particolare è stato osservato per il tratto punta-onda generalizzato l’evidenza di un quadro simile al probando nel 35% dei fratelli e nel 10% dei genitori, per la risposta fotoparossistica nel 32% dei fratelli e per la punta centro-temporale nel 35% dei fratelli e nel 3-20% nei genitori 1, 2, 5. Una forte limitazione degli studi sull’EEG è la spiccata età-dipendenza dei diversi tratti genetici. La presenza di un tratto EEG parossistico in presenza di altri casi familiari determina un rischio a sviluppare il fenotipo epilettico nell’ordine del 15%. La concordanza sindromica Un altro aspetto da valutare riguarda quale forma di epilessia si manifesta in un nuovo caso familiare in relazione alla forma clinica del probando. Un importante contributo su questo aspetto è stato fornito dagli studi della LICE sulla propria casistica di famiglie multigenerazionali 5, 6. È stato osservato che una concordanza completa per la stessa forma sindromica si osserva solo nel 25 % delle famiglie, mentre negli altri casi possono essere presenti nella stessa famiglia due o tre forme sindromiche. La concordanza per la stessa forma clinica è più alta nei parenti di primo grado, con una frequenza dal 30% al 40% nelle diverse forme sindromiche. Nei parenti di secondo grado si osserva una tendenza ad un fenotipo differente ed in particolare è stata vista una più alta frequenza di casi con convulsioni febbrili ed epilessia idiopatica con crisi di grande male. Vol. 40 - N. 2 Gli studi di genetica clinica non hanno permesso di definire un modello di trasmissione genetico univoco per le diverse forme e, ad eccezione per le rare forme con trasmissione mendeliana, nelle forme sindromiche più comuni va assunto un modello di trasmissione complesso di tipo poligenico e/o multifattoriale. Studi di genetica molecolare In questi ultimi anni stiamo assistendo ad un notevole sviluppo della genetica molecolare che ha modificato le conoscenze in molte patologie neurologiche. La individuazione di una specifica mutazione genica è il risultato di complesse e articolate strategie di studio. La ricerca di geni-epilessia ha privilegiato lo studio di singole ampie famiglie informative con modalità di trasmissione mendeliana piuttosto che di ampie casistiche di famiglie nucleari geneticamente eterogenee. I risultati maggiormente rilevanti sono stati così ottenuti nelle rare forme di epilessia con ereditarietà mendeliana autosomico dominante (es. crisi neonatali benigne familiari) o autosomica recessiva (es. epilessie miocloniche progressive), nelle famiglie multigenerazionali con forme cliniche di epilessia più comune e nelle peculiari forme familiari con epilessie non inquadrabili nelle forme sindromiche conosciute 7, 8. Questa metodologia ha permesso l’individuazione di diverse mutazioni e la definizione di nuovi geni candidati, fornendo inoltre importanti informazioni sulla patogenesi delle epilessie. I geni così identificati tuttavia sono coinvolti in un numero ridotto di famiglie, senza al momento una chiara correlazione patogenetica con le più comuni forme di epilessia (Figura 1). Un altro filone di studio è rappresentato dalla ricerca di geni di predisposizione o di suscettibilità attraverso lo studio di gruppi più numerosi di famiglie di non estese dimensioni, caratterizzate da forme cliniche comuni e variabilità fenotipica. L’eterogeneità genetica che caratterizza queste forme tuttavia ha notevolmente complicato gli studi, e, ad oggi, nessun fattore di suscettibilità è noto. La individuazione di un gene mutato può rappresentare uno strumento per verificare la presenza di mutazioni anche in casi sporadici o in forme cliniche affini alle famiglie studiate. Nella Tabella I (anche disponibile sul sito web della Lega Italiana Contro GASLINI 85 STRIANO LA GENETICA DELLE EPILESSIE EPILESSIA BENIGNA DELL’INFANZIA CON PUNTE CENTRO-TEM- PORALI È una sindrome molto comune con una trasmissione ereditaria di tipo complesso e ad eziologia finora sostanzialmente ancora ignota. EPILESSIA AUTOSOMICA DOMINANTE DEL LOBO FRONTALE CON CRISI NOTTURNE Figura 1. — Principali canali e recettori ionici coinvolti nella patogenesi di epilessie a trasmissione genetica. ADNFLE: Epilessia notturna del lobo frontale autosomica dominante; BFNC: Convulsioni neonatali familiari benigne; GEFS+: Epilessia generalizzata con convulsioni febbrili plus; SMEI: Epilessia Mioclonica Severa dell’infanzia. l’Epilessia) sono segnalate in modo sintetico le forme sindromiche dove la ricerca ha al momento individuato alcune localizzazioni genomiche o ha definito il gene implicato nella patogenesi della sindrome. Epilessie focali idiopatiche CRISI BENIGNE NEONATALI FAMILIARI (BNFC) Questa sindrome, caratterizzata da crisi tipicamente nella prima settimana di vita, ha una trasmissione genetica mendeliana di tipo autosomico dominante con alta penetranza. Già i primi studi avevano evidenziato l’eterogeneità genetica della sindrome con la localizzazione di due diversi geni nel cromosoma 20q13.2 e nel cromosoma 8q24.1, successivamente individuati nei geni codificanti i canali del potassio voltaggio-dipendenti KCNQ2 e KCNQ3 9, 10. CRISI BENIGNE INFANTILI FAMILIARI (BNFS) Questa forma, caratterizzata da crisi focali ad insorgenza tra i 4 e gli 8 mesi di vita e buona prognosi, si presenta con una modalità di trasmissione autosomica dominante. In tale condizione sono stati localizzati due loci sul 19q e, soprattutto, 16p12-q12 10. Recentemente, inoltre, sono state descritte mutazioni in alcune famiglie con età di esordio precoce aventi mutazioni nel gene SCN2A, nel cromosoma 2q24 11. 86 Dal punto di vista clinico si caratterizza per episodi accessuali morfeici (in sonno) di tipo ipermotorio e/o risvegli improvvisi notturni ricorrenti. Ha buona risposta alla terapia antiepilettica. Questa forma rappresenta la prima sindrome idiopatica dove è stato individuato un gene coinvolto nella patogenesi della malattia, CHRNA4 codificante la subunità 〈4 del recettore nicotinico dell’acetilcolina 12. Mutazioni nel gene CHRNB2 e CHRNA2, rispettivamente subunità 2 ed 〈2 dello stesso recettore sono state individuate in altre famiglie 13. EPILESSIA FAMILIARE DEL LOBO TEMPORALE L’epilessia familiare del lobo temporale può essere divisa in due forme, mesiale e laterale. Nella forma laterale, in particolare con crisi a semiologia prevalentemente uditiva, sono state individuate mutazioni nel gene LGI1 (epitempina) 14. Ancora scarsi e non univoci sono invece i dati sulle formi mesiali, con e senza sclerosi ippocampale. CONVULSIONI FEBBRILI FAMILIARI È stato ipotizzata l’esistenza di diversi geni coinvolti nella patogenesi delle convulsioni febbrili familiari. Le segnalazioni in letteratura al momento hanno mostrato numerose localizzazioni cromosomiche (Tabella I), raramente “duplicate” in letteratura. Recentemente è stata identificata una mutazione nel gene MASS1 sul cromosoma 5q14.15 in una singola famiglia con convulsioni febbrili 15. Epilessie generalizzate idiopatiche Le Epilessie Generalizzate Idiomatiche (IGEs) comprendono differenti fenotipi clinici come l’Epilessia Mioclonica Giovanile (JME), l’Epilessia Giovanile con Assenze (JAE), l’Epilessia con Assenze dell’Infanzia (CAE), e le Crisi tonico-cloniche “at random (GTCS at random)”. Questi diversi tipi di crisi possono comunque GASLINI Agosto 2008 LA GENETICA DELLE EPILESSIE STRIANO TABELLA I. — Elenco dei loci e dei geni noti associati ad epilessie genetiche. Epilessie idiopatiche Epilessie focali idiopatiche — Crisi neonatali benigne familiari Trasmissione Locus Gene AD 20q13 8q24 2q24 2q24 1q23 20q13 1p21 8p12 10q KCNQ2 KCNQ3 SCN2A SCN2A ATP1A2 CHRNA4 CHRNB2 CHRNA2 LGI2 19q13 2q24 2q24 5q 2q24 19q13 5q34 6p12 2q22 19q SCN1B SCN1A SCN2A GABRG2 SCN1A SCN1B GABRA1 EFHC1 CANCB4 CACNA1A 2q24 2q24 SCN1A SCN1A — Crisi neonatali-infantili benigne familiari — Crisi infantili benigne familiari — Crisi infantili benigne familiari e emicrania emiplegica familiare — E autosomica dominante notturna del lobo frontale AD AD AD AD — E familiare del lobo temporale laterale AD Epilessie generalizzate idiopatiche — E generalizzata idiopatica con crisi febbrili plus (GEFS+) AD — GEFS+ ed E focale temporale AD — E generalizzata idiopatica AD — E generalizzata idiopatica e atassia episodica AD Encefalopatie epilettiche — E mioclonica severa dell’infanzia (SMEI) — E mioclonica severa dell’infanzia - borderline (SMEB) Complessa Complessa ©Lega Italiana Contro l’Epilessia (LICE) - Commissione Genetica (aggiornato al 15 maggio 2008) (www.lice.it). coesistere all’interno della stessa famiglia e manifestarsi persino nello stesso individuo, suggerendo quindi un’eziologia comune (Figura 2). Pertanto è generalmente considerato che, ad esempio, fattori genetici implicati nella suscettibilità per la JME possano anche incrementare il rischio per la JAE e viceversa. Per identificare questi fattori genetici sono stati messi a punto studi genetici su larga scala in famiglie con IGEs, selezionate sia per tipo di sindrome che per tipo di crisi. Questi studi hanno suggerito diversi loci cromosomici in linkage con le IGE. In alcuni casi, inoltre, le famiglie sono state selezionate sulla base dei sottofenotipi di IGE e/o di specifici patterns EEG. Tra i loci di suscettibilità per le IGE vanno citati quelli sul cromosoma 18, 6, 8p e 5p (studio USA) e 2q36, 3q26 e 14q23 (studio europeo) 16, 17. EPILESSIA CON ASSENZE DELL’INFANZIA In una estesa famiglia indiana con crisi di assenze dell’infanzia persistenti nel tempo e crisi tonico-cloniche Vol. 40 - N. 2 Figura 2. — La comorbidità dei sottofenotipi delle diverse forme di Epilessie Generalizzate Idiopatiche (IGEs) suggerisce in tali forme la condivisione dei fattori di suscettibilità genetica. CAE: Epilessia con assenze dell’infanzia; JAE: Epilessia con assenze giovanili; JME: Epilessia Mioclonica Giovanile; GTCS: Epilessia con crisi generalizzate “at random”. GASLINI 87 STRIANO LA GENETICA DELLE EPILESSIE Figura 3. — A. Elettroferogramma di una mutazione (4942 CàT) coinvolgente la subunità · del canale del sodio vdp (SCN1A) in paziente affetta da Epilessia Mioclonica Severa dell’infanzia (Sindrome di Dravet). B, C. Sezione e struttura tridimensionale del canale del sodio vdp con indicazione della sede della mutazione. D. Conservazione del residuo aminoacidico nell’uomo (in blu) ed in diverse specie animali. Modificato da Striano et al., Lancet Neurology 2008;7:278-84 22. è stata riportata una localizzazione nel cromosoma 8q24, ma il gene specifico non è stato mai identificato. EPILESSIA MIOCLONICA GIOVANILE Questa forma per la sua prevalenza, per il ben definito fenotipo clinico e per la presenza di un tratto EEG generalizzato che tende a persistere nel tempo, ha rappresentato il modello clinico privilegiato per lo studio di analisi di linkage. Nel 1988 Greenberg et al. hanno riportato l’esistenza di un linkage tra questa forma ed il tratto EEG di polipunta-onda con la regione dell’HLA (Human Leukocyte Antigen) del cromosoma 6 (6p21) 16. Questi risultati sono stati successivamente confermati in famiglie con casi di epilessia mioclonica giovanile ed altre forme generalizzate idiopatiche. In una singola famiglia franco canadese con una forma autosomica dominante di epilessia mioclonica giovanile è stata identificata una mutazione nel gene codificante la subunità α1 del recettore A del GABA. Più recentemente, inoltre, mutazioni del gene EFHC1, codificante una proteina con tre domini DM10 e un EFhand motif, a funzione ignota, sono state identificate fino al 20% di famiglie con epilessia mioclonica giovanile. EPILESSIA MIOCLONICA BENIGNA FAMILIARE DELL’ADULTO Questa forma descritta inizialmente in Giappone è caratterizzata dalla insorgenza in età medio-adulta di 88 tremore corticale (mioclono fine delle estremità), rare crisi epilettiche, fotosensibilità, e decorso non francamente progressivo. Loci di suscettibilità sono stati individuati sul cromosoma 8q24 e 2p11.1-q12.2 18. EPILESSIA GENERALIZZATA CON CRISI FEBBRILI PLUS (GEFS+) Questa forma descritta da autori australiani è caratterizzata dalla presenza di crisi febbrili, che persistono oltre i 6 anni, e crisi afebbrili di diverso tipo in età adulta. Mutazioni sono state identificate nei geni codificanti le subunità canali voltaggio dipendenti del sodio SCN1B, SCN1A e SCN2A e nella subunità γ2 del recettore GABA-A 19-21. La maggior parte degli autori generalmente ritiene che nello spettro delle GEFS+ rientri anche la forma seguente di epilessia. L’EPILESSIA MIOCLONICA SEVERA DELL’INFANZIA O SINDROME DI DRAVET La sindrome di Dravet è una sindrome epilettica caratterizzata da crisi polimorfe favorite dalla febbre, atassia e ritardo mentale. In un lavoro recente alcuni ricercatori dell’Istituto Gaslini hanno delineato in caratteristiche cliniche e genetiche di questa sindrome 22. Nel 70% dei casi si riscontrano mutazioni, solitamente de novo, del gene SCN1A (Figura 3). Sulla base dei dati disponibili in letteratura alcuni ricercatori dell’Istituto Gaslini hanno delineato le caratteristiche cliniche e genetiche di questa sindrome epilettica. La GASLINI Agosto 2008 LA GENETICA DELLE EPILESSIE STRIANO patologia si manifesta nel primo anno di vita solitamente con convulsioni febbrili prolungate, seguite da crisi afebbrili di diverso tipo e deficit psicomotorio. Nel corso del follow-up i pazienti possono sviluppare crisi di tutti i tipi, crisi miocloniche, atoniche, parziali e assenze, difficilmente controllabili dai farmaci antiepilettici. Poiché si ipotizza che le crisi e le anomalie EEG epilettoformi contribuiscano al deficit progressivo della funzione cerebrale, la Sindrome di Dravet è considerata una encefalopatia epilettica. Inoltre i bambini possono sviluppare atassia, disfunzioni cerebellari, e segni piramidali ed extrapiramidali. In circa il 70% dei pazienti affetti da sindrome di Dravet si riscontrano mutazioni nel gene codificante la subunità α1 del canale del sodio voltaggio dipendente SCN1A 23. Ad oggi sono più di 200 le mutazioni di SCN1A documentate, la maggior parte delle quali determinano la formazione di una proteina tronca. Le mutazioni sono di origine sporadica (de novo) nella quasi totalità dei casi. Tuttavia sono state descritte pazienti SMEI con mutazioni ereditate da genitori con fenotipi epilettici più lievi. Applicazioni delle evidenze genetiche Le nuove acquisizioni nel campo della genetica hanno avuto un forte impatto sia nelle conoscenze di base che nella normale attività assistenziale. Patogenesi delle epilessie Studi sperimentali hanno da tempo individuato nella presenza di scariche fasiche intense di una popolazione di neuroni l’evento cellulare, noto come “paroxysmal depolarization shift” (PDS), alla base dell’epilettogenesi e il ruolo fondamentale delle correnti ioniche nel corso del suo sviluppo, in particolare le correnti del sodio, del potassio, del calcio e del cloro attraverso canali attivati da neurotrasmettitori o variazioni del potenziale di membrana 24. La recente individuazione di mutazioni nei geni codificanti subunità di canali voltaggio-dipendenti del sodio, del potassio e del cloro, di recettori per l’acetilcolina e per il GABA in alcune forme di epilessia hanno confermato gli studi sperimentali e permettono di inserire oggi alcune forme di epilessia idiopatica tra le canalopatie. Tuttavia l’implicazione dei canali ionici in forme molto rare e ad ereditarietà esclusivamente autosomica Vol. 40 - N. 2 dominante impone cautela nell’estendere il concetto di canalopatie a tutte le epilessie idiopatiche. Ad oggi infatti le basi genetiche delle forme comuni di epilessia idiopatica ad ereditarietà complessa sono ignote. Recentemente mutazioni nel gene LGI1, frequentemente deleto in tumori gliali e codificante una proteina a funzione ignota, sono state identificate nell’Epilessia autosomica dominante temporale laterale ed è possibile pertanto che gli eventi molecolari alla base delle epilessie idiopatiche siano notevolmente diversificati 24. Classificazione delle epilessie La classificazione delle epilessie sulla base di criteri clinici è stata da sempre importante nella pratica clinica per formulare una diagnosi, impostare una terapia corretta e ipotizzare una prognosi. Nell’ultima classificazione ILAE del 1989 vengono individuate diverse sindromi epilettiche in base al tipo di crisi, l’età di esordio, il decorso possibile. I dati epidemiologici indicano tuttavia che sindromi clinicamente diverse ricorrono nelle stesse famiglie indicando l’esistenza di fattori ereditari comuni. L’identificazione di mutazioni – ad esempio in SCN1A, SCN1B, GABRG2, CLCN2 – associate a diversi fenotipi in famiglie caratterizzate da fenotipi diversi conferma le osservazioni epidemiologiche che le diverse sindromi si sviluppano dalla azione concomitante di fattori ereditari e background individuale. Gli studi genetici hanno inoltre indicato la presenza, tra le forme frequentemente sporadiche di subset familiari per l’identificazione di soggetti a rischio elevato di sviluppare epilessia ad esempio nell’epilessia notturna del lobo frontale, di epilessia generalizzata con crisi febbrili di tipo plus. La genetica ha inoltre posto l’attenzione su specifici fenotipi familiari successivamente validati come nuove forme sindromiche quali l’epilessia mioclonica benigna familiare dell’adulto, le crisi infantili benigne familiari e l’epilessia autosomica dominante del lobo temporale mesiale e laterale 25. La consulenza genetica e la diagnosi sindromica Le basi genetiche delle epilessie sono ancora oggi largamente sconosciute. Nella pratica clinica quindi la consulenza genetica si basa sui dati epidemiologici e stime di rischio empiriche. Tuttavia l’identificazione di geni-epilessia, ad oggi implicati in rare sindromi mendeliane, fornisce al clinico specifici test molecolari per la diagnosi precedentemente affidata agli accer- GASLINI 89 STRIANO LA GENETICA DELLE EPILESSIE tamenti neurofisiologici e clinici. Nelle epilessie miocloniche progressive ad esempio è possibile offrire la diagnosi prenatale ed analizzare i portatori per l’individuazione di coppie a rischio. Test genetici vengono oggi eseguiti per l’epilessia mioclonica severa dell’infanzia e per le epilessie idiopatiche per le crisi neonatali familiari benigne dell’infanzia, per l’epilessia autosomico dominante notturna del lobo frontale, per l’epilessia familiare del lobo temporale laterale e per l’epilessia familiare con crisi febbrili di tipo plus. Le implicazioni terapeutiche Le implicazioni terapeutiche degli studi genetici dell’epilessia sono ad oggi ancora piuttosto limitate. Tuttavia si intravedono importanti prospettive che possono derivare sia dalla valutazione dell’efficacia farmacologia in relazione, in particolare, al background genetico individuale, attraverso il disegno di nuovi farmaci ad azione specifica su proteine mutate, sia dalla prospettiva di applicare una terapia genica sostitutiva nelle forme più gravi. Bibliografia 1. Ottman R. Family studies. In: Engel JJr, Pedley TA, editors. Epilepsy: a comprehensive textbook. Philadelphia: Lippincott-Raven; 1997. p. 177-83. 2. Pedley TA. EEG traits. In: Engel JJr, Pedley TA, editors. Epilepsy: a comprehensive textbook. Philadelphia: Lippincott-Raven Publ; 1997. p. 185-96. 3. Anderson VE, Rich SS, Hauser WA, Wilcox KJ. Twin studies in epilepsy. In: Beck-Mannagetta G, Anderson VE, Doose H, Janz D, editors. Genetics of the Epilepsy. Heidenberg: Springer-Verlag; 1989. p. 145-55. 4. Lennox WG, Lennox MA. Epilepsy and related disorders. Boston: Little Brown; 1960. 5. Italian League Against Epilepsy Genetic Collaborative Group. Concordance of clinical forms of epilepsy in families with several affected members. Epilepsia 1993;34:819-26. 6. Mosewich RK, So EL. A clinical approach to the classification of seizures and epileptic syndromes. Mayo Clin Proc 1996;71:405-14. 7. Steinlein OK. Genes and mutations in idiopathic epilepsy. Am J Med Genet 2001;106:139-45. 8. Singh NA, Charlier C, Stauffer D, DuPont BR, Leach RJ, Melis R et al. A novel potassium channel gene, KNQ2, is mutated in an inherited epilepsy of newborns. Nat Genet 1998;18:25-9. 9. Charlier C, Singh NA, Ryan SG, Lewis TB, Reus BE, Leach RJ et al. A pore mutation in a novel KQT-like potassium channel gene in an idiopathic epilepsy family. Nat Genet 1998;18:53-5. 10. Striano P, Lispi ML, Gennaro E, Madia F, Traverso M, Bordo L et al. Linkage analysis and disease models in benign familial infantile seizures: a study of 16 families. Epilepsia 2006;47:1029-34. 11. Striano P, Bordo L, Lispi ML, Specchio N, Minetti C, Vigevano F et al. A novel SCN2A mutation in family with benign familial infantile seizures. Epilepsia 2006;47:218. 12. Steinlein OK, Mulley JC, Propping P, Wallace RH, Phillips HA, Sutherland GR et al. A missense mutation in the neuronal nicotinic acetylcholine receptor 〈 4 subunit is associated with autosomal dominant nocturnal frontal lobe epilepsy. Nat Genet 1995;11:201-3. 13. De Fusco M, Becchetti A, Patrignani A, Annesi G, Gambardella A, Quattrone A et al. The nicotinic receptor β2 subunit is mutant in nocturnal frontal lobe epilepsy. Nat Genet 2000;26:275-6. 14. Kalachikov S, Evgrafov O, Ross B, Winawer M, Barker-Cummings C, Martinelli Boneschi F et al. Mutations in LGI1 cause autosomaldominant partial epilepsy with auditory features. Nat Genet 2002;30:335-41. 15. Nakayama J, Fu YH, Clark AM, Nakahara S, Hamano K, Iwasaki N et al. A nonsense mutation of the MASS1 gene in a family with febrile and afebrile seizures. Ann Neurol 2002;52:654-7. 16. Greenberg DA, Delgado-Escueta AV, Widelitz H, Sparkes RS, Treiman L, Maldonado HM et al. Juvenile myoclonic epilepsy (JME) may be linked to the Bf and HLA loci on human chromosome 6. Am J Med Genet 1988;31:185-92. 17. Zara F, Bianchi A, Avanzini G, Di Donato S, Castellotti B, Patel PI et al. Mapping of genes predisponing to idiopathic generalized epilepsy. Hum Mol Genet 1995;4:1201-7. 18. Striano P, Zara F, Striano S. Autosomal dominant cortical tremor, myoclonus and epilepsy: many syndromes, one phenotype. Acta Neurol Scand 2005;111:211-7. 19. Wallace RH, Wang DW, Singh R, Scheffer IE, George AL Jr, Phillips HA et al. Febrile seizures and generalized epilepsy associated with a mutation in the Na+-channel 1 subunit gene SCN1B. Nat Genet 1998;19:366-70. 20. Escayg A, MacDonald BT, Meisler MH, Baulac S, Huberfeld G, An-Gourfinkel I et al. Mutations of SCN1A, encoding a neuronal sodium channel, in two families with GEFS+2. Nat Genet 2000;26:275-6. 21. Baulac S, Huberfeld G, Gourfinkel-An I, Mitropoulou G, Beranger A, Prud’homme JF et al. First genetic evidence of GABA A receptor dysfunction in epilepsy: a mutation in the gamma2-subunit gene. Nat Genet 2001;28:46-8. 22. Striano P, Striano S, Minetti C, Zara F. Refractory, life-threatening status epilepticus in a 3-year-old girl. Lancet Neurol 2008;7:278-84. 23. Mulley JC, Scheffer IE, Petrou S, Dibbens LM, Berkovic SF, Harkin LA. SCN1A mutations and epilepsy. Hum Mutat 2005;25:535-42. 24. Delgado-Escueta AV, Ganesh S, Yamakawa K. Advances in the genetics of Progressive Myoclonus Epilepsy. Am J Med Genet 2001;106:129-38. 25. Engel J Jr. A proposed diagnostic scheme for people with epileptic seizures and with epilepsy: report of the ILAE task force on classification and terminology. Epilepsia 2001;42:1-8. 90 GASLINI Agosto 2008 CASI CLINICO GASLINI 2007;40:91-5 Un ragazzo con febbre e pericardite G. FILOCAMO, A. PARODI, S. SORRENTINO, M. B. DAMASIO, A. BUONCOMPAGNI, P. PICCO, A. MARTINI Dipartimento di pediatria, Istituto G. Gaslini, Genova L a scena si svolge nella clinica pediatrica di un Istituto Scientifico Primo giorno Sala riunioni Entra uno specializzando portando una cartella sottobraccio. Primo specializzando: È arrivato da poco un nuovo paziente; ci è stato trasferito con un sospetto di artrite idiopatica giovanile sistemica. Vi racconto la storia così decidiamo subito gli esami per domattina? Medico di reparto: Va bene Primo specializzando: Graziano ha 15 anni ed è figlio di genitori non consanguinei. Ha due fratelli più grandi in buona salute. L’anamnesi familiare non ha niente di rilevante. Nato a termine da parto eutocico, cresciuto bene, all’età di 3 anni ha avuto una epatite A risoltasi senza problemi. Null’altro di significativo fino a 5 mesi fa circa, quando ha cominciato a presentare febbre persistente fino a 39° C ed è stato trattato con terapia antibiotica. Al settimo giorno di febbre è comparso un intenso dolore in sede retrosternale; è stato quindi ricoverato presso l’ospedale locale dove gli accertamenti laboratoristici e strumentali hanno dimostrato la presenza di una pericardite. In ospedale hanno avviato una terapia con FANS e con prednisone al dosaggio di 30 mg/die (per un peso di 67 kg); hanno poi progressivamente ridotto il prednisone fino ad arrivare a 5 mg/die a distanza di un mese dall’inizio del trattamento. Raggiunto questo dosaggio, il ragazzo ha nuovamente presentato un rialzo febbrile, trattato con paracetamolo e terapia antibiotica senza beneficio. Per il persistere della sintomatologia è stato nuovamente ricoverato. Gli esami ematochimici hanno dimostrato una significativa alterazione degli indici di flogosi, un emocromo nella norma, e una debole positività degli anticorpi antinucleo (ANA 1:80). La radiografia del torace non ha evidenziato versamenti pleurici né lesioni parenchimali in atto; è stato effettuato anche un aspirato midollare risultato negativo. Al controllo cardiologico è stata evidenziata una recidiva della pericardite ed è stato pertanto dimesso in terapia con prednisone 50 mg/die e FANS. Secondo specializzando. Un altro caso di pericardite ricorrente! Vengono proprio a grappolo! Primo specializzando. Aspetta, la storia non è finita. Al momento del secondo ricovero la VES (I h) era 87 e la PCR 14 mg/dl; dopo l’inizio della terapia steroidea la VES si è ridotta a 50 e la PCR a 7,9. Nei giorni successivi, pur mantenendo il prednisone a 50 mg/die gli indici di flogosi non si sono mai normalizzati e la madre riferisce che il ragazzo continuava a presentare febbricola in assenza di altra sintomatologia. Per tale motivo, a due settimane dalla dimissione, il paziente è stato nuovamente ricoverato. Il prednisone è stato comunque ridotto fino alla completa sospensione. Il ragazzo ha però presentato un significativo incremento della febbre e la comparsa di una artrite a livello di entrambe le articolazioni tibio-tarsiche. È stata quindi posta una diagnosi di artrite idiopatica giovanile sistemica ed iniziata una terapia con methotrexate (10 mg /m2 settimana) e prednisone (25 mg/die). Per la persistenza della sintomatologia nonostante Autore di contatto: G. Filocamo, Istituto G. Gaslini, Genova. Vol. 40 - N. 2 GASLINI 91 FILOCAMO UN RAGAZZO CON FEBBRE E PERICARDITE l’avvio del trattamento di fondo, è stato deciso il trasferimento presso il nostro Istituto. Medico di reparto. Come sta adesso il ragazzo? Lo hai già visitato? Primo specializzando: È in discrete condizioni generali. I toni cardiaci sono validi e ritmici con pause libere. Al torace non si apprezza niente di particolare. C’è una modesta tumefazione, con dolore e limitazione funzionale, a livello di entrambe le articolazioni tibiotarsiche. Per il resto non vi sono linfonodi palpabili nelle stazioni superficiali, fegato e milza non sono ingranditi e l’addome è trattabile, non dolente alla palpazione. La pressione arteriosa è normale ed i polsi periferici si sentono bene. Medico di reparto. Com’è l’andamento della febbre? Ha mai avuto rash in corrispondenza delle puntate febbrili? Primo specializzando: La madre riferisce che la febbre era continua anche se si accentuava alla sera e tendeva a ridursi al mattino. In corso di terapia steroidea alla posologia di 25 mg/die, l’andamento della temperatura è stato molto irregolare. In alcuni giorni era apiretico, in altri ha presentato febbre serotina con puntate >38,5° C. Non ho rilevato la presenza di rash e la madre mi ha confermato che non ha mai osservato manifestazioni cutanee. Medico di reparto. L’aspirato midollare mi hai detto che era negativo vero? Primo specializzando: Sì, ma per la verità è stato eseguito quando già aveva fatto una terapia steroidea. Medico di reparto. Ha avuto dolori addominali? C’è presenza di sangue occulto nelle feci? Primo specializzando: Non sono riferiti dolori addominali. La ricerca di sangue occulto non la ho trovata ma la programmiamo comunque a partire da domani. Medico di reparto: Allora cosa ne pensate? Secondo specializzando: L’anamnesi e l’esame obiettivo non confermano una diagnosi di artrite idiopatica giovanile ad esordio sistemico? Ci sono febbre, sierosite e artrite. Primo specializzando: L’andamento della temperatura però non è caratteristico, sembra di capire che era continua anziché intermittente; inoltre le puntate febbrili non dovrebbero in genere essere accompagnate da un rash evanescente? Non è un po’ atipica per essere una artrite sistemica? Medico di reparto: In effetti il quadro non è affatto chiaro, venite che lo visitiamo insieme. Poco dopo, di ritorno dalla stanza del paziente. 92 Medico di reparto: Direi che c’è sostanzialmente un modesto interessamento di entrambe le caviglie con segni di tenosinovite. Vediamo il risultato dei primi esami e poi domani decidiamo cosa fare. Il giorno dopo Sala riunioni Secondo specializzando: Abbiamo i primi risultati. Esame emocromocitometrico: GB 13,93×103/mm3 (N 65,1%, L 26,4%, M 6,4%, E 0,5%, B 0,3%) GR 4,56 106/mm3, Hb 10,5 g/dL, MCV 76,2 fL Piastrine 451 ×103/mm3 PCR 12,26 mg/dl (<0,46), ferritina 438 ng/ml (11120) PT 90% (70-120), PTT 25,6 s (25-38), fibrinogeno 844 mg/dl (170-400) Reuma test 8,8 mg/dl (<10) IgG 1 291 mg/dl, IgA 286 mg/dl, IgM 159 mg/dl C3: 98 mg/dl Esame urine: normale, Proteine totali 7,12 g/dl Transaminasi, elettroliti, sierologie ed altri esami sono normali. Non c’è sangue occulto nelle feci. Anche la visita cardiologia è normale; in particolare non ci sono versamenti pericardici. L’ecografia addominale non mostra nulla di particolare. Gli autoanticorpi ce li danno domani Medico di reparto: C’è una sindrome infiammatoria ma che cosa ci sia sotto non è chiaro. Secondo specializzando: Dobbiamo aumentare la posologia del prednisone? Medico di reparto: Direi di no perché non sapremmo che malattia stiamo trattando. Visto che attualmente non vi è nulla di allarmante nel quadro clinico farei piuttosto il contrario. Proverei a ridurre progressivamente la posologia dello steroide ed introdurrei un FANS per cercare comunque di controllare la sintomatologia, cioè la modesta artrite. Vediamo così se, riducendo il cortisone, compare qualche sintomo che ci possa aiutare nella diagnosi. Due giorni dopo Sala riunioni Medico di reparto: Mi sembra che Graziano stia meglio. GASLINI Agosto 2008 UN RAGAZZO CON FEBBRE E PERICARDITE FILOCAMO Primo specializzando: Sì, clinicamente va meglio, ieri è rimasto apiretico ma durante la notte ha presentato febbricola. La tumefazione alle caviglie è regredita dopo l’inizio della terapia con naprossene. Sono arrivati gli autoanticorpi: gli ANA sono positivi a titolo basso (1/80) mentre gli anticorpi anti-citoplasma dei neutrofili (ANCA) sono negativi. Medico di reparto: E gli esami di oggi? Primo specializzando: L’emocromo è sovrapponibile al precedente, la VES è 70 e la PCR 12,8. Medico di reparto: Restiamo allora a vedere, seguiamolo con molta attenzione e continuiamo a scalare lo steroide. cocardiografia è negativa per versamenti pericardici. L’ecografia della gamba ha evidenziato un aumento di volume e marcate disomogeneità ecostrutturali a carico del terzo superiore e medio del muscolo tibiale anteriore. È stato consigliato un approfondimento con RM Medico di reparto. Certamente, richiediamo una RM con contrasto. Vedi se riescono a farla domattina perché dobbiamo arrivare rapidamente ad una decisione. Il ragazzo come sta oggi pomeriggio? Secondo specializzando: Un po’ meglio; la febbre è modesta; ha artromialgie che vanno e vengono ma che oggi non lo hanno particolarmente infastidito. Medico di reparto: Monitoratelo con attenzione; domani andiamo in radiologia a vedere la RMN, Sei giorni dopo Sala riunioni Primo specializzando: Ci risiamo! Graziano da ieri è peggiorato. Sono comparse artromialgie accompagnate da febbre che questa notte ha raggiunto i 39 °C. Inoltre alla percussione si rileva una ottusità all’emitorace sinistro con riduzione del murmure vescicolare che prima non avevo rilevato. A mio avviso potrebbe esserci una falda di versamento. Attualmente sta assumendo 12,5 mg di prednisone. Ieri la VES era 97 e la PCR 22. Medico di reparto: Vengo a vederlo subito intanto tu chiedi un torace urgente Poco dopo Medico di reparto: Hai ragione sembra proprio che abbia un versamento pleurico. Ma c’è anche un altro aspetto importante. In corrispondenza della regione anteriore della gamba sinistra c’è una tumefazione abbastanza dolente non ben delimitata, di consistenza elastica. È bene che non perdiamo tempo. Oltre al torace chiedi anche una ecografia della gamba e, se riescono, un ecocardiografia per vedere se è ricomparso il versamento pericardio anche se, all’esame obiettivo, non sembrerebbe. Ci rivediamo appena abbiamo i referti. Nel pomeriggio Primo specializzando: Alla radiografia del torace è stato rilevato un versamento pleurico a sinistra, l’e- Vol. 40 - N. 2 Il mattino dopo In radiologia Radiologo: Sì, ci sono dei reperti chiaramente patologici a livello della gamba sinistra. C’è un aumento di volume e intensità di segnale in T2 fat saturation, con disomogeneo aumento del contrasto a livello del terzo superiore e medio del muscolo tibiale anteriore di sinistra con spiccata iperintensità perifasciale e soprafasciale. Non ci sono alterazioni a carico del tessuto osseo. Primo specializzando: Sì ma cerca di tradurlo in termini più comprensibili! Cosa vuole dire? Radiologo: Può essere indicativo di una miosite o di una alterazione ischemica su base microvascolare. Medico di reparto: Questo è molto strano. Miosite localizzata, artromialgie, artrite, pleurite e pericardite, febbre… sono tutte tessere coerenti per un processo immunomediato ma non si incastrano ancora bene tra di loro per formare un quadro coerente. Primo specializzando: Avrà una vasculite sistemica? Medico di reparto: Humm….non mi convince. Che sotto ci possa essere una infiammazione vascolare è possibile ma che cosa la ha determinata? L’unico tessuto che potremmo biopsiare attualmente è il muscolo. Secondo specializzando: Lei dice sempre che quando le tessere non si incastrano bene bisogna sempre pensare ad una neoplasia. Medico di reparto: Si è vero; l’aspirato midollare era però normale e torace e ecografia addominale non hanno segnalato reperti anomali. Tuttavia il midollo è stato fatto dopo un primo ciclo di steroidi il che GASLINI 93 FILOCAMO UN RAGAZZO CON FEBBRE E PERICARDITE Figura 1. —Acquisizione STIR whole body. Sono evidenti A) le linfoadenomegalie sovraclaveari e mediastiniche e B) l’anomalia di segnale a carico delle parti molli della gamba sinistra. potrebbe avere alterato i risultati; inoltre non possiamo certo escludere che i segni di una neoplasia, come per esempio un linfoma, possano comparire a distanza. Primo specializzando: La terapia steroidea che sta facendo potrebbe avere modificato il quadro della malattia. Medico di reparto: Certo, è per questo che abbiamo deciso di ridurla. Siamo comunque ormai ad un bivio in cui dobbiamo rapidamente prendere una decisione. Ripercorriamo tutta la sua storia, rivediamo gli esami fatti finora e rivisitiamo il ragazzo. Un’ora dopo In sala riunioni Medico di reparto: Accidenti! Avete visto che è comparso un linfonodo in sede sopraclaveare; ha le dimensioni di una piccola albicocca ed è di consistenza duro-lignea. Sono sicuro che pochi giorni fa non ci fosse perché avevo pensato all’ipotesi di un linfoma e avevo esaminato con attenzione tutte le stazioni linfonodali. Qui non dobbiamo perdere tempo! Sentiamo subito cosa propongono i radiologi e oncologi ed 94 organizziamo una biopsia del linfonodo. Primo specializzando: Ma e il resto della sintomatologia ? Medico di reparto: Potrebbe benissimo essere espressione di una sindrome paraneoplastica in corso di linfoma. Su suggerimento dei radiologi fu eseguita una STIR whole body. È una RM veloce che valuta tutto il corpo alla ricerca di zone a maggior contenuto idrico (edema ecc.). In pratica uno studio ad ampia copertura e buona sensibilità che ha aspetti simili ad una scintigrafia ma che è basato su principi diversi. La RM in effetti evidenziò la presenza (Figura 1) di linfoadenomegalie in regione sopraclaveare e paratracheale oltre a confermare l’anomalia di segnale a carico delle parti molli della gamba sinistra. La biopsia linfonodale permise di fare una diagnosi di linfoma di Hodgkin (sclerosi nodulare). La biopsia ossea diede reperti di normalità mentre quella muscolare, eseguita contemporaneamente a quella linfonodale, mostrò una vasculite linfocitaria (infiltrato linfomonocitario nella parete arteriolare). Sintomi sistemici quali febbre e dolori ossei o articolari e alterazioni degli indici di laboratorio come aumento dei neutrofili, VES, PCR e immunoglobuline GASLINI Agosto 2008 UN RAGAZZO CON FEBBRE E PERICARDITE FILOCAMO si riscontrano spesso all’esordio di neoplasie pediatriche. Fenomeni paraneoplastici che mimano malattie immuno-mediate sono di riscontro meno frequente ma si possono osservare in particolare in associazione con i linfomi e possono precedere di mesi la diagnosi di neoplasia. Comprendono anemie emolitica o piastrinopenia autoimmuni, vari quadri neurologici compresa la sindrome di Giullain-Barré, glomerulopatie Vol. 40 - N. 2 (glomerulopatia membranosa e sindrome nefrosica e lesioni minime in particolare), artriti, miositi, pemfigo, sarcoidosi ecc.. Nell’adulto una percentuale significativa di dermatomiositi è associata a neoplasie maligne di varia natura, evenienza invece molto rara in pediatria. La patogenesi delle sindromi paraneoplastche è ignota ma si pensa sia da mettere in relazione a fenomeni (rilascio di citochine, produzione di autoanticorpi ecc.) secondari all’attivazione linfocitaria. GASLINI 95 FORUM: QUALITA DELLE CURE GASLINI 2007;40:97-99 PRESENTAZIONE I n questo numero il forum é dedicato alla qualità delle cure. Il costante progresso della medicina e la possibilità di ricorrere a trattamenti sempre più complessi, permettono di ottenere grandi risultati , ma si accompagnano inevitabilmente ad effetti avversi, ad un maggiore rischio di danno iatrogeno e di errori medici. Le situazioni critiche sono molteplici e riguardano, tra le altre, la sicurezza in sala operatoria, le infezioni ospedaliere, gli errori di terapia. Abbiamo pertanto ritenuto interessante presentare sinteticamente un modello di accreditamento , quale quello della Joint Commission International, e le problematiche e le difficoltà che sono state incontrate all’interno del nostro istituto nel lavoro preparatorio necessario prima di sottoporci ai valutatori. Sono poi presentati due protocolli applicativi ed infine una esperienza di un importante centro europeo di neonatologia, a dimostrazione di quanto un costante monitoraggio della qualità delle cure può migliorare l’assistenza. Cos’è Joint Commission C. GIULIANO Unità Operativa Controllo di Gestione e Servizio Qualità Istituto Giannina Gaslini, Genova N el 1919 negli Stati Uniti l’American College of Surgeons elabora il primo programma per la standardizzazione delle strutture e procedure ospedaliere basato su cinque criteri di accreditamento. L’iniziativa presto si diffonde a tutti i settori dell’assistenza sanitaria dando vita ad un dibattito sulla necessità di creare un soggetto giuridico con specifiche competenze nel settore della qualità dell’assistenza sanitaria. Joint Commission on Accreditation of Healthcare Organizations (JCAHO) nasce quindi nel 1951 proprio con lo scopo di migliorare la qualità dell’assistenza sanitaria. Ad oggi JCAHO, agenzia indipendente non governativa no profit, accredita negli USA più di 20 000 organizzazioni sanitarie. A partire dalla fine degli anni Novanta viene istituita una divisione internazionale di JCAHO, Joint Commission International (JCI): l’accreditamento, secondo questa logica, è un processo volontario attraverso il quale un ente terzo, non governativo, riconosce e afferma che un’organizzazione sanitaria rispetta specifici standard che richiedono un continuo miglioramento nelle strutture nei processi e nei risultati Gli standard sono stati sviluppati e vengono perio- Autore di contatto C. Giuliano, Unità Operativa di Controllo e Gestione Qualità, Istituto Giannina Gaslini, Genova, Italia. Vol. 40 - N. 2 GASLINI 97 GIULIANO JOINT COMMISSION TABELLA I. — Gli standard Joint Commission. TABELLA III. — Gli ospedali accreditati in Italia. Gli ospedali accreditati in Italia — Azienda Ospedaliero-Universitaria Trieste, Italia Primo accredito: 9 febbraio 2008 — CDI Centro Diagnostico Italiano s.p.a. Milano, Italia Primo accredito: 20 maggio 2006 — Istituto Europeo di Oncologia Milano, Italia Primo accredito: 20 dicembre 2002 Ri-accreditato: 28 gennaio 2006 — Istituto Giannina Gaslini Genova, Italia Primo accredito: 1 dicembre 2007 — Humanitas Gavazzeni Bergamo, Italia Primo accredito: 23 dicembre 2006 — Humanitas Mirasole s.p.a. Milano, Italia Primo accredito: 14 dicembre 2002 Ri-accreditato: 4 febbraio 2006 — Istituto Clinico Mater Domini Castellanza, Italia Primo accredito: 25 maggio 2007 — Ospedale Pediatrico Bambino Gesù Roma, Italia Primo accredito: 16 dicembre 2006 — Presidio Ospedaliero Oglio-Po Vicomoscano, Italia Primo accredito: 7 ottobre 2006 — Santa Chiara Hospital Trento, Italia Primo accredito: 25 giugno 2005 Sezione I: standard centrati sul paziente ACC. Accesso all’assistenza e continuità delle cure PFR: Diritti del paziente e dei familiari COP: Cura del paziente ASC: Assistenza anestesiologica e chirurgica MMU: Gestione e utilizzo dei farmaci PFE: Educazione del paziente e dei familiari Sezione II: standard centrati sull’organizzazione QPS: Miglioramento della qualità e sicurezza del paziente PCI: Prevenzione e controllo delle infezioni GLD: Governo, leadership e direzione FMS: Gestione e sicurezza delle infrastrutture SQE: Qualifiche e formazione del personale MCI: Gestione della comunicazione e delle informazioni TABELLA II. — Obiettivi internazionali per la sicurezza del paziente. 1. Identificare correttamente il paziente 2. Migliorare l’efficacia della comunicazione 3. Migliorare la sicurezza dei farmaci ad alto rischio 4. Garantire l’intervento chirurgico in paziente corretto, in parte del corpo corretta 5. Ridurre il rischio di infezioni associate all’assistenza sanitaria 6. Ridurre il rischio di danno al paziente in seguito a caduta dicamente aggiornati da un panel di esperti, di diverse professionalità sanitarie e gestionali, provenienti da varie aree geografiche e culturali (prevalentemente Europa, Medio Oriente, America Latina, Africa) in modo da assicurare l’adattabilità del modello di valutazione ai differenti sistemi organizzativi sanitari operanti nei vari Paesi. Ciò ne garantisce l’applicabilità in contesti con proprie caratteristiche culturali, sociali e religiose fermo restando il raggiungimento di un livello atteso uniforme di qualità che garantisca e assicuri aspettative elevate riferite alla cura ed alla sicurezza dei pazienti. I programmi JCI di accreditamento internazionale sono strutturati per: ospedali, laboratori clinici, continuità assistenziale, trasporto, programmi assistenziali specifici per patologia. 98 Il manuale di accreditamento per gli ospedali Il manuale comprende oltre 300 standard e viene rivisto e aggiornato con cadenza triennale (Tabella I). Dal 2008 sono stati inseriti 6 obiettivi internazionali per la sicurezza dei pazienti (Tabella II). È articolato in due sezione: la prima focalizzata sulla cura del paziente, la seconda sulla buona gestione dell’organizzazione della struttura. Ciascuno standard rappresenta un comportamento atteso che deve essere adottato ed applicato dall’ospedale per poter garantire i livelli di eccellenza e sicurezza. L’atteso di ciascuno standard viene meglio esplicitato dall’intento che ne chiarisce contenuti e finalità; gli elementi misurabili elencano nel dettaglio quanto GASLINI Agosto 2008 LATTANTE CON VOMITO RICORRENTE E ARRESTO DELL’ACCRESCIMENTO viene richiesto ai fini della piena conformità allo standard e costituiscono elemento di valutazione e misurazione al momento della verifica. La verifica di accreditamento, survey, è svolta da un team di esperti appartenenti a JCI, composto di norma almeno da un medico, un infermiere, un amministrativo. Ha durata di tre o più giorni secondo le dimensioni e la complessità dell’ospedale. Il team valuta la conformità dell’organizzazione agli standard attraverso interviste con il personale, i pazienti i familiari, osservazione diretta dei processi assistenziali e consultazione di politiche e procedure assunte dall’azienda. Vol. 40 - N. 2 PONGIGLIONE La metodologia usata è quella del tracer che ripercorre il percorso del paziente dal momento dell’ingresso in ospedale alle dimissioni, in modo da individuare eventuali criticità in una o più fasi del processo assistenziale. Attraverso un sistema a punti assegnato ad ogni elemento misurabile degli standard il Comitato JCI per l’accreditamento, sulla base delle proposte formulate dal team che ha condotto la valutazione in loco, stabilisce se l’ospedale può ricevere l’accreditamento che avrà durata triennale e non è rinnovabile automaticamente ma solo a seguito dell’esito positivo di una seconda survey. La Tabella III riporta l’elenco degli ospedali accreditati in Italia. GASLINI 99 GASLINI 2008;40:101-6 L’accreditamento secondo Joint Commission: una opportunità di crescita per le organizzazioni sanitarie U. ROSATI, F. CAVANENGHI, C. GIULIANO, A. LASERO, R. SCALI Unità Operativa Controllo di Gestione e Servizio Qualità, Istituto G. Gaslini, Genova Q uale motivazione può spingere un ospedale che gode già di buon prestigio in ambito nazionale ed internazionale, dove operano professionisti considerati fra i più bravi, ad avviare un programma di accreditamento così articolato e complesso quale quello previsto dalla metodologia Joint Commission International (JCI)? Soprattutto, dopo avere aderito in passato ad altri percorsi di verifica e miglioramento in tema di qualità, sia con il sistema ISO che nel rispetto di quanto previsto dalla normativa regionale. I fattori sono molteplici ma principalmente la scelta è da ricondursi al fatto che la Direzione Generale aveva colto come una eccellente opportunità quella di sottoporre tutto l’Istituto ad una valutazione oggettiva effettuata da specialisti esterni, rispetto al contenuto di standard elaborati esclusivamente per il contesto sanitario da una task force internazionale. Con felice intuizione, era stato ritenuto che questo meccanismo avrebbe potuto rappresentare una scossa positiva per il Gaslini, che per propria missione è orientato al confronto con i paesi più avanzati nel campo della ricerca e dell’assistenza ed uno stimolo in più per la promozione della qualità in termini concreti. Joint Commission (JC), sistema proattivo di miglioramento, favorisce l’analisi sistematica del rischio ed in questa ottica induce gli operatori a cercare la risposta relativamente più adeguata a fronte di ogni situazione, date le caratteristiche ed il contesto organizzativo specifici dell’ospedale, favorendo un processo di crescita culturale e prescindendo da un approccio burocratico-formale. L’Istituto Gaslini ha conseguito l’accreditamento JCI nel novembre 2007 dopo due anni di lavoro preparatorio a cui ha preso parte tutto il personale. In queste pagine descriviamo brevemente la nostra esperienza, le criticità incontrate ed alcuni risultati conseguiti che hanno rappresentato un valore aggiunto per l’Istituto. Un problema: coinvolgere ed orientare il personale ad una visione condivisa della qualità Come già premesso, l’accreditamento secondo JCI, che ha quale obiettivo il miglioramento continuo della sicurezza, dell’efficacia e della qualità dell’assistenza sanitaria, richiede che tutte le componenti dell’Ospedale rispondano, contestualmente, agli standard previsti dal manuale. JC parte dalla considerazione che la cura del paziente implica interazioni estremamente complesse tra tutte le funzioni dell’organizzazione; ne consegue che la sicurezza nei suoi vari aspetti può essere presidiata solo a condizione che tutte le maglie della rete siano strette ed efficacemente collegate. Per questo motivo è indispensabile il coinvolgimento di tutta l’organizzazione e si focalizza l’attenzione sul sistema nel suo complesso e non sulle singole unità operative. Le implicazioni organizzative sono quindi prevalenti nella realizzazione del progetto. È indispensabile rivedere tutte le politiche e le procedure sulla base di quanto espresso dagli standard (sono ben 323, esclusi i patient safety goals, nella ter- Autore di contatto: U. Rosati, Unità Operativa di Controllo di Gestione e Servizio Qualità, Istituto G. Gaslini, Genova, Italia. Vol. 40 - N. 2 GASLINI 101 ROSATI L’ACCREDITAMENTO SECONDO JOINT COMMISSION za edizione del manuale) e dai relativi eventi misurabili; soprattutto deve essere ripensato e reso più funzionale il sistema delle relazioni interne fra le unità operative, sia assistenziali che amministrative. JCI effettua di norma una visita di assessment all’avvio del programma di accreditamento per rilevare quanto l’ospedale si discosti dagli standard e quali azioni prioritarie di miglioramento saranno indispensabili attivare. In questa fase al Gaslini i valutatori, pur apprezzandone l’attività nel complesso, avevano constatato che le varie unità operative dell’ospedale apparivano ai loro occhi come una serie di “repubbliche indipendenti” (testuale). Ciascuna prevalentemente orientata a perseguire finalità proprie di qualità ma con scarsa disponibilità all’integrazione ed alla condivisione degli obiettivi e dei processi con tutte le altre. Questa è la prima grande barriera da abbattere: la qualità per Joint Commission è un valore condiviso e partecipato che deve avere una declinazione univoca nell’organizzazione. Bisogna far comprendere agli operatori che le varie unità operative non sono in competizione fra di loro per una posizione di preminenza in quanto “ottime”, ma debbono condividere la tensione verso il miglioramento. La qualità non è garantita tanto dall’eccellenza del singolo quanto dall’adesione alle buone prassi di tutti. La vera sfida che il management deve affrontare è quella di promuovere un cambiamento culturale di fondo nell’Ospedale che può avvenire solo gradualmente nel tempo. Proprio per questo, il coinvolgimento dei professionisti è essenziale sia per la definizione dei contenuti degli standard che per la messa in atto dei cambiamenti necessari e per i successivi processi di autovalutazione periodica. Alla partenza del progetto, abbiamo istituito in ogni unità operativa due referenti per la qualità, un medico ed una infermiera (un tecnico nei servizi) ed abbiamo costituito gruppi di lavoro multiprofessionali e plurispecialistici sulle principali aree tematiche. Non è stato assolutamente facile né immediato ottenere l’adesione dei professionisti, soprattutto in alcuni settori dell’Istituto. Hanno giocato un ruolo di traino decisivo alcune capo sala ed alcuni medici, particolarmente autorevoli, che hanno saputo reclutare nel tempo i loro colleghi. Questo progetto non può essere calato top-down 102 ed i risultati si vedono solo se tutti si rendono protagonisti del processo di cambiamento. Si pone quindi, innanzitutto, il problema della leadership; il ruolo di chi ha compiti di coordinamento ai vari livelli, di singola unità operativa, di dipartimento, più in generale di Ospedale, è cruciale. Esercitare leadership in un progetto così innovativo significa riuscire a far passare il cambiamento, quando necessario, tenendo conto della storia dell’Ospedale e delle modalità di lavoro che si sono consolidate nel tempo nelle diverse funzioni, dei gruppi di potere interni, che sono sempre presenti anche se non sempre palesi e che possono rappresentare delle barriere per il passaggio della nuova cultura. Il commitment dell’Alta Direzione è di fondamentale importanza: tutto il personale deve percepire che il progetto è strategico per l’Ospedale e le figure individuate per il coordinamento debbono essere pienamente legittimate ad operare con ampi margini di autonomia. Per favorire il coinvolgimento degli operatori e supportarli nel processo di cambiamento e nelle relative azioni da intraprendere, fermo restando il pieno rispetto della loro autonomia professionale, al Gaslini è stato ritenuto opportuno promuovere un piano di formazione di cui vengono richiamati gli aspetti principali. Il piano di formazione a supporto del programma Dapprima sono stati forniti gli elementi conoscitivi di base del programma di accreditamento secondo JCI. Nel corso di due giornate d’aula, ripetute in più edizioni, sono stati presentati ai referenti per la qualità di tutte le unità operative il contenuto degli standard e le modalità per soddisfarne gli elementi misurabili. Si è deciso poi di promuovere un piano di formazione aziendale, accreditato ECM, di durata biennale che ha accompagnato il personale durante tutta la fase di preparazione in vista della visita finale di accreditamento (survey). Sono state realizzate nel periodo, complessivamente, oltre 70 ore d’aula (cui vanno poi aggiunte quelle di formazione sul campo). Scopo del percorso formativo è stato fornire le basi metodologiche per supportare il processo di miglioramento richiesto per l’accreditamento e proporre gli GASLINI Agosto 2008 L’ACCREDITAMENTO SECONDO JOINT COMMISSION ROSATI strumenti idonei per tradurre il contenuto delle politiche e procedure in comportamenti organizzativi. Quanti hanno preso parte al corso hanno di fatto rappresentato il gruppo di “facilitatori” aziendali per la divulgazione del sistema. Il programma è stata articolato in: — workshop e riunioni plenarie; — conferenze e meeting interaziendali. In ogni workshop, focalizzato sulle principali funzioni critiche, i partecipanti sono stati aggregati in gruppi di lavoro e, presi di volta in volta in esame gli standard di riferimento, sono stati coinvolti nella predisposizione delle procedure necessarie. I percorsi di miglioramento non sono quindi stati imposti dall’alto ma sviluppati secondo un sistema bottom up. Ogni documento è stato scritto con le persone che nelle prassi quotidiane attuano effettivamente i processi e che hanno potuto verificarne l’applicabilità sul campo nelle unità operative di appartenenza. Le riunioni plenarie hanno consentito di assicurare l’integrazione fra i vari gruppi e la condivisione delle tematiche trattate. Alle conferenze ed ai meeting interaziendali sono stati invitati esperti esterni e sono state presentate testimonianze su analoghe esperienze condotte presso altri Ospedali. Il percorso di cambiamento: quale valore aggiunto La valutazione dei pazienti Il paziente è elemento centrale: i processi di valutazione del percorso assistenziale, la comunicazione come strumento e supporto alle decisioni rappresentano quindi l’oggetto principale di focalizzazione degli standard JCI. Gli standard richiedono la formalizzazione di procedure e tendono a prevenire situazioni in cui le scelte dipendano dalla libera interpretazione di indicazioni non ben esplicitate. Tutto ciò non rappresenta un vincolo al libero arbitrio dei professionisti ma pone un limite a scelte arbitrarie. Se ad un primo approccio il manuale di accreditamento può apparire ridondante ed sovraccaricare l’attività di routine è possibile cogliere il filo conduttore che lega ì diversi capitoli mano a mano che si cerca di darne applicazione pratica. La comunicazione fra gli operatori e la trasmissione Vol. 40 - N. 2 delle informazioni sono fra i principali fattori di criticità negli ospedali e possono condizionare in misura assolutamente rilevante la qualità degli esiti delle cure. La cartella clinica, fondamentale strumento a supporto della comunicazione, costituisce il documento dove vengono registrate tutte le osservazioni e le determinazioni assunte, ed in virtù di queste considerazioni trovano qui riscontro la maggior parte degli standard. In base all’esperienza fatta, la costituzione della nuova cartella rappresenta l’inizio logico del percorso di adeguamento agli standard. Operazione complessa in fase di avvio che genera resistenze da parte dei professionisti, poco propensi a mettere in discussione documenti e prassi cui sono adusi da tempo. Quando il cambiamento viene colto quale opportunità ed il sistema di monitoraggio del paziente viene modulato sui bisogni effettivi, si possono apprezzarne i vantaggi. Fatta salva l’impostazione generale della cartella che è comune e condivisa fra tutti i reparti dell’Istituto, ciascun settore specialistico del Gaslini ha avuto modo di personalizzarla nelle sezioni specifiche in base alle caratteristiche della propria casistica. JC richiede di standardizzare il processo di valutazione: ciò non significa predisporre un formulario da “crocettare” acriticamente ogniqualvolta si visita un malato; vuol dire pretendere che tutte le rilevazioni che i professionisti stessi hanno ritenuto essere significative vengano poi sempre registrate e, ove necessario, attivino comportamenti idonei, prescindendo da scelte estemporanee e facendo riferimento alle buone prassi condivise. È esemplificativa a questo riguardo la valutazione del dolore. Una analisi condotta prima dell’avvio del programma di accreditamento per stimare la prevalenza del dolore in ospedale aveva dimostrato che il 25% dei bambini ricoverati, osservati in una in una giornata campione, aveva dolore di vario grado, giudicato moderato-severo ben nel 6% dei casi. Il trattamento antalgico in atto risultava inefficace nel 9% dei valutati. Oggi in Istituto questo parametro viene rilevato quotidianamente in tutti i pazienti, compresi i neonati, secondo modalità e tempistica che sono state concordate con gli operatori. I protocolli di trattamento sono univoci ed il personale è stato formato per la corretta interpretazione ed impiego. Ogni paziente ha il proprio medico di riferimento GASLINI 103 ROSATI L’ACCREDITAMENTO SECONDO JOINT COMMISSION quale primo interlocutore nei rapporti con la famiglia e garante dell’integrazione con gli altri professionisti che partecipano al percorso assistenziale. La stesura del piano di cura, sempre redatto in forma sintetica sia dal medico che dall’infermiera al momento del ricovero ed aggiornato ogniqualvolta necessario, consente un immediato orientamento a chiunque debba prendersi carico del paziente, focalizzando l’attenzione sulle problematiche salienti. Sulla base delle scelte fatte relativamente alla tipologia, alla tempistica ed alle modalità di valutazione dei pazienti, sulla titolarità a richiedere ed eseguire specifiche prestazioni, viene sostanzialmente ridefinito il sistema delle relazioni interne di tutto l’ospedale. Sicurezza in sala operatoria Il percorso del paziente soggetto a prestazioni invasive è stato completamente rivisitato: sono state elaborate specifiche check list per la preparazione, il trasferimento e l’accoglienza del paziente in sala operatoria. È stata disposta la marcatura del sito chirurgico quando pertinente, convenute le modalità di rivalutazione da parte dell’anestesista prima della fase di induzione e reso più stretto il monitoraggio in fase di risveglio. È stato introdotto il “time out” quale verifica finale prima dell’inizio dell’intervento per essere certi che si stia per dare atto alla procedura giusta nel paziente giusto, in presenza dell’equipe correttamente costituita che dispone di tutti i presidi necessari. Dati i vincoli strutturali delle sale operatorie del Gaslini (attualmente in fase di ristrutturazione) e la carenza di organico che non consente l’attivazione di una sala risveglio centralizzata, la maggiore accuratezza delle procedure di valutazione pre e post operatoria ha comportato l’allungamento dell’intervallo fra un intervento ed il successivo. Sono attualmente in fase di studio soluzioni che possano consentire un recupero di efficienza senza abbassare la soglia di sicurezza: come è noto, la qualità non è mai a costo zero. Il rischio terapia: imparare dagli errori Gli errori di terapia sono fra i principali fattori di rischio cui va incontro il paziente durante il ricovero: rappresentano da soli circa un quarto degli eventi indesiderati di cui il paziente può essere vittima. Non va scordato infatti che la letteratura internazionale stima intorno al 4% dei ricoveri il rischio di incidenti in ospedale. 104 Per questo motivo un intero capitolo della versione corrente del manuale è dedicato all’uso dei farmaci: sono 21 gli standard e 85 gli elementi misurabili dedicati alla problematica. L’adeguamento a questi standard è stato particolarmente complesso. Sono state attentamente vagliate e, quando necessario, rideterminate tutte le fasi del processo: dalle modalità di conservazione dei farmaci, a quelle di prescrizione, preparazione e somministrazione. È stata introdotta la scheda unica di terapia ed istituito il sistema dei doppi controlli per ogni fase, con particolare attenzione a quelle di preparazione e somministrazione. Questa è stata anche l’occasione per avviare formalmente ed in via definitiva il sistema di registrazione degli eventi avversi compresi quelli scongiurati cioè all’ultimo momento in modo fortuito o per l’intervento decisivo in ultima battuta di un operatore. Questa analisi è attuata mediante schede anonime che vengono compilate dagli stessi operatori coinvolti nell’evento e sono trasmesse al Servizio Qualità. Non ha alcuna finalità punitiva e viene garantita la tutela dei dipendenti, nel rispetto della vigente normativa. Si propone di far crescere la cultura della sicurezza cercando di imparare dagli incidenti: gli esiti delle segnalazioni debbono essere discussi periodicamente per cercare spunti di miglioramento nella consapevolezza che alle spalle ci sono quasi sempre problematiche organizzative. La diffidenza e la resistenza degli operatori non sono certo facili da vincere ed è necessario tempo prima che si crei un clima di reciproca fiducia. Durante il primo anno le segnalazioni, totalmente anonime, sono state oltre 100 e nel 97% dei casi hanno riguardato problemi inerenti la terapia farmacologia. Le infermiere hanno dimostrato una sensibilità superiore al restante personale con un rapporto di segnalazione di 5 a 1 rispetto ai medici. Sul modello che è stato attivato a partire dal 2008 è possibile indicare l’unità operativa sede dell’evento (parametro significativo per avviare valutazioni organizzative) e, se ritenuto opportuno, anche nominativo di chi segnala. Presso la divisione di chirurgia è ormai a regime un sistema di audit, che vede la partecipazione sia del personale medico che infermieristico, attua la revisione sistematica della casistica operatoria e consente la formulazione di istruzione operative quando neces- GASLINI Agosto 2008 L’ACCREDITAMENTO SECONDO JOINT COMMISSION ROSATI sario. Si auspica che il modello venga traslato quanto prima anche a livello dipartimentale. Il problema delle infezioni ospedaliere Le infezioni contratte in ospedale costituiscono un rischio noto e non eliminabile. Pur in carenza di dati esaustivi riferiti al settore pediatrico, i dati della letteratura stimano che il rischio riguardi il 6-8% dei pazienti ricoverati nei reparti ordinari e fino al 20% di quelli nelle aree critiche. Solo gli ospedali che attivano un monitoraggio costante e rigoroso possono disporre di informazioni attendibili e significative relativamente all’andamento epidemiologico delle infezioni. Al Gaslini il Comitato per il Controllo delle Infezioni Ospedaliere (CIO) è attivo dal 1985 ed è costituito da un gruppo multiprofessionale, che comprende infermiere dedicate, microbilogi, infettivologi, intensivisti, farmacisti. Grazie alle competenze ed all’esperienza maturata dal gruppo negli anni è stato agevole orientarne l’attività ai contenuti degli standard, che d’altra parte hanno fornito un importante supporto metodologico per formalizzare e sistematizzare il monitoraggio delle infezioni. È stato così posto in essere un sistema per la rilevazione e trasmissione tempestiva degli eventi sentinella (definiti analiticamente) dal laboratorio ai reparti clinici, in ciascuno dei quali sono stati individuati professionisti di riferimento. Il sistema è attivo continuativamente e fornisce dati in tempo reale per tutto il corso dell’anno. Il CIO oggi si interfaccia continuativamente con i referenti dei reparti e con cadenza almeno trimestrale valuta in collaborazione col Servizio Qualità l’andamento complessivo dell’Istituto. Tutti i dati significativi, le indicazioni e le misure da assumere sono pubblicate in Intranet. Periodicamente viene condotto uno studio di prevalenza su un set di ceppi batterici ritenuti significativi (fra cui MRSA, gram negativi e ceppi resistenti) con elaborazione dei dati espressi in valore assoluto e dei tassi in rapporto alle giornate di degenza per ciascun reparto. L’obiettivo è che gli operatori abbiano sempre chiaro l’andamento delle infezioni nella propria unità operativa rispetto alla tipologia della casistica ed ai volumi di attività in modo da poter assumere tempestivamente le misure più opportune. Vol. 40 - N. 2 Il gruppo delle infermiere dedicate supporta continuativamente il personale di assistenza e svolge campagne per la promozione dell’igiene delle mani. I dati attuali del Gaslini sono confortanti ma tutti hanno imparato che non è assolutamente possibile abbassare la guardia. Le infezioni nel reparto di terapia intensiva neonatale e pediatrica sono passate dal 12,6% al 5%. Le infezioni micotiche nei pazienti sottoposti a trapianto di midollo ed in quelli affetti da LLA sono comprese fra il 4% ed il 6%. L’area gestionale L’applicazione degli standard JCI nel settore gestionale-amministrativo ha imposto una piccola rivoluzione metodologica soprattutto per alcune procedure che riguardano la gestione del personale e la sicurezza delle infrastrutture. Non è stato affatto semplice comprendere ed applicare istanze distanti dalla nostra cultura ed anche dal contesto normativo di riferimento del nostro sistema sanitario. Sono state definite procedure per meglio curare l’orientamento e l’inserimento del nuovo assunto, è stata introdotta la verifica delle credenzialità alla fonte per tutti i dipendenti dell’area sanitaria e sono state riviste le modalità di tenuta dei fascicoli di tutti i dipendenti secondo l’atteso degli elementi misurabili. Soprattutto, il servizio gestione risorse umane, il dipartimento infermieristico e le direzioni dei reparti clinici, ciascuno per quanto di propria competenza, hanno lavorato gomito a gomito per concordare l’assegnazione delle job description per il personale che non è titolato ad operare autonomamente e l’assegnazione dei privilegi per i medici. Queste procedure, in particolare l’assegnazione dei privilegi, definiscono la tipologia di prestazioni che ciascuno è titolato ad erogare in base alle proprie conoscenze, competenze e capacità in completa autonomia o con tutoraggio. Istituiscono un sistema di valutazione periodica in base al quale possono essere rideterminati gli ambiti di autonomia di ciascun professionista e proprio per questo rappresentano un formidabile strumento di garanzia per la sicurezza dei pazienti. Sempre che quanti preposti alla valutazione dei propri collaboratori dimostrino rigore e senso di responsabilità e non interpretino lo standard come un adempimento formale, lettura francamente avvilente per il loro stesso ruolo di dirigenti. GASLINI 105 ROSATI L’ACCREDITAMENTO SECONDO JOINT COMMISSION La sicurezza delle infrastrutture secondo JCI non è un problema “solo” dell’ufficio tecnico o del servizio prevenzione cui scaricare tutti i problemi. La sicurezza è un problema di tutti, ovviamente rispetto alla propria professionalità ed al livello di responsabilità ricoperto nell’organizzazione. Le nozioni di base per la prevenzione e gestione degli incendi, le modalità secondo cui debbono essere predisposte ed attuate le evacuazioni dei reparti in caso di emergenza, la cognizione dello stato di manutenzione delle principali apparecchiature biomedicali rappresentano oggi al Gaslini un patrimonio di conoscenze comuni e condivise. Conclusioni Lo scorso mese di novembre, durante la conferenza di chiusura al termine della survey, l’Aula Magna era stipata come non mai e tutti hanno ascoltato con grandissima emozione la relazione finale di Albert Vogel, team leader dei valutatori, che commentava l’esito favorevole della verifica e si complimentava con tutto il personale asserendo che dovevano “andare orgogliosi del loro ospedale”. La realizzazione del programma è stata certamente molto gravosa sul piano organizzativo e del coinvolgimento del personale a cui è stato richiesto uno sforzo notevole e grande disponibilità al cambiamento. 106 È difficile dire quali delle cose realizzate avrebbero potuto comunque essere portate a termine se non fosse stato avviato l’accreditamento secondo JCI. Alcune, probabilmente. Certamente non sarebbe stata possibile la revisione sistemica di tutti i processi né sarebbe stato coinvolto tutto l’Istituto in un progetto corale di miglioramento, condizioni fondamentali per promuovere concretamente la qualità dell’assistenza al di fuori di ogni slogan. Come ricordato dal nostro Direttore Generale, Antonio Infante “… forse per la prima volta tutte le componenti dell’ospedale, l’area sanitaria, quella tecnica e quella amministrativa, hanno lavorato insieme sullo stesso progetto, condividendo difficoltà e soddisfazioni. Ne esce un Gaslini più forte e più unito”. Se un ospedale è davvero intenzionato a mettersi in gioco ed a ripensare criticamente alle cose che fa ed a come le fa ed è orientato ad intraprendere processi di progettazione e ri-progettazione organizzativa, allora la metodologia JCI, almeno per quello che è stata la nostra esperienza, rappresenta davvero un’opportunità estremamente interessante. In caso contrario è forse più prudente puntare su altri sistemi di promozione della qualità che implicano cambiamenti meno radicali e, conseguentemente, forniscono anche minore valore aggiunto. Per il Gaslini l’acquisizione dell’accreditamento non rappresenta la conclusione di un’esperienza ma l’avvio di un nuovo percorso, nell’impegno di garantire sempre la massima sicurezza possibile ai pazienti. GASLINI Agosto 2008 GASLINI 2008;40:107-13 Un’esperienza di percorso di miglioramento: fast track in chirurgia L. PALOMBA 1, G. MATTIOLI 1, S. TAMBURINI 1, M. CALLEGARI 1, C. KOKKATTIL 1, A. VACCARO 1, E. PENCO 1 R. VIACAVA 1, F. SANFILIPPO 1, G. FRATINO 1, C. MAZZOLA 1, F. FARANDA 1, P. BUFFA 1, C. AMMI 1 M. DELLAROCCA 2, L. MAMELI 2, G. MONTOBBIO 2, P. GANDULLIA 3, U. ROSATI 4, V. JASONNI1 1Dipartimento di Chirurgia, Istituto di Ricerca Giannina Gaslini Università di Genova, Genova 2Anestesia e Rianimazione, Istituto di Ricerca Giannina Gaslini Università di Genova, Genova 3Gastroenterologia, Istituto di Ricerca Giannina Gaslini Università di Genova, Genova 4Centro Controllo Direzionale, Qualità, Istituto di Ricerca Giannina Gaslini Università di Genova, Genova Di che cosa stiamo parlando? Il fast track (percorso veloce) è un modello organizzativo che mette al centro degli sforzi il paziente. Il ruolo della chirurgia è risolvere dei problemi oggettivi, in cui il bersaglio è evidente e concreto, tuttavia esistono differenti strade che seguono delle priorità differenti. Lo scopo di questo modello organizzativo è di migliorare la qualità dell’assistenza al paziente riducendo i tempi di degenza. Cosa vuol dire “migliore risultato”? Per il paziente: ridurre il “tempo” perioperatorio, il trauma chirurgico ed il dolore, le complicanze, con una rapida ripresa delle normali funzioni fisiologiche e quindi una migliore qualità della vita. Per l’azienda: aumentare il peso e l’indice di turnover, riducendo la degenza media, con attività concentrata in una settimana, e quindi con ridistribuzione del carico di lavoro con conseguente ridistribuzione dell’organico nel fine settimana. Per il chirurgo: attività chirurgica programmata ed organizzata, approccio mini-invasivo video-assistito documentato, e gestione del perioperatorio dettagliato. Per il personale infermieristico: ruolo fondamentale di nursing care durante l’intervento chirurgico e nel periodo perioperatorio e scrupoloso controllo per garantire l’efficienza di tutto lo strumentario e l’adeguata esecuzione delle procedure. Come organizzare il fast-track? Permettere al paziente di essere sottoposto ad una chirurgia maggiore con minima degenza è possibile solo se l’azienda è perfettamente organizzata. Questa “organizzazione” è attuabile solo se viene decisa a priori durante la negoziazione del Budget. Permettere il fast track vuol dire dedicare il massimo delle energie al perioperatorio ed alla sala operatoria, potenziando la chirurgia mini-invasiva e l’utilizzo di tecnologia mono-uso (Figura 1). Mantenendo fisso il concetto di lavorare “a risorse date”, questo modello bilancia l’incremento dei costi con la rapida ripresa del paziente ed una riduzione delle complicanze legate al decubito ed all’ileo. Il fast track è indirizzato al paziente. Minimo trauma e massima attenzione ai dettagli in sala operatoria, utilizzo di attrezzature particolari (vedi il ligasure e gli step) sono i punti di forza per ridurre la “morbilità”. Di non minore importanza è la gestione aneste- Autore di contatto: G. Mattioli, Istituto di Ricerca Giannina Gaslini, Università di Genova, Largo G. Gaslini 5, 16100 Genova. E-mail: [email protected] Vol. 40 - N. 2 GASLINI 107 PALOMBA FAST TRACK IN CHIRURGIA Figura 1. — Il percorso fast track e la chirurgia mini-invasiva. L’approccio e la condotta anestesiologica definiscono parte dei risultati. È ovvio che il paziente ed i suoi tutori preferiscono l’approccio mini-invasivo dove, grazie a canule del diametro di pochi millimetri, si riesce ad eseguire interventi chirurgici maggiori. Nella foto due esempi di chirurgia del colon: in alto (A) colectomia totale per colite ulcerosa e in basso (B) emicolectomia sinistra per morbo di Hirschsprung. I vantaggi per il paziente sono indiscutibili: l’approccio mini-invasivo è consigliabile in una elevata percentuale di casi per offrire al paziente una qualità del post-operatorio entusiasmante. L’analisi dei costi approssimativi per il materiale monouso viene riportata di seguito: Tecnica Veress Ports Ligasure/ ultracision Stapler 108 Appendicectomia Esofago Resezione del colon 29 100x3 478 29 100x4 — 29 100x4 478 293 — 293 siologica. L’utilizzo di tecniche sofisticate di anestesia ed analgesia con l’introduzione di cateteri peridurali garantisce il massimo controllo del dolore, permettendo di ridurre al minimo la somministrazione di farmaci sistemici, quali gli oppioidi, che riducono la ripresa delle normali funzioni fisiologiche L’intervento deve essere perfetto: questo è il presupposto. Tutte le procedure devono essere svolte per permettere un decorso post-operatorio perfetto. Il paziente deve alzarsi, mangiare, evacuare appena possibile. Quando? Appena riprendono le normali funzioni: entro 24-48 ore. E quindi deve essere dimesso appena possibile. Quando? Se non ci sono segni di complicanze nelle 24-48 ore successive. Il paziente viene preparato mediante una organizzazione day-care, comprensiva di tutto il work-up preoperatorio. Viene operato ed entro la settimana dimesso. Ovviamente parliamo di chirurgia maggiore che non può essere eseguita in day-surgery che è l’analogo modello organizzativo per la chirurgia maggiore. Facciamo un esempio: resezione del colon (appendicectomia, colectomia totale, emicolectomia, resezioni segmentarie) indipendentemente dalla indicazione (infezioni, malformazioni, MICI, disganglionosi, neoplasie) e dalla età. Il work-up preoperatorio prevede la diagnostica, la valutazione anestesiologica, la pulizia intestinale e il digiuno adeguato per il tipo di intervento proposto che vengono eseguiti a domicilio o in reparto di medicina. L’intervento viene eseguito mediante accessi multipli con sistema step, i peduncoli vascolari vengono manipolati con ligasure e stapler, quindi si esegue la resezione con stapler e l’anastomosi (ove necessaria) con stapler o a mano per via laparoscopica o mediante l’incisione di servizio sovrapubica che viene utilizzata per l’estrazione. Mediante questo approccio nessun muscolo viene sezionato e le resezioni sono eseguite senza rischi di complicanze. Vi è un massimo impegno di costi in sala operatoria che viene bilanciato da due giorni di degenza. La forza del gruppo di lavoro, medico ed infermieristico, in sala operatoria ed in reparto, è la chiave che permette il fast track. I vantaggi sono massimi per il paziente e per il gruppo di lavoro, invece per il chirurgo e per il personale infermieristico (nursing care) vi è una elevata difficoltà che mette alla prova la professionalità e ne seleziona le capacità tecniche e tecnologiche. GASLINI Agosto 2008 FAST TRACK IN CHIRURGIA PALOMBA Discussione • conoscitivo Il paziente deve essere messo al centro della nostra energia (umana, economica e tecnica/tecnologica). Non basta saper fare un ottimo intervento per dare al paziente un ottimo risultato. La forza del gruppo è fondamentale per il risultato e per il paziente. Le attività svolte dal medico, chirurgo, anestesista, personale infermieristico e amministrativo devono essere coordinate per offrire al paziente il massimo. La tecnologia permette di ridurre al minimo le complicanze legate all’atto chirurgico e l’anestesista deve dare il massimo sforzo in sala operatoria e garantire la più rapida ripresa nel post-operatorio. Focalizzando sui dettagli amministrativi si deve potenziare il monouso e la tecnologia in sala operatoria con maggiori costi ma massima efficacia ed efficienza. Il sistema step “azzera” il rischio legato all’accesso. Il ligasure e le stapler riducono al minimo il rischio sanguinamento. Questo materiale ovviamente deve essere conosciuto. Il Joint commission International e le direttive del ministero della salute focalizzano l’attenzione sull’importanza del controllo rigoroso dei risultati clinici ed un intervento viene bene se il paziente sta bene, da ogni punto di vista. Leadership e curva di crescita sono gli aspetti fondamentali che contraddistinguono il gruppo di lavoro, analizzando gli obiettivi, definendo ruoli e competenze ,modulando direzione e supporto in funzione del grado di sviluppo raggiunto dal gruppo stesso. . Il controllo rigoroso dei dettagli e dei risultati clinici mediante controllo di qualità con monitoraggio dei risultati e delle complicanze (morbidità e mortalità, M&M) e secondo sistemi di audit a doppio cieco sono il modello del risk management. Si devono controllare tutti i momenti del percorso del paziente, creare istruzioni operative rigide, condivise ed aggiornabili, per ridurre al minimo il rischio “errore” e per conoscere i punti deboli che, indipendentemente dall’errore, possono portare a complicanze clinicamente rilevanti. La curva di crescita porta al miglioramento dei dettagli e quindi dei risultati. La figura professionale è multidisciplinare ed il paziente è il fulcro al centro dell’energia. Perché spendere per uno step e non usare un trocar poli-uso? Dopo la spesa iniziale (break-in) di un trocar poliuso il costo è nullo. Questa è una infor- Vol. 40 - N. 2 • applicativo • operativo (imperizia, imprudenza, negligenza) • deliberata disonestà (anche omissiva) Figura 2. — Componente etica e rischio errore. L’obiettivo primario è il paziente, che deve essere il fulcro di ogni azione. A tale scopo è necessario un attento monitoraggio dei risultati clinici e dell’efficienza organizzativa, garantendo il minimo trauma per il paziente. Il metodo suggerito è l’utilizzo di audit clinici. Tale termine deriva da “audio” (dar udienza, ascoltare, apprendere) ed è stato utilizzato inizialmente da Florence Nightingale, nel 1854, durante la guerra di Crimea. È una metodologia strutturata e sistematica che ha come obiettivo migliorare la qualità dei servizi. Il metodo utilizzato segue i seguenti principi sempre rispettando l’etica professionale allo scopo di identificare il rischio errore e prevenire le complicanze : confronto sistematico dell’assistenza prestata, criteri espliciti, identificare lo scostamento rispetto agli standard, best practice, attuare le opportunità di cambiamento individuate, monitoraggio dell’impatto delle misure correttive. mazione sbagliata in quanto si deve calcolare il costo manutenzione, sterilizzazione e rischi correlati. Il sistema step riduce al minimo il rischio di parete ed il rischio contaminazione. Un altro esempio si può fare con il ligasure/ultracision o la stapler. Facciamo l’esempio semplice dell’appendicectomia. L’utilizzo di questi sistemi permettono la garanzia, se usati correttamente, di minimizzare il rischio di complicanze per appendicectomie senza lesioni cecali e quindi poter dimettere il paziente entro 24 ore dall’intervento senza rischi aggiunti. I costi devono essere analizzati insieme alla degenza. Non si può pensare di calcolare il bilancio economico solo focalizzando l’attenzione sulle uscite di sala operatoria ma valutando il peso degli interventi, quindi del drg, collegato al volume di attività ed all’indice di turnover. Questa analisi è il presupposto da considerare durante la negoziazione del budget. Però, se consideriamo gli audit clinici, e quindi valutiamo la qualità della nostra assistenza e quindi consideriamo come fulcro dei nostri sforzi il paziente (Figura 2), GASLINI 109 PALOMBA FAST TRACK IN CHIRURGIA TABELLA I. — Caratteristiche organizzate del modello fast track. Obiettivo — primario: migliorare la qualità dell’assistenza per il paziente — secondario: negoziazione dei costi, organizzazione del carico di lavoro, miglioramento del Clima e del Team Metodo — Fast track: (percorso veloce) tempo di degenza ridotta al minimo necessario — Day-surgery: ricovero di giorno per chirurgia minore — Week-surgery: ricovero settimanale per chirurgia maggiore (reale fast-track) Rationale — Produttività: a risorse date la qualità dell’assistenza migliora grazie all’efficienza organizzativa (maggiori costi operatori bilanciati da una riduzione della degenza). — Gruppo (team): più persone che devono lavorare insieme, per raggiungere un obiettivo comune, condividendo la responsabilità dei risultati. Il compito di un gruppo è tale che i risultati di ciascun membro hanno implicazioni x i risultati dei suoi compagni. Team di qualità (nessuno di noi è bravo quanto tutti noi insieme): - P: Proposito comune - E: Talenti di tutti i membri grazie all’empowerment - R: uso efficacia di Relazioni e comunicazione - F: Flessibilità nella presa e nell’attuazione delle decisioni - O: responsabili di una performance Ottimale - R :forniscono Riconoscimenti e apprezzamenti - M: Morale elevato — Clima e Cultura organizzativa: un set di caratteristiche che descrivono un'organizzazione e che la distinguono dalle altre organizzazioni. Queste sono relativamente durature nel tempo ed influenzano il comportamento degli individui nell'organizzazione. Lewin (1939): “atmosfera” “qualcosa di intangibile, una proprietà della situazione sociale complessiva” — Dimensione relazionale: coinvolgimento, supporto, spontaneità. — Dimensione di crescita personale: autonomia, orientamento pratico, orientamento empatico, ansia e aggressione. — Mantenimento delle dimensioni: ordine e organizzazione, chiarezza dei programmi, controllo di staff. Metodologia di lavoro secondo modalità prevista dalla Joint Commission International per la dimostrazione degli audit clinici di riferimento vediamo che, secondo la metodologia di JCI e della EBM, non è possibile tornare indietro. I dati sono evidenti e pubblicati: per il paziente si deve eseguire la chirurgia mini-invasiva e quindi, automaticamente, adottare un modello organizzativo fast track. Lo abbiamo dimostrato per l’appendicectomia, per la resezione del colon, per l’esofago, etc. non vi è alcuna giustificazione “a priori” per non ridurre al minimo il trauma per il paziente e quindi dargli dei 110 risultati clinici al massimo delle nostre energie. Si devono analizzare i reali costi perioperatori. Le prospettive future consistono nel traslare l’esperienza di pochi ad altri professionisti e forzare la formazione secondo modelli europei e internazionali garantendo la qualità per il paziente anche in centri non specialistici. Concludendo, il fast track è un modello organizzativo che deve essere adottato dal gruppo di lavoro allo scopo di offrire il percorso ottimale, secondo le possibilità attuabili nei differenti centri di chirurgia, ai pazienti che devono essere sottoposti a chirurgia maggiore, mantenedo sempre costante il principio che il paziente deve essere al centro degli sforzi (Tabella I). La gestione del rischio clinico prevede differenti fasi e per ognuna di esse devono essere prodotti e discussi standard procedurali per ottenere un miglioramento per il paziente. La metodologia di lavoro è programmata e pianificata e prevede una fase iniziale di valutazione dei risultati clinici (audit) secondo lo schema della Evidence Based Medicine (EBM). Successivamente il percorso del lavoro prevede la produzione di procedure che devono essere condivise da medici ed infermiere, in modo multidisciplinare, da identificare i punti critici, e quindi a rischio di errore. Il percorso svolto per il miglioramento della gestione del rischio clinico del Dipartimento di Chirurgia ha previsto lo sviluppo e la condivisione dei seguenti punti: 1) ricerca clinica e produzione di audit clinici che dimostrassero la “fattibilità” e “sicurezza” della metodologia; 2) produzione di istruzioni operative; 3) preparazione e messa in atto dei moduli di consensi informati specifici chirurgici rispettando le nuove regole; 4) sorveglianza e creazione ed implementazione prospettica di una banca dati dei pazienti ricoverato con complicanze chirurgiche (M&M); 5) produzione di audit clinici, con pubblicazione su GASLINI Agosto 2008 FAST TRACK IN CHIRURGIA PALOMBA riviste a Index, focalizzando sulla “riproducibilità” e “standardizzazione” dei risultati; 6) messa in atto delle procedure di controllo dei ruoli dei medici in formazione; 7) aumento del numero chirurghi che possono eseguire manovre mini-invasive; 8) incremento del numero di interventi eseguiti mediante approccio mini-invasivo; 9) sviluppo di trial clinici per eseguire nuove procedure. Tale percorso è stato condiviso mediante discussioni collegiali di problemi clinici ed organizzativi, tra medici e personale infermieristico mediante: 1) riunioni mensili, documentate, di discussione collegiale delle M&M; 2) riunioni settimanali, documentate, dipartimentali; 3) corsi di aggiornamento; 4) produzione di reportistica discussa collegialmente allo scopo di migliorare i risultati clinici e ridurre il rischio errore; 5) riunioni multidisciplinari con scopo di formazione verso i non tecnici e i parenti dei pazienti. Gli indicatori di qualità prevedono: 1) complicanze e secondi accessi in sala operatoria (M&M); 2) volume di attività; 3) maggiore numero di chirurghi coinvolti; 4) pubblicazioni; 5) produzione di istruzioni operative. Tali indicatori sono esplicitati nei seguenti file: 1) istruzione operativa - protocollo risk management; 2) consensi informati MIAS; 3) istruzioni operative MIAS specifiche per tipo di procedura; 4) pubblicazioni. Di seguito si inseriscono i moduli dei consensi informati e delle istruzioni operative attualmente in uso. Tale modulistica deve essere considerata non un “dovere” ma indicativa per seguire un percorso standard. Il clinico che ha in cura il paziente ed il personale infermieristico che collabora all’intervento chirurgico sono responsabili delle proprie decisioni ed azioni sul singolo paziente. Istruzioni operative eseguite ed adattate: — Completate, revisionate, validate e confermate da AUDIT pubblicati: Vol. 40 - N. 2 1) Informativa; 2) esofago - cardias (acalasia, reflusso gastro-esofageo) da collegarsi alla istruzione operativa “disfagia”; 3) colecisti e vie biliari; 4) milza/pancreas (splenectomia, emisplenectomia, fenestrazione per cisti); 5) gonadi; 6) dialisi; 7) chirurgia del colon; 8) urgenze addominali (appendice, aderenze, invaginazione); 9) stapler (suturatrici meccaniche). — In via di definizione da valicare: 1) nefrectomia e chirurgia renale; 2) stenosi/atresie intestinali; 3) ernia diaframmatici; 4) anestesia/analgesia; 5) fast track; 6) chirurgia toracica (mediastino e polmone); 7) chirurgia oncologica; 8) chirurgia neonatale; 9) management perioperatorio. Si può avere accesso ai file per poter approfondire le conoscenze sui risultati (audit) clinici pubblicati su riviste internazionali con Impact Factor secondo le normative JCI. Il contenuto dei documenti è in via di verifica ed è prevista la revisione nei prossimi 12 mesi. Sono in via di produzione ulteriori istruzioni operative che verranno progressivamente validate, discusse e messe in condivisione. Le istruzioni operative e i consensi informati sono indicativi e devono essere adattati alle singole circostanze e rivalutati in base alle specifiche situazioni da ciascun singolo professionista coinvolto. Letteratura specifica sul fast track pediatrico 1. Coran AG. A personal experience with 100 consecutive total colectomies and straight ileoanal endorectal pull-throughs for benign disease of the colon and rectum in children and adults. Ann Surg 1990;212:242-7; discussion 247-8. 2. Mattioli G, Castagnetti M, Jasonni V. Appendicectomy for simple appendicitis: video-assisted or intracorporeal? J Laparoendosc Adv Surg Tech A 2007;17:478-82. 3. Pini Prato A, Gentilino V, Giunta C, Avanzini S, GASLINI 111 PALOMBA FAST TRACK IN CHIRURGIA Parodi S, Mattioli G et al. Hirschsprung’s disease: 13 years’ experience in 112 patients from a single institution. Pediatr Surg Int 2008;24:175-82. 4. Georgeson K. Laparoscopic-assisted anorectal pull-through. Semin Pediatr Surg 2007;16:266-9. 5. Gilchrist BF, Lobe TE, Schropp KP, Kay GA, Hixson SD, Wrenn EL Jr et al. Is there a role for laparoscopic appendectomy in pediatric surgery? J Pediatr Surg 1992;27:209-14. 6. Luks FI, Logan J, Breuer CK, Kurkchubasche AG, Wesselhoeft CW Jr, Tracy TF Jr. Cost-effectiveness of laparoscopy in children. Arch Pediatr Adolesc Med 1999;153:965-8. 7. Kremer M, Ulrich A, Buchler MW et al. Fast-track surgery: the Heindelberg experience. Recent results. Cancer Res 2005;165:14-20. 8. Reismann M, von Kampen M, Laupichler B, Suempelmann R, Schmidt AI, Ure BM. Fast-track surgery in infants and children. J Pediatr Surg 2007;42:2348. 9. Grewal H, Sweat J, Vazquez WD. Laparoscopic Appendicectomy in children can be done as fast-track or same-day surgery. JSLS 2004;8:151-4. 10. Ramesh IP, Verghese ST, Hannalah RS et al. Fast-tracking children after ambulatory surgery. Anesth Analg 2001;92:918-22. 11. Watkins AC, White PF. Fast-tracking after ambulatory surgery. J Perianesth Nurs 2001;16:379-87. 12. Mattioli G et al. Fast track colon surgery. J Laparoendosc Adv Surg Tech A [in press]. Produzione personale in tema di chirurgia mini-invasiva L’esperienza che si è sviluppata in questi anni ha seguito un percorso scientifico rigoroso con studi clinici controllati. Mediante l’analisi prospettica è stato possibile valutare la metodologia e migliorare progressivamente i risultati clinici. Di seguito si riportano le principali pubblicazioni scientifiche prodotte e pubblicate su riviste recensite. Apparato digerente 1. Mattioli G, Castagnetti M, Jasonni V. Appendicectomy for simple appendicitis: video-assisted or intracorporeal? J Laparoendosc Adv Surg Tech A 2007;17:478-82. 2. Mattioli G, Pini-Prato A, Castagnetti M, Gandullia 112 P, Toma P, Jasonni V. Is perioperative cholangiography necessary in children undergoing elective laparoscopic cholecystectomy? Eur J Pediatr Surg 2007;17:1769. 3. Mattioli G, Pini Prato A, Cheli M, Esposito C, Garzi A, LiVoti G et al. Italian multicentric survey on laparoscopic spleen surgery in the pediatric population. Surg Endosc 2007;21:527-31. 4. Pini Prato A, Gentilino V, Giunta C, Avanzini S, Parodi S, Mattioli G et al. Hirschsprung’s disease: 13 years’ experience in 112 patients from a single institution. Pediatr Surg Int 2008;24:175-82. 5. Prato AP, Felici E, Gentilino V, Giunta C, Avanzini S, Mattioli G et al. Uncommon causes of postoperative chronic diarrhoea mimicking enterocolitis in Hirschsprung’s disease: is there a role for digestive endoscopy? Pediatr Surg Int 2008;24:503-7. 6. Pini-Prato A, Avanzini S, Gentilino V, Martucciello G, Mattioli G, Coccia C et al. Rectal suction biopsy in the workup of childhood chronic constipation: indications and diagnostic value. Pediatr Surg Int 2007;23:117-22. 7. Mattioli G, Bax K, Becmeur F, Esposito C, Heloury Y, Podevin G et al. European multicenter survey on the laparoscopic treatment of gastroesophageal reflux in patients aged less than 12 months with supraesophageal symptoms. Surg Endosc 2005;19:1309-14. 1. Esposito C, Langer JC, Schaarschmidt K, Mattioli G, Sauer C, Centonze A et al. Laparoscopic antireflux procedures in the management of gastroesophageal reflux following esophageal atresia repair. J Pediatr Gastroenterol Nutr 2005;40:349-51. 2. Mattioli G, Sacco O, Gentilino V, Martino F, Pini Prato A, Castagnetti M et al. Outcome of laparoscopic Nissen-Rossetti fundoplication in children with gastroesophageal reflux disease and supraesophageal symptoms. Surg Endosc 2004;18:463-5. 3. Mattioli G, Esposito C, Pini Prato A, Doldo P, Castagnetti M, Barabino A et al. Results of the laparoscopic Heller-Dor procedure for pediatric esophageal achalasia. Surg Endosc 2003;17:1650-2. 4. Mattioli G, Gentilino V, Caponcelli E, Martino F, Castagnetti M, Piniprato A et al. Effectiveness of esophageal manometry in predicting the outcome of children with primary GER after floppy Nissen-Rossetti wrap. Surg Endosc 2004;18:1504-8. 5. Mattioli G, Castagnetti M, Martucciello G, Jasonni V. Results of a mechanical Duhamel pull-through for the treatment of Hirschsprung’s disease and intestinal GASLINI Agosto 2008 FAST TRACK IN CHIRURGIA PALOMBA 3. Papparella A, Parmeggiani P, Cobellis G, Mastroianni L, Stranieri G, Pappalepore N et al. Laparoscopic management of nonpalpable testes: a multicenter study of the Italian Society of Video Surgery in Infancy. J Pediatr Surg 2005;40:696-700. 4. Esposito C, Lima M, Mattioli G, Mastroianni L, Centonze A, Monguzzi GL et al. Complications of pediatric urological laparoscopy: mistakes and risks. J Urol 2003;169:1490-2; discussion 1492. neuronal dysplasia. J Pediatr Surg 2004;39:1349-55. 6. Mattioli G, Montobbio G, Pini Prato A, Repetto P, Carlini C, Gentilino V et al. Anesthesiologic aspects of laparoscopic fundoplication for gastroesophageal reflux in children with chronic respiratory and gastroenterological symptoms. Surg Endosc 2003;17:559-66. 7. Mattioli G, Esposito C, Lima M, Garzi A, Montinaro L, Cobellis G et al. Italian multicenter survey on laparoscopic treatment of gastro-esophageal reflux disease in children. Surg Endosc 2002;16:1666-8. 8. Mattioli G, Repetto P, Leggio S, Castagnetti M, Jasonni V. Laparoscopic Nissen-Rossetti fundoplication in children. Semin Laparosc Surg 2002;9:153-62 9. Mattioli G, Repetto P, Carlini C, Torre M, Pini Prato A, Mazzola C et al. Laparoscopic vs open approach for the treatment of gastroesophageal reflux in children. Surg Endosc 2002;16:750-2. 10. Mattioli G, Cagnazzo A, Barabino A, Caffarena PE, Ivani G, Jasonni V. The surgical approach to oesophageal achalasia. Eur J Pediatr Surg 1997;7:323-7. 11. Mattioli G, Buffa P, Martinelli M, Ivani G, Jasonni V. All mechanical low rectal anastomosis in children. J Pediatr Surg 1998;33:503-6. 12. Mattioli G, Repetto P, Carlini C, Granata C, Montobbio G, Cagnazzo A et al. Medium-term results after cholecystectomy in patients younger than 10 years. Surg Endosc 2001;15:1423-6. 1. Esposito C, Lima M, Mattioli G, Mastroianni L, Riccipetitoni G, Monguzzi G et al.; Italian Society of Videosurgery in Infancy. Thoracoscopic surgery in the management of pediatric malignancies: a multicentric survey of the Italian Society of Videosurgery in Infancy. Surg Endosc 2007;21:1772-5. 2. Mattioli G, Buffa P, Granata C, Fratino G, Rossi G, Ivani G et al. Lung resection in pediatric patients. Pediatr Surg Int 1998;13:10-3. 3. Jasonni V, Martinelli M, Caffarena PE, Bisio G, Mattioli G, Ivani G et al. Neonatal congenital thoracic pathology: new surgical therapies. J Perinat Med 1994;22(Suppl 1):121-4. 4. Mattioli G, Cagnazzo A, Martucciello G, Jasouni V. Use of staplers in congenital lobar emphysema. Eur J Pediatr Surg 1993;3:359-61. Urologia Complicanze 1. Mattioli G, Castagnetti M, Verrina E, Trivelli A, Torre M, Jasonni V et al. Laparoscopic-assisted peritoneal dialysis catheter implantation in pediatric patients. Urology 2007;69:1185-9. 2. Esposito C, Valla JS, Najmaldin A, Shier F, Mattioli G, Savanelli A et al. Incidence and management of hydrocele following varicocele surgery in children. J Urol 2004;171:1271-3. 1. Esposito C, Mattioli G, Monguzzi GL, Montinaro L, Riccipetiotoni G, Aceti R et al. Complications and conversions of pediatric videosurgery: the Italian multicentric experience on 1689 procedures. Surg Endosc 2002;16:795-8. 2. Mattioli G, Castagnetti M, Repetto P, Leggio S, Jasonni V. Complications of mechanical suturing in pediatric patients. J Pediatr Surg 2003;38:1051-4. Vol. 40 - N. 2 Torace GASLINI 113 GASLINI 2008;40:115-8 La prevenzione degli eventi traumatici accidentali del minore in ospedale M. L. SPERLINGA Dipartimento di Servizi Assistenziali, Istituto G. Gaslini, Genova L ’Istituto Pediatrico G. Gaslini ha conseguito nel novembre 2007 l’accreditamento JCI. Il percorso attivato per il conseguimento dell’accreditamento e la metodologia proposta da JCI hanno richiesto la definizione di politiche e procedure finalizzate alla sicurezza dei pazienti, dei processi assistenziali e delle cure erogate. Il Dipartimento dei Servizi Assistenziali (DSA) infermieristici e delle figure di supporto collabora attivamente tramite propri rappresentanti alla pianificazione ed alla realizzazione delle varie iniziative finalizzate all’accreditamento, in particolare per quello all’eccellenza. Tra le iniziative realizzate, il DSA ha condotto un’indagine per determinare l’incidenza del fenomeno “eventi traumatici accidentali” (e.t.a.) nel bambino ricoverato in ospedale finalizzata alla realizzazione di un piano di prevenzione aziendale di tali eventi. Tra gli infortuni in ambito ospedaliero, le cadute dei ricoverati sono considerate indicatori di qualità dell’assistenza, in particolare tra le persone sopra i 65 anni 1, 2 o nei minori al di sotto dei sei anni. ll piano di prevenzione e segnalazione degli eventi nasce dalla limitata conoscenza del fenomeno in ambito pediatrico emersa dalla revisione della letteratura. La letteratura nazionale e internazionale è ricca di contributi scientifici ed esperienze inerenti il fenomeno delle cadute di pazienti adulti, ma scarsa di contributi inerenti agli infortuni dei minori ricoverati 3, 4. Sono stati, invece, reperiti documenti e linee guida finalizzate alla prevenzione degli “incidenti domestici” che evidenziano similitudini con gli infortuni acci- dentali del bambino in ambito ospedaliero, in qualche misura organizzato, nelle zone maggiormente frequentate dai minori, come quello familiare. Una breve ricognizione svolta presso le Direzioni Sanitarie di altri centri pediatrici italiani, contattate informalmente per via telefonica, non ha evidenziato iniziative di particolare interesse o progetti in merito ma ha confermato che gli infortuni sono annotati esclusivamente in cartella clinica, spesso non sono né registrati né monitorati, salvo in casi in cui abbiano sequele medico-legali. L’indagine, con uno studio retrospettivo* ha stimato l’incidenza del fenomeno negli anni 2003-20042005-2006, e raccolto ulteriori informazioni tramite una rilevazione prospettica** relativa agli eventi traumatici avvenuti nel semestre 1 marzo/31 agosto 2007. Il gruppo di lavoro costituito allo scopo, identificato il problema, ha definito il disegno di ricerca, gli obiettivi dello studio e la metodologia per la raccolta e l’elaborazione dati. Per poter realizzare l’indagine si è reso necessario definire, all’interno del gruppo di lavoro, gli eventi accidentali. In considerazione delle indicazioni fornite dalla letteratura si è convenuto che la definizione e.t.a. comprendesse tutti quegli eventi accidentali che cagionano, o potrebbero cagionare, un danno od una lesione al bambino ricoverato. Sono stati quindi considerati tali cadute, urti, ustio*Lo studio prospettico è stato condotto da A. M. Urbano, Dipartimento dei Servizi Assistenziali. **Lo studio prospettico è stato condotto da R. Da Rin Della Mora, Dipartimento dei Servizi Assistenziali. Autore di contatto: M. L. Sperlinga, Dipartimento di Servizi Assistenziali, Istituto G. Gaslini, Largo Gerolamo Gaslini, 16147 Genova. Vol. 40 - N. 2 GASLINI 115 SPERLINGA LA PREVENZIONE DEGLI EVENTI TRAUMATICI ACCIDENTALI DEL MINORE IN OSPEDALE Per prevenire le ferite: — Evitare che oggetti appuntati o taglienti, come coltelli, forbici, presidi od attrezzature sanitarie, od altro, siano lasciati alla portata del bambino perché potrebbero causare ferite. — Evitare che il bambino scontri sporgenze od elementi taglienti ed acuminati presenti nell’ambiente. Figura 1. — Le ferite. Per prevenire le ustioni: — Controllare che la temperatura dell’acqua utilizzata per l’igiene del bambino non superi i 37° C. — Evitare di tenere in braccio il bambino e contemporameante trasportare bevande o cibi cucinati o bollenti. — Non lasciate tazze o piatti con bevande o cibi bollenti sui bordi di tavoli e ripiani, perché il bambino potrebbe raggiungerli o rovesciarseli addosso ustionandosi. — Evitare il contatto diretto del bambino con fonti di calore e prese elettriche presenti nell’ambiente circostante anche se adeguatamente protette. — Preferite indumenti in fibre naturali, evitare quelle sintetiche. Figura 2. — Le ustioni. ni, scosse elettriche, inalazioni di corpi estranei o gas tossici, ingestione o contatti con sostanze potenzialmente irritanti, nocive, tossiche o corrosive. I risultati delle indagini condotte hanno consentito l’elaborazione di un piano aziendale di prevenzione/segnalazione degli eventi e di informazione/sensibilizzazione di genitori e operatori”. I risultati maggiormente significativi emersi dall’indagine retrospettiva sono: — il numero di eventi traumatici rilevati ha un’incidenza, nei pazienti ricoverati, pari al 1,1%. Il dato è in linea con le segnalazioni della letteratura reperita 2; 116 — la fascia d’età maggiormente interessata dal fenomeno è quella tra 1 e 3 anni; — un andamento costante del fenomeno durante l’anno con una più alta frequenza nei mesi di ottobre e maggio (95 eventi nei quattro anni pari al 11,7% ) ed una minore in agosto (41 e.t.a. pari al 5% nel periodo considerato); — una maggiore frequenza degli e.t.a. nella fascia oraria pomeridiana (dalle 13 alle 20 si registrano 338 eventi nei quattro anni pari al 41,5%) probabilmente in relazione a una minore programmazione di attività diagnostico terapeutiche in tale orario; — la modalità più frequente di evento traumatico GASLINI Agosto 2008 LA PREVENZIONE DEGLI EVENTI TRAUMATICI ACCIDENTALI DEL MINORE IN OSPEDALE SPERLINGA Per prevenire le cadute: — Sorvegliare il bambino per prevenire comportamenti a rischio. — Avvisate il personale presente in servizio nei casi in cui dobbiate allontanarvi dal bambino o lasciarlo solo. — Evitare che il bambino sia lasciato solo su fasciatoi, letti, divani, sedie, tavoli. — Adagiate il bambino nel lettino a sponde alzate nei casi in cui non lo potete tenere in braccio o vi dovete allontanare da lui anche per poco tempo. — Evitate che il bambino urti o salga, con rischio di caduta, su sedie od oggetti utilizzabili come scalini vicino a tavoli, ripiani, mobili, finestre, letti, balconi, attrezzature. — Evitare che il bambinosì si aggrappi a mobili, sportelli od ante, caloriferi a parete, attrezzature quando comincia a camminare, intorno ai 12 mesi, od in situazioni particolari in cui l’equilibrio, durante le attività di movimento, sia instabile. — Verificare che le cinture di sicurezza, od altri dispositivi appositi, di passeggini, carrozzelle, ecc., siano utilizzati e fissati adeguatamente per garantire al bambino la necessaria protezione. Verificate la corrispondenza dei dispositivi di sicurezza con l’età del bambino. — Evitare che il bambino cammini o corra su pavimenti o superfici bagnate o scivolose. — Chiedete l’intervento del personale infermieristico nel caso in cui muovere il bambino allettato, o aiutarlo a scendere dal letto, sia difficoltoso o richieda attenzioni particolari. Figura 3. — Le cadute. è la caduta dal letto (209 eventi registrati nel quadriennio oggetto d’indagine, pari al 25,7%); — gli esiti degli eventi non incidono significativamente sulla condizione clinica del minore; — le Unità Operative mediche registrano più eventi di quelle chirurgiche. L’indagine prospettica, inoltre evidenzia che: — la camera di degenza è il luogo dove si verificano più eventi traumatici; — la distrazione del minore e dei familiari gioca un ruolo importante nel determinare l’evento, anche quando l’adulto è presente accanto al bambino nel momento in cui questo accade 5. Il progetto elaborato definisce la politica dell’Istituto per migliorare la qualità dell’assistenza e la sicurezza dei pazienti. Promuove una politica aziendale per la prevenzione degli eventi traumatici accidentali del minore ricoverato attraverso l’attuazione di interventi ambientali ed assistenziali atti a ridurre le situazioni di rischio, facilitare la gestione, la segnalazione ed monitoraggio degli eventi prevede interventi di informazione/sensibilizzazione di genitori ed operatori. Vol. 40 - N. 2 Gli interventi ambientali presuppongono l’adozione di strategie finalizzate ad assicurare strutture idonee per quanto riguarda la sicurezza e la prevenzione degli infortuni accidentali del bambino. A tale scopo utilizza arredamenti, attrezzature e presidi sicuri ed idonei al minore, anche in caso di disabilità. In particolare favorisce la pulizia, l’ordine e l’illuminazione nei locali più utilizzati dal paziente e dai familiari durante la permanenza in ospedale. Per la similitudine rilevata tra gli incidenti domestici dell’infanzia e gli eventi accidentali del minore in ospedale e per il ruolo di tutela e sorveglianza che famigliari ed adulti svolgono nei confronti del bambino 6, la prevenzione degli eventi si è avvalsa di interventi educativi e strumenti informativi finalizzati ad accrescere l’informazione e l’attenzione degli adulti nel prevenire situazioni ambientali pericolose e comportamenti a rischio. A tale fine, per il personale dell’area assistenziale, è stato realizzato un seminario di approfondimento per la conoscenza e la descrizione del fenomeno presso l’Istituto, relativo agli eventi traumatici nel corso del GASLINI 117 SPERLINGA LA PREVENZIONE DEGLI EVENTI TRAUMATICI ACCIDENTALI DEL MINORE IN OSPEDALE quale sono stati presentati e discussi i risultati delle indagini condotte. Inoltre è stato presentato e condiviso il piano aziendale per la prevenzione, segnalazione, gestione e monitoraggio degli eventi ed illustrato l’opuscolo informativo realizzato per l’informazione di genitori e familiari. L’opuscolo, da consegnare ai genitori al momento del ricovero, ha lo scopo di focalizzare l’attenzione su semplici accorgimenti per rendere più sicura e serena la permanenza in ospedale di bambini e familiari ed aumentare la conoscenza delle famiglie in tema di sicurezza e prevenzione degli incidenti in senso generale. In relazione ai risultati emersi dagli studi di ricerca sono state ridefinite le procedure di: — segnalazione degli eventi da parte delle Unità Operative alla Direzione Sanitaria; — le modalità di contenzione del minore da attuarsi esclusivamente nelle situazioni in cui si ravvisi un rischio immediato di pericolo per l’incolumità del bambino, o di altri, o la compromissione del trattamento diagnostico- terapeutico; — valutare il rischio di caduta del paziente al momento del ricovero e, quindi, rivedere la scheda di valutazione iniziale del bambino, prevedendo nella documentazione infermieristica uno spazio specifico. Il monitoraggio ha come obiettivo quello di verificare l’andamento del fenomeno ed i risultati delle azioni attuate per la prevenzione dello stesso. Bibliografia 1. 2. 3. 4. 5. 6. 118 D. La quintana. La prevenzione delle cadute nelle persone anziane: linee guida a confronto, Assistenza infermieristica e ricerca n. 21, 2002. Brandi A. et al. Indagine retrospettiva sulle cadute nei pazienti ricoverati in ospedale, Assistenza infermieristica e ricerca n. 21, 2002. Miller MR, Elixhauser A, Zhan C. Patient safety events during pediatric hospitalization. Pediatrics 2003;111:1358-66. Munro SA, van Niekerk A, Seedat M. Childhood unintentional injuries: the perceived impact of the environment, lack of supervision, and child characteristics. Child Care Health Dev 2006;32:269-79. Morrongiello BA, Corbett M. The parent supervision attributes profile questionnaire: a measure of supervision relevant to children’s risk of unintentional injury. Inj Prev 2006;12:19-23. Schnitzer PG. Prevention of unintentional childhood injuries. Am Fam Physician 2006;74:1864-9. GASLINI Agosto 2008 GASLINI 2008;40:119-25 Miglioramento continuo delle cure in neonatologia: la gestione del rischio iatrogeno I. LIGI 1, S. TARDIEU 2, E. JOUVE 2, R. SAMBUC 2, U. SIMEONI 1 1Service de néonatologie, Pôle Parents-Enfants, Hôpital de La Conception, Marseille, France 2Cellule d’évaluation médicale, Pôle de santé publique, EA 3279, Assistance Publique Faculté de Médecine, Université de la Méditerranée, Hôpitaux de Marseille, Marseille, France I progressi costanti della medicina neonatale permettono l’assistenza a pazienti in condizioni sempre più gravi. Si accompagnano inevitabilmente ad effetti avversi, e ad un rischio di danno iatrogeno e di errore medico. Circa 44 000 decessi ogni anno sono dovuti ad errori in campo medico in USA 1. Il danno iatrogeno si definisce come qualsiasi lesione o sofferenza inflitta ad un paziente inseguito ad un aspetto qualsiasi nella applicazione delle cure. L’errore è umano, e la neonataologia, data l’elevata vulnerabilità dei suoi pazienti, è esposta in modo particolare al rischio iatrogeno 2. La presa in conto e la gestione ottimizzata di tale rischio nel quadro di un programma di miglioramento continuo della qualità può procurare un beneficio significativo tanto al paziente che alle istittuzioni. Il rischio iatrogeno in medicina neonatale La medicina neonatale è una specialità nuova dai rapidi progressi. I limiti della rianimazione neonatale sono stati gradualmente ridotti, permettendo la sopravvivenza di un numero crescente di pazienti, in particolare di prematuri di età gestazionale sempre più bassa. Questi pazienti sono particolarmente vulnerabili e sono tra i più esposti agli effetti collaterali delle terapie, ed all’errore umano. Gli studi disponibili inerenti agli eventi iatrogeni (EI) si sono fin’ora in gran parte orientati verso la medicina dell’adulto o verso la pediatria 3-6, ma non verso la neonatologia sulla qua- le poche conoscenze sono disponibili. Queste provengono principlamente da indagini retrospettive, o da sistemi di monitoraggio generale, non specificamente disegnati per le unità di neonatologia. Il Harvard Medical Practice Study e il Health Cost and Utilization Project (HCUP) study, stimano che tra l’1,2 % et l’1,4 % dei neonati ricoverati subiscono un EI durante il loro ricovero. Questi dati molto verosimilmente sottostimano il rischio reale al quale sono esposti i pazienti nelle unità di medicina e terapia intensiva neonatale. L’importanza della metodica nel monitoraggio e la gestione del rischio iatrogeno L’importanza del monitoraggio delle più frequenti complicanze, in particolare iatrogene, osservate in medicina neonatale è riconosciuta, il problema centrale è comunque metodologico e risiede nella qualità dei sistemi con i quali gli EI vengono riconosciuti e dichiarati. I sistemi di reporting degli EI sono la base della strategia che consente di imparare dagli errori 1. Esistono due tipi principali di sistemi degli reporting degli EI. I sistemi di dichiarazione obbligatoria tendono a riportare alle amministrazioni centrali gli eventi più gravi, che hanno causato una lesione grave o il decesso del paziente, cioè “la parte apparente dell’iceberg”. Sono basati su una review retrospettica della cartella del paziente. Spesso concepiti a livello dell’intero ospedale, sono privi della specificità e della reattività Ringraziamenti. — Gli autori esprimono un vivo ringraziamento alla dott.ssa Francesca Conti per avere riletto il manoscritto. Autore di contatto: U. Simeoni, Service de néonatologie, Hôpital de La Conception, AP-HM 147 Boulevard Baille, 13385 Marseille, France. E-mail: [email protected] Vol. 40 - N. 2 GASLINI 119 LIGI MIGLIORAMENTO CONTINUO DELLE CURE IN NEONATOLOGIA necessaria ad un’azione correttiva efficiente. All’opposto, i metodi basati su una dichiarazione volontaria, simili a quelli usati nell’Aviazione, tendono a rappresentare maggiormente gli eventi di importanza limitata, includendo le situazioni a rischio, ma che non hanno creato effettivamente l’incidente (near miss), in quanto questi sistemi sono concepiti sopratutto per correggere la fallibilità di un sistema operativo. Leape et al. hanno sottolineato l’interesse di una metodica di reporting in tempo reale, non-punitivo, ed anonimo 7. Il sistema di monitoraggio degli EI utilizzato nella nostra esperienza è derivato da quest’ultimo e consiste in un reporting interno alla divisione di neonatologia, omnicomprensivo, continuo, volontario da parte dell’insieme del personale, medico e paramedico della divisione, non-punitivo ed anonimo. Ha consentito di rilevare un’incidenza degli EI vicina al 30% dei ricoveri neonatali e di descrivere la loro tipologia, gravità ed evitabilità 8. Dati precedentemente disponibili 4, 9, basati principalmente sù una raccolta retrospettica e la International Classification of Diseases n. 9, molto verosimilmente sottostimanavo questo problema con un incidenza vicina al 1,8% dei pazienti ricoverati. In questo studio, il documento di segnalazione degli EI è stato elaborato da un gruppo di lavoro costituito da membri del personale medico e paramedico della divisione e da un epidemiologo, sulla base dei dati della letteratura, dei sistemi esperti disponibili e di uno studio pilota (eseguito nel 2003). Il documento contiene, oltre ai dati amministrativi ed ai dati clinici inerenti il paziente, la descrizione libera degli eventuali EI riscontrati, includendo data ed ora, tipo di EI, descrizione, ed evoluzione. Sul retro del documento si trova come aiuto al reporting una lista, non limitativa, di 53 EI tipici, divisi in 7 categorie: infezioni nosocomiali iatrogene, incidenti da ventilazione meccanica/CPAP, incidenti da catetere vascolare, incidenti cutanei, incidenti con ripercussione sull’apparato digerente, errori di medicazione ed effetti indesiderati da farmaci, incidenti non classificabili. La displasia bronco-polmonare, le retinopatia del prematuro, l’enterocolite necrotizzante sono state escluse in quanto la loro origine è multifattoriale. Il documento, parte della cartella clinica del paziente, fa parte dei documenti individuali di sorveglianza di routine, ed è costantemente accessibile, accanto all’incubatore o al lettino del bambino, al personale come ai genitori. Un medico della divisione dedica inoltre una visita, due volte alla settimana, alle equipe assistenziali 120 e completa con loro, se necessario, il documento di reporting. Più sessioni di informazione e di formazione del personale sulla natura del programma e sul reporting sono state organizzate, con lo scopo di familiarizzare gli agenti con il sistema, ma anche di rassicurali e di motivarli a partecipare. Gli EI segnalati sono in seguito periodicamente rivisti e classificati da due medici indipendenti della divisione (con intervento di un terzo medico nel caso di incompatibilità dei pareri), i corrispondenti fattori kappa di variazione per la severità e la prevenibilità essendo pari a 0,94 e 0,84 rispettivamente. La gravità e l’evitabilità degli EI è valutata su una scala di Licker da 1 a 6, il criterio essendo considerato raggiunto con il valore 4. Con periodicità di due mesi, una sintesi degli EI osservati viene restitutita alle equipes, le quali elaborano un azione correttiva destinata a ridurre l’incidenza degli EI più rappresentativi, in particolare quelli incontrati nei casi di emergenza, Sono usate le seguenti definizioni: — evento iatrogeno (EI): qualsiasi evento che abbia commpromesso il margine di sicurezza per il paziente, che abbia causato o no una lesione, che sia stato evitabile o no, che sia stato dovuto ad un errore da parte dell’equipe curante o no. Gli eventi intercettati e spontaneamente rettificati non sono stati presi in conto; — evento iatrogeno prevenibile: qualsiasi EI evitabile inbase alle conoscenze attualmente disponibili ed alle pratiche accettate 3. — effetto indesiderato da farmaco (AIF): qualsiasi EI risultato da un intervento medico relativo all’uso di un farmaco 10. — errore di medicazione (EM): qualsiasi EI evitabile realizzatosi durante il processo di prescrizione, trascrizione, rilascio, somministrazione o monitoraggio di una terapia, che abbia o no causato un danno 5. — infezione nosocomiale iatrogena: infezione contratta in ospedale, associata alle cure, evidenziata 48 ore o più dopo il ricovero. Le definizioni standard dei CDC 11 sono usate nella nostra pratica. Incidenza e tipologia degli eventi iatrogeni in neonatologia L’incidenza, la gravità e l’evitabilità degli EI riportati in seguito provengono da una divisione di neonato- GASLINI Agosto 2008 MIGLIORAMENTO CONTINUO DELLE CURE IN NEONATOLOGIA LIGI TABELLA I. — Incidenza, gravità ed evitabilità degli eventi iatrogeni in neonatalogia. Eventi iatrogeni Totale Prevenibili Gravità: EI minori ed evitabili EI severi ed evitabili EI fatali ed evitabili Incidenza/100 ricoveri Incidenza/1000 giorni-paziente 267 92 (34.4) 68.8 23.7 25.6 8.8 188 (70) 72 (38.3) 77 (29) 20 (26) 2 (0.7) 0 (0) 48.4 18.5 19.8 5.1 0.5 0 18 6.9 7.4 1.9 0.2 0 n (%) Gravità ed evitabilità degli EI Categoria degli EI (n) EI gravi n (%) Vascolari (38) Infezioni nosocomiali (62) Effetti indesiderati da farmaci (34) Cutanei (94) Respiratori (26) Digestivi (11) Totale (265) a logia di 54 posti letto (di cui 15 di terapia intensiva) di terzo livello in un ospedale universitario di riferimento con 3 400 nascite in-born all’anno. Tutti i neonati accettati nella divisione sono stati inclusi nello studio. Lo staff medico consiste in 9 neonatologi senior e 8 junior. La guardia medica è assicurata dalla presenza di un pediatra senior e di un pediatra junior. Il numero di pazienti affidati ad un(a) infermiere(a) è compreso tra 2 a 3. Tutte le prescrizioni sono fatte per iscritto dai medici. Lo studio è stato approvato dal Dipartimento di valutazione medicale ed è parte di un piano di miglioramento continuo della qualità interno alla Divisione di neonatologia, coordinato dal Dipartimento di Sanità Pubblica dell’istituzione. In toto 388 neonati sono stati inclusi in un periodo di 8 mesi nel 2005, il che rapprensenta 10436 giornipaziente. L’età gestazionale mediana era di 33,7 settimane di amenorrea (SA) (24-41) ed il peso mediano alla nascita era di 1 890 g (485-5 050). Quindici percento dei pazienti erano small for gestational age (SGA). La durata mediana del ricovero era di 14 giorni (0-223). Diciasette pazienti sono deceduti durante il periodo di studio. Incidenza, gravità e prevenibilità degli eventi iatrogeni Tra i 388 neonati ricoverati, 116 sono stati affetti da almeno uno EI. In 56 di questi 116 pazienti è stato riscontrato più di uno EI. In tutto 267 eventi sono stati dichiarati, l’incidenza essendo di 25,6 EI per 1 000 giorni-paziente. Un terzo degli EI erano evitabili (8,8 per 1 000 giorni-paziente). Un terzo degli EI erano gravi (7,6 per 1 000 giorni-paziente), ed i EI severi erano meno fre- Vol. 40 - N. 2 TABELLA II. — Gravità ed evitabilità delle varie categorie di eventi iatrogeni osservati in neonatologia. a2 EI evitabili n (%) EI evitabili e gravi n (%) 5 (13.1) 49 (79) 13 (34.2) 9 (14.5) 2 (40) 6 (12.2) 8 (23.5) 19 (55.9) 4 (50) 5 (5.3) 9 (34.6) 0 (0) 78 (30) a 32 (34) 17 (65.4) 1 (9) 91 (34.4) a 5 (100) 3 (33.3) 0 (0) 20 (26) EI non classificati. Tratto da ref 8, con autorizzazione. quentemente evitabili che gli EI minori (26% vs 38%) (Tabella I). La Tabella II rappresenta la gravità e la prevenibilità degli EI secondo il loro tipo. Gli EI cutanei e le infezioni nosocomiali sono i più frequenti. Le infezioni nosocomiali e gli EI respitarori sono i più gravi; gli EI respiratory e gli EIF sono più frequentemente evitabili; in particolare, 50% degli EIF sono evitabili. Tra gli EI vascolari, l’otturazione dell’accesso vascolare e la trombosi sono i più frequenti. Lo stravaso della soluzione perfusa si è realizzato in 7/8 casi in presenza di un catetere venoso per più di tre settimane in un bambino di basso peso alla nascita. Più di 5% dei pazienti hanno subito un errore di medicazione. I più frequenti EM riguardano la somministrazione del farmaco, in particolare nella programmazione delle pompe elettriche di infusione vascolare (consistendo frequentemente nella molteplicazione per 10 del flusso di perfusione prescritto). Spesso si tratta di somministrazione di farmaci sedativi o inotropici/vasocostrittori. Gli EI cutanei riguardano il 24% dei pazienti. Le lesioni cutanee da catetere venoso periferico o dovute alle protesi di supporto respiratorio (in particolare CPAP) sono state le più frequenti. Fattori di rischio di EI In queste studio, la bassa età gestazionale ed il basso peso alla nascita sono significativamente associati agli EI (P<0,0001). L’odds ratio (OR) degli EI nei prematuri di età gestazionale inferiore a 28 settimane di GASLINI 121 LIGI MIGLIORAMENTO CONTINUO DELLE CURE IN NEONATOLOGIA Figura 1. — Il modello del “formaggio svizzero” (secondo Reason, adattato), rappresenta il rischio di evento avverso grave creato dalla combinazione di errori ed insufficienze con vari livelli di gravità. amenorea, comparati ai neonati a termine, e di 24,1 (intervallo di fiducia [IF] 10-57,6, P<0,0001). I pazienti che subiscono un EI hanno una durata superiore di ricovero, di esposizione ad un catetere venoso centrale od ad un’assistenza respiratoria. Nel caso di peso alla nascita inferiore a 1 500 g, un Clinical Risk Index for Babies (CRIB) score elevato è associato ad un incidenza superiore di EI. Dopo aggiustamento da analisi con regressione logistica, il peso alla nascita inferiore a 1 250 g (OR=5,2; IF: 2-13,7; P=0,0004) e la durata di ricovero (OR=1,04; IF 1,02-1,06; P<0,0001) sono i fattori associati con la evenienza di un EI. Insegnamenti ed azioni correttive Organizzazione dei sistemi di monitoraggio degli EI Il reporting ed il monitoraggio degli EI nelle unità operative è utile in quanto permette l’organizzazione di azioni correttive. La qualità della raccolta dati è quindi primordiale, ed impone l’uso di un sistema prospettico 12, 13, rigoroso e perenne. L’esaustività del reporting e la documentazione degli EI nelle banche dati amministrative sono in effetti insufficienti ed in particolare gli EI minori o le defaillances senza danno al paziente solitamente non sono dichiarati. 122 L’organizzazione del programma di gestione del rischio iatrogeno a livello della stessa unità operativa offre i vantaggi, comparato ai sistemi in vigore a livello dell’intera istituzione, di una migliore adeguatezza alla natura dell’attività assitenziale, ai fabbisogni ed agli obbiettivi della struttura, e di paragoni pertinenti con dati storici o, in una strategia di benchmarking, con altri centri coinvolti nella stessa disciplina. In particolare il campo di copertura del rischio, e le definizioni degli eventi da riportare sono cosi adattati alle problematiche percepite dal management e dalle equipe della stuttura stessa. In particolare la presa in conto degli eventi minori, o dei near miss, permette di identificare sintomi che, se ripetuti indicano un errore nel sistema 14. Con tali definizioni, incidenze fino a 45 incidenti per 100 ricoveri neonatali, o 74 per 100 pazienti sono in effeti ritrovate. In effetti, la segnalazione dei eventi considerati minori e dei eventi evitati fa parte di un approccio sistematico che permette di ridurre il rischio di evento avverso grave dovuto alla combinazione di più errrori o insufficienze minori, una sequenza che spesso accade nei fallimenti dei sistemi funzionali (Figura 1). Il reporting viene inoltre migliorato dall’inserzione, nei documenti stessi di sorveglianza del paziente, accanto al suo letto, di un documento facilmente accessibile, alla presenza del quale possono abituarsi tanto le equipe mediche ed infermieristiche, che i genitori dei pazienti. La menzione sul documento, oltre ai dati descrittivi del paziente ed allo spazio per gli eventuali EI riscontrati, di una lista di EI tipici, non limitativa ma funzionante come trigger 15, consente di migliorare l’esaustività del reporting. Per ottenere un risultato consistente, rimane necessario un impegno dell’intera equipe assistenziale ed una preparazione adeguata, con l’apoggio metodologico di una struttura esterna alla divisione neonatale, dedicata alla gestione della qualità nell’istituzione. Questo significa una disponibilià in termini di tempi di lavoro. In effetti, la definizione degli obiettivi, la comprensione e l’adesione al programma di miglioramento continuo della qualità da parte dell’insieme del personale, necessitano un lavoro preparatorio lungo e rigoroso, il quale impone un coinvolgimento collettivo sin dall’inizio nel progetto. Questo procedimento è necessario alla creazione di un sentimento di fiducia da parte del personale assistenziale, nell’utilità del programma, nel suo carattere non punitivo, ed alla sua appropriazione del programma. Il GASLINI Agosto 2008 MIGLIORAMENTO CONTINUO DELLE CURE IN NEONATOLOGIA LIGI personale assistenziale, invece di essere messo a disagio, puo trovare una valorizzazione nel miglioramente della qualità del servizio che presta ai pazienti. Un tempo necessario allo svolgimento di una curva di apprendimento (tempo durante il quale il reporing degli EI è crescente, fino ad un “plateau” deve essere cosi consentito, prima del reale inizio del programma 8, 16. Il coinvolgimento di una struttura esterna (nel caso del presente lavoro, la “Cellule d’Evaluation Medicale” dell’istituzione di riferimento), permette, oltre l’apporto metodologico, di mantenere l’imparzialità necessaria nell’organizzazione e nella raccolta e l’interpretazione dei dati , e permette un audit duraturo. Azioni correttive, programma di miglioramento continuo della qualità I dati provenienti dalla nostra esperienza dimostrano che gli EI sono frequenti in neonatologia, e soprattutto che un terzo degli EI sono gravi, ed un terzo sono evitabili. Benché la proporzione degli EI evitabili sia inferiore nella popolazione neonatologica rispetto a quella osservata nelle popolazioni adulte (dal 40% al 60%), molti aspetti delle cure intensive neonatali risultano migliorabili da un’azione correttiva. Nei neonati, gli EI evitabili sono in particolare respiratori, come la estubazione involontaria 14, 17, 18, o legati all’uso di farmaci. Gli errori di medicazione sono infrequentemente seguiti da effetti avversi. Sembra tipico l’errore consistente nel programmare una pompa di perfusione vascolare con un valore che moltiplica la dose di un fattore dieci, date le caratteristiche di questi dispositivi 5, 19-21. Una parte importante degli EI è dovuta alle infezioni nosocomiali, in particolare con porta d’entrata vascolare. Cio è in relazione con il fatto che il rischio di EI in neonatologia è proporzionale alla durata del ricovero, quindi all’esposizione a una protesi invasiva, in particolare catetere centrale, o tubo tracheale. L’utilità del monitoraggio continuo degli EI risiede nell’identificazione di EI evitabili, di frequenza sufficiente da potere generare una azione correttiva. Questo approccio consiste nell’informazione periodica delle equipe sul valore di vari indicatori di qualità, tra i quali è inclusa l’incidenza dei vari EI, tramite uno strumento “di bordo” sintetico, e nella presa in conto dalle stesse equipe degli indicatori segnati in rosso. Oltre alla reazione correttiva spontanea indivi- Vol. 40 - N. 2 duale, il gruppo di lavoro si riunisce periodicamente per analizzare le cause ed esaminare le azioni possibili per ridurre l’incidenza di uno o più EI la cui incidenza sembra anormale. L’analisi della causa è particolarmente importante per distinguere le cause spesso multiple in atto, le cui tre origini principali risiedono nel sistema stesso, nei fattori umani e nel contesto ambientale 22. Le azioni correttive si traducono in cambiamenti di protocolli di cura o di organizzazione, o nella preparazione e l’adozione di un protocollo supplementare. L’azione è poi seguita da una fase di valutazione dell’applicazione di una risoluzione del problema, con gli stessi marker periodici. L’incidenza degli EI nella nostra esperienza si è cosi ridotta significativamente, dal 69% ad approssivamente il 50% dei ricoveri, mentre la loro severità è diminuita di un terzo (Ligi et al., dati non pubblicati). Queste costatazioni confortano il concetto del circolo virtuoso della qualità, il quale viene costituito dal ruotamento infinito tra l’identificazione e la valutazione quantitativa di un problema, l’azione correttiva, ed una nuova valutazione. Il monitoraggio continuo degli EI è uno dei vari aspetti considerati dai possibili programmi di miglioramento continuo della qualità delle cure in neonatologia. Ad esempio, il programma in atto nella nostra divisione include cosi, oltre all’azione sugli EI e le infezioni nosocomiali, un’azione sulla cura del dolore, l’informazione e la soddisazione dei genitori dei pazienti, la comunicazione nella divisione, l’aggiornamento continuo dei protocolli medici ed infermieristici. Questi programmi sono basati su un’organizzazione collettiva interna o esterna, delle varie tappe della “ruota” della qualità rappresentate in Figura 2. Sono uno strumento di collaborazione e di valorizzazione dell’attività dei medici, dei curanti di ogni categoria, e dell’insieme del personale di una divisione. Contribuiscono a creare un’atmosfera positiva anche per i genitori dei pazienti, e relazioni basate sul rispetto, permessa da una certa umiltà davanti all’errore, e la costruttività. Conclusioni Creare un ambiente sicuro per i pazienti più vulnerabili, come quelli di neonatologia, è uno scopo ambizioso, il quale richiede costanza, perseveranza e collegialità. Merita di essere uno scopo prevalente, e GASLINI 123 LIGI MIGLIORAMENTO CONTINUO DELLE CURE IN NEONATOLOGIA Figura 2. — La ruota di Deming, circolo virtuoso di miglioramento della qualità, ed i procedimenti organizzativi del programma. di essere organizzato al livello stesso dell’unità operativa. Procura comunque ampie soddisfazioni dalla qualità raggiunta, offerta come diretto beneficio al paziente, oltre al riconoscimento di un miglioramento del governo clinico. I programmi di miglioramento della qualità ci sembrano potere essere considerati alla pari delle attività di ricerca clinica o translazionale, nel contribuire ad un progresso rapidamente percepibile, tanto dal paziente, che dai curanti e dalle istituzioni. Bibliografia 1. Kohn L, Corrigan J, Donaldson M. To Err is human: building a safer health system: Washington, DC: National Academy Press; 1999. 2. Ramachandrappa A, Jain L. Iatrogenic disorders in modern neonatology: a focus on safety and quality of care. Clin Perinatol 2008;35:134. 3. Woods D, Thomas E, Holl J, Altman S, Brennan TA. Adverse events and preventable adverse events in children. Pediatrics 2005;115:15560. 4. Brennan TA, Leape LL, Laird NM, Hebert L, Localio AR, Lawthers AG et al. Incidence of adverse events and negligence in hospitalized patients. N Engl J Med 1991;324:370-6. 5. Kaushal R, Bates DW, Landrigan C, McKenna KJ, Clapp MD, Federico F et al. Medication errors and adverse drug events in pediatric inpatients. JAMA 2001;285:2114-20. 6. Leape LL, Brennan TA, Laird N, Lawthers AG, Localio AR, Barnes BA et al. The nature of adverse events in hospitalized patients. N Engl J Med 1991;324:377-84. 7. Leape LL. Reporting of adverse events. N Engl J Med 2002;347:1633-8. 8. Ligi I, Arnaud F, Jouve E, Tardieu S, Sambuc R, Simeoni U. Iatrogenic events in admitted neonates: a prospective cohort study. Lancet 2008;371:404-10. 9. Kanter D, Turenne W, Slonim A. Hospital-reported medical errors in premature neonates. Pediatr Crit Care Med 2004;5:119-23. 10. Bates D, Cullen D, Laird NM, Petersen L, Small S, Leape LL. Incidence of adverse drug events and potential adverse drug events. JAMA 1995;274:29-34. 11. Garner J, Jarvis W, Emori T, Horan T, Hughes J. CDC Definitions of nosocomial infections. Am J Infect Control 1988;16:128-40. 12. Capuzzo M, Nawfal I, Campi M, Valpondi V, Verri M, Alvisi R. Reporting of unintended events in an intensive care unit: comparison between staff and observer. BMC Emergency Medicine 2005;5:3. 13. Michel P, Quenon J, De Sarasqueta A, Scemama O. Comparison of three methods fro estimating rates of adverse events and rates of preventable adverse events in acute care hospitals. BMJ 2004;328:1-5. 14. Frey B, Kehrer B, Losa M, Berweger L, Micallef J, Ebenberger M. Comprehensive critical incident monitoring in a neonatal-pediatric intensive care unit: experience with the system approach. Intensive Care Med 2000;26:69-74. 15. Sharek PJ, Horbar JD, Mason W, Bisarya H, Thurm CW, Suresh G et al. Adverse events in the neonatal intensive care unit: development, testing, and findings of an NICU-focused trigger tool to identify harm in north american NICUs. Pediatrics 2006;118:1332-40. 16. Larsen G, Parker H. Patients’ safety: think and act locally. Lancet 2008;371:364-5. 124 GASLINI Agosto 2008 MIGLIORAMENTO CONTINUO DELLE CURE IN NEONATOLOGIA LIGI 17. Veldman A, Trautschold T, Weib K, Bauer K. Characteristics and outcome of unplanned extubation in ventilated preterm and term newborns on a neonatal intensive care unit. Paediatr Anaesth 2006;16:968-73. 18. Sadowski R, Dechert R, Bandy K et al. Continuous quality improvement: reducing unplanned extubations in a pediatrics intensive care unit. Pediatrics 2006;114:628-32. 19. Raju T, Thornton J, Kecskes S, Perry M, Feldmann S. Medication errors in neonatal and paediatric intensive-care units. Lancet 1989;12:3746. 20. Simpson J, Lynch R, Alroomi L. Reducing medication errors in the neonatal intensive care unit. Arch Dis Child Fetal Neonatal Ed 2004;89:F480-F2. 21. Chappell K, Newman C. Potential tenfold drug overdoses on a neonatal unit. Arch Dis Child Fetal Neonatal Ed 2004;89:F483-F4. 22. Tourgeman-Bashkin O, Shinar D, Zmora E. Causes of near misses in critical care of neonates and children. Acta Paediatr 2008;97:299303. Vol. 40 - N. 2 GASLINI 125 FARMACOLOGIA PEDIATRICA GASLINI 2008;40:127-31 Principi di farmacologia applicati alla pediatria: assorbimento, distribuzione, metabolismo, ed escrezione (ADME) dei farmaci nei bambini O. DELLA CASA ALBERIGHI Farmacologa Clinica, Direzione Scientifica, IRCCS G. Gaslini, Genova S in dall’introduzione della normativa in materia, i farmaci ad uso pediatrico sono stati studiati per gli aspetti di farmacocinetica (PK) e farmacodinamica (PD) nella popolazione pediatrica, con conseguenti importanti cambiamenti ed aggiornamenti della posologia e dello stato registrativo, e con il miglioramento della sicurezza del loro uso nei bambini. Il termine PK si riferisce ai processi con cui il farmaco viene assorbito, distribuito, metabolizzato ed escreto dall’organismo, espressi dalle relative misure di assorbimento (A), distribuzione (D), ed escrezione (E) quali l’area sotto la curva (area under the curve =AUC) della concentrazione plasmatica /sierica del farmaco nel tempo (esposizione), la concentrazione di picco (Cmax) ed altre derivate (clearance, emivita, volume di distribuzione). Un farmaco puó essere eliminato sia attraverso il metabolismo (M) con uno o più metaboliti attivi o inattivi, che attraverso un’escrezione del farmaco non modificato. L’insieme dei processi di ADME controlla l’esposizione sistemica al farmaco ed ai suoi metaboliti a partire dalla sua somministrazione. L’esposizione sistemica al farmaco viene usata per mettere in correlazione la dose sia con l’efficacia che con gli effetti collaterali. Il termine PD si riferisce al meccanismo d’azione del farmaco nell’organismo ed alla relazione tra la concentrazione del farmaco ed i suoi effetti sia positivi che negativi. Le misure di PD consentono una migliore comprensione delle relazioni fra dose/concentrazione e risposta di un farmaco per una possibile estrapolazione di tali informazioni dagli adulti alla popolazione in età pediatrica. È comunque necessario studiare gli aspetti di PK e PD nelle diverse fasce di età pediatriche, dato i rapidi cambiamenti nei processi fisiologici che governano l’ADME, e quindi gli effetti di un farmaco: ad esempio, mentre la funzionalità renale è paragonabile a quella dell’adulto a partire dall’anno di età, si raggiunge una maturità delle funzioni alveolari ai due anni di età, di quelle cerebrali e riproduttive con l’adolescenza. Per la registrazione pediatrica di un farmaco è necessario presentare i risultati di PK, sicurezza ed efficacia, come indicato nello US Pediatric Exclusivity Act e nella Pediatric Rule. Considerazioni generali di metodo per la conduzione di studi di PK in pediatria sia per farmaci che per agenti biologici, che consentono di minimizzare il numero dei soggetti sperimentali, sono riportate nelle linee guida della FDA per l’industria farmaceutica 1, con indicazione delle informazioni farmacocinetiche necessarie alla selezione di una dose di farmaco appropriata per la popolazione pediatrica cui verrà somministrato il farmaco (Figura 1): 1) avendo assunto che sia la malattia da trattare che la relazione dose-risposta del farmaco in studio, e quindi l’esito della terapia, siano comparabili negli adulti e nei bambini, si possono estrapolare i dati di efficacia dall’adulto e limitarsi a condurre studi sulla PK e sicurezza del farmaco nei bambini delle fasce di età di sua applicazione; 2) si possono estrapolare inoltre dati di efficacia dai bambini più grandi a quelli di età inferiore se sussista la comparabilità della malattia e degli effetti della terapia, limitandosi a studiare la PK e sicurezza nei bambini delle fasce di età di applicazione del farmaco; 3) nel caso il meccanismo della malattia sia simile nell’adulto e nel bambino, ma non siano note le concentrazioni ematiche efficaci, si ritengono sufficienti Autore di contatto: O. Della Casa Alberghi, Farmacologa Clinica, Direzione Scientifica, IRCCS G. Gaslini, Genova. Vol. 40 - N. 2 GASLINI 127 DELLA CASA ALBERIGHI PRINCIPI DI FARMACOLOGIA APPLICATI ALLA PEDIATRIA Selezione della dose di un farmaco (pazienti in età pediatrica vs adulti) – la progressione della malattia è simile? – la risposta all’intervento è simile? Se la risposta è sì, in entrambi i casi No • Condurre studi di farmacocinetica • Condurre studi relativi alla sicurezza e all’efficacia del farmaco* La risposta dose - reazione (C-R) al farmaco è da considerare uguale nei pazienti in età pediatrica e negli adulti? No Sì No Condurre studi di farmacocinetica per ottenere risultati simili a quelli che si ottengono con la somministrazione agli adulti Si può usare farmacodinamica** per predire l’efficacia del farmaco? Sì • Condurre studi di farmacocinetica e dinamica per ottenere dei valori di C-R • Condurre studi di farmacocinetica per ottenere concentrazioni target basate sul C-R • Condurre studi per determinare la sicurezza del farmaco Figura 1. — Percorso decisionale per lo svolgimento di studi clinici in ambito pediatrico (da http://www.fda.gov/cder/guidance/5341fnl.htm). la valutazione della PK/PD e sicurezza nei bambini delle fasce di età di applicazione del farmaco; 4) in caso di differenze nella dose-risposta tra adulti e bambini, i risultati di efficacia clinica nei bambini devono essere prodotti ad hoc; 5) per i medicinali attivi per uso topico, dove lo studio della PK non si applica, l’estrapolazione tra diverse popolazioni di pazienti si basa sui dati di PD; 6) per registrare il farmaco in una nuova indicazione, o qualora il meccanismo della malattia sia differente negli adulti in confronto ai bambini (ad esempio, l’artrite reumatoide dell’adulto e l’artrite idiopatica giovanile), devono essere condotti studi di efficacia clinica nei bambini. A fini registrativi, un piano di sviluppo clinico pediatrico deve specificare quali età pediatriche debbano essere studiate per la PK in base alle caratteristiche del farmaco ed all’indicazione di applicazione (Tabella I). 128 Le classi di età definite dalle diverse autorità regolatorie differiscono tra le varie aree geografiche (Giappone, Nord America, Europa). Per la generalizzabilità delle informazioni, il disegno dello studio deve essere flessibile ad includere tali richieste per i diversi sottogruppi di età, oltre ad ulteriori strati in una fascia di età, ad esempio quella dei bambini, per evitare la variabilità connessa alla diversa maturità metabolica e fisiologica, alle modalità di presentazione della malattia e alla frequenza e profilo differente degli eventi avversi. Il mancato riconoscimento di influenze maturative, fisiologiche e metaboliche sulla PK di un farmaco possono infatti portare a differenti effetti collaterali, condizionti la scelta della posologia per fascia di età. Nella popolazione pediatrica, il processo di crescita implica variazioni funzionali e strutturali in molti organi e sistemi (sistemi nervoso centrale per le funzioni sensitive, motorie, di apprendimento e memoria in sviluppo fino all’adolescenza; renale già matu- GASLINI Agosto 2008 PRINCIPI DI FARMACOLOGIA APPLICATI ALLA PEDIATRIA DELLA CASA ALBERIGHI TABELLA I. — Comparazione della efficacia preventiva tra idrolisati estensivi e parziali (latti HA). Classificazione ICH-E11 FDA EMEA Prematuro Neonato a termine Infante, lattante Bambino Adolescente Nato pretermine 0-27 giorni 28 giorni-23 mesi 2-11 anni 12 fino a 16-18 anni Categoria non contemplata Dalla nascita al primo mese 1 mese - 2 anni 2 -12 anni 12 -16 anni Neonato <36 settimane di gestazione 0-27 giorni 28 giorni-23 mesi 2-11 anni 12-17 anni EMEA: European Medicines Evaluation Agency; FDA: Food and Drug Administration; ICH: International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use. ro all’anno di età; polmonare in maturazione nel corso dei primi due anni; riproduttivo, immunitario, scheletrico in sviluppo fino all’adolescenza). La crescita e lo sviluppo influenzano i processi di ADME con conseguenti variazioni nei parametri di PK quando confrontati a quelli degli adulti per un dato farmaco, come esemplificato nei paragrafi a seguire. TABELLA II. — Confronto della biodisponibilità di farmaci nei neonati rispetto ai bambini ed agli adulti. Assorbimento Farmaco Assorbimento orale Acetaminofene/Paracetamolo Ampicillina Diazepam Digoxina Fenitoina Fenobarbital Penicillina G Sulfonamidi Diminuito Aumentato Normale Normale Diminuito Diminuito Aumentato Normale Modificato da Koren 2007. I processi maturativi dell’età evolutiva che possono influenzare l’assorbimento includono le variazioni nell’acidità gastrica (da molto basica a molto acida durante il primo mese), i tempi di svuotamento gastrico ed intestinale (ritardato nei neonati e con valori simili a quelli degli adulti raggiunti entro i 6-8 mesi), la superficie di area corporea (maggiore nei bambini) al sito di assorbimento (l’assorbimento percutaneo è aumentato nei in neonati pretermine), il sistema degli enzimi gastrointestinali per farmaci attivamente trasportati attraverso la mucosa gastrontestinale, la permeabilità gastrointestinale e la funzionalità biliare. Analogamente, le variazioni maturative nella pelle, muscoli, tessuti grassi, per esempio nel contenuto in acqua e nello stato di vascolarizzazione, possono influire sull’assorbimento di farmaci somministrati per via intramuscolare, sottocutanea o percutanea. La Tabella II mostra il confronto dell’assorbimento orale (biodisponibilità) di farmaci di comune impiego nel neonato rispetto ai bambini ed agli adulti. Distribuzione La distribuzione di un farmaco può essere influenzata dalle variazioni nella composizione corporea, quali il Vol. 40 - N. 2 contenuto totale in acqua (70-75% nei bambini rispetto al 50-60% negli adulti); ed in tessuto adiposo (il contenuto in massa grassa è più elevato negli infanti e pari al 25%, riducendosi nei bambini al 10%); tali variazioni non sono necessariamente proporzionali a quelle del peso corporeo. L’elevato volume di acqua extracellulare durante il primo anno di vita (pari al 45% del peso corporeo nei neonati rispetto al 20% negli adulti) può essere determinante per la concentrazione del farmaco al sito recettoriale di farmaci idrosolubili, quali gli antibiotici aminoglicosidici. Tali variazioni di legame ai tessuti ed il legame alle proteine plasmatiche (ridotto nei neonati) derivanti dalla crescita e sviluppo possono influenzare la distribuzione dei farmaci. Essendo il farmaco non legato quello farmacologicamente attivo, ne deriva un aumentato effetto del farmaco ed potenziali eventi avversi nonostante la concentrazione totale (libero e legato) sia normale o ridotta. Ad esempio, il diazepam quando somministrato ad un neonato pretermine in dose aggiustata per il peso corporeo può portare ad una esposizione più elevata di 5 volte dovuta alla più elevata quota di farmaco libero per ridotto legame con l’albumina, non subitamente compensato da una più rapida eliminazione. GASLINI 129 DELLA CASA ALBERIGHI PRINCIPI DI FARMACOLOGIA APPLICATI ALLA PEDIATRIA TABELLA III. — Confronto nel neonato e nell’adulto delle emivite di eliminazione (T1/2) di vari farmaci. Farmaco Età neonatale Neonati T1/2 (h) Acetaminofene/paracetamolo 2.2-5 0.9-2.2 — — 25-100 40-50 Diazepam Digoxina Adulti t1/2 (h) — 60-70 30-60 Fenobarbital 0-2 giorni 5-15 giorni 1-30 mesi 200 100 50 64-140 — — Fenitoina 0-2 giorni 5-15 giorni 14-50 giorni 80 18 6 12-18 — — Salicilati — 4.5-11 10-15 Neonato Bambino 13-26 3-4 5-10 Theophylline Metabolismo Il metabolismo dei farmaci ha luogo maggiormente nel fegato, ma anche nel sangue, nella parete gastrointestinale, nei reni, polmoni e cute. Durante il periodo evolutivo, la capacità metabolica può influire sia sull’assorbimento che sull’eliminazione, in misura dei processi metabolici intestinali od epatici coinvolti, per diminuita clearance e prolungata emivita. Isoforme del citocromo P450 (reazioni di fase 1 di ossidazione e coniugazione), ed in parte gli enzimi di glucuronidazione, coniugazione con solfati e metilazione (reazioni di fase 2), sono immaturi alla nascita (funzionando al 50-70% rispetto all’adulto), aumentano rapidamente durante il primo mese, quindi diminuiscono all’anno di età, e tendonono ad essere più efficienti nei bambini che negli adulti. L’immaturità metabolica del neonato predispone ad eventi avversi per i farmaci metabolizzati dal fegato. In Tabella III si illustrano le differenze tra neonati ed adulti nella durata dell’emivita di vari farmaci, ed in particolare come l’emivita di fenobarbital e fenitoina diminuiscano nel corso dei primi giorni dalla nascita. La maturazione enzimatica già a livello fetale nei casi in cui la madre assuma farmaci induttori enzimatici, quali il fenobarbital, va considerata poi in età neonatale, in cui la capacità metabolica per certi farmaci sarà maggiore rispetto all’atteso, con conseguente minore effetto terapeutico e concentrazioni ematiche inferiori quando venga somministrata la dose usuale per il neonato. 130 TABELLA IV. — Linee guida posologiche per la teofillina. Età Posologia Nato a termine-1 mese 0-2 mesi 2-6 mesi 46-12 mesi 1-9 anni 9-12 anni 12-16 anni Adulti 2-4 mg/kg/die suddiviso q8-12 h (apnea) 3-6 mg/kg/die suddiviso q8h 6-15 mg/kg/die suddiviso q6h 15-22 mg/kg/die suddiviso q6h 22 mg/kg/die suddiviso q6h 20 mg/kg/die suddiviso q6h 18 mg/kg/die suddiviso q6h 13 mg/kg/die suddiviso q6h A titolo esemplificativo, sono riportate in Tabella IV le linee guida posologiche della teofillina condizionate dalle variazioni del metabolismo epatico per la progressiva maturazione del citocromo CYP1A2. I processi metabolici di coniugazione hanno ricevuto storicamente meno attenzione rispetto al quelli del citocromo P450. Un gruppo importante di reazioni di coniugazione sono catalizzate dalle 5’ uridina-difosfato (UDP)-glucuronosiltransferasi (UGTs), di cui sono noti almeno 10 differenti isoforme. Le UGTs non sono soltanto coinvolte nel metabolismo di molti farmaci quali morfina, acetaminofene/ paracetamolo, ma anche nella biotrasformazione di importanti substrati endogeni (bilirubina, etinilestradiolo) e diversi xenobiotici. Una mancata glucuronidazione della bilirubina contribuisce alla iperbilirubinemia del neonato. Eventi avversi gravi associati alla somministrazione di cloramfenicolo nel neonato si spiegano con le importanti variazioni maturative della attività delle UGTs. Escrezione e funzionalità renale L’escrezione per via renale dei farmaci è controllata dalla filtrazione glomerulare (tasso di filtrazione glomerulare: 2-4 ml/min nei neonati a termine, 8-20 ml/min durante i primi 2-3 giorni; i livelli dell’adulto sono raggiunti fra i 6 ed i 12 mesi di età); dalla secrezione tubulare (la secrezione di anioni organici deboli è inizialmente bassa; raddoppia nel corso della prima settimana; aumenta di 10 volte nel primo anno di età); e dal riassorbimento tubulare. Dato che tali processi di escrezione maturano in tempi differenti nella popolazione pediatrica, l’età influenza l’esposizione sistemica di farmaci con prevalente eliminazione per via renale (in periodo neonatale, l’esposizione di GASLINI Agosto 2008 PRINCIPI DI FARMACOLOGIA APPLICATI ALLA PEDIATRIA DELLA CASA ALBERIGHI TABELLA V. — Estrapolazione della dose dall’adulto al bambino per le diverse classi di età. Peso corporeo (kg) Età approssimata Superficie corporea (m2) Percentuale della dose dell’adulto 3 6 10 20 30 40 50 60 70 Neonato 3 mesi 1 anno 5,5 anni 9 anni 12 anni 14 anni adulto adulto 0,2 0,3 0,45 0,8 1,0 1,3 1,5 1,7 1,76 12 18 28 48 60 78 90 102 103 Nota esemplificativa: se la dose per un adulto è pari a 1 mg/kg, la dose per un infante di 3 mesi dovrebbe essere pari a 0,18 mg/kg, cioè pari ad una dose totale di 1,1 mg. Modificato da Koren 2007. penicilline, antibiotici aminoglicosidici quali kanamicina, gentamicina, neomicina, streptomicina, e digoxina possono risultare aumentate per ridotta escrezione renale). Analoghe considerazioni si applicano alla diversa maturazione di altre vie escretorie, quali quella biliare e polmonare. Nei lattanti, viceversa, si possono riscontrare per meccanismo non noto ridotte emivite dei farmaci rispetto ai bambini ed agli adulti, in seguito ad aumentati eliminazione renale e metabolismo (ad esempio, la dose/kg di digoxina da somministrare nei lattanti è piu elevata che negli adulti). Farmacocinetica e posologia dei farmaci Il tipo di studi clinici da condurre nei bambini e il novero delle informazioni necessarie alla registrazione di un prodotto medicinale per uso pediatrico dipendono dalla classe del farmaco e dalle informazioni già disponibili. L’insieme degli studi deve portare alla conoscenza dell’ADME di un farmaco nei soggetti pediatrici di varie classi di età. Le concentrazioni ematiche di un farmaco forniscono le basi per la messa a punto della posologia, in particolare per quei farmaci le cui con- Vol. 40 - N. 2 centrazioni ematiche/ sieriche/plasmatiche possono essere correlate con gli effetti farmacologici e terapeutici. L’iniziale titolazione della dose può essere stimata in base al peso o alla superficie corporea, estrapolando le informazioni dagli adulti per le varie classi di età (Tabella V), non essendo possible effettuare studi di distribuzione con l’impiego di materiale radiomarcato. L’identificazione e quantificazione dei principali metaboliti di un farmaco consentono di paragonare il profilo di eliminazione a quello negli adulti. Il riscontro di maggiori differenze costituisce un segnale anticipatorio per possibili eventi avversi e deve portare alla caratterizzazione del diverso profilo metabolico del soggetto in età evolutiva. Il legame con le proteine plasmatiche deve essere caratterizzato almeno nei neonati e negli infanti. Conclusioni In sintesi, sin dall’introduzione di nuove normative, i farmaci destinati alla prescrizione pediatrica devono essere studiati per la loro farmacocinetica e farmacodinamica per garantirne la sicurezza d’impiego. Letture consigliate 1. FDA: http://www.fda.gov/cder/pediatric/index. htm. http://www.fda.gov/cder/guidance/1970dft.pdf http://www.fda.gov/cder/guidance/5341fnl.htm 2. EMEA: http://www.emea.europa.eu/htms/human/paediatrics/inventory.htm — Linee Guida ICH: http://www.ich.org/cache/ compo/276-254-1.html — E4: Dose-Response Information to Support Drug Registration — E6: Good Clinical Practice: Consolidated Guidelines — E8: General Consideration for Clinical Trials — E10: Choice of Control Group and Related Issues in Clinical Trials — E11: Clinical Investigation of Medicinal Products in the Pediatric Population. GASLINI 131 QUIZ RADIOLOGICO GASLINI 2008;40:133-4 Patologia infiammatoria acuta M. B. DAMASIO 1, S. RENNA 2 1Radiologia, Istituto Giannina Gaslini, Genova 2Pronto Soccorso Medico e Medicina d'Urgenza, Istituto Giannina Gaslini, Genova I l caso riguarda un neonato di 25 giorni con febbre, tosse e tachipnea. Il radiogramma standard del torace dimostra una massiva opacità a destra (con broncogramma d’aria e shift omolaterale del mediastino) e aumento di volume a sinistra (Figura 1). La proiezione laterale “cross table” esclude il pneumotorace (Figura 2). Qual è l’ipotesi più verosimile? Figura 1. — Il radiogramma standard del torace dimostra una massiva opacità a destra e aumento di volume a sinistra. Figura 2. — La proiezione laterale “cross table” che esclude il pneumotorace. Autore di contatto: M. B. Damasio, Radiologia, Istituto Giannina Gaslini, Genova, Italia. Vol. 40 - N. 2 GASLINI 133 DAMASIO PATOLOGIA INFIAMMATORIA ACUTA Patologia infiammatoria acuta Figura 3.— Il radiogramma dopo due giorni di trattamento (con parziale risoluzione del quadro) conferma la diagnosi. Le polmoniti al di sotto dei 2 anni: — sono di solito virali (parainfluenza, sinciziale, ADV): — L’iperinsufflazione/air trapping può essere il solo segno radiologico (bronchiolite) - Sono dovuti all’edema parietale e alla presenza del muco intrabronchiale associati alla elevata compliance delle pareti tracheo bronchiali. Concomitano essudato interstiziale, alveoli peribroncovascolari prossimali pieni di liquido, piccole atelettasie. — Il quadro radiologico è descritto in vari modi: - Ispessimento-[flou, cuffing]-infiltrazione peribroncovascolare, polmonite peribronchiale, polmonite interstiziale, infezione del tratto respiratorio inferiore…. — Le stesse cause possono determinare grandi atelettasie. La diagnosi differenziale comprende l’enfisema lobare congenito che di solito non si associa però ad atelettasie controlaterali e, talora, può essere ipotizzato all’ecografia prenatale; inoltre, la rarefazione vascolare nell’enfisema è maggiore. Anche l’agenesia polmonare (in particolare la lobare) può essere ipotizzata, ma nel nostro caso nell’opacità di destra si apprezza chiaramente un broncogramma d’aria. La tipicità del quadro può far evitare l’esecuzione di un’eventuale TC. Il radiogramma dopo due giorni di trattamento (con parziale risoluzione del quadro) conferma la diagnosi 1-5 (Figura 3). Bibliografia 1. 2. 3. 4. 5. 134 Bramson RT, Griscom NT, Cleveland RH. Interpretation of chest radiographs in infants with cough and fever. Radiology 2005;236:229. Coblentz C, Babcook C, Alton D, Riley B, Norman G. Observer variation in detecting the radiologic features associated with bronchiolitis. Invest Radiol 1991;26:115–8. Arthur R. Interpretation of the paediatric chest X-ray. Paediatr Respir Rev 2000;1:41-50. Leonard E, Swischuk. imaging of the newborn, infant, and young child. 5th ed.Philadelphia: Lippincott Williams & Wilkins; 2003. Slovis TL. Caffey's Pediatric Diagnostic Imaging. 11th ed.Philadelphia: Mosby-Elsevier; 2007. GASLINI Agosto 2008 QUIZ DERMATOLOGICO GASLINI 2008;40:135-6 Un’insolita placca al cuoio capelluto G. VIGLIZZO, O. NEMELKA, D. BLEIDL, C. OCCELLA Unità Operativa di Dermatologia, Istituto Giannina Gaslini, Genova P .S., bambino di 5 anni, perveniva alla nostra osservazione con una voluminosa placca del diametro di 4 cm e dello spessore di circa 1 cm in corrispondenza della regione temporale sinistra (Figura 1); erano presenti, inoltre, due chiazze più piccole parzialmente crostose e prive di capelli in regione occipitale e temporale destra. La superficie della lesione principale si presentava alopecica ed irregolare per la presenza di piccoli tragitti fistolosi, ricoperti da un essudato di tipo sanioso e da croste. La spremitura della lesione, estremamente dolorabile, determinava la fuoriuscita di gemizio ematico-puruloide con frammenti di peli. I pochi capelli residui si staccavano alla minima trazione. Era inoltre presente una significativa linfoadenopatia retroauricolare e sub-occipitale. La lesione in regione temporale era comparsa da 20 giorni ed era stata trattata, dal curante, dapprima con topici antivirali (acyclovir) e anti batterici (gentamicina+betametasone) nel sospetto di un’infezione erpetica impetiginizzata, successivamente con ceftriaxone intramuscolo (500 mg/die per 5 gg) senza alcun beneficio. In seguito alla comparsa di due nuove lesioni il bambino veniva visitato presso un centro ospedaliero di altra regione dove veniva instaurata, dopo diagnosi di impetigine, terapia con mupirocina topica e claritromicina per os per 7 gg. Il rapido e progressivo peggioramento del quadro clinico determinava infine il ricovero in DH presso la nostra UO per le indagini e cure del caso. Sono stati eseguiti esami ematici di base e l’esame microscopico diretto e colturale dei capelli in terreno di Agar-Sabouraud. Qual è la diagnosi? Figura 1. — Placca in corrispondenza della regione temporale sinistra. Figura 2. — Esame colturale (isolamento di Microsporum Canis-dermatofita zoofilo). Figura 3. — Completa risoluzione del quadro clinico. Autore di contatto: G. Viglizzo, Unità Operativa di Dermatologia, Istituto Giannina Gaslini, Genova, Italia. Vol. 40 - N. 2 GASLINI 135 VIGLIZZO UN’INSOLITA PLACCA AL CUOIO CAPELLUTO Kerion Celsi Nel nostro caso il quadro clinico caratteristico e l’esame microscopico diretto dei peli (presenza di ife e spore fungine), confermato poi dall’esame colturale (isolamento di Microsporum Canis-dermatofita zoofilo) (Figura 2), hanno permesso la diagnosi di Kerion Celsi. La terapia con griseolfulvina per os (20 mg/kg/die) e con crema contenente econazolo all’1% per 25 giorni, nonché la rimozione dei capelli parassitati determinava la completa risoluzione del quadro clinico (Figura 3). Il Kerion Celsi è una intensa forma infiammatoria di infezione da dermatofiti (miceti) generalmente zoofili (Microsporum Canis, Trichophhyton verrucosum, ecc.) che colpisce il cuoio capelluto, quasi esclusiva- mente nei bambini. Di solito esso si presenta con una o più placche di colorito rosso-vivo derivate dall’evoluzione infiammatoria, granulomatosa e suppurativa di una Tinea Capitis (infezione micotica del cuoio capelluto) sia per il potente stimolo immunogeno del micete causale sia per protratte terapie incongrue (antibiotici non specifici e cortisonici locali). Alla guarigione, tendenzialmente spontanea, seguono aree di alopecia permanente, se non si interviene rapidamente con mirata terapia antibiotica antifungina . È opportuno pertanto non sottovalutare le lesioni suppurative, crostose e pseudo-alopeciche del cuoio capelluto e, nel dubbio diagnostico, inviare il paziente presso centri di Dermatologia in grado di eseguire gli accertamenti necessari e le terapie specifiche; diagnosi ritardate possono causare, come sopra ricordato, vistosi ed inestetici esiti cicatriziali di alopecia cicatriziale. Bibliografia 1. 2. 3. 136 Ali S, Graham TA, Forgie SE. The assessment and management of Tinea capitis in children. Pediatr Emerg Care 2007;23:662-5. Aste N, Pinna AL, Pau M, Biggio P. Kerion Celsi in a newborn due to Microsporum canis. Mycoses 2004;47:236-7. Pomeranz AJ, Sabnis SS. Tinea capitis: epidemiology, diagnosis and management strategies. Paediatr Drugs 2002;4:779-83. GASLINI Agosto 2008
Scaricare