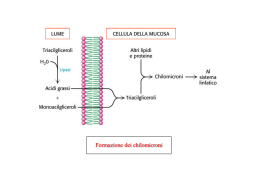
MODULO 4 – IL METABOLISMO DEI LIPIDI RICHIAMI SULLA CHIMICA DEI LIPIDI Introduzione I lipidi sono una classe di composti estremamente eterogenei per caratteristiche chimiche, ma accomunati dalla proprietà fisica dell’insolubilità in acqua e della solubilità in solventi organici. Infatti sono per lo più caratterizzati da una voluminosa porzione idrocarboniosa che ne fa molecole largamente o totalmente apolari. All’eterogeneità strutturale si associa anche lo svolgimento di funzioni molto diverse nel contesto degli organismi viventi. Alcuni (grassi ed oli) sono importanti fonti di energia, altri hanno prevalentemente compiti strutturali (fosfolipidi), alcuni agiscono da ormoni o ancora favoriscono l’assorbimento ed il trasporto delle sostanze nutritive. Obiettivi La lezione richiamerà gli aspetti fondamentali dei lipidi, soffermandosi sulle caratteristiche chimiche e fisiche dei lipidi maggiormente coinvolti nel metabolismo umano: (1) gli acidi grassi (2) i triacilgliceroli (3) i fosfolipidi (4) gli steroidi. Lipidi I lipidi sono un gruppo eterogeneo di macromolecole accomunate dalla proprietà di essere insolubili in acqua e solubili in solventi non polari. Comprendono una serie di composti molto diversi dal punto di vista chimico e suddivisibili in diverse categorie: (1) gli acidi grassi (2) i trigliceridi (3) i fosfolipidi (4) le prostaglandine (5) le cere (6) i terpeni (7) gli steroidi. Dal punto di vista biologico sono una fonte di energia importante per l’organismo, che può accumularne, quale riserva, quantità elevate nel tessuto adiposo, che agisce anche da isolante termico e meccanico. I lipidi svolgono anche altre funzioni importanti: sono componenti strutturali essenziali delle membrane biologiche ed alcuni di essi agiscono da ormoni. Acidi grassi Gli acidi grassi sono acidi monocarbossilici (gruppo funzionale –COOH) con una lunga catena alifatica, che può essere satura (senza doppi legami) o insatura (con doppi legami C=C). Sono abbondanti in natura, anche se per lo più non in forma libera, ma uniti tramite legami estere o ammidici ad altre molecole. La tabella evidenzia gli acidi grassi più abbondanti nei lipidi naturali: hanno almeno 10 o 12 atomi di carbonio e possono essere saturi o insaturi. Nel caso di acidi grassi insaturi, generalmente sono in configurazione cis, mentre rari sono quelli con configurazione trans. La nomenclatura ufficiale assegna un nome all’acido grasso in base alla lunghezza della catena alifatica; così se sono presenti 18 atomi di carbonio, si definirà acido ottadecanoico. Il nome verrà poi opportunamente variato in modo da indicare presenza e posizione di eventuali doppi legami (per esempio, acido cis-9-ottadecanoico,dove il numero 9 indica la posizione del primo carbonio coinvolto nel doppio legame). Esistono anche alcune abbreviazioni spesso utilizzate in luogo della nomenclatura estesa. Molto nota è quella che indica l’acido grasso con il numero di atomi di carbonio, seguito dal numero di doppi legami e dal simbolo ω e un altro numero che indica la distanza del doppio legame dall'atomo di carbonio terminale della catena alifatica (per esempio, Acido cis-9-ottadecanoico è abbreviato come 18:1 ω 9). La serie ω 3 degli acidi grassi è molto nota per i possibili effetti benefici sul metabolismo lipidico nell’uomo. Alla nomenclatura ufficiale IUPAC si associa spesso la nomenclatura classica, che assegna agli acidi grassi nomi diversi quali: acido stearico, acido palmitico, acido oleico, acido linoleico, acido linolenico. ACIDI GRASSI: Proprietà fisiche. Le proprietà fisiche degli acidi grassi sono determinate prevalentemente dalle caratteristiche (lunghezza, numero e tipo di doppi legami) della catena idrocarburica. La presenza del gruppo funzionale –COOH associato ad una catena alifatica, fa sì che queste molecole abbiano una testa polare, che può interagire con l’acqua, ed una porzione altamente idrofobica. Quanto più lunga è la porzione alifatica tanto maggiore è l’insolubilità in acqua. La presenza di una testa polare rende conto della tendenza degli acidi grassi a formare micelle in ambiente acquoso. Le micelle sono strutture praticamente sferiche, che espongono sulla superficie, a contatto con l’acqua, il gruppo carbossilico polare, mentre nascondono all’interno, lontano dall’acqua, la porzione alifatica ed idrofobica. Il numero degli atomi di carbonio nella catena influenza inoltre altre proprietà fisiche di queste molecole: dato che le interazioni deboli idrofobiche e di van der Waals aumentano all’aumentare della lunghezza della catena, anche i punti di fusione e di ebollizione seguono la stessa regola. La presenza di doppi legami, specie se in configurazione trans, influenza fortemente questi parametri fisici. Come evidenzia la figura, un doppio legame in configurazione trans provoca una netta curvatura nella catena alifatica, rendendo molto meno efficaci le interazioni idrofobiche intercatenarie: molecole insature (specie se in configurazione trans) avranno quindi punto di fusione molto più basso rispetto ad acidi grassi della stessa lunghezza, ma saturi. Così la temperatura di fusione: del 18:0 è circa 69°C, del 18:1 ω 9 è circa 13°C, di 18:2 ω 3 o ω 6 è inferiore a 0°C. Questo spiega perché gli oli vegetali, che contengono molti acidi grassi insaturi, sono liquidi a temperatura ambiente, mentre grassi animali quali il burro o il lardo, contenendo più acidi grassi saturi, sono solidi. ACIDI GRASSI: Proprietà chimiche. Dal punto di vista chimico gli acidi grassi hanno le stesse caratteristiche degli acidi carbossilici. Sono acidi deboli con una costante di acidità Ka = 10-5, quindi in acqua sono per lo più nella forma indissociata. Le reazioni principali, che coinvolgono il gruppo funzionale carbossilico, sono quelle di saponificazione ed esterificazione. Nella prima reagiscono con gli idrossidi di metalli alcalini formando sali solubili in acqua, detti saponi. Nell’esterificazione reagiscono con alcoli a formare appunto legami estere; nei tessuti umani, la maggior parte degli acidi grassi è presente in forma esterificata. Alcune reazioni possono coinvolgere la catena alifatica, che quando insatura, può andare incontro ad ossidazione (irrancidimento dei grassi animali). I triesteri del glicerolo Grassi ed oli sono sostanze comuni, che fanno parte della nostra vita quotidiana; burro e lardo sono grassi animali, mentre gli oli sono generalmente di origine vegetale (olio di oliva, di mais, di soia). Anche se ci appaiono con caratteristiche fisiche diverse, sono accomunati dalla stessa struttura organica e sono costituiti essenzialmente da triesteri del glicerolo o triacilgliceroli (detti anche trigliceridi). Sono molecole abbondanti negli organismi animali e vegetali e svolgono funzioni diverse. Sono una riserva energetica importante, in quanto, rispetto ai carboidrati, forniscono a parità di peso, il doppio delle calorie. Inoltre, essendo altamente idrofobici, l’accumulo avviene senza trattenere molecole di acqua. Alla funzione energetica si associano anche quelle di isolamento termico e protezione meccanica. Sono costituite da una molecola di glicerolo, un polialcol, i cui tre idrossili sono esterificati con il gruppo carbossilico di altrettanti acidi grassi. Esistono molecole in cui gli acidi grassi legati al glicerolo sono uno (monacilgliceroli) o due (diacilgliceroli). La natura degli acidi grassi presenti nella molecola di trigliceride può essere differente nelle diverse posizioni. Le caratteristiche fisiche sono riconducibili a quelle degli acidi grassi, anche se nei triacilgliceroli, essendo il gruppo carbossilico degli acidi grassi impegnato nel legame con il glicerolo, anche la minima porzione idrofilica viene persa, rendendo le molecole completamente apolari ed idrofobiche. Per le altre caratteristiche fisiche (punti di fusione ed ebollizione) vale quanto descritto per gli acidi grassi. Anche per le proprietà chimiche ci si deve rifare a quanto detto per gli acidi grassi, considerando inoltre la presenza di legami estere nella molecola. L’idrolisi di questi legami è una delle reazioni più importanti, essendo la prima tappa del catabolismo di queste molecole, essa infatti libera i componenti del trigliceride: tre acidi grassi ed una molecola di glicerolo. Saponificazione I trigliceridi possono andare incontro a saponificazione se riscaldati in presenza di idrossidi di metalli alcalini: in queste condizioni si ha infatti la rottura dei legami estere e la formazione di sali di acidi grassi. Idrogenazione Se gli acidi grassi presenti nel trigliceride sono insaturi, possono subire reazioni di ossidazione oppure di idrogenazione. In questo caso si ha la trasformazione del doppio legame in legame semplice. Fosfolipidi I fosfolipidi sono molecole molto importanti perché costituiscono gli elementi strutturali essenziali delle membrane cellulari. Sono divisibili in glicerofosfolipidi e sfingofosfolipidi. I primi sono molto simili ai trigliceridi: considerando la molecola capostipite, nell’acido fosfatidico si osserva che le posizioni 1 e 2 del glicerolo sono impegnate in legami estere con acidi grassi, mentre la posizione 3 è esterificata da una molecola di acido ortofosforico. Quando al residuo acido dell’acido fosforico sono legati altri residui, quali una molecola di colina, di etanolammina, di serina oppure lo zucchero inositolo, si hanno altri fosfolipidi definiti rispettivamente: fosfatidilcolina, fosfatidiletanolam-mina, fosfatidilserina, fosfatidilinositolo. Sfingofosfolipidi Gli sfingofosfolipidi sono caratterizzati invece da una struttura diversa, in cui funge da gruppo centrale la molecola di sfingosina. Ad essa è legato, tramite un legame ammidico, una molecola di acido grasso; al gruppo ossidrile della sfingosina si legano gruppi polari, contenenti acido ortofosforico e residui, quali quelli contenuti nei fosfolipidi (colina, serina, etc). Lo sfingofosfolipide, contenente la colina, è detto sfingomielina ed è quello più abbondante dei tessuti animali. Fosfolipidi: proprietà fisiche. La caratteristica fondamentale dei fosfolipidi è quella di essere molecole anfipatiche, ovvero dotate di una porzione idrofilica (gruppo fosfato e residui ad esso legati) ed una idrofobica (acidi grassi e glicerolo o sfingosina). Quando immerse in un ambiente acquoso, queste molecole formano strutture sopramolecolari tipiche: le più semplici sono le micelle formate anche dagli acidi grassi; tuttavia i fosfolipidi possono formare anche doppi foglietti lipidici e liposomi, vale a dire strutture sferiche che presentano una cavità acquosa, separata dal mezzo della soluzione da un doppio strato fosfolipidico. L’organizzazione strutturale di un liposoma ricorda, in maniera semplificata, quella delle membrane cellulari, di cui i fosfolipidi sono una componente essenziale. Prostaglandine e Leucotrieni Altre classi di composti lipidici di certo interesse per la biochimica umana sono quelle delle prostaglandine e dei leucotrieni. Le prostaglandine sono molecole diffuse in tutti i tessuti umani e, come gli ormoni, sono attive in quantità minime, influenzando: il metabolismo dei grassi, la pressione sanguigna, la risposta al dolore, la temperatura corporea. Dal punto di vista chimico derivano dall’acido arachidonico (un acido grasso con 20 atomi di carbonio), per ciclizzazione (enzima Ciclossigenasi) della molecola tramite un legame tra gli atomi 8 e 12. Anche leucotrieni e lipossine derivano dall’acido arachidonico per azione enzimatica (lipossigenasi). Questi composti aciclici esercitano un ruolo importante nei processi infiammatori e nelle reazioni immunitarie. Steroidi Gli steroidi sono lipidi caratterizzati dall’avere una struttura tetraciclica, con tre anelli esatomici ed uno pentatomico. Sono sintetizzati tramite ciclizzazione di una molecola detta squalene, con formazione di lanosterolo. Lo steroide più semplice ed importante per la biochimica umana è il colesterolo, caratterizzato dalla presenza di un idrossile in posizione 3, di metili in posizione 10 e 13 e di una catena alifatica in posizione 17. Viene assunto con la dieta ma anche sintetizzato dalle cellule. È un costituente importante delle membrane cellulari, dove s’inserisce posizionando il gruppo idrossilico all’interfaccia con l’ambiente acquoso. Ha anche un ruolo importante quale precursore di molte molecole che svolgono azioni diverse nell’organismo. Tra queste gli ormoni steroidei, che includono quelli prodotti dalla corticale del surrene e quelli sessuali, e gli acidi biliari, essenziali per l’assorbimento intestinale dei lipidi. Molto importante dal punto di vista medico è la correlazione esistente tra elevati livelli di colesterolo nel siero (ipercolesterolemia) e aumentato rischio di patologie cardiovascolari ed ictus cerebrale. Riepilogo I lipidi sono un gruppo di macromolecole caratterizzate dalla proprietà di essere insolubili in acqua e solubili in solventi non polari. Appartengono ai lipidi una serie di composti molto diversi dal punto di vista chimico e suddivisibili in diverse categorie: (1) gli acidi grassi (2) i trigliceridi (3) i fosfolipidi (4) le prostaglandine (5) le cere (6) i terpeni (7) gli steroidi. Acidi grassi e trigliceridi hanno un ruolo biochimico fondamentale quali fonte di energia. I fosfolipidi sono molecole anfipatiche e costituenti fondamentali delle membrane biologiche. Gli steroidi, il cui capostipite è il colesterolo, esplicano sia funzione strutturale nella costituzione delle membrane sia funzione ormonale. DIGESTIONE DEI LIPIDI Introduzione I lipidi sono una componente importante della dieta, rappresentando di norma il 20-40% delle calorie assunte. I principali tipi di lipidi esogeni sono: triacilgliceroli, osfolipidi, esteri del colesterolo, colesterolo. Per la loro digestione, il loro assorbimento ed il loro trasporto nell’organismo vengono messi in atto meccanismi opportuni che consentono di ottimizzare l’interazione tra molecole altamente idrofobiche, come essi si presentano, e l’ambiente prevalentemente acquoso in cui devono essere utilizzati. Emulsionamento, idrolisi, risterificazione, formazione di lipoproteine sono fenomeni essenziali nel metabolismo lipidico. Obiettivi I contenuti essenziali di questa lezione consentiranno di comprendere i meccanismi fondamentali attraverso cui i lipidi in genere, vengono digeriti e assorbiti a livello intestinale per passare nel torrente circolatorio. Digestione dei lipidi Digestione, assorbimento e trasporto dei lipidi. I lipidi sono una fonte di energia importante per l’uomo, potendo fornire circa 9 kcal per grammo. Oltre alla funzione energetica si deve ricordare che il nostro organismo non può sintetizzare alcuni tipi di acidi grassi insaturi, che sono tuttavia necessari perché precursori per la sintesi di molecole quali prostaglandine e leucotrieni e per il corretto assemblaggio di fosfolipidi di membrana. Ed ancora esistono vitamine liposolubili che sono necessariamente veicolate con i lipidi. Da ciò si deduce che l’apporto di lipidi con la dieta è fondamentale e deve essere associato al buon funzionamento dei meccanismi di assorbimento intestinale, messi in atto al fine di ottimizzare l’interazione tra molecole altamente idrofobiche, e ambiente e molecole idrofiliche (enzimi). Evidenzia tutti i passaggi fondamentali del percorso dei lipidi dall’esterno all’interno dell’organismo: (1) (2) (3) (4) (5) (6) l’emulsionamento a livello intestinale l’idrolisi ad opera delle lipasi la riesterificazione negli enterociti la formazione dei chilomicroni il trasporto nel sangue la ridistribuzione ai tessuti. La digestione dei triacilgliceroli (i lipidi più abbondanti nella dieta) avviene in parte già nella bocca e nello stomaco, dove lipasi capaci di operare a pH acidi iniziano la scissione dei legami estere tra glicerolo ed acidi grassi, dando luogo soprattutto a 2-acilgliceroli e acidi grassi. Tuttavia la fase preponderante della digestione avviene nell’intestino tenue. In questo tratto intestinale avviene un processo fisico fondamentale per consentire l’attacco enzimatico dei lipidi da parte degli enzimi digestivi, processo propedeutico all’assorbimento. I lipidi, grazie alla secrezione della bile accumulata nella cistifellea, vengono emulsionati e suddivisi in piccole sfere micellari, in cui i lipidi anfipatici espongono alla superficie la testa polare e idrofilica, mentre l’interno della micella ingloba le porzioni idrofobiche e i lipidi completamente apolari. La fine dispersione in micelle consente il contatto tra enzimi digestivi contenuti nell’ambiente acquoso e i lipidi idrofobici. La bile, prodotta dal fegato, contiene sali biliari, (tra cui l’acido colico e deossicolico), derivati dal colesterolo, fosfolipidi e colesterolo che, nel complesso, agiscono da tensioattivi, facilitando la formazione delle micelle e stabilizzando l’emulsione. Idrolisi Contemporaneamente alla secrezione della bile si ha anche la secrezione dei succhi pancreatici, che contengono i diversi enzimi digestivi. In relazione all’assorbimento lipidico, il pancreas secerne lipasi pancreatica e procolipasi, fosfolipasi e colesterolo esterasi. Questi enzimi sono rispettivamente in grado di scindere i legami estere presenti nei triacilgliceroli, nei fosfolipidi e negli esteri del colesterolo. La procolipasi è una proteina che viene attivata nel lume intestinale tramite proteolisi parziale catalizzata dalla tripsina, enzima anch’esso contenuto nel succo pancreatico. La colipasi attiva, coniugandosi alla lipasi pancreatica, ne consente l’adesione alla superficie delle micelle lipidiche e quindi il contatto con i triacilgliceroli presenti nel cuore delle gocciole lipidiche. La lipasi pancreatica, come tutte le lipasi, scinde i legami estere tra acidi grassi e glicerolo, attaccando con efficacia quelli in posizione 1 e 3 dando luogo, quale prodotto finale, a 2-monoacilgliceroli ed acidi grassi, che vengono captati e portati nel cuore delle micelle biliari. Acidi grassi e monoacilgliceroli sono poco solubili in acqua, ma vengono comunque assorbiti come monomeri liberi. Questo implica che essi attraversino l’ambiente acquoso che bagna la membrana apicale degli enterociti, le cellule che costituiscono la parete intestinale. Questa è la fase limitante dell’assorbimento lipidico e, ancora una volta, è resa possibile dalle piccolissime dimensioni delle micelle biliari, contenenti nel loro cuore i prodotti della lipolisi: esse possono consentire un notevole avvicinamento dei lipidi alla membrana degli enterociti e quindi l’ingresso nelle cellule. Gli acidi grassi a catena lunga sono assorbiti meno efficacemente di quelli a catena corta, specie se presenti nelle posizioni 1 e 3 del triacilglicerolo, quelli saturi meno dei corrispondenti insaturi. Esiste comunque un malassorbimento fisiologico, che può aumentare in diete molto ricche di grassi saturi a catena lunga. Malassorbimenti patologici possono associarsi a: malattie pancreatiche, resezioni intestinali o gastriche, ipersecrezione acida gastrica. Si deve ricordare che anche la maggior parte dei sali biliari secreti con la bile vengono riassorbiti nell’ileo e riveicolati al fegato, e quindi alla colecisti. Trigliceride lipasi L’azione svolta dalla lipasi pancreatica sui triacilgliceroli è un processo fondamentale per l’assorbimento di queste molecole. Abbiamo visto che enzimi che esplicano la stessa attività catalitica, ma in condizioni diverse (ambiente con pH più acido), esistono nella saliva (lipasi linguale) e nello stomaco (lipasi gastrica). Altre lipasi sono presenti nell’organismo e catalizzano lo stesso tipo di reazione, che è necessaria ogniqualvolta che un triacilglicerolo debba superare una membrana cellulare. Così abbiamo la lipasi lipoproteica, che idrolizza i trigliceridi presenti nel sangue, per rendere possibile l’ingresso nelle cellule; e ancora la lipasi ormono-sensibile, presente negli adipociti, che compie la stessa azione sui trigliceridi intracellulari per consentire l’uscita dalle cellule verso il torrente circolatorio. Anche gli epatociti hanno una lipasi con caratteristiche peculiari. Nome Localizzazione Lipasi pancreatica Succo pancreatico Lipasi ormono-sensibile Adipociti Lipasi acida Lisosomi Lipasi lipoproteica Endotelio dei capillari Lipasi epatica Fegato Funzione Proprietà Digestione dei trigliceridi Idrolizza i trigliceridi solo alimentari se presenti nelle micelle miste Attiva mediante fosforilazione ad opera Mobilizzazione dei grassi di una proteina chinasi cAMP dipendente Digestione intracellulare ph ottimale 5,0 Utilizzazione dei Rilasciato nel plasma per trigliceridi presenti nelle azione della eparina; lipoproteine viene inibita dalla protamina Rilasciato nel plasma per Catabolismo delle azione della eparina; lipoproteine non viene inibita dalla protamina Tutti questi enzimi sono proteine diverse, ma accomunate dalla capacità di catalizzare lo stesso tipo di reazione chimica. Fosfolipasi A2. Se la digestione dei triacilgliceroli è l’aspetto quantitativamente più rilevante della digestione lipidica, nel lume intestinale avvengono altri processi digestivi a carico di lipidi quali gli esteri del colesterolo ed i fosfolipidi. I primi, sempre inclusi nel cuore delle micelle, sono attaccati dalla colesterolo esterasi che scinde il legame estere, liberando colesterolo e, in genere, un acido grasso. L’assorbimento degli steroidi, data la loro scarsa solubilità, non è molto efficace: circa il 40-50% del colesterolo presente può essere assorbito, ma altri steroidi lo sono in percentuali molto inferiori. Anche i fosfolipidi sono idrolizzati da un enzima pancreatico, la fosfolpasi A2, che rimuove l’acido grasso in posizione due e genera lisofosfolipidi, che possono essere rapidamente assorbiti. La formazione, ad opera dello stesso enzima, di lisolecitina a partire dal fosfolipide fosfatilcolina, abbastanza abbondante nella bile, è un fenomeno importante per l’assorbimento lipidico: infatti la presenza di lisolecitina nelle micelle lipidiche facilita notevolmente il passaggio dei monoacilgliceroli e degli acidi grassi dal cuore delle gocciole lipidiche agli enterociti. Assorbimento e trasporto Assorbimento e riesterificazione. Gli acidi grassi a catena medio-corta lasciano liberamente l’enterocita per riversarsi nel sangue portale. Sono trasportati complessati alla proteina albumina plasmatica e ridistribuiti ai vari tessuti. Gli acidi grassi a catena lunga, una volta raggiunto l’interno dell’enterocita, vengono rapidamente riesterificati a triacilgliceroli. Il processo, di natura biosintetica, richiede il consumo di ATP che viene idrolizzato nella reazione di attivazione degli acidi grassi ad acil-CoA, tappa preliminare alla riesterificazione con il monoaciliglicerolo. Questa reazione mantiene alto il gradiente di concentrazione tra esterno ed interno dell’enterocita, consentendo il mantenimento del flusso dei prodotti della digestione verso l’interno. L’enzima che catalizza l’attivazione degli acidi grassi è l’acil-CoA sintasi, che utilizza ATP e Coenzima A. Il legame tioestere che si forma tra Coenzima A ed acido grasso è energeticamente forte e la sua scissione consente la formazione successiva di legami estere tra acido grasso e 2-monoacilglicerolo, a formare triacilglicerolo. Lo stesso fenomeno avviene a carico di lisofosfolipidi trasformati a fosfolipidi, e per il colesterolo, in buona parte riesterificato con acidi grassi. Secrezione ed utilizzo dei trigliceridi. I triacilgliceroli e gli altri lipidi assunti e risintetizzati negli enterociti non vengono trasportati nel sangue portale, come il resto delle molecole (carboidrati, aminoacidi etc) assorbite durante la digestione. Vengono invece inglobati in particolari strutture micellari, denominate chilomicroni e in minor misura VLDL, che lasciano l’enterocita sotto forma di un liquido lattiginoso, il chilo, raccolto dai vasi linfatici e, quindi, immessi nella circolazione sistemica attraverso il dotto toracico. Dal sangue saranno ridistribuiti ai diversi tessuti attraverso meccanismi che ricordano quelli che avvengono durante l’assorbimento nel lume intestinale, ma che implicano, quale enzima lipolitico, la lipasi lipoproteica. Dopo l’assunzione di lipidi con la dieta si verifica un incremento sensibile della concentrazione di lipidi nel sangue. La progressiva ridistribuzione ai tessuti porta la lipemia a valori normali nell’arco di poche ore. Quantità adeguate di lipidi nella dieta sono necessarie per la salute poiché forniscono gli acidi grassi essenziali e le vitamine liposolubili. Al tempo stesso si deve ricordare che l’eccesso di grassi nella dieta è associato ad aumentato rischio di patologie gravi quali: obesità, aterosclerosi, coronaropatie, alcuni tipi di tumori. La percentuale di grassi consigliata è del 30% in individui sedentari e del 35 % in individui attivi. Molto importante è anche la composizione dei grassi che si apporta con l’alimentazione. Si è per esempio osservato che alcuni acidi grassi saturi (miristico, palmitico) determinano un aumento delle lipoproteine seriche. Anche gli acidi grassi insaturi in configurazione trans (poco abbondanti in natura, ma spesso prodotti dalla trasformazione industriale di alcuni oli, quali la produzione di margarine) sembrano comportare incrementi dei livelli di lipoproteine LDL e riduzione delle lipoproteine HDL, con possibile incremento del rischio di patologie cardiovascolari. Anche per incrementi del colesterolo plasmatico si è osservata un’associazione con lo stesso tipo di patologie, tuttavia la correlazione tra colesterolo alimentare e quello ematico non è sempre lineare, poiché esso può essere ampiamente prodotto anche dal fegato e diversi fattori genetici intervengono a regolarne il metabolismo. Riepilogo I lipidi sono insolubili in acqua e, per il loro assorbimento e digestione, sono messi in atto meccanismi peculiari che consentono di ottimizzare l’interazione tra enzimi digestivi e molecole lipidiche. L’emulsionamento, ovvero la dispersione in finissime goccioline, è fondamentale ai fini della digestione ed è ottenuta e stabilizzata grazie anche alla bile, secreta nel lume intestinale dalla cistifellea. Sulla superficie di queste fini micelle operano gli enzimi digestivi: la lipasi pancreatica, la fosfolipasi A2, la colesterolo esterasi. I lipidi complessi sono semplificati dall’idrolisi dei legami estere in essi contenuti. Ciò facilita l’assorbimento negli enterociti, dove avviene la riesterificazione a trigliceridi, fosfolipidi ed esteri del colesterolo a spese di ATP. Questi lipidi complessi vengono veicolati nel sangue, attraverso la linfa, sotto forma di strutture micellari (lipoproteine) denominate chilomicroni e VLDL. TRASPORTO EMATICO DEI LIPIDI: LE LIPOPROTEINE Introduzione I lipidi assunti con la dieta o sintetizzati all’interno dell’organismo sono accomunati dal fatto di essere scarsamente solubili in ambiente acquoso. Tuttavia devono essere trasportati nel sangue o nel liquido interstiziale per essere ridistribuiti ai vari tessuti ed organi. Questo pone un problema importante perché si deve contrastare la naturale tendenza di queste molecole a coalescere in masse uniche, al fine di ridurre le interazioni con l’ambiente acquoso. Questo potrebbe comportare la formazione di emboli adiposi con ostruzione dei vasi sanguigni. Il problema è contrastato tramite la dispersione dei lipidi in finissime goccioline, mantenute separate dal rivestimento superficiale di fosfolipidi e soprattutto proteine. Tali strutture sono definite lipoproteine e il loro metabolismo è una parte importante del metabolismo lipidico. Obiettivi La lezione descrive: 1. la natura e la funzione delle lipoproteine, 2. le apolipoproteine, 3. il ruolo ed il ruolo biologico dei diversi tipi di lipoproteine, 4. le implicazioni mediche del metabolismo delle lipoproteine. Caratteristiche e funzioni delle lipoproteine Trasporto ematico dei lipidi. L’elevata insolubilità dei lipidi rende problematico il loro metabolismo, necessariamente in ambiente acquoso. Si è visto come l’assorbimento dei lipidi assunti con la dieta dipenda dall’emulsionamento degli stessi, reso possibile dai sali biliari e dai fosfolipidi secreti con la bile. Un meccanismo tutto sommato simile è messo in atto per assicurare il trasporto di queste molecole apolari nei liquidi interstiziali e soprattutto nel sangue. Gli acidi grassi liberi a catena corta possono essere trasportati nel sangue legati all’albumina, una proteina serica, secreta dal fegato. La maggior parte dei lipidi è però veicolata sotto forma di piccole strutture micellari, definite lipoproteine. Si tratta di strutture sferiche in cui possiamo distinguere: un nucleo centrale in cui si trovano i lipidi maggiormente apolari (triacilgliceroli, esteri del colesterolo), uno strato più superficiale, occupato da molecole anfipatiche, quali i fosfolipidi che rivolgono la loro porzione idrofilia verso l’esterno. Sulla superficie si riscontrano infine anche molecole di natura proteica, dette apolipoproteine. Le lipoproteine sono sintetizzate prevalentemente in due organi: l’epitelio intestinale, che le produce utilizzando i lipidi esogeni, con lo scopo di immetterli nel torrente circolatorio e farli giungere ai diversi tessuti dell’organismo; il fegato, che interviene nelle fasi post-prandiali a garantire la ridistribuzione dei lipidi endogeni in base alle necessità di ciascun tessuto e allo stato metabolico complessivo. Lipoproteine Esistono diversi tipi di lipoproteine, caratterizzate da variazioni nella composizione lipidica e proteica. Esistono anche diverse classificazioni, basate su criteri diversi quali la densità e la migrazione in un campo elettrico. La classificazione più comune si basa sulla densità delle lipoproteine, caratteristica fisica che viene utilizzata per isolarle dal sangue e suddividerle tramite ultracentrifugazione. Infatti, il grasso puro è meno denso dell’acqua e quindi quanto una lipoproteina è più ricca il lipidi, tanto minore sarà la sua densità. Questa tenderà di conseguenza a crescere all’aumentare della quota proteica. In base a questo parametro fisico si distinguono cinque tipi principali di lipoproteine: 1. i chilomicroni, con densità bassissima; 2. le VLDL, a densità molto bassa; 3. le IDL, a densità media; 4. le LDL, a densità bassa; 5. le HDL, a densità elevata. Caratteristiche lipoproteine Da quanto detto possiamo immaginare che il contenuto in lipidi diminuisce dai chilomicroni alle HDL, mentre quello proteico procede i senso opposto. Anche la natura dei lipidi contenuti è diversa: quelle meno dense contengono soprattutto triacilgliceroli, quelle più dense colesterolo. Queste differenze strutturali sottendono ovviamente differenze funzionali, che tuttavia dipendono anche dalla natura delle proteine contenute. Sono infatti le proteine che possono agire da cofattori ed attivatori di attività enzimatiche coinvolte nel metabolismo lipidico. I chilomicroni (CM) sono lipoproteine costituite pressoché esclusivamente dai triaciligliceroli alimentari. Contengono apolipoproteina B48, AI, AII, C, ed E, che rappresentano solo il 2% della massa totale. Le VLDL contengono soprattutto triacilgliceroli endogeni ed esteri del colesterolo e le apolipoproteine B100, C ed E. Le IDL sono molto simili alle VLDL, da cui derivano e non hanno apolipoproteina C. Le LDL contengono una quota preponderante di esteri del colesterolo e una quota significativa di fosfolipidi e trigliceridi e la apolipoproteina B100. Le HDL hanno contenuti elevati di fosfolipidi e minori di colesterolo e trigliceridi. Le apolipoproteine AI, AII, C, E, F sono circa il 40% della massa totale. Percentuale e tipo Classe Densità Diametro Proteine Trigliceridi Colesterolo Fosfolipidi (g/l) (nm) (% e tipo) (%) (esteri e non) CL < 950 80-500 2 B48 AI AII C E 85 5 7 VLDL 950-1006 90-80 8 B100 C E 52 23 17 IDL 1006-1019 25-35 15 B100 E 35 32 18 LDL 1019-1063 20-22 22 B100 9 49 20 HDL 1063-1210 7-11 48 AI AII C E F 4 19 29 È molo importante osservare che le lipoproteine non sono strutture statiche, ma i diversi tipi rappresentano un continuo di specie correlate, che si trasformano le une nelle altre tramite scambi dinamici di lipidi e proteine tra loro e con i diversi tessuti dell’organismo. Liproproteine e Apolipoproteine La funzione delle lipoproteine è strettamente correlata alla natura delle apolipoproteine contenute. Esse hanno una funzione strutturale, correlata al fatto di potersi disporre all’interfaccia lipidi/ambiente acquoso stabilizzando la micella lipidica. Possono poi svolgere una funzione metabolica, agendo da attivatori di enzimi che catalizzano trasformazioni a carico dei lipidi. Ed infine possono avere funzione di ligando per recettori posti alla superficie di cellule specifiche, mediando il riconoscimento lipoproteina/organo, fenomeno preliminare alla cessione o assunzione di metabolici da parte delle lipoproteine stesse. La natura dinamica delle lipoproteine si manifesta anche attraverso scambi di apolipoproteine oltre che di lipidi. APOPROTEINA Lipoproteina AI HDL CM nascenti B48 CM B100 VLDL IDL CI CM VLDL HDL CII CM VLDL HDL E CM VLDL LDL HDL FUNZIONE Attivatore della Lecitina-Colesterolo Acil-Transferasi (LCAT). Ligando per recettore HDL Ligando per il recettore dei CM Secreta dal fegato con VLDL. Ligando per il recettore delle LDL Attivatore LCAT Attivatore Lipasi Lipoproteica Ligando per il recettore dei residui dei chilomicroni e delle LDL La tabella mostra le funzioni di alcune apolipoproteine. La AI agisce da attivatore dell’enzima Lecitina Colesterolo Acil-Transferasi (LCAT), fondamentale per i processi di esterificazione e scambio del colesterolo. Funge inoltre da ligando per il recettore delle HDL. Le apolipoproteine B48 e B100 agiscono rispettivamente come ligando per il recettore dei CM e delle LDL. L’apolipoproteina CII è un importante attivatore della lipasi lipoproteica, necessaria per l’idrolisi dei trigliceridi che devono essere ceduti ai tessuti. Infine l’apolipoproteina E agisce da recettore per i residui dei CM e LDL. Metabolismo delle lipoproteine: I chilomicroni Passiamo ora ad analizzare il metabolismo dei singoli tipi di lipoproteine. I chilomicroni sono lipoproteine prodotte dall’epitelio intestinale in conseguenza dell’assorbimento dei grassi apportati con la dieta. Sono riversati dagli enterociti nei vasi linfatici (chilo) e, tramite il dotto toracico, nel sangue. Oltre ai CM il chilo contiene anche una percentuale di VLDL, che tuttavia sono per la maggior parte sintetizzate dal fegato. I CM hanno quindi il compito di veicolare i trigliceridi alimentari ai tessuti dell’organismo. Una volta raggiunto il sangue, essi sono rapidamente metabolizzati, con un tempo di dimezzamento nell’uomo inferiore all’ora. Il fenomeno avviene tramite l’acquisizione dell’Apo CII dalle HDL, che attiva la lipasi lipoproteica, presente sulle cellule dei capillari di vari tessuti. Alla stessa stregua della lipasi pancreatica, la lipoproteinlipasi attacca preferenzialmente i legami estere in posizione 1 e 3, dando luogo a 2monoacilglicerolo e acidi grassi. Soprattutto a livello del muscolo, del miocardio e del tessuto adiposo avviene la rimozione della maggior parte (>90%) dei trigliceridi contenuti dai CM. Le particelle che residuano dopo questa cessione, lasciano altre componenti proteiche e lipidiche alle HDL e così si costituisce buona parte del colesterolo e dei fosfolipidi. Queste particelle, dal diametro molto più piccolo dei CM, vengono definite residui dei chilomicroni. Essi sono attivamente captati, probabilmente tramite riconoscimento della Apo E, e metabolizzati dal fegato. Metabolismo delle lipoproteine: VLDL Destino e funzione molto simile a quella dei CM è quello delle VLDL. Queste lipoproteine sono per la maggior parte sintetizzate a livello epatico e sono responsabili della ridistribuzione ai tessuti extraepatici dei lipidi sintetizzati dal fegato. A differenza dei CM contengono B100 e non B48, ma anch’esse si arricchiscono in Apo CII e Apo E dalle HDL. Riconosciute tramite recettori B100 specifici nei tessuti extraepatici, cedono i loro trigliceridi tramite attivazione della lipoproteinlipasi ad opera della Apo CII. Le particelle che residuano sono definite IDL e hanno un contenuto di trigliceridi nettamente inferiore. Le IDL possono essere captate dal fegato oppure, in seguito ad ulteriore cessione di lipidi alle HDL e al fegato, con contemporaneo arricchimento in colesterolo, si trasformano in LDL. Ciascuna VLDL e LDL contiene una sola molecola di Apo B, e perciò si può dedurre che da ogni VLDL deriva una LDL. Queste lipoproteine, nell’uomo, trasportano più della metà del colesterolo ematico. Sono metabolizzate dal fegato (70%) e dai tessuti extraepatici (30%) principalmente attraverso l’interazione tra Apo B100 e un recettore specifico sulla membrana delle cellule. Questo recettore è molto ben caratterizzato dal punto di vista strutturale e media l’internalizzazione delle VLDL, LDL e HDL. La sua mancanza determina una forma di ipercolesterolemia familiare. Dati recenti suggeriscono che una parte del metabolismo delle LDL sia indipendente dal recettore per Apo B100. Diversi fattori, sia ormonali che alimentari, influiscono sul metabolismo delle LDL, spesso attraverso effetti sul recettore per Apo B100. Per esempio, l’ormone insulina fa aumentare l’attività del recettore, mentre il colesterolo alimentare ed i grassi saturi la fanno diminuire. Metabolismo delle lipoproteine: le HDL Il metabolismo delle HDL è sicuramente meno noto di quello delle altre lipoproteine. Possono essere distinte in più sottoclassi con una complessa eterogeneità di composizione apoproteica. Uno dei ruoli fondamentali è comunque quello di fungere da depositi di Apo C ed Apo E, che possono cedere ad altre lipoproteine. Le HDL sono in parte prodotte dal fegato, come micelle ad alto contenuto fosfolipidico e di colesterolo. Nel sangue acquisiscono colesterolo dai tessuti e dalle altre lipoproteine e l’enzima LCAT, secreto dal fegato. Questo enzima catalizza il trasferimento di un acido grasso dai fosfolipidi al colesterolo, producendo esteri del colesterolo che, divenuti completamente apolari, passano nel cuore della micella, modificandone la forma. Queste HDL meno dense sono captate dal fegato, che rimuove da esse gli esteri del colesterolo fino a quando la particella non diventa più densa e torna nuovamente in circolo. Le HDL sono quindi coinvolte in un processo noto come trasporto inverso del colesterolo, ovvero il trasporto dello steroide dai tessuti al fegato. La colesterolemia e le iperlipemie Le concentrazioni ematiche di colesterolo e trigliceridi hanno un’importanza notevole in medicina in quanto diversi studi hanno dimostrato correlazioni significative tra i loro valori e patologie di diverso tipo. In particolar modo la concentrazione plasmatica di colesterolo LDL (LDL-c), ovvero del colesterolo associato alle lipoproteine LDL, è direttamente e positivamente correlata all’incidenza di aterosclerosi coronaria: anche se non esiste una soglia precisamente definibile (viene generalmente considerata normale una concentrazione ematica di colesterolo totale pari a 200mg/dL), è certo che maggiori livelli di LDL-c aumentano il rischio di patologie cardiovascolari. Si è anche osservato che gli acidi grassi saturi e insaturi hanno effetti opposti su LDL-c; i primi ne provocano un forte aumento, mentre i secondi tendono a diminuirlo. Diete ricche di grassi saturi possono generare maggior rischi di danni cardiaci che non diete ricche in colesterolo. È importante notare che il colesterolo HDL (HDL-c) risulta invece inversamente correlato al rischio di aterosclerosi vascolare. I livelli di colesterolo e lipidi ematici sono fortemente influenzati da diversi fattori, sia ambientali sia genetici. Tipo 1 2a 2b 3 5 5 Designazione e tipo di anormalità lipoproteica Aumentano i triacilgliceroli esogeni (chilomicroni) Ipercolesterolemia LDL con triacilgliceroli nella norma Come la 2a con ipertrigliceridemia modesta Ipertrigliceridemia e ipercolesterolemia (aumentano le IDL) Ipertrigliceridemia endogena da modesta a discreta (2,8-7,9 mmol.l-1 o 250-700 mg.dl-1) con aumento delle VLDL Ipertrigliceridemia endogena da discreta a grave (11,3 mmol.l-1 o 1000 mg.dl-1) in presenza di una miscela di VLDL e chilomicroni La tabella descrive alcuni tipi di iperlipidemia, distinguibili per tipo e quantità di lipidi accumulati nel sangue. Nell’ambito delle iperlipidemie secondarie (non genetiche) i fattori che giocano ruoli determinanti sono: l’alimentazione, lo stile di vita sedentario, il fumo, l’uso di contraccettivi orali. Riepilogo I lipidi sono molecole altamente idrofobiche e il loro trasporto nel sangue avviene grazie alla formazione di strutture micellari, definite lipoproteine. Esse ottimizzano l’interazione con l’acqua esponendo alla superficie le porzioni idrofiliche dei lipidi e varie proteine (apolipoproteine), nascondendo invece all’interno le porzioni lipidiche più idrofobiche. Esistono diversi tipi di lipoproteine, caratterizzati da contenuto proteico e lipidico specifico per qualità e quantità. In base alla loro densità si distinguono: 1. chilomicroni, con densità bassissima; 2. le VLDL, a densità molto bassa; 3. le IDL, a densità media; 4. le LDL, a densità bassa; 5. le HDL, a densità elevata. Sono comunque strutture dinamiche, che scambiano tra loro e con i diversi tessuti dell’organismo sia la componente lipidica sia quella proteica. Le apolipoproteine servono o da recettori per il riconoscimento lipoproteina-cellula oppure da enzimi e attivatori enzimatici necessari per lo scambio di lipidi tra lipoproteine e cellule. Chilomicroni e VLDL si generano a livello intestinale per consentire l’ingresso dei lipidi con la dieta e sono molto ricche in trigliceridi. Le VLDL sono prodotte anche dal fegato per ridistribuire i lipidi neosintetizzati negli epatociti. IDL e LDL si formano dalle VLDL in seguito agli scambi di lipidi tra queste lipoproteine e le cellule dell’organismo. Le HDL sono sintetizzate dal fegato e da altri tessuti e svolgono un ruolo specifico nel traffico del colesterolo tra i tessuti. LDL e HDL sono le lipoproteine più ricche in colesterolo e incrementi della loro concentrazione sierica modificano il rischio individuale di malattie cardiovascolari. In particolar modo le LDL aumentano tale rischio, mentre le HDL sembrano diminuirlo. IL CATABOLISMO DEGLI ACIDI GRASSI Introduzione I triacilgliceroli, e gli acidi grassi da essi derivati, sono la classe di lipidi più importanti ai fini energetici. A differenza di quanto visto per il glucosio, il loro catabolismo è un processo essenzialmente aerobico che utilizza substrati di origine alimentare oppure substrati accumulati nel tessuto adiposo, derivati in parte anche dal metabolismo glucidico. La via demolitiva principale, chiamata β-ossidazione degli acidi grassi, è un processo che avviene nei mitocondri ed è svolto efficacemente in molti tessuti ed organi. Il prodotto finale della β-ossidazione è l’acetil-CoA, substrato di partenza per il ciclo di Krebs. Un’ossidazione accentuata degli acidi grassi, fenomeno che si può manifestare nel corso di un digiuno prolungato o in seguito a diabete mellito non opportunamente controllato, può comportare un’eccessiva produzione di corpi chetonici da parte del fegato, ed eventualmente sfociare in uno stato di chetoacidosi. Obiettivi In questa lezione verranno presentate le tappe essenziali del catabolismo degli acidi grassi e i meccanismi fondamentali che regolano tale processo metabolico. Saranno inoltre presentate le tappe biochimiche della produzione dei corpi chetonici e il loro significato in alcune situazioni patologiche. Il catabolismo degli acidi grassi: aspetti generali Gli acidi grassi sono i lipidi più importanti dal punto di vista energetico per il nostro organismo. Dalla combustione degli acidi grassi si ottengono ben 9 kcal/g, due volte quante se ne ottengono dall’utilizzo di zuccheri o aminoacidi. Essi sono quindi una fonte energetica importante e, anche se il fegato è l’organo maggiormente coinvolto nel metabolismo lipidico, quasi tutti i tessuti dell’organismo umano possono utilizzare acidi grassi per produrre energia. Il catabolismo degli acidi grassi è un processo biochimico che utilizza ossigeno: avviene infatti nei mitocondri e determina la completa ossidazione degli atomi di carbonio a CO2 attraverso il ciclo di Krebs e la fosforilazione ossidativa. Il bisogno di ossigeno dipende quindi dalla stretta correlazione con questi processi mitocondriali. Con il termine di β-ossidazione si definisce l’insieme di tappe ossidative che trasformano progressivamente, e attraverso un percorso a spirale, la catena carboniosa di un acido grasso in diverse molecole di Acetil-CoA (2 atomi di carbonio). I substrati della β-ossidazione Mobilizzazione degli acidi grassi dal tessuto adiposo. Gli acidi grassi utilizzati quali substrato per la βossidazione possono giungere direttamente dalla dieta, ma, in condizioni normali, è probabile che provengano dalla demolizione dei triacilgliceroli accumulati nel tessuto adiposo. I trigliceridi del tessuto adiposo rappresentano infatti un deposito di acidi grassi e glicerolo. Ormoni specifici (glucagone e/o adrenalina), spesso secreti in risposta a valori glicemici bassi, attivano la lipasi ormono-sensibile, che catalizza la scissione dei legami estere dei trigliceridi liberando acidi grassi e glicerolo. Gli acidi grassi entrano nel torrente circolatorio e veicolati dall’albumina, raggiungono: muscoli, cuore, fegato altri tessuti dell’organismo. Anche il glicerolo liberato dai trigliceridi può essere utilizzato dalle cellule per produrre energia, venendo trasformato in glicerladeide-3-fosfato, cioè un intermedio della glicolisi. Attivazione dell’acile ad acil-CoA. L’utilizzo nelle cellule degli acidi grassi giunti dalla dieta o mobilizzati dal tessuto adiposo prevede una tappa preliminare di attivazione, con dispendio di energia e trasformazione dell’acido grasso in acil-CoA. Come visto per la fosforilazione del glucosio a glucosio-6-P, questo meccanismo mantiene bassa la concentrazione citosolica degli acidi grassi liberi, e quindi consente il flusso passivo delle molecole dall’esterno all’interno della cellula. Si deve anche ricordare che in alternativa, gli acidi grassi possono giungere ai diversi tessuti attraverso i lipidi trasportati dalle lipoproteine sintetizzate dal fegato. L’attivazione dell’acido grasso ad acil-CoA è catalizzata da un enzima posto sulla membrana mitocondriale esterna, l’Acil-CoA sintasi. Utilizza come coenzima il coenzima A e la reazione avviene con contemporanea scissione di una molecola di ATP ad AMP e pirofosfato. L’idrolisi successiva del pirofosfato sposta la reazione fortemente verso destra (a prezzo del consumo di due legami altamente energetici). L’acil-CoA può avere destini metabolici diversi, determinati dalle momentanee esigenze cellulari. Oltre ad essere il substrato di partenza per il catabolismo, rappresenta la molecola iniziale del percorso anabolico che porta alla formazione di trigliceridi, fosfolipidi ed esteri del colesterolo; o ancora gli acil-CoA possono venire modificati tramite reazioni di allungamento o accorciamento della catena carboniosa. Spartiacque tra i possibili destini dell’acil-CoA è l’ingresso della molecola nel mitocondrio, essenziale per il catabolismo ossidativo. Sistema navetta della Carnitina Gli acil-CoA non possono superare la membrana mitocondriale interna come tali, ma interviene un sofisticato e specifico sistema di trasporto degli acili alla matrice mitocondriale, che viene comunemente definito sistema navetta della carnitina. Il processo si basa sulla molecola carnitina e su tre enzimi: la carnitina-palmitoiltransferasi I, la carnitina-palmitoiltransferasi II, la carnitina-acilcarnitinatraslocasi. Come evidenzia la figura il meccanismo consente l’ingresso di un acile nella matrice mitocondriale utilizzando la carnitina come vettore. Un coenzima A del pool mitocondriale viene trasferito sull’acile giunto all’interno, e la carnitina viene nuovamente traslocata all’esterno per riprendere un nuovo ciclo di trasferimento. β-ossidazione: generale La demolizione ossidativa degli acidi grassi all’interno del mitocondrio consta di tre fasi distinte: la prima tappa è la β-ossidazione, che rimuove progressivamente unità bicarboniose (acetil-CoA) dalla catena alifatica. Si tratta di reazioni di ossidoriduzione che distaccano quattro elettroni e quattro idrogenioni per ciascun acetil-CoA prodotto, trasferendoli sui coenzimi FAD+ e NAD+. la seconda fase prevede l’ingresso delle unità di acetil-CoA così generate nel ciclo di Krebs. Quindi metaboliti del catabolismo degli zuccheri e metaboliti del catabolismo lipidico confluiscono a questo processo biochimico mitocondriale che ossida definitivamente gli acetil-CoA a CO2. Com’è noto anche in questo ciclo equivalenti riducenti sono trasferiti ai coenzimi NAD+ e FAD+. la terza fase prevede la riossidazione dei NADH e FADH2, generati nel corso delle reazioni di ossidoriduzione attraverso la catena di trasporto degli elettroni all’ossigeno molecolare. La β-ossidazione: le tappe enzimatiche La β-ossidazione degli acidi grassi avviene in quattro tappe enzimatiche che portano al distacco di un’unità di acetil-CoA, tramite la rottura del legame tra gli atomi di carbonio α(2) e β(3), da cui deriva il nome di βossidazione. L’acile accorciato ripete quindi il percorso enzimatico più volte, definendo un ipotetico cammino a spirale, fino alla completa trasformazione in acetil-CoA. Considerando il caso più semplice di un acido grasso saturo con numero pari di atomi di carbonio, quali il palmitoil-CoA, la stechiometria della reazione sarà: Pamitoil-CoA+ 7CoA + 7 FAD+ +7NAD+ +7H2O -> 8 Acetil-CoA + 7 FADH2 +7 NADH +7 H+ La prima reazione catalizzata dall’Acil-CoA deidrogenasi toglie elettroni dai carboni α e β, con introduzione di un doppio legame nella catena, e la contemporanea riduzione di FAD+ a FADH2. Successivamente il doppio legame viene addizionato di una molecola di acqua, e quindi deidrogenato con introduzione di un doppio legame di tipo trans tra carbonio β ed ossigeno ( β-chetopamitoil-CoA) e riduzione di un coenzima NAD+. L’intervento dell’enzima acil-CoAacetiltransferasi (nota anche come tiolasi) rende possibile il distacco dell’acetil-CoA con contemporaneo legame di un Coenzima A alla catena carboniosa restante e formazione di un acil-CoA, di due unità più breve (miristoil-CoA). A questo punto il percorso può riprendere dalla prima tappa enzimatica e concludersi, dopo 7 cicli ossidoriduttivi, con la completa trasformazione in acetil-CoA. La resa energetica della β-ossidazione La β-ossidazione non produce direttamente (tramite fosforilazione a livello di substrato) alcuna molecola di ATP. Produce tuttavia coenzimi ridotti NADH e FADH2 (1+1 per ciclo) che confluiranno nella catena respiratoria e molecole di acetil-CoA, che forniscono il substrato di partenza del ciclo di Krebs. La resa energetica della β-ossidazione deve quindi tener conto di questi ulteriori processi biochimici. Reazione 1+2 3 4 Totale N° ATP prodotti -2 ATP (1 FADH2 + NADH) x 7 = 35 ATP 8 Cicli Krebs x 12 = 96 ATP 129 ATP Considerando sempre l’acido grasso saturo con 16 atomi di carbonio (palmitato), osserviamo come l’ingresso nella β-ossidazione comporta il consumo di 2 legami altamente energetici. La riossidazione dei coenzimi ridotti nel corso della β-ossidazione produce ben 35 molecole di ATP, mentre ne vengono prodotte altre 96 dall’ossidazione degli acetil-CoA nel ciclo di Krebs. Complessivamente la resa energetica dell’ossidazione completa di una molecola di palmitato consiste in 129 molecole di ATP. Ossidazione acidi grassi insaturi Esistono meccanismi enzimatici che consentono anche l’ossidazione di acidi grassi poliinsaturi o a catena dispari. I grassi insaturi sono molto diffusi in natura e sono generalmente in configurazione cis, cosa che li rende non automaticamente accessibili per la β-ossidazione. L’intervento di una isomerasi converte il doppio legame in forma trans e rende così possibile l’ossidazione dell’acido grasso insaturo. Un altro enzima la dienoil-CoA reduttasi rende invece possibile l’ossidazione di molecole insature con più di un doppio legame. Anche se rari in natura, esistono anche acidi grassi con un numero dispari di atomi di carbonio. L’ultima tappa della loro ossidazione libera non due molecole di acetil-CoA, ma una di acetil-CoA ed una di propionil-CoA, con tre atomi di carbonio. Questo composto non entra direttamente nel ciclo di Krebs, ma, attraverso una serie di tappe enzimatiche, viene trasformato in succinil-CoA, un intermedio dello stesso ciclo. La regolazione della β-ossidazione La β-ossidazione è strettamente regolata in base alle necessità energetiche, cellulari e soprattutto da meccanismi che fanno sì che tale processo, e quello opposto di sintesi di acidi grassi, non avvengano contemporaneamente, con un futile consumo di energia. L’ingresso dell’acil-CoA nel mitocondrio vincola l’acido grasso al destino catabolico e quindi, tale processo di trasferimento attraverso la membrana mitocondriale interna è la tappa limitante dell’intero processo catabolico. Il malonil-CoA è il primo intermedio nella sintesi di acidi grassi ed è un forte inibitore della Carnitina Aciltransferasi I, enzima che inizia il trasferimento degli acili nel mitocondrio. Nel fegato esiste inoltre un’importante regolazione ormonale di questi processi, con l’insulina che favorisce la formazione di malonil-CoA, mentre il glucagone ha un effetto contrario. È importante osservare come i processi metabolici degli zuccheri e dei lipidi (ma anche di altri metabolici) siano fortemente interconnessi e reciprocamente regolati. Così vediamo come la disponibilità di acetil-CoA di origine lipidica, induca un blocco della trasformazione di piruvato ad acetil-CoA, favorendo invece la formazione di ossalacetato, utile per mantenere attivo il ciclo di Krebs, ma anche substrato di partenza per la gluconeogenesi. Al contrario, la disponibilità di zuccheri, favorendo la formazione di malonil-CoA, rallenta l’utilizzo catabolico dei grassi e ne favorisce la sintesi e il deposito, quale riserva. Controllo della lipolisi nel tessuto adiposo Un altro punto importante nella regolazione del flusso di acidi grassi lungo il percorso ossidativo è rappresentato dalla velocità con cui gli stessi grassi sono mobilizzati dal tessuto adiposo e liberati nel sangue, in modo da essere disponibili per le cellule dell’organismo. La lisi dei trigliceridi nel tessuto adiposo è catalizzata dall’enzima lipasi ormono-sensibile, che è appunto finemente regolata dalla presenza di ormoni di diversa natura. L’adrenalina, secreta dalla midollare del surrene, e il glucagone, secreto dal pancreas, attivano l’enzima in condizioni di bassa disponibilità ematica di combustibili (soprattutto zuccheri). Come noto, gli stessi ormoni stimolano la demolizione del glicogeno epatico a glucosio, con l’obiettivo di innalzare la glicemia. Al contrario, l’insulina, secreta dal pancreas in presenza di livelli glicemici elevati, limita l’attività della lipasi ormono-sensibile, facilitando invece il processo opposto di sintesi e deposito di trigliceridi. Riepilogo Buona parte dell’energia utilizzata dagli animali deriva dagli acidi grassi, componenti principali dei trigliceridi. L’estrazione di energia chimica dagli acidi grassi avviene attraverso un processo di ossidazione (β-ossidazione), che semplifica la molecola trasformando la catena alifatica in tante unità bicarboniose, coniugate a coenzima A. L’utilizzo di queste molecole nel ciclo di Krebs e la riossidazione dei coenzimi ridotti generati dalle ossidoriduzioni dell’intero percorso catabolico, fanno sì che l’ossidazione completa di un acido grasso produca molte molecole di ATP (ben 129 da un acido grasso saturo con 16 atomi di carbonio). Per evitare inutili consumi di energia chimica, la β-ossidazione è regolata in modo da non avvenire quando la disponibilità di zuccheri ed energia rende possibile la sintesi di acidi grassi. I CORPI CHETONICI Introduzione Acetoacetato, β-idrossibutirrato ed acetone sono molecole note come corpi chetonici. Si tratta di molecole prodotte dal fegato nel corso dell’ossidazione degli acidi grassi, e utilizzate da altri organi quali fonte di energia. Un’eccessiva produzione di corpi chetonici può determinare un abbassamento del pH ematico e sfociare in una condizione di coma chetoacidotico o metabolico. Obiettivi Questa lezione presenta le molecole note come corpi chetonici, ne descrive la funzione metabolica ed i possibili danni indotti da una loro eccessiva produzione. Corpi chetonici o chetoni I corpi chetonici sono molecole normalmente prodotte dai mitocondri epatici a partire dall’acetil-CoA generato dalla β-ossidazione degli acidi grassi. Due molecole di acetil-CoA condensano a formare acetoacetil-CoA; questo viene condensato con un’altra molecola di acetil-CoA a formare 3-idrossi-3-meilglutaril-CoA, intermedio della sintesi del colesterolo. Da questa molecola si può generare l’acetoacetato, un corpo chetonico, con contemporanea liberazione di acetil-CoA. L’acetoacetato è in equilibrio con il β-idrossibutirrato, altro corpo chetonico. L’acetone, il terzo corpo chetonico, si forma spontaneamente per decarbossilazione dell’acetoacetato. Acetoacetato e β-idrossibutirrato sono liberati nel sangue dal fegato e, grazie alla loro maggiore solubilità, sono facilmente utilizzati dal cervello, dal muscolo cardiaco e da altri tessuti, quali fonti energetiche. L’acetone, che si forma spontaneamente dall’acetoacetato, è volatile e viene eliminato con la respirazione o con le urine. Quindi la formazione di corpi chetonici può essere vista come un meccanismo attraverso il quale il fegato prepara combustibili di semplice utilizzo per gli altri organi. Regolazione della chetogenesi Controllo della chetogenesi. La produzione di corpi chetonici è strettamente correlata al metabolismo degli acidi grassi. Non si ha presenza di chetoni senza un’attiva mobilizzazione degli acidi grassi dal tessuto adiposo. Tale processo è sotto controllo ormonale, con insulina e glucagone che esercitano effetti opposti, rispettivamente bloccando o facilitando la lipolisi. A livello epatico, la chetogenesi è strettamente correlata alla β-ossidazione degli acidi grassi. Tappa limitante di questo processo biochimico è l’ingresso dell’acido grasso attivato nel mitocondrio, favorito dall’azione della Carnitina Palmitoil Transferasi I (CPTI). L’attività di questo enzima dipende fortemente dalla disponibilità di substrati energetici alternativi agli acidi grassi: infatti in condizioni di normale alimentazione (disponibilità di zuccheri), gli acil-CoA vengono indirizzati verso l’esterificazione con il glicerolo a formare trigliceridi, e contemporaneamente viene limitato il loro ingresso nel mitocondrio, bloccando appunto la CPTI. In caso di ridotta disponibilità di altri substrati (digiuno), la CPTI è attiva e trasporta efficacemente acili all’interno dei mitocondri, sostenendo così la β-ossidazione. Ancora una volta, questi effetti sono determinati, almeno in parte, dall’azione opposta esplicata da insulina e glucagone sul processo di lipogenesi epatica. Regolazione e Chetoacidosi. La regolazione della chetogenesi avviene anche all’interno del mitocondrio, dove viene deciso il destino metabolico dell’acetil-CoA. In circostanze normali, la maggior parte dell’acetilCoA prodotto dall’ossidazione degli acidi grassi entra nel ciclo di Krebs attraverso la reazione di condensazione con l’ossalacetato; una piccola parte viene invece indirizzata verso la produzione di corpi chetonici (chetogenesi fisiologica). Questo equilibrio è garantito dalla disponibilità di ossalacetato, la cui quantità deve essere sufficiente a sostenere il flusso in entrata di acil-CoA. Esistono meccanismi regolatori che tendono a garantire questo equilibrio; infatti l’enzima Piruvato carbossilasi, che catalizza la conversione di piruvato ad ossalacetatato, viene stimolato dall’acetil-CoA stesso, che, in questo modo, si assicura l’ingresso nel ciclo di Krebs e mantiene bassa la produzione di corpi chetonici. In alcune condizioni, quali il digiuno o il diabete, caratterizzate da un elevato catabolismo lipidico ed una scarsa disponibilità o utilizzo di carboidrati, si ha una massiccia produzione di acetil-CoA da parte della βossidazione degli acidi grassi, ma scarsità di ossalacetato; infatti, da un lato è limitata la sua produzione a partire dal piruvato e dall’altro è favorito il suo utilizzo per la gluconeogenesi. Di conseguenza gli acetilCoA sono massivamente indirizzati verso la produzione di corpi chetonici. In tali condizioni, la concentrazione ematica di questi metaboliti può superare i livelli fisiologici (chetosi patologica) e, se non adeguatamente controllata, può provocare una riduzione pericolosa del pH ematico (chetoacidosi o acidosi metabolica) e condurre al coma e alla morte. Accumulo di corpi chetonici nella chetosi diabetica Normale Chetosi estrema (diabete non controllato) Escrezione urinaria (mg/24 h) < (o uguale a) 125 5000 Escrezione urinaria (mg/100 mL) <3 90 Riepilogo I corpi chetonici sono metaboliti prodotti principalmente dagli epatociti a partire da molecole di acetilCoA. Liberati in circolo dal fegato, sono attivamente captati da organi quali il muscolo cardiaco e scheletrico e il cervello, che li utilizzano quali substrati energetici. La produzione di corpi chetonici è strettamente correlata al metabolismo generale degli acidi grassi; la loro produzione è tanto maggiore quanto più sono attivi i processi di mobilizzazione dei trigliceridi dal tessuto adiposo e quello di ossidazione degli acidi grassi a livello epatico. In condizioni in cui si realizza uno squilibrio tra l’utilizzo di carboidrati (particolarmente ridotto) e quello dei lipidi (particolarmente elevato), si può determinare una produzione eccessiva di corpi chetonici, con conseguente chetosi e acidosi metabolica. BIOSINTESI DEGLI ACIDI GRASSI Introduzione La sintesi degli acidi grassi è un processo anabolico che, nei mammiferi, avviene principalmente nel fegato. Pur apparendo come il percorso biochimico inverso della β-ossidazione, se ne distingue in realtà per una serie di caratteristiche specifiche, quali la localizzazione e la natura di enzimi e coenzimi in esso coinvolti, che ne fanno una via metabolica del tutto separata e indipendente da quella catabolica. Partendo da molecole di acido acetico prodotte nei mitocondri porta alla formazione di molecole di acido palmitico, un acido grasso saturo con 16 atomi di carbonio. Obiettivi La lezione propone una rapida panoramica delle caratteristiche principali della sintesi degli acidi grassi, sottolineando gli aspetti che la distinguono dal processo della β-ossidazione. Sono inoltre presi in considerazione i meccanismi di regolazione opposti di sintesi e degradazione degli acidi grassi. Sintesi degli acidi grassi: aspetti generali La biosintesi di acidi grassi è il processo biochimico che determina la produzione di acido palmitico a partire da molecole di acetato. Nell’uomo avviene nel citosol di cellule di diversi tessuti, quali: il fegato, la ghiandola mammaria, il tessuto adiposo, il rene, il cervello. Il substrato di partenza, l’acetato, deriva principalmente dal catabolismo dei carboidrati, che quindi possono essere attivamente trasformati in lipidi, mentre è impossibile, nell’uomo, il processo opposto. Passaggio iniziale necessario per il processo biosintetico è il trasporto dei gruppi acetile dal mitocondrio al citoplasma cellulare. Il trasferimento avviene in realtà tramite la fuoriuscita dal mitocondrio di molecole di citrato, flusso che avviene soprattutto quando il ciclo di Krebs è rallentato dall’abbondanzadi NADH. Nel citosol il citrato è scisso in acetil-CoA ed ossalacetato ad opera dell’enzima ATP-citrato liasi. La reazione avviene con consumo di una molecola di ATP. Mentre l’acetil-CoA è il substrato di partenza per la biosintesi degli acidi grassi, l’ossalacetato può rientrare nel mitocondrio dopo essere stato trasformato in malato e quindi in piruvato. Queste tappe sono importanti in quanto generano NADPH, la fonte di equivalenti riducenti necessari per la biosintesi riduttiva degli acidi grassi. NADH e NADPH I coenzimi NADH e NADPH hanno potenziale di riduzione identico e, dal punto di vista termodinamico, dovrebbero essere intercambiabili; in realtà, nella cellula, vengono utilizzati in modo specifico, in percorsi diversi: il coenzima NAD+ è l’agente ossidante dei processi catabolici e la sua forma ridotta viene riossidata nel contesto della respirazione mitocondriale, al fine di produrre ATP. Il coenzima NADPH viene prodotto prevalentemente nella via dei pentoso fosfati e il suo potere riducente è invece utilizzato nei processi anabolici riduttivi, quali appunto la sintesi degli acidi grassi. La prima tappa chimica nella sintesi degli acidi grassi Reazione catalizzata da acetil-CoA carbossilasi. La sintesi degli acidi grassi avviene attraverso la progressiva unione di unità bicarboniose fino alla costituzione di una molecola con 16 atomi di carbonio. Il donatore di ciascuna unità bicarboniosa non è l’acetil-CoA, ma il malonil-CoA, un acido bicarbossilico con tre atomi di carbonio. La sintesi di questa molecola rappresenta la tappa iniziale del processo anabolico ed è catalizzata dall’enzima acetil-CoA carbossilasi. Si tratta di una proteina multienzimaica che contiene biotina quale cofattore, e rende possibile la carbossilazione di una molecola di acetil-CoA a malonil-CoA, utilizzando bicarbonato come fonte di carbonio e consumando un legame altamente energetico dell’ATP. L’enzima chiave: l’acido grasso sintasi La condensazione di unità bicarboniose a formare un acido grasso è catalizzata dall’enzima denominato acido grasso sintasi. É un enzima complesso, attivo solo nella forma dimerica; ciascuna subunità è costituita da un polipeptide che contiene sette siti attivi diversi, che esplicano le sette attività enzimatiche necessarie per il processo anabolico, e la proteina trasportatrice di acili (ACP). L’unione di tutte le attività enzimatiche necessarie in un solo complesso enzimatico, consente una elevata efficienza del processo biochimico ed una sorta di compartimentalizzazione dell’attività enzimatica nell’ambito del citoplasma cellulare, anche in assenza di veri e propri confini fisici. Lo stesso fenomeno rende possibile la sintesi coordinata delle diverse attività enzimatiche. Le reazioni chimiche successive Prima reazione di condensazione. Acetil-CoA e malonil-CoA sono i substrati di partenza per la prima reazione di condensazione; essi, e tutti i metaboliti intermedi lungo il percorso che porta alla formazione di acido palmitico, si legano covalentemente al complesso enzimatico attraverso legami tio-estere, che coinvolgono due gruppi –SH dell’enzima. Uno appartiene ad una cisteina di una delle sette attività enzimatiche; l’altro fa parte del cofattore pantotenato legato alla proteina trasportatrice di acili. AcetilCoA e malonil-CoA vengono dapprima coniugati rispettivamente a questi due gruppi tiolici. Quindi avviene la condensazione tra i due substrati, con trasferimento del gruppo acetitico sul gruppo malonilico legato all’ACP; si ha così la formazione di un intermedio con 4 atomi di carbonio, legato alla ACP (acetoacetilACP), con contemporanea eliminazione di una molecola di CO2. Una serie di reazioni successive determinano la riduzione (NADPH è il donatore di equivalenti riducenti), l’idratazione e l’ulteriore riduzione (utilizzo di altro NADPH) del gruppo carbonilico, con formazione finale di butirril-ACP, un acile saturo. Successivamente si ha il trasferimento dell’acile dall’ACP al gruppo tiolico della cisteina, consentendo in tal modo la coniugazione all’ACP di una nuova molecola di malonil-CoA. Questo prelude al ripetersi delle reazioni sopra descritte, in una serie di cicli (sette) che portano al progressivo allungamento della catena carboniosa, fino alla formazione del palmitato. L’acido grasso con 16 atomi di carbonio si distacca dall’ACP e conclude il processo di sintesi. Stechiometria del processo di sintesi La stechiometria dell’intero processo anabolico è la seguente: Acetil-CoA + 7 Malonil-CoA + 14 NADPH + 20 H+ -> Palmitato + 7 CO2 + 14 NADP+ + 8 CoA + 6 H2O La sintesi del malonile necessario prevede: 7 Acetil-CoA + 7 ATP + 7 CO2 -> 7 Malonil-CoA + 7 ADP + 7 Pi + 7 H+ La sintesi di ogni molecola di palmitato richiede l’utilizzo di sette molecole diATP e di 14 NADPH prevalentemente fornito dallo shunt dei pentosi. Se la produzione di acidi grassi saturi con 16 atomi di carbonio è l’esito più frequente del percorso di sintesi degli acidi grassi, si deve ricordare che, tali acili possono essere ulteriormente allungati e modificati nella cellula, attraverso tappe enzimatiche successive, che avvengono soprattutto nel reticolo endoplasmatico. Gli epatociti dispongono anche di un enzima capace di inserire doppi legami nella catena alifatica di acidi grassi saturi, trasformandoli in composti insaturi. Il doppio può tuttavia essere inserito solo in posizione Δ 9, ovvero tra il C9 ed il C10. Ciò spiega perché l’acido linoleico e linolenico, avendo doppi legami (oltre il C), sono molecole essenziali, che devono essere apportate dall’esterno. Un altro aspetto peculiare della sintesi di acidi grassi si ha nella ghiandola mammaria: durante l’allattamento, in questo tessuto si verifica una sensibile produzione di acili con catena più corta, che finiscono nel latte materno determinandone la maggiore digeribilità. Differenze tra biosintesi e ossidazione Dal confronto tra le caratteristiche fondamentali della β-ossidazione e della sintesi degli acidi grassi si deduce come le due vie, pur apparendo dal punto di vista chimico a processi simili, ma percorsi in senso opposto, sono in realtà vie ben distinte ed indipendenti. La β-ossidazione è localizzata nei mitocondri, ha come substrato fondamentale l’acetil-CoA, produce coenzima NADH ed è favorita da una bassa carica energetica. La lipogenesi, al contrario, avviene nel citoplasma cellulare, richiede oltre all’acetil-CoA anche il malonilCoA, dipende dalla presenza di coenzima NADPH e di bicarbonato ed è favorita da un’elevata disponibilità di ATP. Viene inoltre attivata dal citrato, ed inibita dalla presenza di acili a catena lunga. PARAMETRO Sede Intermedi Legame Tioestere Agenti REDOX Dipendenza dal bicarbonato Stato energetico favorevole Attivazione da citrato Inibizione da Acil-CoA Attività massima OSSIDAZIONE Mitocondrio Acetil-CoA CoA-SH NADH No ALTO [ADP] No No Digiuno Diabete SINTESI Citoplasma Acetil-CoA e Malonil-CoA ACP-SH NADPH Sì ALTO [ATP] Sì Sì Dieta ricca in carboidrati Sintesi di trigliceridi Il destino principale degli acidi grassi neosintetizzati è quello di essere trasformati in triacilgliceroli e trasportati al tessuto adiposo per l’immagazzinamento. La sintesi dei trigliceridi prevede l’attivazione degli acili ad acil-CoA, con consumo di ATP, e la successiva coniugazione al glicerolo-3 fosfato, con formazione di acido fosfatidico. Successivamente si ha il distacco del fosfato in posizione tre e l’aggiunta di un’ulteriore acil-CoA, con definitiva produzione del trigliceride. Sintesi degli Acidi Grassi: Regolazione La sintesi di acidi grassi è un percorso anabolico fortemente regolato e lo stato nutrizionale è il fattore fondamentale che determina la velocità della lipogenesi. Essa è maggiore in condizioni di abbondanza di nutrienti (soprattutto di carboidrati), mentre risulta limitata in carenza di nutrienti oppure quando è elevato l’apporto esogeno di acidi grassi, o ancora in stati di carenza di insulina (diabete mellito). Queste ultime condizioni provocano un aumento della concentrazione plasmatica di acidi grassi liberi, che influenzano negativamente la lipogenesi, qualunque sia la loro origine (dalla dieta o dalla lipolisi del tessuto adiposo). La correlazione tra stato nutrizionale e lipogenesi si realizza attraverso meccanismi regolatori a breve e lungo termine. Nel primo caso si hanno modifiche allosteriche e covalenti degli enzimi coinvolti, nel secondo caso viene invece regolata la sintesi e quindi la quantità intracellulare degli stessi enzimi. L’acetil-CoA carbossilasi catalizza la tappa limitante della lipogenesi ed è regolata allostericamente, ed in senso opposto, da citrato e acil-CoA: il primo, segnalando una disponibilità di substrati, attiva l’enzima; il secondo esercita invece una sorta di inibizione da prodotto e blocca l’attività enzimatica. Quindi un incremento dei livelli intracellulari di acil-CoA, imputabile sia ad uno scarso utilizzo per la formazione di trigliceridi piuttosto che ad un elevato apporto con la dieta o dal tessuto adiposo, comporta in ultima istanza il blocco della litogenesi. Anche l’AMP, segnalando una bassa disponibilità di energia, rallenta l’attività dell’acetil-CoA carbossilici inducendone la fosforilazione. Anche gli ormoni intervengono a regolare la lipogenesi e l’acetil-CoA carbossilasi. L’insulina facilita in genere la lipogenesi epatica facilitando l’ingresso del glucosio negli epatociti e garantendo la disponibilità di piruvato per la sintesi di acetil-CoA. Blocca inoltre la lipolisi nel tessuto adiposo, limitando quindi l’arrivo di acidi grassi al fegato. Inoltre l’insulina stimola direttamente l’Acetil-CoA carbossilasi, mantenendola in uno stato di defosforilizazione. Il glucagone e l’adrenalina, al contrario, bloccano la lipogenesi disattivando l’enzima attraverso processi di fosforilazione cAMP dipendenti. A queste regolazioni rapide, a breve termine, si sovrappongono regolazioni di lungo termine, che modificano i livelli intracellulari degli enzimi coinvolti nella lipogenesi. Ancora una volta l’insulina esercita un effetto positivo inducendo la sintesi degli enzimi necessari per il processo anabolico, mentre il glucagone esercita un effetto opposto, di repressione. Riepilogo La sintesi degli acidi grassi è un processo anabolico che, partendo da acetil-CoA, produce acidi grassi saturi con 16 atomi di carbonio (palmitato), utilizzando ATP, NADPH e bicarbonato. Avviene soprattutto nel citoplasma degli epatociti, ad opera di due sistemi multienzimatici: l’acetil-CoA carbossilasi l’acido grasso sintasi. Avviene soprattutto quando la disponibilità di ATP e carboidrati è elevata, con lo scopo di accumulare, sotto forma di trigliceridi da inviare al tessuto adiposo, substrati energetici presenti in eccesso rispetto alle necessità momentanee dell’organismo. Per questo è una via metabolica strettamente regolata dalla disponibilità di nutrienti dell’organismo, attraverso meccanismi allosterici e ormonali che attivano o inibiscono l’acetil-CoA carbossilasi, enzima che catalizza la tappa limitante dell’intero percorso biochimico. METABOLISMO DEL COLESTEROLO Introduzione Il colesterolo è un lipide importante per numerosi animali e per l’uomo. È un componente fondamentale delle membrane plasmatiche ed il precursore di composti con funzioni essenziali quali gli acidi biliari e gli ormoni steroidei. È presente nel sangue in forma esterificata e non all’interno delle lipoproteine, che veicolano i lipidi in genere. La sua concentrazione ematica è un parametro importante in medicina in quanto è il fattore che modifica sensibilmente il rischio individuale di aterosclerosi e malattie cardiovascolari. Non è un nutriente essenziale per l’uomo in quanto può essere efficacemente sintetizzato dal fegato e dall’intestino a partire dall’unità bicarboniosa acetil-CoA. In condizioni normali, la sintesi endogena è correlata all’apporto esogeno. Obiettivi In questa lezione sono descritti i passaggi biochimici e gli aspetti regolatori più importanti del metabolismo del colesterolo. Colesterolo: Metabolismo, Ruolo, Fonti In condizioni normali, circa la metà del colesterolo dell’organismo proviene dalla biosintesi e il resto ha origine esogena. Anche se tutte le cellule nucleate sono in grado di sintetizzarlo, esso viene prodotto soprattutto dagli epatociti e dagli enterociti. Le tappe chimiche che portano alla formazione del colesterolo sono le seguenti: 1. Sintesi di mevalonato 2. Formazione di unità isoprenoidi 3. Condensazione delle unità isoprenoidi a squalene 4. Formazione di lanosterolo 5. Conversione del lanosterolo in colesterolo. Sintesi e destini del Colesterolo Sintesi del Colesterolo. La prima parte di questo processo anabolico è del tutto simile a quella che, nei mitocondri, porta alla sintesi di corpi chetonici. In questo caso però le reazioni avvengono nel citoplasma e in corrispondenza del reticolo endoplasmatico, e sono quindi distinte da quelle mitocondriali. Le tappe iniziali prevedono anche qui la condensazione di due molecole di acetil-CoA a formare acetoacetil-CoA. L’ulteriore addizione di un acetil-CoA forma il 3-idrossi-3-metilglutaril-CoA (HMG-CoA), la cui successiva riduzione porta al mevalonato. L’ultima trasformazione chimica è catalizzata dall’enzima HMG-CoA riduttasi, localizzato sulla membrana del reticolo endoplasmatico. L’enzima, in presenza di NADPH, riduce un gruppo carbossilico del HMG-CoA a gruppo alcolico. Questa è la tappa limitante dell’intero processo biochimico e la sua regolazione governa la biosintesi del colesterolo. La classe di farmaci attualmente più efficace nella riduzione della colesterolemia (statine), agisce bloccando questo enzima. Il mevalonato va incontro ad una serie di trasformazioni chimiche che, consumando ATP, portano alla formazione di molecole pentacarboniose coniugate a due fosfati (unità isoprenoiche). L’unione di sei unità isoprenoidi consente la formazione dello squalene, composto con una struttura molto simile a quella del nucleo steroideo. La ciclizzazione dello squalene forma il lanosterolo, che, in seguito a rimaneggiamenti della catena laterale e di alcuni gruppi metilici, viene trasformato in colesterolo. Destini del colesterolo. Il colesterolo neosintetizzato dal fegato può avere destini diversi. In piccola parte può essere direttamente inserito nelle membrane degli epatociti. Alternative quantitativamente più importanti sono utilizzate per la sintesi di acidi biliari oppure per l’esterificazione con un acil-CoA e la secrezione nel circolo ematico nel contesto delle lipoproteine VLDL e LDL. Nei soggetti con diete di tipo occidentale, il colesterolo plasmatico totale (prevalentemente esterificato) è di circa 5,2 mmol/L (200mg/dL). In periferia colesterolo ed esteri del colesterolo sono captati dai diversi tessuti, in base alle specifiche esigenze cellulari. La regolazione della sintesi del Colesterolo HMG CoA Riduttasi Come accennato precedentemente, la biosintesi del colesterolo è regolata in corrispondenza delle prime tappe enzimatiche e soprattutto tramite interventi sull’enzima HMG-CoA reduttasi. Anche in questo caso sono noti meccanismi di controllo con effetto rapido e meccanismi con effetti a lungo termine. La sintesi dell’enzima risulta repressa dal colesterolo stesso (o un suo metabolita), che induce anche una maggiore degradazione della proteina. Così, in condizioni normali, un elevato apporto di colesterolo con l’alimentazione inibisce la sintesi endogena. L’enzima HMG-CoA reduttasi può essere inoltre attivato o inattivato tramite meccanismi di defosforilazione/fosforilazione. Il glucagone rallenta il processo anabolico, favorendo la fosforilazone dell’enzima, mentre l’insulina ha l’effetto opposto, favorendo lo stato defosforilato. Il catabolismo del Colesterolo Colesterolo nella dieta. Il catabolismo del colesterolo non è un processo che può essere sfruttato per produrre energia. Gli acidi biliari possono essere considerati i cataboliti principali del colesterolo. Infatti la maggior parte del colesterolo eliminato quotidianamente ( il turnover del colesterolo nel corpo umano è pari a circa 800 mg/die) è rappresentato dai sali biliari secreti nell’intestino con la bile e persi con le feci. Quantità minori sono invece perse con la desquamazione cutanea e con la trasformazione in ormoni steroidei. Strategie per controllare l’ipercolesterolemia L’ipercolesterolemia è un importante fattore di rischio per malattie cardiovascolari. Molto spesso la riduzione della quantità di colesterolo apportata con la dieta non è sufficiente a garantire la regolarizzazione della colesterolemia e si deve ricorrere a terapie farmacologie. I farmaci oggi più impiegati per il controllo del colesterolo sierico sono le statine, inibitori competitivi dell’enzima HMG-CoA riduttasi, enzima chiave della sintesi del colesterolo. Di discreta efficacia sono anche le resine capaci di sequestrare gli acidi biliari nell’intestino, che impedendone il riassorbimento aumentano sensibilmente l’entità dell’eliminazione giornaliera di colesterolo. Riepilogo Il colesterolo è un lipide anfipatico con un importante ruolo strutturale nelle membrane plasmatiche. Esercita inoltre funzioni importanti sotto forma di sali biliari e ormoni steroidei. Fegato ed intestino sono gli organi in cui, nell’uomo, è più attiva la sintesi di questo composto. Si tratta di un processo biochimico che avviene nel reticolo endoplasmatico e nel citosol e che prevede tappe iniziali simili a quelle che portano alla formazione di corpi chetonici. Partendo dall’acetil-CoA, una serie complessa di reazioni chimiche forma prima HMG-CoA, successivamente squalene, lanosterolo e quindi colesterolo. In condizioni normali il processo anabolico è strettamente regolato dalla disponibilità di ATP e dal colesterolo stesso: apporti elevati di colesterolo con la dieta riducono notevolmente la biosintesi. Il catabolismo del colesterolo consiste essenzialmente nella perdita della molecola da parte dell’organismo, prevalentemente sotto forma di sali biliari nelle feci.
Scaricare
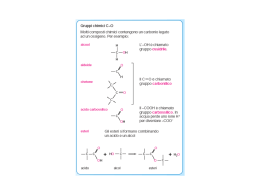

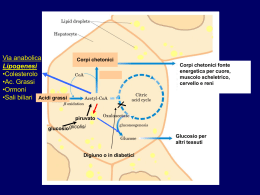

![Glucidi-Lipidi-010210 [modalità compatibilità]](http://s2.diazilla.com/store/data/000277307_1-441d3d97a43d1d65dca012877e5172ad-260x520.png)