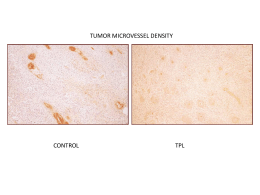
RICERCA E SVILUPPO DI SOLUZIONI SOFTWARE PER LA MEDICINA CAD: Computer-Assisted Detection Sistemi di pattern recognition basati su modelli fisicomatematici, calcolo di feature discriminanti, metodi di [email protected] classificazione come le reti neurali artificiali. Scopo: individuazione automatica di strutture e patologie nei dati biomedici (spesso, immagini diagnostiche provenienti da RM, TAC!). ADAM è un Gruppo di Ricerca e Sviluppo di soluzioni software per la Medicina. Comprende fisici, informatici, medici con esperienza comune nel campo della Fisica e dell'Informatica per la Medicina. Gli appartenenti provengono dall'Università del Salento, ma anche da altri enti, in particolare l'Università VitaSalute S. Raffaele di Milano, l'Università di Camerino, Ecomedica srl di Empoli. In ADAM ci occupiamo del trattamento avanzato di dati biomedici, soprattutto a scopo diagnostico, e operiamo in svariati campi di interesse. Esperti nel trattamento informatico delle immagini di diagnostica medica, abbiamo l'obiettivo di rendere automatiche e indipendenti dall’operatore determinate procedure medico-diagnostiche della pratica clinica, in particolare oncologica. Di recente, l’interesse si è esteso a dati biomedici di natura diversa dalle immagini diagnostiche, e stiamo sviluppando software di elaborazione dati EEG (elettroencefalografia) per la realizzazione di sistemi BCI (Brain-Computer Interface). Advanced Data Analysis in Medicine http://adam.unisalento.it [email protected] Un sistema CAD (Computer-Assisted Detection) per il glioma cerebrale e il follow-up chemioterapico in immagini di Risonanza Magnetica (MRI) e in Tensore di Diffusione (DT-MRI) L’IDEA: Advanced Data Analysis in Medicine http://adam.unisalento.it IL PROGETTO: commercializzazione di un’infrastruttura basata su un sistema software CAD (Computer-Assisted Detection) per l’individuazione e il contornamento (“segmentazione”) (semi)automatici dei tumori, e il loro follow-up terapico. Il sistema concerne in particolare il glioma, il più diffuso tumore primario del cervello, in immagini di Risonanza Magnetica “convenzionali” (T2w o FLAIR, ad esempio) e in Tensore di Diffusione (DTI o DT-MRI, Diffusion Tensor – Magnetic Resonance Imaging). Il prodotto nasce da una specifica esigenza dell’Unità di Neuroradiologia e del Centro di Eccellenza CERMAC, dell’Ist. Scientifico e Univ. Vita-Salute S. Raffaele (Milano): disporre di MRI, in cui individua e contorna il glioma. un sistema di contornamento della regione tumorale in immagini di RM, che sia stabile, oggettivo e riproducibile. Le FLAIR (FLuid Attenuated Inversion Recovery), generate da sequenze di impulsi con una pesatura in T2 e soppressione del liquido cerebrospinale, sono utilizzate per studi di volumetria del tumore a seguito di interventi terapeutici. VANTAGGI: L’imaging in tensore di diffusione (DT-MRI o DTI), tecnica La segmentazione manuale del glioma da parte del medico richiede tempo, è operazione ripetitiva affetta da errori derivanti da stanchezza, è soggettiva. Il sistema proposto solleva da questo compito il radiologo, o il radioterapista che lavora al TPS (Treatment Planning System), consentendogli di dedicarsi ad attività cliniche in cui è insostituibile. Il rapido processamento delle immagini riduce l’attesa del referto radiologico o i tempi di preparazione dei piani RT. Il CAD permette di confrontare segmentazioni realizzate a distanza di tempo. In radioterapia una miglior definizione dei margini tumorali consente di concentrare la dose nella zona malata, riducendo il rischio di necrosi in aree sane. GLIOMA EVIDENZIATO (in FLAIR) SEGMENTAZIONE AUTOMATICA IL SOFTWARE processa immagini MRI (T2w, FLAIR…) e DT- La doppia lettura indipendente di un’immagine diagnostica favorisce la qualità della diagnosi; le risorse per la Sanità non consentono, però, di incrementare a tal fine il personale medico-radiologo. Soluzione: il CAD può svolgere il ruolo di secondo lettore indipendente. di risonanza magnetica avanzata sensibile alla diffusione direzionale dell’acqua nei tessuti, permette di identificare anormalità della materia bianca dovute al glioma, che non sono visibili in MRI convenzionale, evidenziando le regioni d’infiltrazione del tumore. La Risonanza Magnetica convenzionale, infatti, non può localizzare con accuratezza le infiltrazioni microscopiche del glioma, il che rappresenta un problema in caso d’intervento chirurgico o radioterapia (che devono tener conto di un margine più esteso) e per determinare la risposta alla chemioterapia. Oltre all’individuazione e il contornamento automatici del tumore, applicazione di rilievo del software è in chemioterapia. L’efficacia del trattamento chemioterapico è attualmente valutata confrontando il volume del tumore prima e dopo il trattamento, metodica grossolana perché solo variazioni volumetriche importanti sono significative. Il CAD da noi sviluppato permette il confronto punto per punto (nelle immagini DTI) del tessuto cerebrale pre- e postchemioterapia, misurando con accuratezza il ricompattamento delle fibre (successo della terapia!) o la diffusione del tumore (fallimento della terapia). [email protected] Un sistema CAD (Computer-Assisted Detection) per il glioma cerebrale e il follow-up chemioterapico in immagini di Risonanza Magnetica (MRI) e in Tensore di Diffusione (DT-MRI) COME FUNZIONA? Il CAD per l’individuazione e la segmentazione del tumore nei Advanced Data Analysis in Medicine http://adam.unisalento.it IL CAD è d’ausilio per il medico radiologo nella fase di diagnosi del tumore; è impiegabile, in caso di chemioterapia, per valutare il successo della cura nel follow-up in base alla variazione di isotropia e anisotropia in immagini DT-MRI; è utile per la segmentazione delle immagini in fase di trattamento radioterapico. Clienti potenziali sono i medici radiologi, ma tessuti cerebrali, si basa sull’analisi statistica tessiturale in 3D: i feature tessiturali di Haralick sono adoperati per caratterizzare e discriminare tessuti patologici da quelli sani. LINEAR DISCRIMINANT ANALYSIS TESSITURE IN NATURA, e (a destra) IN UN’IMMAGINE DTI DI ANISOTROPIA IL SOFTWARE produce mappe di probabilità di presenza di tessuto tumorale e poi, in base alla soglia individuata con criteri statistici, fornisce una segmentazione e la volumetria del tumore segmentato. Un classificatore, basato su una rete neurale artificiale di tipo feed-forward, è stato allenato con ottimi risultati in termini di sensibilità e specificità. anche di radioterapia, se il sistema è integrato in un TPS (Treatment Planning System), e quindi le Aziende Sanitarie o le cliniche ospedaliere in cui essi svolgono la loro attività. Il prototipo è attualmente in fase di test presso l’Istituto Vita-Salute San Raffaele di Milano, dove sono in corso prove di accuratezza basate su prelievi istologici dei pazienti durante resezione dei gliomi. E’ prevista un’interfaccia web per la fornitura del servizio di segmentazione e follow-up. SINISTRA: MAPPA DI PROBABILITA’ (SU p). CENTRO E DESTRA: SEGMENTAZIONI p E q CONCLUSIONI: il sistema identifica bene, soprattutto nelle FLAIR e nelle immagini di isotropia, il tessuto tumorale. Esso RETE NEURALE FEED-FORWARD, ed ESEMPIO DI CURVA ROC OTTENUTA produce alcuni falsi positivi, eliminabili con approccio semiTecniche di riduzione dello spazio dei feature (PCA, LDA) sono automatico (in cui il medico identifica visualmente la regione state impiegate per ridurre la dimensionalità esaltando il tumorale, e poi usa il CAD per la segmentazione). potere discriminante dei feature. Il sistema è supervisionato! Il sistema è versatile! [email protected] Un sistema CAD (Computer-Assisted Detection) per il glioma cerebrale e il follow-up chemioterapico in immagini di Risonanza Magnetica (MRI) e in Tensore di Diffusione (DT-MRI) SI OSSERVA, AD ESEMPIO, CHE NELLE MAPPE DI ISOTROPIA p, VARIAZIONI DEI VALORI DI ISOTROPIA corrispondono a mutamenti Advanced Data Analysis in Medicine http://adam.unisalento.it APPLICAZIONE DEL CAD AL FOLLOW-UP DI PAZIENTI SOTTOPOSTI A CHEMIOTERAPIA Mappe DTI differenti forniscono informazioni differenti sul tumore: separando il tensore di diffusione nelle sue componenti isotropica e anisotropica, è possibile individuare nel tumore due regioni: la parte centrale, caratterizzata da ridotta anisotropia ed da isotropia aumentata, che corrisponde al cuore del tumore, e, attorno a questa, una regione con valori di isotropia aumentati e di anisotropia invariati; quest’ultima corrisponde all’infiltrazione del tumore. Poiché le variazioni delle modalità di diffusione delle molecole d’acqua a seguito di successo o fallimento di un trattamento chemioterapico potrebbero presentarsi prima di una variazione volumetrica del tumore, l’individuazione non invasiva di questa microscopica infiltrazione diventa fondamentale perché in grado di fornire informazioni aggiuntive nella valutazione della risposta ad un trattamento chemioterapico. nell’infiltrazione tissutale del tumore. Considerazioni analoghe valgono per le altre mappe DTI. Su questa base, il nostro CAD è stato impiegato in una procedura di valutazione dell’evoluzione del tumore, voxel per voxel anziché volumetrica. I test effettuati hanno provato che la variazione della diffusione dell’acqua nei tessuti tumorali è un indicatore dell’efficacia della cura e dell’evoluzione del tumore. COME FUNZIONA? Si acquisiscono mappe DTI prima e durante il trattamento chemioterapico; le immagini sono coregistrate, e sono prodotti grafici e mappe differenziali che rendono conto della variazione dei valori di isotropia e anisotropia punto per punto (nelle ROI individuate dal CAD), e quindi dell’evoluzione del tumore e dell’efficacia della cura. In alto: le immagini a sinistra e al centro sono FLAIR assiali acquisite prima del trattamento chemioterapico e dopo tre mesi dall’inizio: non si percepisce un’evoluzione significativa. L’immagine a destra mostra una mappa differenziale di diffusione (isotropia: p) che testimonia invece la regressione del tumore (regione blu) e quindi l’efficacia della cura. MA FUNZIONA? Il fallimento o il successo del trattamento (dedotti dalla nostra analisi) sono confermati da riscontri clinici In queste mappe differenziali di diffusione anisotropica q (riduzione/aumento di crisi epilettiche), da analisi (a tre e a sei mesi dall’inizio della chemioterapia) il nostro volumetriche su FLAIR e da analisi intraoperatorie software ha evidenziato in rosso una regione di (studi di conduzione elettrica). ricompattamento delle fibre nervose: il trattamento si sta dimostrando efficace!
Scaricare