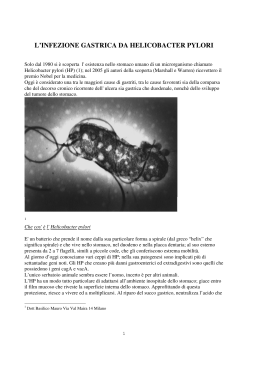
LE MONOGRAFIE DI DOCUMENTA HELICOBACTER PYLORI Riccardo Negrini* Nino Manca* * Istituto di Microbiologia e Virologia, Spedali Civili - Università di Brescia. [email protected] Monografie di Documenta pubblicate: • F. Mandler: Microbiologia dello Sputo e delle Vie Aeree Inferiori (1988) • R. Bisicchia: Microbiologia delle Gastroenteriti Batteriche e Virali (1990) • Autori Vari: Atti del Convegno - Nuove Metodiche Analitiche per l’Esame Microbiologico degli Alimenti. Milano, 5 luglio 1990 • E.M. Magliano, P. Clerici: Esame Microbiologico delle Infezioni Cervico-Vaginali (1992) • E. Gulletta: Microbiologia Clinica dell’Apparato Oculare (1992) • G. Sbaraglia: Microbiologia Clinica delle Febbri di Origine Ignota (1993) • P. Martelossi, L. Riul, G.A. Botta: Aspetti Selezionati di Microbiologia Clinica del Cavo Orale (1994) • G. Giocoli, E. Manso: Infezioni Batteriche e Micotiche della Cute (1995) • F. Mandler, S. Frugoni, D. Stangalini: Microbiologia delle Infezioni delle Vie Aeree Inferiori. Sviluppi innovativi; II edizione (1996). • D. Crotti: Aspetti Attuali nella Diagnosi delle Infezioni Intestinali. La Coprocoltura in Chiave Moderna (1997). • F. Mandler, P. Casella: Orecchio-Naso-Gola, argomenti selezionati di microbiologia clinica (1998) • G. Miragliotta: Le infezioni da catetere vascolare (1999) • E. Manso, P.E. Varaldo: La resistenza agli antibiotici negli stafilococchi (2002) DOCUMENTA Programma di Documentazione Scientifica Edizioni Scientifiche Mascia Brunelli, Biolife Indice INTRODUZIONE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pag. 5 CENNI STORICI . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 6 IL GENERE HELICOBACTER . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 7 EPIDEMIOLOGIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 10 PATOGENESI . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 11 Fattori di virulenza batterica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 11 Fattori legati all’ospite . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 12 MALATTIE ASSOCIATE ALL’INFEZIONE . . . . . . . . . . . . . . . . . . . . . . . . . » 15 Dispepsia non ulcerosa. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 15 Ulcera peptica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 15 Linfoma MALT . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 15 Carcinoma gastrico. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 16 Malattia del reflusso gastroesofageo (GERD) . . . . . . . . . . . . . . . . . . . . . . . . » 17 Malattie extragastriche . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 17 DIAGNOSI . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 18 Esami invasivi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 19 Coltura . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 19 Sensibilità agli antibiotici . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 20 Istologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 22 Test Rapido all’ureasi (RUT) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 23 Esami non invasivi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 23 Urea breath test (UBT) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 23 Sierologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 23 Ricerca dell’antigene fecale . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 25 ......................................................» 26 PROSPETTIVE DI UN VACCINO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 26 APPENDICE (LINEE GUIDA) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 27 BIBLIOGRAFIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . » 30 TERAPIA . . HELICOBACTER PYLORI 5 INTRODUZIONE La pubblicazione su Lancet nel 1983 da parte di Warren e Marshall ha rivoluzionato la gastroenterologia. Anche se i due ricercatori non sono stati i primi ad osservare la presenza di batteri di forma incurvata nello stomaco umano, a loro va dato il merito di avere indirizzato le ricerche nella giusta direzione, consentendo di ottenere uno dei più importanti successi della medicina del ventesimo secolo. La scoperta che l’H.pylori è la causa dell'ulcera ha infatti cambiato la vita di migliaia di persone. Una malattia tipicamente cronica che obbligava il paziente ad una continua assunzione di farmaci può ora essere curata definitivamente in una sola settimana con un'appropriata terapia antibiotica. L’aspetto curioso è che il primo isolamento culturale del microrganismo sia stato almeno in parte il risultato di un evento casuale. Dopo 34 tentativi andati a vuoto, le piastre seminate con le biopsie gastriche, invece di essere eliminate dopo 48 ore, furono lasciate in incubatore a causa dell'intervallo delle festività Pasquali. Solo dopo 4-5 giorni fu possibile vedere le prime colonie isolate. Gli importanti progressi fatti in questi vent'anni hanno consentito di stabilire che H.pylori non solo è la causa dell'ulcera, ma è implicato in quasi tutta la patologia che interessa lo stomaco e il duodeno e probabilmente in alcune malattie extra-gastriche. L’aspetto più importante è che il batterio rappresenta il fattore di rischio più importante per lo sviluppo di un tumore dello stomaco. Rimangono aperte importanti questioni sulla patogenesi, le strategie terapeutiche e la possibilità di sviluppare un vaccino efficace. 6 R. NEGRINI - N. MANCA CENNI STORICI 1875 Bottcher e Letulle scoprono la presenza di batteri nel fondo e nei margini di ulcere gastriche ed ipotizzano possono essere la causa dell’ulcera. 1889 Jaworski dimostra la presenza di batteri spiraliformi nel sedimento di aspirati gastrici, e li denomina Vibrio rugula. Ipotizza possano avere un ruolo nella patologia dello stomaco. 1893 Bizzozero trova spirochete nella mucosa gastrica dai cani. Nel 1996 questi batteri saranno poi denominati Helicobacter bizzozeroni. 1896 Salomon riesce a produrre un’infezione nei topi con Helicobacter bizzozeroni 1906 Krienetz evidenzia spirochete nell’aspirato gastrico di pazienti con carcinoma dello stomaco. 1938 Doenges descrive l’associazione tra gastrite e spirochete nello stomaco del Macaco e nell’uomo. 1940 Freedberg e Barron concludono che queste particolari spirochete non hanno nessun ruolo delle malattie dell’uomo 1940 Gorham suggerisce che batteri "amanti dell’ambiente acido" possono essere causa di ulcera. 1975 Steer pubblica una fotografia al microscopio elettronico che dimostra un leucocito che sta fagocitando un Helicobacter. 1983 Warren e Marshall scrivono sul ruolo del Campylobacter pylori nella gastrite. Il batterio è anche isolato per la prima volta. 1985-1987 L’ingestione di H.pylori da parte di volontari induce gastrite. 1989 Viene coniato il nuovo genere "Helicobacter", che inizialmente comprende H.pylori ed Helicobacter mustelae (prima Campylobacter mustelae) 1994 Il National Institutes of Health Consensus Development Conference conclude che l’H.pylori è la causa più importante di ulcera peptica e che tutti i pazienti con diagnosi di ulcera devono essere trattati con terapia antibiotica. 1994 Lo IARC (Organizzazione Mondiale della Sanità) classifica H.pylori come carcinogeno di prima classe. 1997 È pubblicata la sequenza completa di H.pylori. HELICOBACTER PYLORI 7 IL GENERE HELICOBACTER L’H.pylori (Figura 1) è un batterio Gram negativo della lunghezza di 2,5-5 µm, di forma curva o spiraliforme (1,5 giri), mobile per la presenza ad un polo di 1-7 flagelli capsulati, con estremità rigonfiata a bulbo. Figura 1: Immagine di H.pylori al microscopio elettronico. Ha la singolare proprietà di produrre elevate quantità di ureasi, che gli consentono di sopravvivere nell’ambiente acido caratteristico dello stomaco. Il batterio si localizza fra la mucina superficiale e l’epitelio sottostante, al quale può ancorarsi mediante specifiche proteine di adesione superficiali. L’ambiente acido sembra essere importante per la sua sopravvivenza nello stomaco. Infatti H.pylori tende ad abbandonare lo stomaco che, per effetto di una terapia con antiacidi o in condizioni patologiche (gastrite atrofica), perde la capacità di produrre acido cloridrico. In condizioni ostili assume forma coccoide, che gli conferisce proprietà di resistenza, sia nello stomaco che nell’ambiente. Il genere Helicobacter (Tabella 1) fu coniato in seguito all’osservazione che l’analisi dell’rRNA 16S dimostrava caratteristiche tali da dover configurare un nuovo genere di batteri gram-negativi microaerobici all’interno della suddivisione epsilon dei Proteobatteri. Originariamente il genere comprendeva H.pylori ed Helicobacter mustelae, quest’ultimo isolato dalla mucosa gastrica del furetto. Nel 1991 vennero incluse nel nuovo genere due specie associate a patologia intestinale, prima classificate nel genere Campylobacter: Helicobacter cinaedi e Helicobacter fenneliae. Le specie successivamente introdotte sono state isolate in parte dall’uomo e in gran parte da animali. 8 R. NEGRINI - N. MANCA Sulla base della sequenza del gene 16S, fino ad ora sono state ascritte al genere Helicobacter almeno 25 specie diverse, mentre numerose altre, identificate solo attraverso metodiche di biologia molecolare, attendono di essere ufficialmente classificate. Per comodità, gli Helicobacter possono essere raggruppati in base alla sede di colonizzazione: stomaco, intestino, fegato, vie biliari. La produzione dell’enzima ureasi sembra essere una caratteristica necessaria per la colonizzazione dello stomaco. Le specie che vivono in ambiente extra gastrico possono invece essere sia ureasi positive che negative. Esistono dati che suggeriscono che certe specie di Helicobacter possono avere un ruolo nella patogenesi di malattie extragastriche. Nel topo, Helicobacter hepaticus, il cui genoma è stato recentemente sequenziato, è una causa importante di epatite e di carcinoma epatico e rappresenta un importante modello sperimentale di carcinogenesi epatica. Nell’uomo, alcune specie di Helicobacter isolate frequentemente a livello delle vie biliari, sia nei pazienti che in soggetti normali, sono state chiamate in causa nella patogenesi della calcolosi della colecisti, della colangite sclerosante, del carcinoma del fegato e delle vie biliari. Le ricerche in questo campo sono fortemente limitate dall’assenza di uno standard per la diagnosi di questi microrganismi nella bile. Molti dei lavori pubblicati sono basati su metodiche di biologia molecolare, piuttosto che sulla diretta evidenziazione dei microrganismi. Un’importante limite di queste ricerche è infatti la difficoltà di coltivare gran parte delle nuove specie identificate e di poter quindi procedere ad una loro caratterizzazione fenotipica, oltre che molecolare. Alcune specie di Helicobacter sono state isolate dall’intestino umano. H. cinaedi, H. fennelliae, H. pullorum, H. westmeadii, H. canadensis, e H. rappini sono stati isolati da pazienti immunodepressi con sintomatologia intestinale. H. rappini è stato isolato anche in un paziente con setticemia. Non esistono ancora informazioni convincenti sul ruolo patologico di queste specie batteriche extra-gastriche, ma non è escluso che in futuro si possa dimostrare che alcune di esse possono essere agenti eziologici di alcune forme di enterite. L' Helicobacter heilmannii (ex Gastrospirillum hominis), è riconosciuto essere causa dello 0,2-0,6% delle gastriti umane. È un batterio facilmente riconoscibile per la maggiore spiralizzazione (Figura 2) Figura 2: alcuni elementi di Helicobacter heilmannii nella mucosa gastrica di un paziente con dispepsia. HELICOBACTER PYLORI 9 Helicobacter heilmannii è stato isolato in coltura solo in un’occasione. È stato geneticamente e morfologicamente correlato a H.bizzozeronii e H. salomonis, batteri presenti abitualmente nello stomaco di cani e gatti, e più recentemente anche a “Candidatus H. suis”, una specie presente nello stomaco del maiale, nel quale appare in grado di indurre gastrite e ulcera peptica. Se questi animali possono rappresentare un possibile serbatoio per l’infezione umana rimane poco chiaro. TABELLA 1: Il genere Helicobacter Specie di Helicobacter Anno di identificazione Primo isolamento Sito di identificazione H acinonyx H.aurati H.bizzozzeronii H.bilis Candidatus H.bovis H.canadensis H.canis H.cholecystus H.cinaedi H.felis H.fenneliae H.ganmani H.heilmannii H.hepaticus H.mesocricetorum H.muridarum H.mustelae H.nemestrinae H.pametensis H.pullorum H.pylori H.rappini H.rodentium H.salomonis Candidatus H.suis H.suncus H.trogontum H.typhlonicus H.winghamensis 1993 2000 1996 1995 1999 2000 1993 1996 1985 1991 1985 2001 1993 1994 2000 1992 1988 1991 1994 1994 1985 2000 1997 1997 1999 1998 1996 1999 2001 ghepardo criceto cane topo di laboratorio bovino uomo cane criceto uomo, mammiferi gatto uomo topo di laboratorio uomo topo di laboratorio criceto ratto, topo furetto maiale, macaco maiale, uccelli pollame, uomo uomo feto di agnello abortito topo di laboratorio cane maiale topo ratto topo di laboratorio uomo stomaco stomaco, intestino stomaco bile, fegato, intestino stomaco intestino feci colecisti intestino stomaco intestino intestino stomaco fegato, intestino feci intestino stomaco stomaco feci fegato, intestino stomaco fegato intestino stomaco stomaco stomaco intestino fegato, intestino intestino 10 R. NEGRINI - N. MANCA EPIDEMIOLOGIA L’infezione da H.pylori interessa più della metà della popolazione mondiale (2). La sua diffusione varia notevolmente nei vari paesi del mondo, come pure all’interno di una singola nazione. Nei paesi sottosviluppati la prevalenza può essere superiore all’80% entro i cinque anni di età, senza ulteriore sensibile aumento sopra i trent’anni. Nei paesi sviluppati la prevalenza è di solito inferiore al 10-15% sotto i quindici anni di età, e aumenta progressivamente nei decenni successivi. Il progressivo aumento della frequenza di infezione con l’età è stato inizialmente interpretato essere il risultato di un progressivo accumulo del tempo delle probabilità di venire in contatto con il batterio. Ulteriori indagini epidemiologiche hanno invece ribaltato questa interpretazione. Infatti, quando furono analizzati campioni di siero di persone di varia età, prelevati in epoche diverse, si osservò che persone della stessa età in differenti epoche non avevano le stessa prevalenza di infezione. In altre parole, i trentenni di trent’anni fa avevano una prevalenza di infezione sensibilmente superiore dei trentenni di adesso. Quindi il progressivo aumento di prevalenza di infezione con l’età è risultato essere un cosiddetto “effetto coorte”. Oggi è ampiamente accettato che l’infezione da H.pylori è contratta quasi esclusivamente nell’infanzia, specialmente sotto i dieci anni, e che i bambini di oggi hanno una probabilità di essere infetti molto più bassa di ieri. Tale variazione va senz’altro attribuita al miglioramento delle condizioni socioeconomiche che si sono verificate a partire dal dopoguerra. Una convincente dimostrazione a tale riguardo viene dal Giappone, dove esiste una drammatica differenza di prevalenza di infezione fra le persone nate prima del 1950 e quelle nate dopo il 1970, come conseguenza della progressiva occidentalizzazione del paese. Numerosi studi epidemiologici hanno dimostrato che l’infezione da H.pylori è condizionata fortemente da fattori socioeconomici, ossia un basso livello di studio, povertà, sovraffollamento, scarso livello di igiene e consumo di acqua inquinata. È stata dimostrata anche una maggiore diffusione dell’infezione a livello familiare come pure all’interno di comunità. L’H.pylori è stato isolato dalle feci. La trasmissione oro fecale potrebbe avvenire direttamente da persona a persona oppure attraverso veicoli intermedi come acqua contaminata e verdure contaminate da acque inquinate. I tentativi di isolare l’H.pylori dal cavo orale hanno dato risultati contrastanti. Sembra improbabile che il batterio possa risiedere a livello della placca dentale, mentre si ritiene probabile che possa essere occasionalmente presente nella bocca a causa di un rigurgito gastrico e che possa anche essere eliminato all’esterno attraverso il vomito. È possibile che la via oro-orale abbia un ruolo nella trasmissione verticale dalla mamma al bambino nel momento del bacio o a causa della premasticazione del cibo. Contro questa ipotesi è vi è tuttavia la dimostrazione che i dentisti, categoria a rischio di contaminazione da saliva, non hanno in realtà prevalenza di infezione superiore ai controlli. Al contrario, il personale medico che esegue esami endoscopici ha una prevalenza di infezione superiore alla norma. Un’ulteriore aspetto degno di nota è una possibile contaminazione di pazienti in corso di gastroscopia a causa di un’insufficiente sterilizzazione dell’endoscopio. Il ruolo di altri fattori, come il gruppo sanguigno, l’assunzione di alcolici, la dieta e il fumo sembra essere inconsistente. Non è escluso che, in una percentuale dei casi, l’infezione possa essere trasmessa da animali. Ad esempio, il personale addetto alla macellazione ed i bambini che hanno criceti sembrano essere più a rischio di infezione. Nell’uomo l’infezione non tende a risolvere spontaneamente se non è trattata con una terapia specifica. Sembra invece che nei bambini questa eventualità sia possibile, probabilmente per le frequenti somministrazioni di antibiotici. HELICOBACTER PYLORI 11 PATOGENESI L’H.pylori è localizzato alla superficie della mucosa gastrica (Figura 6). Il batteri solo occasionalmente contraggono rapporti di adesione con le cellule epiteliali; in gran parte rimangono immersi nel gel di muco che ricopre la mucosa gastrica, all’interno del quale si insinuano spostandosi velocemente con un movimento a cavaturaccioli. H.pylori non è in grado di oltrepassare l’epitelio e quindi di infiltrarsi nella lamina propria della mucosa. Ciò nonostante è in grado di indurre costantemente una reazione infiammatoria che interessa la mucosa in tutto il suo spessore, e che può complicarsi nelle altre più gravi malattie dello stomaco di cui H.pylori è riconosciuto essere il responsabile o il principale fattore di rischio, quali l’ulcera peptica, la gastrite atrofica e il carcinoma dello stomaco. I meccanismi alla base dell’azione patogena del batterio sono in gran parte sconosciuti. Si possono comunque distinguere fattori di virulenza batterici e fattori legati alla reazione infiammatoria dell’ospite. Fattori di virulenza batterica Alcuni fattori di virulenza sono considerati importanti per l’instaurarsi dell’infezione gastrica: la motilità ad opera dei flagelli, che permette al batterio di penetrare lo strato di muco che ricopre la mucosa, forse con l’aiuto di un’attività depolimerizzante il muco sostenuta da una o più proteasi e fosfolipasi. 2) la produzione di elevate quantità di ureasi, un enzima principalmente contenuto nel citoplasma batterico e presente anche in discreta quantità alla sua superficie. L’enzima, attraverso la liberazione di ammoniaca, permette al batterio di neutralizzare nelle immediate vicinanze l’acido cloridrico secreto dalle cellule parietali gastriche. La produzione di ureasi è un fattore fondamentale per la colonizzazione dello stomaco. L’enzima è altamente immunogeno e per questo è uno degli antigeni più studiati nella ricerca di un vaccino. 3) la capacità di aderire alla mucosa per mezzo di una o più adesine di superficie, che legandosi al loro recettore renderebbero il batterio in grado di trasmettere alle cellule il suo effetto citopatico. È stato suggerito anche un possibile effetto irritante o tossico dell’ammoniaca liberata dall’ureasi batterica. Risultati recenti sembrano tuttavia suggerire che questo meccanismo è di importanza secondaria, sia per quel che concerne un ruolo diretto dello ione ammonio, che attraverso la formazione di monocloroamine. A contatto con la cellula epiteliale H.pylori è in grado di indurre una lesione che si manifesta nella comparsa di numerosi vacuoli citoplasmatici. Tale lesione è secondaria alla produzione di una citotossina denominata VacA (Vacuolating cytotoxin A). Essa è inglobata dalla cellula epiteliale dove causa la fusione fra endosomi e lisosomi, e quindi il vacuolo. La struttura di queste citotossina, la cui sintesi è attivata in ambiente acido, sembra essere soggetta a variazioni fra i vari ceppi batterici: alcune forme sarebbero associate alla presenza di ulcera duodenale mentre altre all’assenza di lesioni infiammatorie significative o di sintomi. Tutti i ceppi di H.pylori ospitano il gene VacA, ma per ragioni sconosciute il gene è attivo solo in una percentuale dei ceppi di H.pylori. Un secondo fattore patogenetico è la CagA (cytotoxin associated gene), un’isola di patogenicità costituita da circa 30 geni. I geni sarebbero iniettati dentro la cellula epiteliale che verrebbe indotta a produrre interleuchina 8. Quest’ultima, insieme ad altre citochine prodotte nel contesto della reazione infiammatoria, esercita un’azione chemotattica sui leucociti neutrofili che accorrono dai capillari nella lamina propria fino ad infiltrarsi nell’epitelio. Il rilascio da parte dei leucociti neutrofili di proteasi e di derivati altamente reattivi dell’ossigeno può essere uno dei meccanismi attraverso i quali H.pylori causa l’ulcera peptica. Il contenuto di guanina + citosina di CagA è nettamente diverso da quello del rimanente genoma di H.pylori, suggerendo che l’isola di patogenicità sia stata acquisita dal H.pylori da un altro microrganismo. 12 R. NEGRINI - N. MANCA In alcuni studi condotti sulla popolazione dei paesi sviluppati, l’infezione da parte di ceppi di H.pylori CagA positivi è stata messa in relazione alla presenza di ulcera, gastrite atrofica e tumori dello stomaco. Questa associazione non è stata confermata in studi su popolazioni in paesi in via di sviluppo, suggerendo che lo status CagA non è un marker di patogenicità sufficientemente affidabile. Ceppi di H.pylori che contengono l’isola di patogenicità CagA di solito producono una VacA più virulenta ma le ragioni di questa associazione sono sconosciute. Un altro gene è stato recentemente identificato e denominato IceA (induced contact epithelium); è indotto in seguito a contatto del H.pylori con l’epitelio gastrico. La funzione della proteina codificata da questo gene è sconosciuta. Un ruolo patogenetico di IceA non è stato ancora dimostrato. Fattori legati all’ospite L’infezione della mucosa gastrica e duodenale da H.pylori si associa costantemente ad una reazione infiammatoria che, anche se non è sufficiente a risolvere l’infezione, determina un equilibrio più o meno costante fra il batterio e l’ospite. L’infiammazione è caratterizzata da una risposta sia immunitaria umorale che cellulare, diretta verso antigeni batterici di superficie e extracellulari. L’interazione fra il batterio e la mucosa superficiale dà origine al rilascio di fattori pro-infiammatori, in particolare interleuchina 8, che determina l’accumulo di leucociti polimorfonucleati. Le cellule epiteliali sono indotte ad esprimere antigeni di istocompatibilità di classe II, che le rendono a loro volta competenti a presentare al sistema immunitario antigeni batterici, amplificando così l’infiammazione. I numerosi mediatori dell’infiammazione presenti della mucosa gastrica, in particolare il TNF e numerose citochine (IL-6, IL-8, IL-10 leucotriene 4), anche se commissionati a controllare l’infezione, possono esercitare un effetto patologico sulla mucosa stessa. Inoltre i leucociti attivati liberano negli spazi interstiziali i radicali liberi dell’ossigeno, che tendono a produrre danni genetici sul DNA delle cellule epiteliali e dei linfociti B. Queste, mutazioni, che si accumulano con il perdurare della infezione, favoriscono la progressione verso la trasformazione neoplastica. La gastrite provocata da H.pylori può progredire verso due forme topograficamente distinte e con diverse conseguenze anatomo-cliniche: a) infiammazione prevalentemente confinata all’antro; questo pattern è di solito caratteristico dei pazienti con l’ulcera peptica. b) distribuzione multifocale, caratterizzata da coinvolgimento sia dell’antro che del corpo con progressivo sviluppo di atrofia ghiandolare (Figura 3) e di metaplasia intestinale. Questo pattern è di solito quello che si riscontra nei pazienti con carcinoma gastrico. Un’altro importante meccanismo attraverso il quale la reazione immunitaria dell’ospite può giocare un ruolo patogenetico è l’induzione di una risposta autoimmunitaria dovuta ad una cross reazione fra antigeni batterici e antigeni costitutivi della mucosa gastrica ( antigenic mimicry). Il fenomeno dell’“antigenic mimicry” è bene evidente sia nell’animale che nell’uomo. Nel topo Balb/c, fino al 30% degli anticorpi monoclonali anti-H.pylori ottenuti dalla sensibilizzazione con un pool di isolati batterici cross-reagiscono con la mucosa gastrica. Il bersaglio principale sono determinanti antigenici correlati con i gruppi sanguigni, in particolare Lewis x, Lewis y, Lewis b, e Le d (H tipo 1). Tali determinanti, di natura carboidratica, sono espressi nell’antigene O dell’LPS della maggior parte dei ceppi di H.pylori e sono anche costitutivi di glicoproteine dell’epitelio gastrico, inclusa la mucina superficiale. Nell’uomo, la presenza di infezione si accompagna per il 60-70% dei casi alla presenza nel sangue di autoanticorpi anti-stomaco. La reazione autoimmune interessa prevalentemente le mucine epiteliali, ed è particolarmente intensa nei confronti delle cellule della zona rigenerativa, probabilmente perché sono coinvolti uno o più antigeni criptici smascherati solo durante la replicazione cellulare. In circa il 20% dei pazienti infetti sono inoltre presenti anticorpi che cross-reagiscono con il canalicolo secretore delle cellule parietali, la sede della pompa protonica deputata alla secrezione di acido cloridrico (Figura 4). HELICOBACTER PYLORI 13 Figura 3: Biopsia gastrica. Paziente con grave gastrite atrofica. Si noti la quasi completa scomparsa delle ghiandole che hanno lasciato il posto ad un’intensa infiltrazione flogistica. La gastrite atrofica è causata da H.pylori ed è un’importante fattore di rischio di carcinoma gastrico. Figura 4. Autoanticorpi anti mucosa gastrica in paziente con infezione da Helicobacter pylori. Questi autoanticorpi sono in gran parte prodotti attraverso un meccanismo di cross reazione fra Helicobacter pylori e antigeni espressi in condizioni normali nell’epitelio gastrico. In questo caso gli autoanticorpi, di classe IgG, (colorazione marrone) sono diretti verso il canalicolo della cellula parietale, la sede della pompa protonica, l’enzima che produce l’acido cloridrico. 14 R. NEGRINI - N. MANCA La presenza di autoanticorpi è correlata con la gravità della gastrite, in particolare con il grado di infiltrazione leucocitaria e con la presenza di fenomeni di atrofia e di metaplasia intestinale. La natura cross-reattiva degli autoanticorpi è dimostrata dalla loro neutralizzazione dopo preadsorbimento del siero con una sospensione di H.pylori. Ceppi di H.pylori isolati da pazienti con grave gastrite atrofica hanno una maggiore capacità di indurre autoanticorpi rispetto a ceppi isolati da pazienti asintomatici. Questi dati dimostrano che nell’associazione con la gastrite atrofica, gli autoanticorpi sono più una causa che un effetto. Le ricerche mirate a definire se anche nell’uomo gli antigeni di Lewis sono il principale bersaglio della reazione autoimmunitaria crociata, hanno dato risultati contrastanti. Recenti ricerche suggeriscono che sono in causa anche altri determinanti espressi dall’antigene O dell’LPS. (risultati non pubblicati). HELICOBACTER PYLORI 15 MALATTIE ASSOCIATE ALL’INFEZIONE Dispepsia non ulcerosa Per dispepsia non ulcerosa (NUD) si intende la presenza di sintomi riferibili allo stomaco che possono simulare quelli di un’ulcera peptica in pazienti che all’esame endoscopico risultano negativi per ulcera. I sintomi sono piuttosto variabili e possono consistere in dolore, bruciore, eruttazioni, gonfiore addominale, nausea o vomito. Sono state suggerite numerose possibili cause di NUD: stile di vita, stress, ipersensibilità viscerale, alterazioni della motilità gastrica, della secrezione gastrica e l’infezione da H.pylori. Alcuni studi epidemiologici hanno dimostrato che la prevalenza di infezione è superiore nei pazienti dispeptici rispetto ai controlli. Tuttavia i risultati degli studi prospettici mirati a studiare gli effetti della terapia hanno dato risultati contrastanti. Sembra comunque risultare un miglioramento in una percentuale dei pazienti inferiore al 10%. Di conseguenza l’eradicazione dell’infezione non sembra rappresentare una terapia di elezione per questa sindrome. Ulcera peptica Una grande quantità di studi epidemiologici e clinici hanno chiaramente dimostrato che l’H.pylori è la causa di oltre il 90% delle ulcere peptiche sia duodenali che gastriche. Le ulcere H.pylori negative sono causate di solito da abuso di farmaci antiinfiammatori non steroidei (FANS). La dimostrazione più chiara del ruolo di H.pylori è che la terapia eradicante risolve quasi costantemente la storia di questa malattia, che prima era tipicamente cronica e poteva essere controllata solo attraverso l’assunzione continua di farmaci inibenti la secrezione acida. Inoltre nei pochi casi in cui la malattia recidiva è di solito presente anche una reinfezione da H.pylori. Poiché solo una percentuale dei pazienti con l’infezione sviluppa un’ulcera, devono essere chiamati in causa anche altri fattori, legati all’ospite (costituzione, farmaci, alcolici, fumo, alimentazione, stress ecc.) o al grado di virulenza di H.pylori. Il meccanismo patogenetico alla base dell’ulcera peptica è sconosciuto. Sicuramente la presenza di acido dello stomaco rappresenta una condizione importante perché l’ulcera si instauri; infatti l’inibizione della secrezione acida con i potenti farmaci oggi a disposizione è in grado di guarire la malattia, anche se non definitivamente. Inoltre pazienti le cui capacità di secernere acido sono compromesse a causa di una gastrite atrofica, anche se infetti da H.pylori, non vanno incontro ad ulcera. I dati a disposizione suggeriscono il seguente meccanismo patogenetico: la presenza di H.pylori a livello dell’antro gastrico provoca l’inibizione dei meccanismi di controllo del rilascio delle gastrina da parte delle cellule G della mucosa antrale, con conseguente ipersecrezione acida. L’aumentato carico di acido che si riversa nel duodeno induce la mucosa duodenale ad adattarsi sviluppando aree di trasformazione dell’epitelio di superficie da intestinale a gastrico (metaplasia gastrica). L’H.pylori può ora estendere l’area di infezione alle zone di metaplasia, a livello delle quali può sopravvivere. La duodenite cronica che ne deriva compromette ulteriormente la resistenza della mucosa nei confronti dell’acido, con conseguente insorgere della lesione ulcerativa. Linfoma MALT È stato ampiamente dimostrato che il linfoma che più frequentemente insorge nello stomaco, denominato linfoma MALT (mucosa associated lymphoid tissue), è indotto da un’infezione da H.pylori. La dimostrazione più convincente è che buona parte dei linfomi MALT regrediscono con l’eradicazione dell’infezione. 16 R. NEGRINI - N. MANCA Il linfoma dello stomaco si sviluppa in un organo in cui in condizioni normali non vi sono cellule linfatiche. La risposta immunologica all’infezione si manifesta con una gastrite caratterizzata dalla formazione di follicoli linfoidi e infiltrati linfoidi nella lamina propria. Si viene quindi a formare un vero e proprio tessuto linfoide commissionato alla risposta all’infezione. Istologicamente questo tessuto, più che quella di un linfonodo, riproduce l’architettura del tessuto linfoide che costituisce le placche di Peyer dell’intestino (MALT). In condizioni patologiche, all’interno del MALT gastrico si sviluppa una popolazione monoclonale neoplastica di cellule B (linfoma MALT). La patogenesi della trasformazione neoplastica è sconosciuta ma probabilmente sono in causa danni genetici sulla cellula B indotti dai radicali liberi liberati nel corso dell’infiammazione cronica ed accumulati durante gli anni di infezione. I sintomi del linfoma sono vaghi e variabili. L’aspetto endoscopico è variabile (forma diffusa, vegetante o ulcerativa). Il linfoma può anche avere una distribuzione multifocale, per cui sono necessari prelievi bioptici multipli per confermare la diagnosi. L’ecografia endoscopica consente di documentare l’entità della lesione. I linfomi che sono confinati alla mucosa o alla sottomucosa sono considerati essere causati dall’infezione da H.pylori, e la terapia eradicante è quella di elezione. Linfomi MALT che si presentano in fase più avanzata, richiedono invece un trattamento più aggressivo, quale la resezione chirurgica, la radioterapia o la chemioterapia. Il follow-up è condotto attraverso l’esame istologico e molecolare di biopsie multiple e una ecografia endoscopica dopo 3, 6 e12 mesi dalla fine della cura. L’esame istologico della mucosa gastrica in molti pazienti in fase di remissione continua a mostrare aree residue di cellule B monoclonali. Non è chiaro se queste rappresentino semplicemente una memoria immunologica dell’infezione oppure cellule neoplastiche dormienti. La ricomparsa di un linfoma MALT va comunque considerata possibile e per questo i pazienti devono essere monitorati indefinitivamente. Carcinoma gastrico Il carcinoma dello stomaco, anche se la sua prevalenza appare in forte declino, rimane la seconda causa di morte per cancro nel mondo dopo il cancro del polmone. Una grande quantità di studi epidemiologici basati sulla sierologia e sull’istologia ha dimostrato che H.pylori è il fattore di rischio principale per lo sviluppo di questa neoplasia. Per tale ragione il batterio è stato classificato da un organismo dell’Organizzazione Mondiale della Sanità (IARC, 1994) come carcinogeno di prima classe. In un recente studio prospettico su oltre 1500 soggetti giapponesi (3), è stato osservato che un cancro gastrico si sviluppava nel 2,9% dei pazienti con l’infezione entro 8 anni dall’inizio dello studio, mentre nessuna neoplasia si era sviluppata nei soggetti di controllo non infetti. Ancora più interessante, non si erano evidenziati casi di cancro nel sottogruppo di pazienti trattati con la terapia eradicante all’inizio dello studio. Gli stessi autori hanno anche dimostrato che l’eradicazione dell’infezione contribuisce ad evitare recidive nei pazienti sottoposti a intervento chirurgico per “early gastric cancer”. Un ulteriore supporto del ruolo di H.pylori viene dalla induzione di carcinomi gastrici nel modello sperimentale del “mongolian gerbil” infetto da H.pylori. I meccanismi patogenetici attraverso i quali H.pylori induce il cancro sono sconosciuti. Sono chiamati in causa diversi fattori legati alla reazione flogistica, quali l’aumentato ritmo di proliferazione cellulare, il danno ossidativo sul DNA da parte dei radicali liberi liberati dai granulociti, la diminuzione della apoptosi, la compromissione dei meccanismi di riparazione del DNA o di immunosorveglianza sull’emergere di cloni neoplastici. L’ipotesi più accettata tuttavia è che la neoplasia si sviluppi per un processo multifattoriale, dove tali fattori sono in varia misura legati al ceppo infettante, alla reazione immunitaria ed altri fattori costituzionali dell’ospite, all’alimentazione, al fumo e all’ambiente. Probabilmente lo sviluppo della neoplasia è il risultato di un danno progressivo sulle cel- HELICOBACTER PYLORI 17 lule epiteliali accumulato durante alcuni decenni di infezione da H.pylori. Il primo stadio patologico di questa progressione è la trasformazione della gastrite da superficiale ad atrofica, con associata metaplasia intestinale ed ipocloridria. È infatti riconosciuto che questo fenotipo ha maggiore probabilità di progredire verso la displasia e il carcinoma (4). In circa il 4% dei pazienti il carcinoma gastrico ha una storia di famigliarità. È stato suggerito che una delle possibili cause di questo fenomeno sia l’infezione della famiglia da parte dello stesso ceppo di H.pylori. L’eradicazione dell’infezione nei membri del nucleo familiare potrebbe quindi essere un importante strumento profilattico per lo sviluppo di questa neoplasia La famigliarità per carcinoma gastrico rappresenta infatti una delle condizioni principali in cui la terapia eradicante è raccomandata secondo le ultime linee guida stabilite dagli esperti riunitisi a Maastricht nel 2000. (Appendice). C’è un grande interesse nello stabilire se esiste un punto di non ritorno oltre il quale la terapia eradicante non sia più in grado di prevenire l’insorgenza di carcinoma. Alcuni studi hanno dimostrato un certo miglioramento nell’atrofia gastrica, mentre le metaplasia intestinale sembra non migliorare. La valutazione dell’efficacia e del rapporto costo-beneficio della eradicazione dell’infezione nella popolazione normale come misura profilattica per il cancro è uno degli obiettivi principali di alcuni importanti trials ancora in corso. Malattia da reflusso gastroesofageo (GERD) La relazione fra H.pylori e GERD, comprendendo le sue varie manifestazioni, cioè l’esofagite cronica e l’esofago di Barrett, è oggetto di controversie tra i gastroenterologi. Diversi studi hanno indicato un legame fra presenza di infezione e diminuito rischio di sviluppare esofagite da reflusso, come se l’H.pylori esercitasse un effetto protettivo verso questa malattia. Tale ipotesi è stata ulteriormente rinforzata da diverse pubblicazioni che segnalano l’insorgenza di GERD in seguito alla eradicazione dell’infezione nei pazienti con ulcera duodenale. Questo fenomeno può essere spiegato con un aumento della secrezione acida in pazienti che in precedenza avevano una gastrite estesa al corpo gastrico che ne comprometteva le capacità secretive. Contro questa ipotesi vi sono tuttavia ricerche che hanno dimostrato che la prevalenza dell’infezione nei pazienti con GERD non è diversa da quella dei controlli. Ulteriori studi saranno in grado di definire la fondatezza il significato clinico di questa relazione. Malattie extra-gastriche Esiste un’ampia letteratura che suggerisce un ruolo di H.pylori in numerose sindromi o malattie extra gastriche. Si tratta di ricerche senza dubbio molto interessanti perché danno la speranza di trovare una terapia per malattie la cui causa è sconosciuta. Le associazioni segnalate sono numerose e con malattie molto diverse fra di loro, (cardiovascolari, autoimmunitarie, allergiche, cutanee, epatiche, ematologiche, dismetaboliche, neurologiche, linfomi MALT extra gastrici, morte precoce nella culla, ritardo di crescita, glaucoma ecc.).Attualmente non vi sono dati sufficienti per trarre considerazioni realistiche su queste osservazioni. Di particolare interesse per la loro importanza, sono gli studi che riguardano l’associazione dell’infezione da H.pylori con la patologia cardiovascolare. Numerose di queste ricerche riguardano il ruolo di H.pylori, insieme a Chlamydia pneumoniae, nella patogenesi della vasculopatia coronarica, ma i risulati sono controversi. 18 R. NEGRINI - N. MANCA DIAGNOSI La diagnosi di infezione da H.pylori può essere effettuata con metodi diretti, dove il batterio è ricercato direttamente sul frammento bioptico (metodiche invasive), oppure con metodi indiretti, che offrono il vantaggio di risparmiare al paziente una fastidiosa gastroscopia. Le caratteristiche di questi tests sono riassunte nella Tabella 2. TABELLA 2: I tests per la diagnosi di infezione da Helicobacter pylori a confronto Test Sensibilità Specificità Costo Vantaggi Svantaggi INVASIVI Istologia 90-99% 90-95% +++ • Valutazione • d’insieme • Risultati tardivi Coltura/ antibiogramma 70-90% 100% +++ • Antibiogramma • Alta specificità • Risultati tardivi • Costoso • Bassa sensibilità Test rapido ureasi 80-95% 90-95% + • Economico • Rapido • Pratico • Sensibilità e specificità non ottimale NON INVASIVI Sierologia 90-99% 75-90% + • Economico • Alta sensibilità • Screening • Pratico • Bassa specificità • Non adatta al monitoraggio UBT 95-99% 99% +++ • Alta sensibilità • Alta specificità • Costo elevato • Necessaria la strumentazione • Non pratico nei bambini Antigene 70-95% 80-95% ++ • Buona alternativa a UBT (rivela infezione in atto) • Ideale nei bambini • Non necessaria la presenza del paziente • Sensibilità e specificità non elevate • Raccolta delle feci HELICOBACTER PYLORI 19 ESAMI INVASIVI Coltura L’esame colturale è il test più specifico per la ricerca dell’H.pylori, in quanto l’identificazione è effettuata dal microbiologo sulla base di precise caratteristiche morfologiche e biochimiche. La sensibilità diagnostica tuttavia non è elevata, perché dipende da numerosi fattori critici: pregressa assunzione di antibiotici o antiacidi, insufficiente carica batterica, presenza di tracce di disinfettante nelle pinze bioptiche, terreno di trasporto, terreno di coltura, esperienza e motivazione del microbiologo. Dato che esistono sistemi meno impegnativi e anche più affidabili per la diagnosi di infezione, la coltura non è utilizzata a scopo diagnostico (14), ma è comunque di fondamentale importanza perché consente di eseguire il test di sensibilità ai farmaci antimicrobici. Il paziente non deve avere assunto antibiotici e antiacidi negli ultimi 15-30 giorni. Devono essere eseguiti almeno 2 prelievi bioptici per ridurre al minimo la possibilità di campionare zone di mucosa prive di H.pylori, in quanto il batterio tende a colonizzare lo stomaco a “carta geografica”, specialmente nei pazienti con gastrite atrofica. I prelievi bioptici devono essere messi in apposito terreno di trasporto e consegnati al laboratorio entro poche ore. Possono essere utilizzati diversi terreni di trasporto, sia liquidi che semi-solidi, come la semplice soluzione fisiologica sterile, brodo nutriente, BHI (brain heart infusion), brodo Brucella, STM (Stuart’s transport medium). Le biopsie possono essere conservate in terreno di trasporto per alcune ore a temperatura ambiente e fino a 24 ore a 4°C. Il campione bioptico è di solito seminato sulla piastra dopo essere stato ridotto in piccoli frammenti, ma può anche essere seminato direttamente strisciandolo ripetutamente sulla superficie dell’agar. Sono stati descritti diversi terreni per la coltura di H.pylori. In generale possono essere utilizzati i comuni terreni per coltivare organismi “fastidiosi”, supplementati con 5-10% di sangue animale. I più comuni sono il Columbia agar, BHI, Brucella agar, agar-cioccolato. Per l’isolamento è necessario che in terreno sia addizionato di agenti selettivi, poiché essendo H.pylori un batterio a lenta crescita sarebbe facilmente soverchiato da un’eventuale flora contaminante. Questo si verifica facilmente nei pazienti con secrezione acida compromessa per una gastrite atrofica o per l’assunzione di farmaci antiacidi. La formulazione più diffusa è la seguente: vancomicina (10 mg/L), trimethoprim (5 mg/L), cefsulodin (5 mg/L), anfotericina B (5 mg/L). Data la segnalata possibilità che gli agenti selettivi possano inibire alcuni ceppi di H.pylori, si suggerisce di seminare il campione anche su una piastra di terreno non selettivo. Le piastre devono essere incubate in ambiente microaerofilo. A tale scopo possono essere usati comuni incubatori a CO2, impostati al 10% CO2, con umidità del 95% e a 37 °C. Con un’atmosfera al 5% di CO2 solo una percentuale dei ceppi può sopravvivere. In alternativa possono essere usati i sistemi disponibili sul mercato per creare un ambiente microaerofilo. Fra i più diffusi quelli basati sull’impiego di sacchetti nei quali un’atmosfera microaerofila è generata con apposite bustine, oppure sull’impiego di una giara a chiusura ermetica all’interno della quale l’atmosfera è creata con apposite buste o con bombola di gas. È sempre molto importante creare un’atmosfera satura di umidità, lasciando sul fondo della giara pochi millilitri di acqua oppure una carta assorbente impregnata di acqua. Le piastre devono essere esaminate topo 3-4 giorni. In pazienti sottoposti a recente terapia, se le piastre appaiono negative è meglio protrarre l’incubazione per qualche giorno in più. Morfologicamente le colonie sono piccole (1-2 millimetri), di forma convessa, traslucide e non emolitiche. Al microscopio sono bastoncini gram-negativi di forma curva, talora con qualche elemento spiraliforme. Quando le capacità nutritive del terreno cominciano ad esaurirsi i batteri assumono velocemente la forma coccoide, e perdono vitalità. Questo processo può avvenire anche in poche ore, compromettendo la possibilità di eseguire successivi passaggi. 20 R. NEGRINI - N. MANCA L’identificazione è confermata attraverso le prove biochimiche dell’ureasi, catalasi, e ossidasi, per i quali il batterio dà una reazione positiva. Ulteriori prove biochimiche utili sono la positività per le fosfatasi alcalina, le negatività per idrolisi dell’ippurato e la riduzione del nitrato, la resistenza all’acido nalidixico. Per la lunga conservazione dei ceppi si può usare la liofilizzazione, ma molto efficace è anche il congelamento in sospensione. Ottimi risultati si possono ottenere sospendendo colture giovani (entro il terzo giorno) in soluzione fisiologica o PBS sterili supplementate con 10% di siero fetale bovino e 20% di glicerina. Le provette congelate possono essere conservate fino al 1-2 anni a -80 °C, ed indefinitivamente in azoto liquido. Sensibilità agli antibiotici. Purtroppo nella pratica di routine sono pochi i gastroenterologi che eseguono un prelievo bioptico in più da destinare al saggio per la sensibilità agli antibiotici prima di sottoporre il paziente alla terapia eradicante. Se da un lato questo è comprensibile, sia per motivi economici e sia perché le terapie oggi a disposizione garantiscono il successo nell’80-90% dei casi, dall’altro questa condotta espone il paziente al rischio di assumere antibiotici inutili. Un altro aspetto negativo non meno importante è che una terapia non appropriata e l’uso indiscriminato degli antibiotici favorisce l’emergere di resistenze primarie e secondarie. L’aumento di resistenza dell’H.pylori ai principali antimicrobici, impiegati per le terapie dell’infezione, ha subito in questi anni un grave incremento in tutto il mondo. In Europa attualmente la resistenza al metronidazolo è variabile dall’11 al 70%, mentre per la claritromicina arriva fino al 15%. Numerose meta-analisi hanno dimostrato che la resistenza al metronidazolo o alla claritromicina sono un’importante fattore predittivo di fallimento della terapia. Purtroppo, anche se è chiaro che quando la terapia è guidata da un test di sensibilità agli antibiotici la percentuale di successo aumenta notevolmente, ragioni economiche da un lato e disponibilità di metodiche diagnostiche alternative alla coltura dall’altro, hanno fanno preferire l’approccio terapeutico empirico, seguendo protocolli predefiniti. La tendenza della maggior parte dei centri è quella di eseguire il test di sensibilità solo nei pazienti nei quali la terapia è fallita una, o più spesso due volte. Diventa quindi di importanza fondamentale utilizzare un protocollo terapeutico ideale per prevenire l’insuccesso della terapia e il successivo emergere di ceppi resistenti come risultato di un trattamento non ottimale. Sebbene sia raccomandato che questa scelta sia basata su risultati locali di sensibilità agli antibiotici, pochi paesi hanno sviluppato sistemi di sorveglianza regionale. Tale inerzia è dovuta in parte ai problemi di testare un organismo che cresce con una certa difficoltà, e in parte alla difficoltà di interpretare dati di sensibilità ottenuti con metodiche non standardizzate, compromettendo la corrispondenza con i risultati ottenuti in vivo. Il National Committee for Clinical Laboratory Standards (NCCLS) ha pubblicato delle linee guida per l’esecuzione del test con il sistema della diluizione in agar: si suggerisce l’impiego di Mueller-Hinton agar base con 5% di sangue di pecora e incubazione di 72 ore a 35°C. Il metodo della diluizione è però laborioso e quindi poco applicabile alla attività di routine. La British Society for Antimicrobial Chemotherapy (BSAC) ha fornito le linee guida per l’Epsilometer test (Etest), indicando l’uso di una sospensione colturale di 2-3 giorni (MacFarland 3), seminata con tampone su terreno Mueller-Hinton con 5-10% di sangue e incubazione in microaerofilia per 3-5 giorni. La figura 5 illustra un esempio di MIC determinata con Etest su H.pylori. HELICOBACTER PYLORI 21 Figura 5: H.pylori resistente al metronidazolo con Etest (MIC>32 µg/ml) Gli studi riguardanti il confronto fra l’Etest e il metodo della diluizione in agar hanno dimostrato una buona corrispondenza per la claritromicina e l’amoxicillina (7). Per il metronidazolo nessuno dei due metodi ha dimostrato una buona riproducibilità. Non è chiaro se questi risultati variabili siano da imputare alle condizioni di incubazione. Per quel che riguarda il metodo con i dischetti di antibiotico (Kirby Bauer) vi sono problemi legati all’instabilità del gradiente antibiotico nell’agar, alla lenta crescita del batterio e non esistono ancora metodi standardizzati. Sono necessari ulteriori sforzi per definire dei precisi protocolli di esecuzione del test di sensibilità agli antibiotici e per organizzare sistemi di controlli di qualità per aumentare la riproducibilità di questo esame. Tali progressi forniranno la base per organizzare adeguati controlli sia nazionali e internazionali sulla diffusione dell’antibioticoresistenza, e quindi di guidare il protocollo terapeutico ottimale su base locale. Studi recenti di biologia molecolare hanno messo in evidenza che la resistenza di H.pylori agli antibiotici è dovuta a mutazioni puntiformi. Sono già a disposizione tests per determinare la resistenza alla claritromicina basati sulla determinazione di alcune mutazioni sul gene che codifica per l’RNA ribosomiale 23S. Al momento attuale non esistono ancora metodi altrettanto efficaci per diagnosticare la resistenza al metronidazolo. Anche i meccanismi che sono alla base dei rari casi di resistenza ad amoxicillina e tetraciclina sono stati recentemente chiariti. Lo sviluppo dei metodi di biologia molecolare rappresenta uno degli obiettivi più interessanti della ricerca poiché il test molecolare presenta due fondamentali vantaggi rispetto alla metodica colturale: maggiore affidabilità e risultati in tempi più rapidi. L’applicazione futura più importante di questi test è la loro esecuzione su un campione fecale, rendendo così possibile determinare la resistenza agli antibiotici senza ricorrere all’esame endoscopico. 22 R. NEGRINI - N. MANCA Istologia In questo esame la ricerca di H.pylori è eseguita dal patologo durante l’esame istologico di routine per diagnosticare il tipo lesione gastrica. Si tratta quindi di un test economico e che non richiede un prelievo bioptico in più da parte del gastroenterologo. Nei centri in cui l’esame istologico è effettuato di routine, la ricerca del batterio mediante istologia, se eseguita da un buon patologo, è un test altamente sensibile e specifico. Possibili falsi negativi possono essere originati da un esame superficiale di una sezione che presenta pochissimi elementi batterici oppure di un campione singolo effettivamente privo di batteri, come può accadere nei pazienti con gastrite atrofica. La sensibilità dell’esame istologico è aumentata quando sono esaminati almeno due prelievi bioptici e quando siano esaminate anche vetrini preparati con colorazioni speciali oltre a quella di base con ematossilina ed eosina (Giemsa, arancio di acridina,Warthin-Starry, Genta) (Figura 6), Possibili falsi positivi possono essere originati dalla presenza nello stomaco di flora batterica contaminante, condizione che si verifica nei pazienti con grave gastrite atrofica o sotto terapia prolungata con farmaci inibitori della pompa protonica. In questo caso è utile eseguire una reazione immunoistochimica, attraverso la quale gli anticorpi animali specifici coloreranno specificamente e intensamente solo l’H.pylori. Questa reazione è particolarmente utile anche per diagnosticare la presenza di forme coccoidi di H.pylori. Figura 6: Sezione istologica di biopsia gastrica di un paziente con dispepsia. Numerosi elementi batterici di Helicobacter pylori alla superficie dell’epitelio gastrico. (colorati in nero con la metodica di Genta) HELICOBACTER PYLORI 23 Test rapido all’ureasi (RUT) L’H.pylori produce grandi quantità di ureasi che, trasformando l’urea in ammoniaca e bicarbonato, permette al batterio di neutralizzare localmente l’acido prodotto dalle ghiandole gastriche. Poiché l’ureasi non è prodotta dal corpo umano la sua presenza nel campione di mucosa gastrica è indicativa della presenza di H.pylori. Nel RUT una biopsia gastrica è aggiunta ad un terreno liquido o substrato solido contenente urea e un indicatore colorato di pH. La presenza di urea nel campione determinerà la produzione di ammoniaca e il conseguente viraggio del colore dell’indicatore. Il test è in commercio in diversi formati: terreno liquido, gel su supporto solido, o direttamente su carta. I vantaggi di questo test sono la sua economicità e la rapidità di esecuzione. La sensibilità del RUT dipende dal dispositivo usato, dalla quantità di batteri presenti nel campione, dal numero di biopsie esaminate e dall’intervallo di tempo che passa prima di interpretare il risultato. La maggior parte dei casi positivi diventano tali entro tre ore, mentre quando la carica batterica è scarsa il viraggio può avvenire anche dopo diverse ore. In quest’ultimo caso il risultato va interpretato con cautela poiché sono possibili falsi positivi causati dalla scarsa quantità di ureasi prodotte da un’occasionale flora contaminante presente nello stomaco, in pazienti con ipocloridria. La sensibilità del test tende a diminuire nei pazienti sottoposti a recente terapia eradicante; per questo è stato suggerito di non utilizzarlo prima di 6 mesi dalla fine della terapia. Il RUT presenta in generale ottime caratteristiche di sensibilità e specificità diagnostica, ed è entrato nella routine di molti ambulatori di endoscopia digestiva. ESAMI NON INVASIVI Urea breath test (UBT) Per la sua elevata sensibilità e specificità, l’UBT rappresenta il test non invasivo più accurato, sia per diagnosticare l’infezione che per diagnosticare il successo della terapia eradicante. Esso si basa sulla assunzione di una bevanda contenente urea marcata con 13C o 14C. Una volta nello stomaco, in presenza di H.pylori, l’urea è rapidamente trasformata in CO2 marcata ed ammoniaca. La CO2 marcata entra in circolo ed è eliminata con il respiro entro 15-30 minuti, dove può essere misurata con un apposito strumento. Per il 14C UBT è necessario uno scintillatore a raggi beta, mentre per l’analisi della 13CO2 uno spettrometro di massa. La sensibilità dell’UBT è superiore al 95% e la specificità si avvicina al 100%. La sensibilità può essere aumentata addizionando acido citrico alla bevanda contenente l’urea; in questo modo si ottiene un rallentato svuotamento dello stomaco, favorendo la permanenza in loco dell’urea marcata. Possibili falsi negativi sono in genere dovuti ad altri batteri presenti nello stomaco in pazienti con gastrite atrofica oppure in seguito a recente terapia antibiotica. L’esame quindi deve essere eseguito almeno dopo un mese dalla fine della terapia. I fattori che ne limitano l’impiego sono l’elevato costo e la necessità di disporre dell’apposita strumentazione. Altri aspetti negativi sono la difficoltà a raccogliere un campione di respiro nei bambini piccoli e nei pazienti con insufficienza respiratoria. L’UBT rimane comunque il “gold standard” della diagnosi di infezione da H.pylori e su questo test vengono di solito validati gli altri sistemi diagnostici. Sierologia La determinazione di anticorpi anti-H.pylori nel siero offre importanti vantaggi rispetto ad altre metodiche: oltre ad essere non invasiva, è sensibile, economica, pratica e non è in- 24 R. NEGRINI - N. MANCA fluenzata dalla precedente assunzione di farmaci antiacidi. È inoltre il test ideale per indagini epidemiologiche o di screening della popolazione. L’aspetto negativo della sierologia sono i falsi positivi dovuti alla frequente presenza in circolo di anticorpi anamnestici. La presenza di livelli elevati di anticorpi è invece altamente predittiva di una infezione in atto. Sul mercato esistono numerosi kits diagnostici; la metodica impiegata è generalmente un’ELISA quantitativo di tipo indiretto, dove una diluizione del siero umano è messa a contatto con una fase solida sensibilizzata con antigeni di H.pylori. La presenza di immunoglobuline ancorate alla fase solida è poi rilevata con un secondo l’anticorpo anti immunoglobuline umane coniugato con enzima ed infine con il substrato cromogeno. Sulla base della curva di taratura le densità colorimetriche vengono trasformate in valori di concentrazione, di solito espressi in unità arbitrarie/ml. Dopo numerosi studi per valutare l’importanza della determinazione delle singole classi di immunoglobuline si è concluso che il test più affidabile è quello basato sulla ricerca delle IgG. Infatti la ricerca delle immunoglobuline di classe IgM, che teoricamente dovrebbero essere utili per diagnosticare un’infezione recente, di fatto si è rivelata inaffidabile per la scarsa specificità di questi anticorpi. La ricerca delle IgA produce risultati sovrapponibili a quelle delle IgG, ma può essere utile per dirimere i casi dove la determinazione delle IgG ha dato valori dubbi. La sensibilità del test sierologico è in genere molto elevata, forse anche superiore a quella del breath test. I valori di specificità sono invece variabili (75%-90%) in rapporto con il sistema impiegato, ma anche al valore soglia utilizzato. Alcuni lavori hanno infatti messo in evidenza che la performance di un kit migliorava quando il cut-off era modificato sulla base dei risultati locali. Il sistema sierologico ideale è quello che non solo presenta una buona sensibilità e specificità ma riduce al minimo i valori borderline. Un altro aspetto importante è il grado di linearità della curva standard in base alla quale vengono effettuate le misurazioni delle concentrazioni di anticorpi, espressa abitualmente in unità arbitrarie. Quanto più la curva di calibrazione è lineare tanto più il valore è preciso e riproducibile. Questo aspetto è particolarmente importante quando si vuole utilizzare il test sierologico per diagnosticare l’effetto della cura. Il titolo anticorpale scende lentamente dopo l’eradicazione, e diminuisce in media del 50% dopo 6 mesi. È stato stabilito che solo dopo questo periodo la sierologia può essere affidabile nel predire l’avvenuta eradicazione. Una maggiore riproducibilità del valore sierologico potrebbe probabilmente rendere possibile la diagnosi di guarigione entro 3 mesi dalla fine della cura. Va inoltre sottolineato che con i comuni test sierologici è misurata l’attività anticorpale globale (policlonale) verso i numerosi antigeni presenti nella fase solida del kit, dove tali antigeni sono di solito rappresentati da preparazioni grezze di omogenati batterici. La cinetica della diminuzione del tasso delle singole specificità anticorpali verso ciascuno di questi antigeni è eterogenea, in altre parole anticorpi verso alcuni antigeni scendono molto rapidamente e altri molto lentamente. Queste caratteristiche sono già state evidenziate in precedenza con la metodica più imdaginosa del Western blotting. Un miglioramento tecnologico della scelta dell’antigene, con l’esclusione degli antigeni nel secondo tipo potrebbe portare allo sviluppo di kits dove la caduta del titolo anticorpale appare molto più rapida. Il vantaggio che ne deriverebbe sarebbe duplice: non solo la possibilità di diagnosticare l’avvenuta guarigione più precocemente ma soprattutto la diminuzione dei falsi positivi alla diagnosi di infezione dovuti alla presenza di anticorpi anamnestici. Un’importante applicazione della sierologia è il suo impiego nel formato “test rapido”, eseguibile nello studio medico o dal paziente stesso. Attualmente i sistemi a disposizione, in genere di tipo immunocromatografico o di agglutinazione al lattice, hanno sensibilità inferiori al sistema ELISA, mentre la specificità sembra essere uguale (70%-80%). I pazienti con infezione da Helicobacter heilmannii danno di solito un risultato falsamente negativo con i comuni kit del commercio. I tests basati sulla ricerca di anticorpi nella saliva e nelle urine hanno dimostrato di avere utilità limitata in confronto alla sierologia. HELICOBACTER PYLORI 25 Ricerca di antigene fecale La ricerca di materiale antigenico di H.pylori nelle feci è una metodica non invasiva che, a differenza della sierologia ed analogamente all’UBT, offre la possibilità di diagnosticare una infezione in atto. Può essere quindi usata non solo nella diagnosi, ma anche per valutare l’effetto della terapia già dopo un mese dalla fine della stessa. Il primo sistema introdotto, e ancora ampiamente utilizzato, consiste in un ELISA tipo “sandwich” basato sull’impiego di immunoglobuline policlonali di coniglio. La sensibilità e la specificità di questo test sono comprese tra il 70 e il 97%, secondo quanto riportato dalla letteratura (8,9,11). L’accuratezza è quindi accettabile, ma inferiore a quella dell’UBT. Per questo il test fecale è attualmente considerato solo una valida alternativa all’ UBT, particolarmente utile quando quest’ultimo non è disponibile. Importanti vantaggi possono derivare dall’introduzione di sistemi basati su anticorpi monoclonali al posto di antisieri policlonali. Gli anticorpi monoclonali offrono infatti maggiori garanzie di specificità e di riproducibilità fra diversi lotti di kits. Sistemi diagnostici di questo tipo sono stati recentemente introdotti nel commercio ma necessitano ancora di una sufficiente validazione clinica. Se le performances si dimostreranno simili a quelle del UBT, il test fecale potrebbe essere paragonabile o anche preferibile a quest’ultimo, in quanto presenta i seguenti vantaggi: 1) non necessita della costosa strumentazione necessaria per effettuare l’UBT, e quindi è più economico; 2) può essere eseguito nei pazienti in cui l’UBT non è facilmente eseguibile (bambini piccoli e pazienti con insufficienza respiratoria); 3) non richiede la presenza del paziente; 4) il paziente non deve assumere alcuna sostanza. 26 R. NEGRINI - N. MANCA TERAPIA La terapia ideale, basata su un singolo farmaco che garantisca la guarigione in oltre 95% dei pazienti, purtroppo ancora non esiste. Le migliori terapie attualmente a disposizione sono combinazioni di almeno tre o quattro farmaci da assumere per una o due settimane. L’esistenza di diversi protocolli terapeutici e il continuo accumularsi di nuovi dati sono spesso fonte di confusione per i medici generici che si trovano ad affrontare questo comune problema. Va innanzitutto evitato l’uso di terapie con solo uno o due farmaci. Approcci di questo tipo infatti non superano il 50% di efficienza. È meglio abbinare ad uno o due farmaci antimicrobici un potente farmaco inibitore della secrezione acida. In questo modo si garantisce una maggiore efficienza degli antibiotici, si inibisce la crescita dell’ H.pylori, e si aumenta la sensibilità del batterio al metronidazolo. La resistenza agli antibiotici è un problema che sta diventando sempre più grave. Nel prescrivere una terapia bisognerebbe tener conto, quando possibile, della prevalenza locale della resistenza a ciascuno dei farmaci antimicrobici usati. La resistenza al metronidazolo è elevata nei paesi in via di sviluppo. In Europa è compresa fra il 5 e il 70%. La resistenza alla claritromicina è compresa fra il 5 e il15%. La resistenza a tetraciclina e amoxicillina sono rare. Numerose ricerche hanno dimostrato che quando il ceppo infettante è sensibile ad entrambi gli antimicrobici impiegati la percentuale di guarigione si avvicina al 100%. Quando il ceppo infettante e resistente ad almeno un antibiotico il rischio d’insuccesso aumenta ma rimane accettabile. Quando c’è resistenza a due antibiotici le probabilità scendono sotto il 50%. Il valore soglia per la resistenza al metronidazolo (MIC) è stabilito in 8 mg/ml. Tuttavia non c’è significativa associazione tra resistenza all’antimicrobico e fallimento della terapia fino a quando la MIC è inferiore a 32 mg/ml. Il valore soglia di MIC per la claritromicina è 2 mg/ml. Non c’è significativa associazione tra resistenza e fallimento della terapia finché la MIC è inferiore a 32 mg/ml. Nel 2000 si sono riuniti a Maastricht i maggiori esperti mondiali per redigere le linee guida sulla terapia, la diagnosi, e le strategie da seguire per la gestione dei pazienti e della popolazione asintomatica con infezione da H.pylori. I risultati di questo incontro, inclusi i protocolli terapeutici raccomandati, sono riassunti nell’appendice. L’alta prevalenza dell’infezione da H.pylori nel mondo, il suo ruolo di fattore di rischio di neoplasie dello stomaco, insieme all’emergere del fenomeno dell’antibiotico resistenza, rendono di prioritaria importanza scoprire nuovi farmaci ed introdurre adeguate misure profilattiche per contrastare l’infezione. PROSPETTIVE DI UN VACCINO Le ricerche effettuate su un modello animale hanno mostrato risultati incoraggianti. Nell’uomo i risultati delle sperimentazioni cliniche in fase I hanno dimostrato la sicurezza delle diverse preparazioni antigeniche in fase di studio, incluse quelle basate sulla ureasi. I primi dati sulla efficacia di questi vaccini saranno disponibili solo fra alcuni anni.. APPENDICE 27 APPENDICE Linee guida messe a punto dal Gruppo Europeo di Studio sull’ Helicobacter pylori al Consensus Report di Maastricht del 2000, per rendere uniforme il trattamento dei pazienti con infezione da Helicobacter pylori. Argomenti chiave trattati • Gestione dell’infezione da H.pylori in medicina generale • Gestione a livello specialistico • L’infezione da H.pylori come argomento di salute pubblica Chi trattare? Come trattare Tre livelli di raccomandazioni: • fortemente raccomandato • consigliabile • incerto Ogni livello di raccomandazione è suddiviso su cinque livelli 1. Studi ben programmati ed appropriatamente controllati 2. Studi caso-controllo o di coorte ben disegnati, talora studi non metodologicamente corretti o evidenze indirette convincenti 3. Case reports, studi seri metodologicamente non corretti o evidenze indirette suggestive 4. Esperienze cliniche 5. Evidenze insufficienti per formulare una opinione Chi trattare? Indicazioni fortemente raccomandate INDICAZIONI (H.pylori positivi) EVIDENZE SCIENTIFICHE (livello) Ulcera duodenale/ulcera gastrica attiva o non, inclusa l’ulcera pilorica complicata 1 Linfoma MALT 2 Gastrite atrofica 2 Gastroresecati per carcinoma 3 Parenti di 1° grado di pazienti con cancro gastrico 3 Pazienti che lo desiderano, ma dopo consultazione medica 4 28 R. NEGRINI - N. MANCA Affermazioni rilevanti INDICAZIONI (H.pylori positivi) EVIDENZE SCIENTIFICHE Dispepsia funzionale • L’eradicazione dell’ H. pylori è una opzione appropriata. • L’eradicazione porta ad un miglioramento sintomatico a lungo termine in una parte dei pazienti. Malattia da reflusso gastroesofageo (GERD) • L’eradicazione dell’H. pylori non è associata con lo sviluppo della GERD in gran parte dei casi • L’eradicazione non peggiora una GERD esistente • H. pylori dovrebbe essere eradicato, comunque, in pazienti che necessitano di terapia antisecretiva a lungo termine FANS L’eradicazione dell’H.pylori • riduce l’incidenza di ulcera, se effettuata prima dell’uso dei FANS • da sola è insufficiente a prevenire il sanguinamento recidivante da ulcera in soggetti ad alto rischio che utilizzano FANS • non migliora la guarigione dell’ulcera gastrica o duodenale nei pazienti in terapia antisecretiva che continuano ad assumere FANS. • H. pylori e FANS/aspirina sono fattori di rischio indipendenti per l’ulcera duodenale. 2 2 3 3 3 2 2 1 2 Come trattare Il trattamento deve essere attuato secondo associazioni che tengano in considerazione contemporaneamente terapie eradicanti di prima e seconda scelta (possono variare i dosaggi approvati localmente come, ad esempio, per il metronidazolo). Terapia di prima scelta IPP (o RBC) a dosi standard bid + Claritromicina 500 mg bid (C) + Amoxicillina 1000 mg bid (A) o Metronidazolo 500 mg bid (M)* per almeno 7 giorni. *C+A è preferibile a C+M perché dà modo di ottenere risultati migliori in caso di trattamento di seconda scelta con quadruplice terapia. In caso di fallimento: Terapia di seconda scelta IPP a dose standard bid + Bismuto (subsalicilato/subcitrato) 120 mg qid + Metronidazolo 500 mg tid + Tetraciclina 500 mg qid per almeno 7 giorni. Se non è disponibile il bismuto, dovrebbe essere usata una triplice basata su IPP. APPENDICE 29 Un nuovo insuccesso dovrebbe essere gestito caso per caso. Antibiotici specifici per l’H.pylori, probiotici e vaccini potrebbero in futuro entrare a far parte dell’armamentario terapeutico tuttavia, allo stato attuale, non possono essere formulate raccomandazioni per il loro utilizzo. Punti chiave selezionati Strategie di management • Un approccio “test and treat” dovrebbe essere utilizzato in pazienti adulti con dispepsia persistente di età <45 anni (il cut-off per l’età può variare localmente) dopo aver escluso i pazienti: con sintomi prevalenti di GERD, che utilizzano FANS, con sintomi d’allarme o con storia familiare di cancro gastrico. • La diagnosi di infezione dovrebbe essere effettuata con UBT o test fecale. • Andrebbe sempre confermata l’eradicazione con UBT o endoscopia se questa è clinicamente indicata. Il test fecale è un valido test alternativo se non è disponibile l’UBT. • In pazienti con ulcera duodenale non complicata non è necessario che la terapia eradicante sia seguita da ulteriore trattamento antisecretivo. • Se fallisce la terapia quadruplice di secondo livello in primary care, il paziente va inviato allo specialista. • L’eradicazione non è generalmente indicata per malattie extradigestive. Problemi di salute pubblica • Una strategia “search and treat” è raccomandata per pazienti con ulcera peptica in terapia antisecretiva a lungo termine o intermittente. • Dovrebbero essere realizzati programmi di sorveglianza per le resistenze visto che la resistenza alla claritromicina influenza l’efficacia del trattamento di prima scelta. • H. pylori è un fattore eziologico riconosciuto per il cancro gastrico non cardiale. Sebbene una percentuale importante di cancro gastrico possa essere attribuita all’infezione da H. pylori, solo una minoranza dei soggetti infetti svilupperà cancro gastrico. • La popolazione generale asintomatica non dovrebbe essere screenata per l’infezione da H.pylori allo stato attuale. Pazienti pediatrici Maastricht 2-2000 condivide le opinioni del documento dell’EH.pyloriSG e dell’ESPHHAN (J. Pediatr. Gastroenterol. Nutr. 2000;30:208-13). 30 R. NEGRINI - N. MANCA BIBLIOGRAFIA RECENTE CONSIGLIATA 11. Suerbaum S, Michetti P. Helicobacter pylori infection. N Engl J Med. 2002;347:1175-86. 12. Go MF. Review article: natural history and epidemiology of Helicobacter pylori infection. Aliment Pharmacol Ther. 2002 Mar;16 Suppl 1:3-15. 13. Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, Sasaki N, Schlemper RJ. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med. 2001;345:784-9. 14. Sipponen P. Gastric cancer: pathogenesis, risks, and prevention. J Gastroenterol. 2002;37 Suppl 13:39-44. 15. Nedrud JG, Blanchard SS, Czinn SJ. Helicobacter pylori inflammation and immunity. Helicobacter. 2002;7 Suppl 1:24-9. 16. McNulty C, Owen R, Tompkins D, Hawtin P, McColl K, Price A, Smith G, Teare L; PHLS Helicobacter Working Group. Helicobacter pylori susceptibility testing by disc diffusion. J Antimicrob Chemother. 2002;49:601-9. 17. Glupczynski Y, Broutet N, Cantagrel A, Andersen LP, Alarcon T, Lopez-Brea M, Megraud F. Comparison of the E test and agar dilution method for antimicrobial suceptibility testing of Helicobacter pylori. Eur J Clin Microbiol Infect Dis. 2002;21:549-52. 18. Kabir S. Review article: clinic-based testing for Helicobacter pylori infection by enzyme immunoassay of faeces, urine and saliva. Aliment Pharmacol Ther. 2003;17:1345-54. 19. Gisbert JP, Pajares JM. Diagnosis of Helicobacter pylori infection by stool antigen determination: a systematic review. Am J Gastroenterol. 2001;96:2829-38. 10. Ndip RN, MacKay WG, Farthing MJ, Weaver LT.Culturing Helicobacter pylori from Clinical Specimens: Review of Microbiologic Methods. J Pediatr Gastroenterol Nutr. 2003;36:616-22. 11. Basset C, Holton J, Ricci C, Gatta L, Tampieri A, Perna F, Miglioli M, Vaira D. Review article: diagnosis and treatment of Helicobacter: a 2002 updated review. Aliment Pharmacol Ther. 2003;17 Suppl 2:89-97. BIBLIOGRAFIA 31 12. Versalovic J. Helicobacter pylori. Pathology and diagnostic strategies. Am J Clin Pathol. 2003 Mar;119(3):403-12. 13. Moayyedi P. Helicobacter pylori test and treat strategy for young dyspeptic patients: new data. Gut. 2002;50 Suppl 4:47-50. 14. Zullo A, Hassan C, Lorenzetti R, Winn S, Morini S. A clinical practice viewpoint: to culture or not to culture Helicobacter pylori? Dig Liver Dis. 2003;35:357-61. 15. Del Giudice G. Towards the development of vaccines against Helicobacter pylori: status and issues. Curr Opin Investig Drugs. 2001;2:40-4. RINGRAZIAMENTI Si ringrazia il Dott. Vincenzo Villanacci, patologo presso gli Spedali Civili di Brescia, per avere fornito alcune delle immagini istologiche mostrate nella presente pubblicazione. .
Scarica