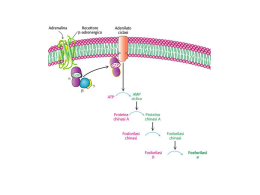
Metabolismo del galattosio Riserve energetiche nell’uomo Fuel Tissue Fuel Reserves (g) (kcal) Glycogen Liver 70 280 Glycogen Muscle 120 480 Fat Adipose 15,000 135,000 Protein Muscle 6,000 24,000 ØIl glicogeno è un polimero del glucosio. Viene costruito a partire da molecole di glucosio in tessuti come il fegato ed il muscolo scheletrico che lo immagazzinano come riserva di carboidrati e di energia. ØNon è il solo materiale energetico immagazzinato dagli animali: infatti infatti le più più grandi riserve energetiche sono quelle del tessuto adiposo che immagazzina immagazzina trigliceridi (grassi). La struttura del glicogeno è (GLUCOSIO)n dove n può raggiungere centinaia di unità unità. La molecola non ha un numero definito di unità unità, perché perché le sue dimensioni cambiano secondo la particolare condizione metabolica o di attività attività della cellula. Durante il digiuno le dimensioni del glicogeno epatico diminuiscono, mentre mentre quelle del glicogeno muscolare diminuiscono durante l’ l’esercizio fisico. Invece dopo i pasti sia le dimensioni del glicogeno epatico sia quelle del glicogeno muscolare aumentano per l’ l’aggiunta di ulteriori unità unità. Struttura del glicogeno mitocondrio granuli 1 ramo ogni 8-12 residui Le molecole di glucosio contenute nel glicogeno sono unite tra loro da legami covalenti (legami αglucosidici). glucosidici). Il carboniocarbonio-1 di una unità unità è legato mediante un ponte di ossigeno con il carboniocarbonio-4 dell’ dell’unità unità successiva (legami α-1,41,4-glucosidici) e così così via formando filamenti che sono legati tra loro da legami α-1,61,6-glucosidici, costituendo così così una macromolecola ramificata ~ decasaccaride Il fegato utilizza le sue riserve di glicogeno per regolare la glicemia glicemia Il fegato ha un ruolo essenziale nella regolazione della glicemia glicemia (la concentrazione di glucosio nel sangue). La glicemia normale nella nella specie umana è compresa tra 80 e 110 mg per 100 ml di sangue (e dipende dallo stato nutrizionale: i valori minimi coincidono con il digiuno fisiologico). fisiologico). Tale concentrazione può aumentare (dopo un pasto) o diminuire (in (in ore lontane dai pasti) causando transitori stati di iperglicemia o di di ipoglicemia che vengono prontamente corretti con processi di regolazione mediati mediati dagli ormoni insulina e glucagone. glucagone. Insulina e glucagone sono ormoni che regolano la glicemia L’insulina viene secreta (dal pancreas endocrino, cellule beta) dopo dopo i pasti in risposta all’ all’aumento della glicemia e la sua azione è tale che provoca una diminuzione della glicemia, rinormalizzandola dopo un breve tempo dalla secrezione. Anche il glucagone viene secreto dal pancreas endocrino (cellule alfa), ma solo in condizioni di ipoglicemia; ipoglicemia; esso stimola il fegato a demolire le riserve di glicogeno (che viene viene trasformato in glucosio da una via metabolica detta glicogenolisi) glicogenolisi) rinormalizzando ben presto la glicemia. Quindi il fegato non immagazzina il glucosio (come glicogeno) per per le sue proprie necessità necessità energetiche, energetiche, ma invece è un organo altruista perché perché, riversando le sue riserve di glucosio nel sangue, permette ad altri altri organi, come il cervello, di disporre costantemente di questa importante sostanza energetica (il cervello in condizioni normali consuma solo glucosio glucosio come materiale energetico ! ). Il muscolo invece utilizza le sue riserve di glicogeno come fonte fonte di energia per il lavoro meccanico di contrazione muscolare. La contrazione dei muscoli è una funzione importante che permette agli animali di spostarsi da un luogo all’ all’altro, di lottare, di fuggire, di lavorare etc. Ambedue i tessuti (fegato e muscolo) demoliscono il glicogeno, mediante mediante la via metabolica glicogenolisi (vedi glicogenolisi epatica e glicogenolisi muscolare). Tuttavia il fegato, a differenza del muscolo, possiede possiede un enzima detto glucosio 66-fosfatasi che è necessario per l’ l’esportazione di glucosio nel sangue. Nel fegato glicolisi Nel muscolo LATTATO (PIRUVATO) Schema della struttura del glicogeno: azione della glicogeno fosforilasi - Unità Unità di glucosio ad un nodo - Glucosio in catena PRIME FASI DELLA GLICOGENOLISI Glicogenolisi. Glicogenolisi. (glucosio)n rappresenta il glicogeno. Il simbolo “n” indica il numero di molecole di glucosio da cui è costituita una molecola di glicogeno enzima deramificante H2O CH2-OH CH2-OH glucosio HO glucosio O CH2-OH CH2-OH glucosio O CH 2-OH glucosio O glucosio O O Pi CH2-OH CH2-OH glucosio CH2-OH glucosio CH2-OH glucosio CH2 CH2-OH glucosio glucosio CH2-OH glucosio glucosio OH HO O O Pi O Pi O O O Pi glicogeno fosforilasi 1) 2) (glucosio) n + Pi (glucosio) n-1 + glucosio-1-P l'enzima deramificante stacca blocchi di 3 unità in vicinanza delle ramificazioni e li trasferisce su un ramo differente, allungandolo. Poi idrolizza il legame alfa-1,6 Le prime fasi della glicogenolisi prevedono l’ l’attacco del glicogeno da parte del fosfato inorganico (Pi). Il fosfato rompe il legame α-1,41,4glucosidico; così così le unità unità di glucosio si staccano come glucosioglucosio-1-fosfato dalle estremità estremità delle ramificazioni, dove sono presenti unità unità di glucosio con il gruppo –OH in posizione 4 non impegnato in legami glicosidici (estremità (estremità non riducenti del glicogeno). La reazione è catalizzata dalla glicogeno fosforilasi. Il distacco delle unità unità monomeriche avviene in modo sequenziale e questa azione porta ad un accorciamento dei rami. Quando l’ l’enzima giunge alla distanza di 4 unità unità di glucosio da un nodo (il nodo è il sito molecolare dove c’è c’è un legame α-1,61,6-glucosidico) non può più più agire. Allora la demolizione del ramo prosegue con l’ l’aiuto di un secondo enzima (enzima (enzima deramificante) deramificante) che stacca in una sola volta 3 delle 4 unità unità di glucosio rimaste e le trasferisce su un altro ramo, allungandolo. allungandolo. Infine lo stesso enzima deramificante stacca anche l’ l’ultima unità unità di glucosio mediante l’ l’idrolisi del legame α-1,61,6-glucosidico. La reazione catalizzata dalla glicogenoglicogeno-sintasi. sintasi. enzima ramificante Reazione catalizzata dall’ ). I simboli “¡” dall’enzima ramificante (transglicosidasi (transglicosidasi). rappresentano le molecole del glucosio nella molecola del glicogeno glicogeno (struttura ramificata). Nel tronco e nei rami le molecole di glucosio glucosio sono unite tra loro con legami α-1,41,4-glicosidici, mentre ai nodi un ramo si innesta nel tronco principale e in un altro ramoscello con legami α-1,61,6-glicosidici. Schema generale della glicogenosintesi e della glicogenolisi epatica 11 Glicogeno sintesi glucosio 6-fosfato glucosio 1-fosfato + UTP H2O + PPi glicogeno(n) + UDP-glucosio glicogeno(n) + glucosio 6-phosphate + UTP + H2O glucosio 1-fosfato UDP-glucosio + PPi 2 Pi glicogeno (n+1) + UDP glicogeno (n+1) + UDP + 2 P i Rigenerazione di UTP • Nucleoside difosfato cinasi UDP + ATP ↔ UTP + ADP • La sintesi del glicogeno richiede due legami ~P ad alta energia [(G-1-P), UTP] • Parte dell’energia è conservata nel legame α 1 → 4 glicosidico La glucosio-6-fosfatasi è localizzata nel reticolo endoplasmatico del fegato (e del rene) Glicogenina: Glicogenina È necessaria per “iniziare” la sintesi del glicogeno • genera gli 8 residui iniziali del glicogeno • prima lega una molecola di glucosio donata da UDPglucosio (legame acetalico con una tirosina) • forma un complesso con la glicogeno sintasi • UDP-glucosio viene usato per estendere la catena • resta legata al glicogeno, anche dopo la “fine” dell’azione della glicogeno sintasi Enzima Enz (CH2)4 N+ HC O− −O H2 C P O H O− O + N H CH3 Base di Schiff tra il PLP e una lisina Enzyme (Lys)-PLP Schiff base della glicogeno fosforilasi Nella fosforilasi, il fosfato del PLP agisce come catalizzatore acido-base. Il Pi substrato si lega tra il fosfato del PLP ed il legame Oglicosidico del glucosio terminale di una catena del glicogeno. Dopo che il fosfato del substrato ha donato un H+ durante la rottura del legame glicosidico, riceve un H+ dal fosfato del PLP. Il PLP quindi recupera un H+ quando l’O del fosfato attacca il C1 del glucosio staccato dalla catena per produrre glucosio-1-fosfato. Regolazione della glicogeno fosforilasi ØViene regolata sia da metaboliti che agiscono come effettori allosterici che da ormoni ØI complessi meccanismi di regolazione del metabolismo del glicogeno (glicogenolisi e glicogeno sintesi) saranno oggetto di una successiva e approfondita descrizione e discussione La fosforilasi è regolata da metaboliti con meccanismo allosterico • Quando ATP o G-6P aumentano nella cellula, l’enzima viene inibito, mentre quando l’AMP aumenta l’enzima viene attivato. • La regolazione è mediata da cambiamenti nei contatti subunità/subunità: il legame degli effettori al sito allosterico influenza il legame dell’enzima con il fosfato (Pi). La fosforilasi è anche controllata per fosforilazione reversibile • Esiste in due forme dette “a” e “b” • a e b differiscono per una fosforilazione sulla Ser 14 • Le forme fosforilate sono attive ed insensibili alla regolazione allosterica ! • L’apo-enzima è ancora regolato allostericamente • Un meccanismo a cascata innescato da ormoni (glucagone, adrenalina) determina la fosforilazione dell’enzima Regolazione reciproca della glicogeno sintasi e della glicogeno fosforilasi ØLa GS è attiva quando è defosforilata (glicogeno sintasi a) Øla defosforilazione è catalizzata dalla fosforilasi-a fosfatasi (PP1), lo stesso enzima che defosforila la glicogeno fosforilasi. ØLa GS è inibita quando è fosforilata (glicogeno sintasi b) (9 differenti serine possono essere fosforilate, con meccanismi differenti) Glicogeno glicogeno fosforilasi Glucagone +Attiva G-6-P cAMP F-6-P PFK-1 Inibisce - F-1,6-P2 PEP piruvato cinasi -Inibisce Piruvato PKA Potente Attivatore della Glicolisi PFK-2 F-6-P PFK-1 F-2,6-P2 + F-1,6-P2 glicolisi Fructosio-2,6 bisfosfato Malattie Metaboliche Congenite a) manca un gene b) un gene è sottoespresso c) c’è un gene mutato poco funzionante Acquisite a) malattie di un organo b) malattie di un tessuto endocrino Difetti congeniti del metabolismo del glicogeno
Scarica