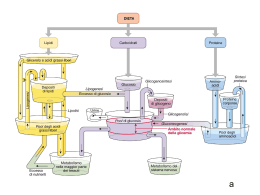
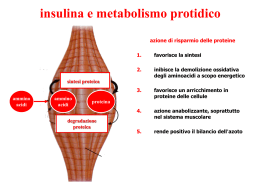
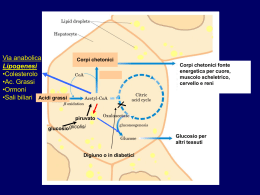
ENDOCRINOLOGIA E NUTRIZIONE UMANA – LEZIONE 7 – PANCREAS Le due porzioni del pancreas, esocrino ed endocrino, sono anatomicamente e funzionalmente diverse. Isole del Langherans Contengono da poche centinaia ad alcune migliaia di cellule endocrine dimensione da 50 a 300 mm Ø ~ un milione di isole. Tipi di cellule Cellule esocrine Cellule endocrine Isola di langherans Cellula α; Secreto: Glucagone Cellula ∞; Secreto: Somatostatina Cellula β; Secreto: insulina, amilina Relazioni funzionali Le relazioni anatomiche tra le cellule a, b, d, e l’esistenza di tight e gap junctions tra loro, hanno portato all’ipotesi che i tre ormoni insulari possano influenzarsi reciprocamente mediante azioni paracrine. Queste relazioni funzionali tra gli ormoni pancreatici determinano un miglior coordinamento tra l’avanzamento del chimo, la digestione e l’assorbimento e le risposte dell’insulina e del glucagone per la distribuzione adeguata dei principi nutritivi al fegato e agli altri tessuti. Circolazione I vasi sanguigni afferenti penetrano fino al centro prima di ramificarsi e ritornare verso la superficie delle isole. Quindi le cellule più interne ricevono sangue arterioso mentre le cellule situate più esternamente ricevono sangue contenente i prodotti di secrezione delle cellule più interne. Innervazione Ortosimpatico Parasimpatico Le risposte ai segnali nervosi in ingresso dipendono dall’attivazione dei recettori adrenergici o colinergici. Clinica La determinazione dei livelli circolanti di peptide C ha notevole importanza clinica perché offre informazioni sulla capacità secretoria delle cellule b, che non è sempre possibile determinare dosando l’insulina. Infatti il peptide C, che non ha altre attività fisiologiche ben definite, non viene metabolizzato dal fegato, a differenza del l’insulina che, per circa l’80%, viene degradata a livello epatico e renale con un’emivita di circa 5 minuti. Regolazione della secrezione Concentrazione del glucosio La secrezione di insulina è praticamente nulla quando la concentrazione del glucosio plasmatico è 0,50 mg /mL, mentre la risposta è massima per una glicemia uguale o superiore a 2,5 mg/mL. Digiuno Sedi d’azione Valori In condizioni di stimolazione insulinica massimale si ha un aumento di 5-6 volte della velocità di utilizzazione del glucosio da parte dei tessuti periferici e una contemporanea riduzione del 50% della liberazione epatica di glucosio. La maggior parte dell’utilizzazione periferica del glucosio si verifica nei muscoli e solo una piccola frazione nel tessuto adiposo. Circa il 75% del glucosio viene trasformato in glicogeno mentre il 20-30% entra nella glicolisi e ossidato. La velocità di ossidazione viene aumentata di circa 3 volte. Immagazzinamento dei carboidrati • facilita la captazione di glucosio nella maggior parte delle cellule grazie al reclutamento di trasportatori specifici (GLUT4), particolarmente disponibili nelle cellule muscolari scheletriche e del tessuto adiposo; • stimola la produzione di glicogeno a partire dal glucosio (glicogenesi) sia nel fegato che nel muscolo scheletrico (aumenta l’attività dell’enzima glicogeno sintetasi); • inibisce la glicogenolisi favorendo l’immagazzinamento dei carboidrati e riducendo, quindi, la produzione di glucosio da parte del fegato; • inibisce, a livello epatico, la conversione di aminoacidi in glucosio (gluconeogenesi), diminuendo così, ulteriormente, la produzione di glucosio; questo risultato è ottenuto diminuendo la disponibilità di aminoacidi per il fegato e inibendo gli enzimi specifici per questa conversione. Azioni sui grassi ADIPOCITI Trigliceridi (↓) - 2/3 Acidi grassi (↓ ↓) Glicerolo PLASMA (↓) -90% OSSIDAZIONE Riduce la concentrazione plasmatica degli acidi grassi e a promuove l’immagazzinamento dei trigliceridi. Mediante queste azioni, i grassi introdotti con la dieta, e non necessari per le richieste energetiche immediate, vengono immagazzinati. Immagazzinamento dei trigliceridi • favorisce la captazione di acidi grassi da parte delle cellule del tessuto adiposo aumentando l’attività della lipoproteina lipasi; • favorisce, nel fegato, con l’aumento della produzione di a-glicerolo fosfato, lo smistamento di acidi grassi liberi in arrivo verso le reazioni di esterificazione, evitandone così l’utilizzo nella b-ossidazione (come conseguenza si ha una minore produzione di b-idrossibutirrato e acetoacetato e, quindi, un potente effetto antichetogenico); • inibisce l’attività lipolitica tissutale ormone-sensibile, ovvero quella dei trigliceridi immagazzinati, sopprimendo, quindi, la formazione e la liberazione di acidi grassi dal tessuto adiposo e la loro disponibilità per gli altri tessuti; • aumenta la captazione di glucosio, utilizzato per la formazione di acidi grassi e glicerolo e, quindi, di trigliceridi; • stimola, a partire dall’acetil-CoA, la sintesi degli acidi grassi liberi. Azioni sulle proteine La diminuzione della velocità di ingresso nel plasma dell’aminoacido leucina riflette la riduzione della proteolisi e quindi il risultato netto è un aumento delle proteine corporee. Azioni sul metabolismo proteico • inibisce la degradazione delle proteine; • favorisce il trasporto attivo, Na+ dipendente, di aminoacidi dal sangue ai muscoli e ad altri tessuti; • stimola la sintesi proteica, aumentando l’utilizzo degli aminoacidi; • svolge, inoltre, un’importante azione sui tessuti cartilaginei e ossei al pari di alcuni peptidi strutturalmente simili all’insulina, le somatomedine, che stimolano la sintesi di proteine, RNA, DNA e altre macromolecole. Pertanto, l’insulina svolge un importante ruolo nella crescita, nei processi di rigenerazione tissutale e nel rimodellamento osseo. Diabete Tipo I Diabete insulino-dipendente denominato in passato anche come diabete giovanile per la sua maggior incidenza tra i giovani. È legato a deficienza funzionale del pancreas endocrino nel produrre insulina. Tipo II Diabete insulino-resistente si manifesta con il progredire nell’età. Si manifesta come una forma di resistenza delle cellule, in particolare le cellule muscolari, all’azione dell’insulina: infatti si caratterizza per una normale secrezione di insulina e livelli plasmatici di questo ormone normali o aumentati. Gluconeogenesi • aumenta la captazione epatica di aminoacidi; • stimola l’attività dei principali enzimi gluconeogenetici; • riduce l’attività dei principali enzimi glicolitici, fosfofruttochinasi e piruvato chinasi. Un’altra azione intraepatica del glucagone è quella di evitare che gli acidi grassi liberi vengano utilizzati per la sintesi dei trigliceridi, dirigendoli verso la b-ossidazione. Il glucagone è pertanto un ormone chetogenetico. Rapporto insulina/glucagone • In conclusione i flussi dei substrati energetici sono finemente regolati dalla secrezione coordinata di insulina e glucagone. Per questo motivo, il parametro critico non è tanto la loro concentrazione assoluta, quanto il loro rapporto plasmatico che, di norma, risulta intorno a 2. • Qualora venga richiesta una mobilizzazione e una rapida utilizzazione dei substrati endogeni, si osserva una caduta del rapporto insulina/glucagone a valori uguali o inferiori a 0,5. Ciò si verifica tipicamente nel digiuno, nell’esercizio fisico prolungato e anche nel periodo neonatale quando il neonato, privato dell’apporto materno, non è ancora capace di assimilare efficacemente i principi nutritivi esogeni. • Al contrario, in condizioni in cui sia utile immagazzinare i substrati, come ad esempio dopo un pasto misto o ricco di carboidrati, il rapporto aumenta fino a 10 o più, soprattutto per un aumento della secrezione di insulina. Funzioni • La funzione generale della somatostatina insulare è quella di ridurre la velocità di digestione e assorbimento dei principi nutritivi nel tratto gastrointestinale e la loro successiva utilizzazione. • Infatti la somatostatina insulare inibisce la mobilità gastrica, duodenale, colecistica e riduce la secrezione di HCl, di pepsina, di gastrina, di secretina, di succo intestinale e di succo pancreatico. • La somatostatina inibisce l’assorbimento di glucosio e trigliceridi da parte della mucosa intestinale ed è inibitore della secrezione di insulina e glucagone. In pratica la presenza di cibo nell’intestino determina la liberazione di somatostatina per prevenire la ricezione di un eccesso di chimo e, quindi, un sovraccarico di sostanze nutritive da digerire.
Scaricare