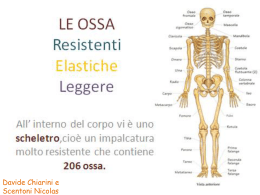
Tessuto muscolare cardiaco Tessuto muscolare cardiaco Tessuto muscolare cardiaco Tessuto muscolare cardiaco Tessuto muscolare cardiaco Tessuto muscolare cardiaco MUSCOLARE STRIATO CARDIACO • Costituito da cellule uninucleate: miocardiociti 20µm x 100µm (m. schel 20100µm X cm) • Il nucleo (al max. due) è al centro della cellula • Tra una cellula e l’altra, sul lato più corto, sono visibili linee trasversali dette dischi intercalari o strie scalariformi • dove troviamo – Zonulae adhaerentes actina – Desmosomi desmina – Gap junctions per l’accoppiamento elettrico Tessuto muscolare cardiaco Tessuto muscolare cardiaco Tessuto muscolare cardiaco T. CARDIACO (in sez. longitudinale) Tessuto muscolare cardiaco Tessuto muscolare cardiaco Tessuto muscolare cardiaco Tessuto muscolare striato cardiaco disco intercalare Tessuto muscolare cardiaco Cardiocita 1 cardiocita 2 miofibrille 61.500 x Tessuto muscolare cardiaco Giunzioni aderenti Gap junction Tessuto muscolare cardiaco In sezione longitudinale... Tessuto muscolare cardiaco ...e in sezione trasversale Tessuto muscolare cardiaco Ancora in sezione trasversale Tessuto muscolare cardiaco Cos’ha di diverso dal muscolo scheletrico? • Miofibrille più ampie e meno evidenziabili • Tubuli T di diametro 3-4 volte maggiore con superficie interna munita di lamina basale • Reticolo sarcoplasmatico meno organizzato: • Diadi a livello delle strie Z (invece le triadi sono a livello A–I) • Numerosi mitocondri (~40% in volume) ++ • Diverso ruolo del Ca (vedi avanti) Tessuto muscolare cardiaco Cos’ha di diverso dal muscolo scheletrico? • La contrazione si origina in modo autonomo nel cuore e si dirama tramite un tessuto di conduzione • Da queste cellule del tessuto di conduzione l’impulso si trasmette alle cellule muscolari cardiache: il t. muscol. cardiaco è un sincizio funzionale • I dischi intercalari o strie scalariformi – Zonulae adhaerentes actina – Desmosomi desmina – Gap junction accoppiamento elettrico (permettono la sincronizzazione della contrazione) • L’innervazione (SNA) ha la funzione di modulare il battito cardiaco (contrazione) ma non di originarla Contrazione del cardiomiocito • Il potenziale d’azione induce l’ingresso di Ca++ nel sarcoplasma attraverso il sarcolemma ed i tubuli T. • L’aumento della concentrazione di Ca++ nel sarcoplasma è il segnale che induce il reticolo sarcoplasmatico a rilasciare altri ioni Ca++ (rilascio di calcio indotto dal calcio) CARDIOMIOCITA in sezione trasversale miofibrille di forma irregolare Tessuto muscolare cardiaco MIT Miofilamenti spessi Tubuli di ret. sarcoplasmatico Tessuto muscolare cardiaco Tessuto muscolare cardiaco Ricordate questo? Tessuto muscolare cardiaco Tessuto muscolare cardiaco CARDIOMIOCITA: cinque miofibrille sezionate longitudinalmente 1 diade 2 Tubulo REL 3 Granuli di glicogeno 4 Tessuto muscolare cardiaco 5 tubulo T MIT Tessuto muscolare cardiaco sarcoplasma di cardiocita di muscolo cardiaco: mitocondri, gocce lipidiche e granuli di glicogeno tra le miofibrille. Tessuto muscolare cardiaco M Tessuto muscolare MIT cardiaco M= miofibrille G= glicogeno M G 47.000 x Cellula muscolare atriale con granuli secretori muniti di membrana lamina basale Tessuto muscolare cardiaco granuli atriali specifici (GATR): contengono il fattore natriuretico atriale (ANF) che regola equilibrio idrico-salino e pressione arteriosa. Rigenerazione dei tessuti muscolari • E’ possibile per il muscolare striato scheletrico e per il liscio. • Non sembra possibile per il t. musc. cardiaco se non con estrema difficoltà. Tuttavia… …esistono le staminali cardiache • Bearzi C, Rota M, Hosoda T, Tillmanns J, Nascimbene A, De Angelis A, Yasuzawa-Amano S, Trofimova I, Siggins RW, Lecapitaine N, Cascapera S, Beltrami AP, D’Alessandro DA, Zias E, Quaini F, Urbanek K, Michler RE, Bolli R, Kajstura J, Leri A, Anversa P. Human cardiac stem cells. Proc Natl Acad Sci U S A. 2007;104:14068–14073. • Bearzi C, Leri A, Lo Monaco F, Rota M, Gonzalez A, Hosoda T, Pepe M, Qanud K, Ojaimi C, Bardelli S, D’Amario D, D’Alessandro DA, Michler RE, Dimmeler S, Zeiher AM, Urbanek K, Hintze TH, Kajstura J, Anversa P. Identification of a coronary vascular progenitor cell in the human heart. Proc Natl Acad Sci U S A. 2009;106:15885–15890
Scarica