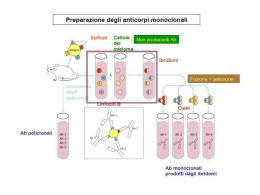
Breve Relazione International Myeloma Foundation 12650 Riverside Drive, Suite 206 North Hollywood, CA 91607-3421 Hotline (USA and Canada): (800) 452 CURE (2873) Tel: (818) 487-7455 Fax: (818) 487-7454 Email: [email protected] Website: www.myeloma.org © 2011, International Myeloma Foundation della malattia e delle opzioni terapeutiche Mieloma Multiplo Tumore del midollo osseo International Myeloma Foundation A cura di Brian G.M. Durie, MD Edizione 2011/2012 TABELLA DEI CONTENUTI INTRODUZIONE 4 COS’È IL MIELOMA 4 PRODUZIONE DELLA PROTEINA MONOCLONALE 5 NOTE STORICHE 7 EPIDEMIOLOGIA 12 PATOFISIOLOGIA 13 MALATTIA DELL’OSSO 14 ANEMIA 14 DISFUNZIONE RENALE 15 DISFUNZIONE DEGLI ALTRI ORGANI 15 TIPI DI MIELOMA 16 SINTOMI CLINICI 16 STADIAZIONE E FATTORI PROGNOSTICI 17 DEFINIZIONE DELLA RISPOSTA CLINICA 19 TRATTAMENTI 20 Trattamento sistemico anti-mieloma 23 Trapianto 29 Radioterapia 33 Terapia di mantenimento 34 Terapia di supporto 35 Gestione della malattia recidivante o refrattaria 37 Nuovi ed emergenti trattamenti 39 REFERENZE 39 3 INTRODUZIONE PRODUZIONE DELLA PROTEINA MONOCLONALE La presente relazione sul mieloma redatta dall’IMF è una descrizione delle opzioni terapeutiche riguardante la patofisiologia, le caratteristiche cliniche e le opzioni terapeutiche. Ci auguriamo che queste informazioni possano essere utili sia per i medici che per i pazienti. DA PARTE DELLE CELLULE DEL MIELOMA COS’È IL MIELOMA Il mieloma è un tumore delle plasmacellule del midollo osseo. Mieloma è sinonimo di mieloma multiplo e di mieloma plasmacellulare. Le plasmacellule maligne (vedere Figura 1) o cellule del mieloma, si accumulano nel midollo osseo. Caratteristico del Mieloma è l’accumulo eccessivo di plasmacellule nel midollo osseo che causa: •l’alterazione del normale funzionamento del midollo osseo con conseguente anemia e/o basso livello di globuli bianchi o piastrine. •distruzione ed invasione dell’osso che circonda la cavità del midollo osseo •produzione e rilascio della proteina monoclonale (Proteina M) nel sangue e/o nelle urine da parte delle cellule del mieloma •riduzione della normale funzione immunitaria, con conseguente riduzione dei livelli normali delle immunoglobuline e aumento della predisposizione alle infezioni.. Il verificarsi di infezioni è tanto più probabile quanto più basso è il numero di globuli bianchi presenti nel sangue. I Plasmocitomi sono “tumori” localizzati costituiti da plasmacellule, che possono crescere all’interno dell’osso (intramidollari) o fuori dall’osso (extramidollari o del tessuto molle). La condizione di plasmocitomi multipli dentro o fuori dall’osso, è comunque definita mieloma multiplo. FIGURA 1: Cellule Del Mieloma La proprietà caratteristica delle cellule del mieloma è la produzione e il rilascio (o secrezione) di proteine monoclonali nel sangue e/o nelle urine. La quantità di proteine monoclonali prodotta dalle cellule del mieloma varia considerevolmente da paziente a paziente. Nel valutare il tipo di mieloma, è molto importante sapere se il clone mielomatoso produce o meno la componente monoclonale. Una volta conosciuto il rapporto tra il livello della proteina e lo stato del mieloma nel midollo osseo, è possibile interpretare e capire la relazione tra un particolare livello di proteina e la proliferazione tumorale. La proteina monoclonale è anche chiamata Proteina-M, componente-M, proteina del mieloma, paraproteina, o picco monoclonale. La proteina monoclonale è definita picco a causa del modo in cui si presenta nel quadro elettroforetico, una tecnica di laboratorio usata per separare ed identificare le proteine. (vedere Figura 2). FIGURA 2: Picco Monoclonale Cellule mielomatose stanno generando la proteina-M La proteina monoclonale è un’immunoglobulina o una componente/frammento di un immunoglobulina. La figura 3 illustra la struttura di una normale molecola di immunoglobulina.. Nelle cellule del mieloma, una o più mutazioni sono state riscontrate nei geni responsabili della produzione delle immunoglobuline. Tuttavia, le proteine del mieloma hanno una sequenza aminoacida e una struttura proteica anormale. Solitamente, la funzione immunitaria delle immunoglobuline è persa e la struttura tridimensionale della molecola potrebbe essere anormale. L’aumento della produzione di immunoglobuline alternate può avere un certo numero di consequenze, quali : •La proteina M in eccesso che si accumula nel sangue e nelle urine è espulsa nelle urine come picco monoclonale. •Le molecole monoclonali anormali possono aderire a qualsiasi tipo di tessuto come, ad esempio, le cellule del sangue, vasi sanguigni, e altre componenti del sangue. Ciò può ridurre il flusso sanguigno e la circolazione, causando la sindrome dell’iperviscosità (discussa in basso). 4 5 FIGURA 3: Struttura Della Molecola Immunoglobulina 2.Malattia da deposito delle catene leggere – Le catene leggere si depositano accidentalmente, specialmente nei piccoli vasi sanguigni degli occhi e dei reni. 3. Malattia da depositi di immunoglobuline monoclonali – C’è anche la possibilità di depositi che includono frammenti sia di catene pesanti che di catene leggere. Importante è anche notare che i prelievi di sangue routinari possono dare risulati molto strani a causa della viscosità o iperviscosità analizzati con metodiche automatiche oppure possono interferire con le relazioni chimiche. NOTE STORICHE •Approssimativamente nel 30% dei casi, le catene leggere vengono prodotte in eccesso rispetto a quelle necessarie per la combinazione con le catene pesanti per formare un’unica molecola. Queste catene leggere in eccesso sono chiamate proteine di Bence Jones (vedi la sezione Note Storiche). Le proteine libere di Bence Jones hanno un peso molecolare di 22.000 daltoni e sono abbastanza piccole da riuscire a passare facilmente nelle urine. •Le proteine monoclonali anormali possono provocare altri effetti quali: •legarsi ai normali fattori della coagulazione con conseguente aumento della tendenza al sanguinamento oppure favorendo la formazione di coaguli di sangue e flebiti. •legarsi ad ormoni od elementi circolanti con conseguenti disfunzioni ormonali e metaboliche. •Le proteine libere di Bence Jones possono anche aderire a qualsiasi altro tessuto (come fa la stessa molecola immunoglobulina). In questo caso il risultato finale può essere duplice: 1.Amiloidosi – Tipo di malattia in cui le catene leggere di Bence Jones si legano in modo simmetrico e si depositano in tessuti tra cui rene, nervi e tessuto del cuore. FIGURA 4: Fasi Della Malattia Il dott. Henry Bence Jones fu il primo a studiare una strana proteina contenuta nelle urine di un paziente affetto da mieloma. Ciò che stimolò l’attenzione del Dott. Bence Jones fu una proteina delle urine che si dissolse in fase di ebollizione, ma che precipitò nuovamente nella fase di raffreddamento; questo portò a chiamare tali catene leggere “proteine di Bence Jones”. Si dimostrò che il paziente avesse una strana malattia che noi oggi definiamo mieloma. Quello che segue è una breve relazione riguardante i progressi nella ricerca e nel trattamento del mieloma multiplo e delle malattie correlate da quel periodo in avanti. 1844 -1850 La descrizione del primo caso si riferiva alla malleabilità e alla fragilità dell’osso (ossa morbide e fragili). Il primo paziente, Thomas Alexander McBean, fu diagnosticato nel 1845 dal Dott. William Macintyre, uno specialista di Londra. Lo strano problema che egli scoprì fu prima studiato dal Dott. Bence Jones, che pubblicò le sue ricerche nel 1848. Nel 1846, il chirurgo John Dalrymple, notò e pubblicò scritti che indicavano come le ossa malate contenessero cellule che successivamente vennero definite plasmacellule. Il Dott. Macintyre pubblicò tutti i dettagli del caso di mieloma di Bence Jones nel 1850. Da notare è che il Dott. Samuel Solly pubblicò un caso simile di mieloma (Sarah Newbury) nel 1844, ma senza alcuno studio dettagliato sulle urine. 1873 Rustizky introdusse il termine “mieloma multiplo” per definire la presenza di lesioni osteolitiche dell’osso. 1889 Otto Kahler pubblicò una descrizione clinica dettagliata del mieloma multiplo chiamata “Kahler’s disease.” 1890 Ramon y Cajal fornì la prima descrizione microscopica delle plasmacellule. 1900 1903 6 Wright scoprì che le cellule del mieloma multiplo sono plasmacellule. Weber notò che le lesioni osteolitiche potevano essere individuate ai raggi X. 1909 Weber suggerì che le plasmacellule nel midollo osseo sono responsabili della distruzione dell’osso. 1930s Diagnosticare il mieloma rimase un compito difficile fino al 1930, quando gli aspirati midollari furono praticati per la prima volta ad ampia scala. Lo sviluppo dell’ultracentrifuga e dell’elettroforesi delle proteine del siero e delle urine migliorò sia la selezione (screening) che la diagnosi. 7 1953 1956 1958 1961 1962 1964 1969 1975 1976-1992 1979-1980 1982 1983 1984 1984-1986 1986-1996 1996 8 L’immunoelettroforesi fu introdotta per permettere l’identificazione precisa delle proteine monoclonali del mieloma. L’immunofissazione fu introdotta come un metodo più efficace. Korngold e Lipari notarono come le proteine di Bence Jones (BJ) corrispondessero alle normali gammaglobuline sieriche così come a quelle anormali. In loro onore, i due tipi di proteine di Bence Jones furono chiamati kappa (k), e lambda (λ o L). Scoperta del sarcolysine nell’USSR. Da ciò derivò il Melphalan (Alkeran). Per la prima volta fu reso possibile il trattamento. Waldenström sottolineò l’importanza della distinzione tra gammmopatia monoclonale o policlonale. Egli associò le proteine monoclonali IgM con la macroglobulinemia, quale forma distinta dal mieloma. Prima relazione di Bergsagel sul trattamento con Melphalan (Alkeran) come terapia efficace sul mieloma. Prima relazione di Korst sul trattamento con ciclofosfamide (Citoxan) con risultati positivi sul mieloma. I risultati ottenuti con l’utilizzo di ciclofosfamide risultarono simili a quelli del Melphalan. Alexanian scoprì la superiorità del Melphalan e del Prednisone rispetto all’uso del solo Melphalan. Introduzione del sistema di stadiazione del mieloma introdotto da Durie/Salmon secondo il quale i pazienti vengono classificati in base ai differenti stadi (I, II, III, A o B) della malattia per ottenere benefici dalla chemioterapia. Varie combinazioni degli agenti chemioterapici testati, compreso il regime M2 (VBMCP), VMCP-VBAP ed ABCM, con evidenze di superiorità rispetto alla terapia con MP. Tuttavia, nel 1992, una meta-analisi comparativa (Gregory) dimostrò risultati equivalenti per tutte le combinazioni. Labeling index (analisi del fattore di crescita) fu inizialmente introdotta come test per il mieloma e per le malattie correlate. Fu identificata la fase stabile di remissione o di plateau del mieloma, in cui la frazione di crescita (LI%) delle plasmacellule residue del midollo osseo era dello 0%. Introduzione del doppio trapianto autologo nel trattamento del mieloma da Fefer e Osserman. Primo utilizzo della β2 microglobulina come fattore prognostico (Bataille, Child, e Durie). Barlogie e Alexanian introducono la chemioterapia VAD. Prime relazioni sul trapianto allogenico nel mieloma multiplo da parte di vari ricercatori. Ampio numero di studi riguardanti il trapianto autologo di midollo o di cellule staminali come terapia nel mieloma. Furono introdotti sia il singolo (McElwain) che il doppio trapianto (Barlogie) . • Primo studio randomizzato indicante i possibili benefici delle terapia ad alte dosi con trapianto di midollo osseo rispetto alla chemioterapia standard (Attal). • Studio randomizzato di bifosfonati (Aredia®) nei confronti del placebo che mostra una riduzione degli eventi scheletrici (osteolisi). 1997 1998 1999 2000 2001 2002 Evidenza che i virus possono essere coinvolti nel mieloma in evoluzione. Il mieloma è molto comune nei pazienti con HIV ed epatite C. L’Herpes virus 8 (HHV-8) è ricercato nelle cellule dentritiche del mieloma ritrovato nel sangue RNA con specificità per il virus sul “cancro correlato” nella scimmia. • Continue ricerche sul ruolo della chemioterapia ad alte dosi seguita da trapianto autologo o allogenico. Incerta rimane l’entità del beneficio ottenuto. Il trapianto come prima linea di trattamento ha dimostrato di aver prodotto risultati simili quando eseguito in prima recidiva. • La delezione del cromosoma 13 non è risultato un importante fattore prognostico per il trapianto così come per la altre terapie. • Nuovi studi confermano che il prednisone è utile come terapia di mantenimento nel prolungare della remissione. Anche l’Interferon Alpha ha dimostrato di poter prolungare la remissione di malattia. • La Talidomide si è dimostrata un efficace terapia anti-mieloma in pazienti con malattia recidiva e/o refrattaria. • Il trapianto allogenico a bassa intensità di condizionamento (mini allo) rappresenta un approccio meno tossico con un effetto di graft verso mieloma. • Studi francesi randomizzati hanno dimostrato che il doppio trapianto autologo non ha risultati migliori rispetto al singolo trapianto. • Studi con follow up a lungo termine dimostrano che il trattamento continuato con Aredia per 2 anni è utile. Emergono nuovi approcci terapeutici promettenti nella terapia del mieloma. Nuove sperimentazioni cliniche includono gli analoghi della Talidomide (es.Revlimid® e Actimid™), analoghi dell’adriamicina con azione a lunga durata di (es. doxorubiciba peghilata o Doxil®), arsenico triossido (Trisenox®), agenti anti-angiogenesi (es. inibitore tyrosinchianasi di VEGF), agenti che bloccano l’adesione delle cellule, betatine e inibitori del proteasoma (es. VELCADE®). • Nuovi sistemi di classificazione per il mieloma e le malattie correlate (vedere Tabella 4 in basso). • Nuovi fattori prognostici o sistemi di stadiazione proposti: • SWOG (Southwest Oncology Group) utilizza la separazione in 4 gruppi basati su livelli sierici della β2 microglobulina e dell’albumina. • IFM (French Study Group) utilizza la separazione in 3 gruppi basati su livelli sierici di β2 microglobulina e sulla presenza/assenza di anomalie del cromosoma 13 rilevate attraverso l’esame FISH. • Evidenza dell’ efficacia dei nuovi agenti in ambito di sperimentazioni cliniche, inclusi VELCADE® (Fase III, Millennium) e Revlimid® (Fase III, Celgene). • Talidomide combinata con desametasone come terapia di prima linea per il mieloma induce risposta di circa il 70%. • In Gran Bretagna MRC presenta i dati dell’autotrapianto all’ ASH (American Society of Hematology) Annual Meeting. Evidenti benefici, specialmente per pazienti con un elevato livello di β2 microglobulina (> 7.5 mg/L). 9 2003 2004 2005 2006 10 • VELCADE® (bortezomib; precedentemente chiamato PS-341) approvato dall’F.D.A. come trattamento in pazienti affetti da Mieloma in recidiva dopo almeno due linee terapeutiche. • I risultati dell’ MRC sull’autotrapianto hanno fornito i successivi dati sullo studio randomizzato che mostra il vantaggio del trapianto autologo rispetto alla chemioterapia convenzionale. • I risultati degli studi dell’IFM che confrontano il singolo con il doppio trapianto dimostrano che il doppio trapianto dopo più di 4 anni di follow-up ha un maggiore beneficio sulla sopravvivenza. Tuttavia, non vi sono benefici aggiuntivi per i pazienti già in remissione completa con il primo trapianto. Rimangono interrogativi sul ruolo della sopravvivenza con il doppio trapianto. • Il gruppo di Little Rock (Shaugnessy/Barlogie) ha dimostrato che il danno dell’osso nel mieloma è associato alla produzione di una particolare proteina chiamata DKK-1. • Vengono presentati i risultati delle sperimentazioni cliniche dell’ECOG che comparano l’utilizzo di talidomide più desametasone rispetto all’utilizzo di desametasone da solo in pazienti alla diagnosi: 59% di risposta ottenuta con la terapia di associazione rispetto al 41% ottenuta col solo Desametasone (ECOG criteria). • I risultati di sperimentazioni cliniche multi istituzionali comparavano VELCADE® con desametasone e venivano presentati dimostrando una superiorità del VELCADE® (dettagli discussi nel testo). • Eccellenti risultati mostrati con l’utilizzo di Velcade in prima linea: un tasso di risposta dell’83% con VELCADE®/ desametasone e 94% con VELCADE®/adriamicina/desametasone e si è dimostrata, inoltre, la possibilità di raccolta di cellule staminali periferiche con buona riuscita nel trapianto e nell’attecchimento. Ulteriore follow-up è richiesto. • Introduzione del nuovo sistema di stadiazione del mieloma, l’ISS (International Staging System). Vedere pagina 18. • Due studi clinici di Fase III dimostra che Revlimid® più desametasone è superiore a desametasone da solo (Tempo alla progressione >15 mesi a 5 mesi). • VELCADE® approvato dall’F.D.A. come trattamento in pazienti affetti da mieloma in recidiva dopo una linea terapeutica. • L’I.S.S. (International Staging System), è pubblicato per L’International Myeloma Working Group (IMWG) dell’IMF. • Molti nuovi farmaci in via di sviluppo e studi clinici in attenuazione. Nuovi ihibitori di proteine “Heat Shock 90” negli studi clinici Fase I e II. • Eccellenti tassi di risposta con l’addizione di Talidomide alla terapia Melphalan/Prednisone. Molti studi clinici in via di esecuzione. • Sviluppo e pubblicazione dei nuovi criteri di valutazione del beneficio del trattamento. • Il REVLIMID® riceve l’approvazione dall’FDA per il trattamento del mieloma in associazione con desametasone in pazienti che hanno ricevuto almeno 1 precedente linea terapeutica. • Numerosi nuovi agenti continueranno ad essere sviluppati. 2007 2008 2009 2010 • L’FDA accetta un NDA supplementare per l’uso di VELCADE® più Doxil® nel trattamento di pazienti affetti da mieloma recidivo o refrattario che hanno eseguito almeno una precedente linea terapeutica. Combinazione di talidomide/desametasone più Doxil® rispetto all’associazione talidomide/desametasone in studi di fase III per pazienti con nuova diagnosi di mieloma. • Nuovi agenti includono: heat shock protein-90 inhibitors, nuovi inibitori del proteasoma e nuove formulazioni arseniche. Evidente è come alcune nuove terapie possono superare alcuni fattori di rischio seri. • La talidomide è stata approvata in Europa dell’EMEA come parte dell’associazione “MPT” (melphalan/prednisone/talidomide) per la terapia di prima linea in pazienti non candidabili al trapianto. • Il VELCADE® è stato approvato negli U.S. dall’FDA come parte del regime “VMP” (VELCADE®/melphalan/prednisone) per la terapia di prima linea in pazienti non candidabili al trapianto. • Sviluppo di multi nuovi agenti. L’inibitore del proteasoma di seconda generazione, ossia Carfilzomib (Proteolix 171) ha prodotto risultati incoraggianti in diversi studi clinici. • Mozobil® (plerixafor) approvato in combinazione con G-CSF per la raccolta delle cellule staminali di il trapianto autologo in pazienti con mieloma. • Lo sviluppo di nuovi farmaci continua, con risultati incoraggianti provenienti da studi clinici di carfilzomib, un inibitore del proteasoma di seconda generazione e NP-0052; vorinostat e panobinostat, inibitori HDAC; sostanze che alterano il tanespimycin HSP90; elotuzumab, un anticorpo monoclonale e pomalidomide, un agente immunomodulatore di terza generazione. • L’analisi IMWG mostra anomalie citogenetiche e alla FISH che insieme allo stadio ISS fanno da fattori prognostici; alcune nuove terapie superano i fattori di basso rischio. • L’FDA degli Stati Uniti ha approvato una valutazione del rischio e una strategia di mitigazione (REMS) per garantire l’uso sicuro di agenti stimolanti l’eritropoiesi (ESA), che possono favorire la crescita del tumore, ridurre la sopravvivenza, e aumentare il rischio di eventi cardiovascolari avversi. • una prima individuazione dei recettori Epo sulle cellule del mieloma. • Lo sviluppo di nuovi farmaci continua, con risultati incoraggianti provenienti da studi clinici di carfilzomib, un inibitore del proteasoma di seconda generazione e NP-0052; vorinostat e panobinostat, inibitori HDAC; sostanze che alterano il tanespimycin HSP90; elotuzumab, un anticorpo monoclonale e pomalidomide, un agente immunomodulatore di terza generazione. • Diversi studi suggeriscono un ruolo per la terapia di mantenimento con lenalidomide. • La terapia di prima linea con nuovi agenti può essere efficace come il trapianto in pazienti eleggibili. • Zometa® (acido zoledronico), può avere un effetto anti-mieloma; un’efficace igiene dentale può ridurre la comparsa di ONJ. 11 EPIDEMIOLOGIA PATOFISIOLOGIA L’incidenza approssimativa del mieloma è 3-4/100.000 negli USA, approssimativamente l’1% di tutti i tipi di cancro. Ogni anno ha stimato approssimativamente 20.000 nuovi casi di mieloma negli USA. Il mieloma è molto comune tra gli afroamericani e caucasici. Per esempio, nella contea di Los Angeles l’incidenza del mieloma afroamericani è 9,8/100.000 contro 4,3/100.000 nei caucasici. L’incidenza varia da paese a paese a partire da <1/100.000 in Cina fino a 4/100.000 in gran parte dei paesi industrializzati dell’ovest. Il rapporto uomo: donna è di 1,25 : 1 negli Stati Uniti. Migliori tecniche diagnostiche e l’elevata età media sulla popolazione può in parte spiegare la variazione di incidenza dopo le ultime dieci decadi. L’aumento delle diagnosi in pazienti con età inferiore a 55 anni implica il ruolo di fattori ambientali negli ultimi 60 anni. Molti studi recenti hanno valutato la causa o la predisposizione al mieloma, all’MGUS, e ai disordini correlati. Soggenti quali vigili del fuoco o altri individui esposti a fumi tossici, o soggetti affetti da obesità possono facilmente ammalarsi di mieloma multiplo. Mangiare pesce contaminato da agenti chimici o metallici può essere un fattore di rischio per favorire lo sviluppo del mieloma. Altre condizioni mediche, inclusi disordini del sistema immunitario o infezioni, possono essere alla base dello sviluppo del mieloma multiplo. Molte sperimentazioni sono orientate sullo studio dei fattori genetici che portanto allo sviluppo del mieloma. La crescita incontrollata delle cellule del mieloma comporta molte conseguenze, incluse la distruzione delle ossa, l’alterata funzione del midollo osseo, l’aumento del numero delle plasmacellule e della viscosità, la soppressione della normale produzione delle immunoglobuline e l’insufficienza renale. Tale malattia può rimanere asintomatica per parecchi anni, come visto nella discussione riguardo l’MGUS. Nella fase sintomatica, il sintomo che più frequentemente si manifesta è il dolore osseo. TABELLA 1 Definizioni Di Mieloma E Gammopatie Monoclonali Correlate NOME DEFINIZIONE MGUS • Presenza di proteina monoclonale (Gammopatia •N essun disturbo attivo di plasmacellule Monoclonale di incerto significato) MIELOMA ASINTOMATICO O SMOLDERING • Livello di malattia più alto rispetto l’MGUS, ma senza danno d’organo • Può essere classificato tra basso o alto rischi a seconda della maggiore o minore transizione in mieloma attivo MIELOMA SINTOMATICO O ATTIVO • Presenza di proteina monoclonale • Uno o più “CRAB”, caratteristiche della presenza di danno d’organo * *Danno d’organo classificato come “CRAB” C – calcio elevato (>10 mg/L) R – disfunzione renale (creatinina >2 mg/dL) A – anemia (emoglobina <10 g/dL o una diminuzione di ≥ 2 g/dL dal normale) B – malattia ossea (lesioni litiche o osteoporosi) UNO O PIU’ richiesti per la diagnosi di MIELOMA SINTOMATICO. Altre caratteristiche meno comuni possono anche essere un criterio per un singolo paziente, tra cui: • Infezioni gravi ricorrenti • Neuropatia correlata al mieloma • Amiloidosi o deposito di componente-M • Altre caratteristiche uniche 12 TABELLA 2 Schema Di Patofisiologia Risultati Scheletrici • Lesioni osteolitiche solitarie o multiple • Diffusa osteoporosi (osteopenia) Effeti Associati Alla Distruzione Dell’osso • Elevato calcio sierico • Ipercalcemia (aumento del calcio nell’urina) • Fratture dell’osso • Perdita di altezza (collasso vertebrale) Mieloma Extra Scheletale (Raro) • Complicazione del tessuto soffice, più comunemente nell’area testa/collo (es. nasofaringe); anche in fegato, reni e altri tessut Soffici Sangue Periferico • Anemia • Coaugulazione anormale • Leucopenia • Trombocitopenia • Leucemia delle cellule plasmatiche • Circolazione monoclonale dei linfociti B (precursori delle cellule del mieloma) Cambiamenti Delle Plasma Proteine • Iperproteinemia (elevata proteina) • Ipervolemia (espansione del volume) • Immunoglobuline monoclonali (IgG, IgD, IgA, IgM, IgE, delle catene leggere) • Spacco limitato dell’anione (basso sodio sierico) • Elevati livelli di β2-microglobulina • Decremento dell’albumina sierica • Elevata IL6 e proteina C-reattiva (PCR) sierica Effetti Sul Rene • Proteinuria, getti senza leucociti o eritrociti • Disfunzione tubolare con acidosi • Uremia (disfunzione del rene) • Amiloidosi 13 La proteina M del siero e delle urine è elevata e solitamente aumenta al momento della diagnosi. (Nota: M è usato per Monoclonale, Mieloma, Immunoglobulina monoclonale e componente M, che non hanno un significato identico ma simile). L’intero modello per i pazienti con mieloma è illustrato nella Figura 4. È importante notare che esistono vari periodi di remissione e risposta. La patofisiologia del mieloma è riassunta in forma schematica nella tabella 2. MALATTIA DELL’OSSO Sin dal primo riconoscimento di mieloma nel 1844, la presenza di proteina monoclonale è stata collegata alla distruzione dell’osso. È stato necessario molto tempo per determinare i meccanismi coinvolti. Il primo indizio era rappresentato dal fatto che sia le cellule del mieloma che il numero elevato di osteoclasti fossero presenti a livello delle aree osteolitiche. La comprensione dei meccanismi patofisiologici deriva dall’osservazione che le cellule del mieloma producevano fattori attivanti osteoclasti (OAFs) sin alla scoperta di citochine locali come IL-1β, IL-6, e TNF-α e -β; chemochine come MIP1α; e processi di involuzione dell’adesione delle cellule , che sono coinvolte nella crescita e nell’attività degli osteoclasti. Più recentemente una sostanza chiamata RANK ligando (RANKL) è stata identificata come mediatore dell’attivazione degli osteoclasti. Alcuni studi stanno valutando l’efficacia clinica degli inibitori specifici del RANKL, chiamati RANK.Fc e osteoprotegerina (OPG), che hanno mostrato efficacia in studi di laboratorio e test clinici preliminari. Un’osservazione completamente nuova da parte del gruppo di Little Rock è che la malattia litica dell’osso sia associata alla produzione di una proteina locale denominata DKK-1. Questo è un altro spunto per nuove strategie terapeutiche. Oltre all’attivazione degli osteoclasti, l’altra caratteristica del mieloma come malattia dell’osso è l’inibizione degli osteoblasti, i quali sono i responsabili della nuova formazione di tessuti dell’osso e quindi della guarigione dell’osso. “L’accoppiamento” della funzione degli osteoclasti e degli osteoblasti è responsabile del rimodellamento e della riparazione dell’osso. Il meccanismo responsabile del “non accoppiamento” nel mieloma è in fase di ricerca. Una nuova importante osservazione si riferisce ai farmaci ipercolestoremizzanti (HMG-CoA reductase inhibitors, Lipitor®, Mevacor®), possono aumentare l’attività degli osteoblasti e promuovere la guarigione dell’osso. Inoltre, sia il VELCADE® che la Lenalidomide (Revlimid®) sono stati indicati per promuovere la guarigione dell’osso, oltre ad esercitare una potente attività antimieloma. Studi per approfondire ulteriormente il beneficio di diverse terapie per la malattia ossea sono in corso. ANEMIA L’anemia è una delle caratteristiche del mieloma. Anche l’interpretazione midollare né è indubbiamente un fattore, l’inibizione della produzione dei globuli rossi nel sangue da parte di citochine nel microambiente è una spiegazione più funzionale. Le cause esatte dell’anemia correlata al mieloma sono oggetto di indagine di vari gruppi di ricerca. 14 DISFUNZIONE RENALE La riduzione della funzionalità renale è una delle complicazioni più comuni nei pazienti affetti da mieloma. Ad ogni modo, ciò non significa che ogni paziente debba avere questo problema. In alcuni pazienti, le proteine del mieloma, specialmente la proteina di Bence Jones, provoca lesioni renali causate da diversi meccanismi: danno tubolare dovuto all’accumulazione di catene leggere, o selettivi danni tubolari che si manifestano con effetti metabolici chiamati sindrome di Fanconi. La sindrome di Fanconi è caratterizzata da un danno selettivo tubolare che si manifesta con la perdita di aminoacidi e fosfato nelle urine, che possono causare una malattia metabolica dell’osso. Altri importanti fattori legati alla riduzione della funzionalità del rene nei pazienti con mieloma multiplo sono ipercalcemia, infezioni ed effetti collaterali dovuti all’assunzione di farmaci (es. antibiotici nefrotossici, FANS: farmaci antiinfiammatori non steroidali). La consapevolezza di un potenziale danno al rene, mantenendo una fluida capacità di assorbimento eccellente, è molto importante soprattutto per i pazienti con mieloma per contribuire ad evitare gli effetti dannosi di questi diversi fattori. DISFUNZIONI DEGLI ALTRI ORGANI Le cellule del mieloma possono accumularsi nel midollo osseo e/o in altri tessuti e produrre una vasta gamma di potenziali complicazioni. •Danni a carico del tessuto nervoso sono spesso presenti in pazienti con mieloma multiplo. Essi sono dovuti all’azione diretta della componente monoclonale o al deposito di fibrille di amiroliade sul tessuto nervoso provocando una neuropatia periferica da distinguere con altre neuropatie (es. diabete). A causa della suscettibilità all’infezione, le infezioni virali del tessuto nervoso sono abbastanza comuni, in particolare l’Herpes zoster. •Plasmacitomi – sia nell’osso che dei tessuti molli, i plasmacitomi possono determinare compressione nei nervi, nella colonna vertebrale, o spesso nel cervello. Questi effetti di pressione possono rappresentare un’urgenza medica e richiedere immediatamente un trattamento con alte dosi di corticosteroidi, terapia con radiazione o neurochirurgia. •Infezioni – la predisposizione alle infezioni è forse la caratteristica più peculiare nei pazienti affetti da mieloma oltre alla fragilità dell’osso. Il meccanismo responsabile della suscettibilità alle infezioni non è ancora stato pienamente spiegato. La produzione di una Ig monoclonale dà una retroinibizione della produzione delle altre Ig (ipogammaglobulinemia), inoltre è aberrante l’attività del sistema monocito-macrofogico e risulta ridotta l’attività del linfocita T. I pazienti con mieloma sono suscettibili sia alle infezioni virali che alle infezioni con batteri “incapsulati”come il pneumococco. Tuttavia, in considerazione della neutropenia e degli effetti immunodepressori della chemioterapia ad alte dosi, e con l’aggiunta di cause locali di cateteri impiantati (es. catetere Hickman), l’intera gamma di batteri, funghi, e infezioni opportunistiche può colpire i pazienti con mieloma in terapia. 15 In sintesi, gli aspetti chiave delle infezioni nei pazienti con mieloma sono: •immunità ridotta a causa del mieloma •Basso livello di globuli bianchi a causa dell’accumulo di mieloma nel midollo osseo e/o a causa dell’impatto del trattamento. Infezioni, o qualsiasi altra questione di infezione, non devono essere ignorate. Una tempestiva verifica è necessaria per valutare la necessità di un’eventuale terapia antibiotica immediata e/o la somministrazione di antivirali. Molti pazienti imparano a portare con sé la propria terapia per ogni emergenza. TIPI DI MIELOMA I tipi di proteine monoclonali prodotti variano da paziente a paziente. Il più comune è l’IgG e il più raro è l’IgE. La Tabella 3 mostra la percentuale dei vari tipi di mieloma. Ogni tipo è associato con modelli un pò differenti di malattia. Per esempio, il mieloma IgA è più comunemente associato malattia extramidollare, invece il mieloma IgD è più comunemente associato alla leucemia plasmacellulare e al danno renale. SINTOMI CLINICI Circa il 70% dei pazienti affetti da mieloma si presentano con dolori di varia intensità, spesso in sede lombare. Un dolore severo improvviso può rappresentare un segno di frattura o collasso del corpo vertebrale. Malessere generale e dolori vaghi sono frequenti . Un significativo abbassamento dell’altezza è raro. TABELLA 3 Tipi Di Proteine Monoclonali (%) 1. Siero IgG IgA IgD IgE % 52 21 2 < 0.01 2. Urine (Bence Jones) tipi κ e λ 3. Due o più paraproteine monoclonali Solamente Catene Pesanti (G o A) No paraproteine monoclonali < 1 <1 1 75% 11% 2% 4. IgM (raramente mieloma, comunemente associate alla Macroglobulemia di Waldenstrom) 12% TOTAL 100% Fonte: Dati su 1,827 pazienti con Mieloma Multiplo raccolti e analizzati da Pruzanski e Ogryzlo, 1970. 16 Totali Sia la neutropenia che l’ipogammaglobulemia aumentano la probabilità di infezioni. Anche se la polmonite da pneumococco è la più comune nel mieloma alla diagnosi, altri batteri, come gli streptococchi e gli stafilococchi, sono ormai isolati. Anche l’infezione Haemophilus e l’infezione herpes zoster sono comuni. L’ipercalcemia, tradizionalmente presente nel 30% dei pazienti alla diagnosi, causa stanchezza, sete, e nausea. La precipitazione dei sali di calcio può causare il deterioramento della funzionalità renale. Negli ultimi anni l’incidenza di ipercalcemia nei pazienti alla diagnosi si è ridotta fino al 10-15%, molto probabilmente a causa delle diagnosi precoci. L’iperviscosità, dovuta agli alti livelli di proteine del mieloma, può causare problemi come visione annebbiata, ronzii auricolari, epistassi, emicranie, spurgo gastrointestinale, sonnolenza e una varietà di sintomi ischemici neurologici causati da riduzione del flusso sanguigno. L’iperviscosità colpisce meno del 10% dei pazienti con mieloma. L’iperviscosità interessa, invece, circa il 50% dei pazienti con macroglobulemia di Waldentrom (paraproteina IgM o componente M). Il rischio emorragico è spesso accentuato dalla trombocitopenia, in aggiunta alle proteine monoclonali che si legano a fattori di coagulazione e/o piastrine. La compressione nervosa può risultare in problemi specifici che dipendono dalla localizzazione. Problemi particolarmente comuni sono compressione del midollo spinale, meningiti, e sindromi del tunnel carpale. Sebbene sia la meningite che la compressione del midollo spinale siano dovute alla formazione e all’infiltrazione di cellule tumorali nel liquido, la sindrome del tunnel carpale è di solito dovuto al deposito di amiloide. STADIAZIONE E FATTORI PRONOSTICI La prognosi nel mieloma è determinata sia dal numero che dalle caratteristiche delle cellule del mieloma nel singolo paziente. Le proprietà specifiche includono il tasso di crescita delle cellule del mieloma, il tasso di produzione delle proteine monoclonali, e la produzione o meno di varie citochine che danneggiano o alterano in modo significativo altri tessuti, organi, o le loro funzione. Nel 1975, è nato il sistema di stadiazione Durie/Salmon (Tabella 4). Questo sistema include i maggiori parametri clinici in relazione con alla massa mielomatosa (il numero totale delle cellule del mieloma in tutto il corpo). Il sistema di stadiazione Durie/Salmon continua ad essere utilizzato in tutto il mondo soprattutto perché fornisce la migliore correlazione diretta con le singole caratteristiche cliniche del paziente. I pazienti in stadio I sono affetti da mieloma smoldering; i pazienti in fase II e III, sono affetti da mieloma attivo. Nel 2005 un nuovo sistema di stadiazione è stato sviluppato dallo sponsorizzato dell’IMF – International Myeloma Working Group (IMWG). Dati clinici e di laboratorio sono stati calcolati su 10.750 pazienti con mieloma sintomatico precedentemente non trattati da 17 istituzioni, includendo il Nord America, Europa, e Asia. Utilizzando varie tecniche statistiche sono stati studiati i più importanti e noti fattori prognostici. β2 microglobulina sierica (S-β2M), albumina sierica, numero di piastrine, creatinina sierica, e l’età sono emersi come fattori prognostici più importanti della sopravvivenza e furono analizzati ancora successivamente. 17 Una combinazione dei livelli di β2 microgobulina sierica e albumina sierica ha fornito il più semplice, potente e riproducibile sistema di classificazione. Questo nuovo International Staging System (ISS) è mostrato nella Tabella 5. L’ISS fu ancora convalidato da dimostrazioni di efficacia in pazienti in Nord America, Europa e Asia; nei pazienti < e > di 65 anni e in confronto con il sistema Durie/Salmon. Il nuovo International Staging System (ISS) è semplice, basato su variabili più facili da usare (β2M sierica e albumina sierica) ed è largamente utilizzato. Il mieloma può essere ulteriormente classificato in categorie genetiche a Il mieloma può essere ulteriormente classificato sulla base del rischio genetico mediante l’esame ibridazione in situ (FISH) e sulle base delle caratteristiche Criteri TABELLA 4 Sistema Di Stadiazione Durie/Salmon Massa della cellula del mieloma misurabile (cellule del mieloma in miliardi/m2)* in Stadio I (massa cellulare bassa) 600 miliardi* • Valore dell’emoglobina > 10 g/dL • Valore normale del calcio sierico < 10.5 mg/dL • Raggi X dell’osso, struttura normale dell’osso (scala 0) o solamente plasmcitoma solitario dell’osso • Bassi tassi di produzione della componente M valore IgG < 5.0 g/dL valore IgA < 3.0 g/dL Componente M della catena leggera dell’urina all’elettroforesi < 4 g/24h in Stadio II (massa cellulare intermedia) 600 a 1.200 miliardi* Nessun adattattamento allo stadio I e allo stadio II. in Stadio III (massa cellulare alta) >1.200 miliardi* Uno o più dei seguenti: • Valore dell’emoglobina < 8.5 g/dL • Valore del calcio sierico > 12 mg/dL • Avanzamento di lesioni litiche dell’osso (scala3) • Alti tassi di produzione della componente M valore IgG >7.0 g/dL valore IgA > 5.0 g/dL Componente M della catena leggera dell’urina all’ elettroforesi < 12 g/24h in Sotto-classificazione (A o B) • A: funzione renale relativamente normale (valore della creatinina sierica) < 2.0 mg/dL • B: funzione renale anormale (valore della cratinina sierica) > 2.0 mg/dL Esempi: Stadio IA(bassa massa cellulare con funzione renale normale) Stadio IIIB (alta massa cellulare con funzione renale anormale) *cellule del mieloma in tutto il corpo 18 TABELLA 5 Sistema Di Stadiazione Internazionale (ISS) Stadiazione del mieloma multiplo STADIO VALORI STADIO I β2M <3.5 ALB ≥3.5 STADIO II β2M <3.5, et ALB <3.5 o β2M 3.5 – 5.5 STADIO III β2M >5.5 Note: β2M = β2 microglobulina in mg/L ALB = albumina in g/dL citogenetiche identificate nelle cellule del mieloma presenti nel midollo osseo. Tale classificazione può avere importanti implicazioni per il trattamento. Una malattia ad alto rischio è definita come la presenza di una qualsiasi delle seguenti mutazioni genetiche: t (4; 14), t (14; 16), t (14; 20), delezione 17p alla FISH, o delezione del cromosoma 13 o ipodiploipida da metafase citogenetica convenzionale. E’ fondamentale essere consapevoli che il rischio di classificazione è fortemente influenzato dal trattamento scelto. Ad esempio, la presenza di 17p alla FISH è l’unico fattore che si correla in modo coerente con i risultati più scarsi, di tutte le terapie disponibili nel 2011. Al contrario, per esempio, la presenza di t (4; 14), che nel passato è sempre stata considerata un basso fattore di rischio, è stata ampiamente superata con l’introduzione di VELCADE® (bortezomib) come regime di associazione. Vi è anche un impatto positivo dei regimi a base di lenalidomide-(Revlimid®) in pazienti con t (4; 14) in numerosi studi clinici. Una recente relazione del gruppo francese IMF indica che la presenza di t (14; 16) non è più un fattore prognostico predittivo nei loro studi clinici. Si prevede che, nel corso del tempo, vengano introdotti nuovi sistemi di classificazione del rischio e sarà, così, possibile offrire un trattamento di selezione basato su risultati documentati di nuovi approcci terapeutici. DEFINIZIONE DELLA RISPOSTA CLINICA È consigliato l’utilizzato dei nuovi criteri di risposta della’International Myeloma Working Group (IMWG) per classificare le risposte (vedere Tabella 7) La riduzione dei livelli di componente monoclonale deve essere associata all’evidenza di miglioramenti dal punto di vista clinico (dolore osseo ridotto, valori del sangue in aumento, ecc.) È importante ricordare che un’alta percentuale di regressioni non da necessariamente miglioramenti pero quanto concerne la sopravvivenza. In caso di malattia residua, le caratteristiche delle cellule del mieloma resistenti al farmaco determioneranno il resultato. Il numero di cellule resistenti al mieloma dipende in primo luogo dal pre-trattamento o dallo studio. I pazienti che rispondono alla terapia paasano da un alto rischio ad un basso rischio quando vi è assenza di sintomi di represa della malattia, o con la stabilizzazione della malattia stessa ma con malattia residua misurabile. Il tempo richiesto per raggiungere la stabilizza- 19 zione della malattia è variabile, e può andare dai 3 ai 6 mesi (risposta rapida), ai 12-18 mesi risposta lenta). Vedere Figura 4. Poiché i trattamenti sono aumentati, è diventato importante valutare la risposta del trattamento nel modo più accurato possibile, oltre all’intensità della risposta che viene indicata attraverso la PR (miglioramento ≥ 50%) o la VGPR (≥ 90%) [vedere Tabella 7] occorre, quindi, prendere in considerazione la durata della risposta. Due termini importante sono: • TTP – Tempo alla progressione : il tempo che intercorre dall’inizio del trattamento alla recidiva di malattia. • PFS – Sopravvivenza libera da progressione : la durata della sopravvivenza del paziente in remissionedi malattia.* * La remissione viene generalmente considerata una risposta (almeno una PR, es. miglioramento ≥ 50%) quando dura almeno 6 mesi. TR ATTAMENTI DESCRIZIONE La preghiamo di leggere la sezione storica per una descrizione dell’evoluzione dei trattamenti attualmente utilizzati. Da quando il melphalan fu introdotto per la prima volta nel 1962, varie combinazioni di schemi terapeutici sono stati utilizzate e sono stati fatti tentativi per migliorare i risultati usando alte dosi di regimi chemioterapici con il supporto di trapianto di midollo osseo (BMT) o il trapianto di cellule staminali periferiche (PSCT). Non c’è finora nessun consensosulla migliore strategia per trattare il mieloma. Tuttavia, qui di seguito Le verranno fornite alcune linee guida di riferimento. Negli anni ‘80 e ‘90, il melphalan ad alte dosi con raccolta di cellule staminali è stata una delle poche tecniche/trattamenti disponibili per ridurre il carico tumorale di mieloma e ottenere migliori risultati. Con l’introduzione della talidomide per il trattamento del mieloma nel 1997, le opzioni terapeutiche sono improvvisamente cambiate. Risposte complete possono essere così raggiunte anche con un semplice agente orale. Con molta rapidità sono successivamente stati introdotti nuovi agenti: dapprima il VELCADE®, poi il carfilzomib e il Revlimid®, e ora e la pomalidomide, farmaci pronti per l’approvazione iniziale da parte dell’FDA. Altri agenti come l’elotuzumab, il vorinostat, il panobinostat, e altri stanno mostrando risultati promettenti. Non esiste una risposta unica alla domanda “quale sia la migliore opzione di trattamento” disponibile nel 2011. Fortunatamente, vi sono numerosi regimi che producono risposte molto profonde (oltre il 90% di riduzione di componente-M [VGPR]), risposte durevoli (durata della remissione ≥ 2 anni), e una migliore sopravvivenza generale. La scelta migliore per ogni paziente dipende da fattori individuali quali l’età, lo stadio, le caratteristiche genetiche, lo stato dei reni, e naturalmente la preferenza personale. Capire se il trapianto debba essere richiesto come parte del primo trattamento o se possa essere utilizzato come scelta terapeutica in prima recidiva resta tuttora una questione aperta. È importante che i pazienti affetti da mieloma siano consapevoli della necessità di discutere attentamente con il proprio medico. 20 ESCLUDERE L’MGUS O IL MIELOMA ASINTOMATICO La prima e più importante decisione è capire se la terapia è necessaria. I pazienti con MGUS e mieloma asintomatico dovrebbero essere osservati molto attentamente piuttosto che trattati. Attualmente non ci sono terapie che possano aumentare il controllo immunitario del mieloma di nuova diagnosi o ridurre la probabilità della progressione della malattia. Tuttavia, sono in corso diverse sperimentazioni per valutare se il trattamento precoce è utile in alcuni pazienti. Un ampio studio di gruppo cooperativo (ECOG/SWOG) è stato avviato nell’autunno del 2010. I pazienti con alto rischio di mieloma smoldering sono stati randomizzati nel braccio Revlimid® vs. placebo. La terapia con bifosfonati può essere utilizzata per pazienti con malattia ossea precoce. L’eritropoietina può essere considerata come opzione per il trattamento dell’anemia isolata, tenendo presente le avvertenze riguardanti questo agente. Un trattamento specifico anti-mieloma è raccomandato quando il mieloma diventasintomatico con un aumento della componente monoclonale e/o con la comparsa di problemi clinici o “CRAB” (Tabella 1). I problemi che possono richiedere l’inizio di un trattamento specifico includono la distruzione dell’osso (lesioni osteolitiche e/o osteoporosi), insufficienza renale, progres- TABELLA 6 Opzioni Di Trattamenti Per Il Mieloma 1. Chemioterapia 2. Terapia ad alte dosi con trapianto 3. Terapia radiante 4. Terapia di mantenimento (es. alpha interferon, prednisone) 5. Cure di appoggio: • Eritropoietina* • Farmaci per il dolore • Bifosfonati • Fattori di crescita • Antibiotici • Busto di sostegno • Esercizio • Cure di emergenza (es. dialisi, plasmaferesi, chirurgia) 6. Trattamento della terapia resistente ai farmaci 7. Trattamenti nuovi ed emergenti: • Talidomide, Revlimid®, e nuove generazioni di IMiD in sperimentazioni cliniche, ad esempio, pomalidomide • VELCADE® (inibitore del proteasoma) e inibitori del proteasoma di prossima generazione in studi clinici, ad esempio, carfilzomib, NPI-0052 • Doxil® (doxorubicina liposomiale pegilata) in sostituzione all’infusione di Adriamicina • Trapianto Mini-Allo (non-mieloablativo) • Inibitore dell’istone deacetilasi (HDAC) in studi clinici, ad esempio, vorinostat e panobinostat • Anticorpi monoclonali in studi clinici, ad esempio, elotuzumab * Con caveat 21 TABELLA 7 International Myeloma Working Group E Criteri Uniformi Di Risposte CR e Altre Categorie Di Risposte Sottocategoria di risposta sCR Criteri di rispostaa Stessi criteri della CR come definita in basso più: • Tasso di FLC normale • Assenza di cellule clonali nel midollo osseob attraverso esami di immunochimica o immunofluorescenzac CR • Immunofissazione negativa nel siero e nelle urine • Scomparsa di ogni eventuale plasmocitoma • ≤5% di plasmacellule nel midollo osseob VGPR • Proteina M nel siero e nelle urine visibile all’immunofissazione ma non attraverso l’elettroforesi • riduzione di più del 90% della proteina M nel siero e livelli di proteina M nelle urine <100 mg 24h PR • Riduzione della proteina M nel seiro ≥50% e nelle urine delle 24 h ≥90% o <200 mg 24h • Se i livelli di proteina M nel siero e nelle urine non sono misurabili, una dimunuizione ≥50% nella differenza tra i livelli di FLC coinvolti e non coinvolti è richiesta. • Se la proteina M nel siero e nelle urine non è misurabile e l’analisi delle catene leggere libere del siero sono anche esse non misurabili una riduzione ≥50% delle plasmacellule è richiesta al posto della proteina M Oltre ai criteri sopra elencati, se al basale vi è la presenza di un plasmocitoma una riduzione ≥50% del tessuto molle è richiesta. Non vi sono criteri né di CR, VGPR, PR, o progressione di (non raccomandata malattia. come indicatore di risposta; la stabilità della malattia è meglio descritta fornendo il tempo di progressione di malattia stimato) SD Abbreviazionis: CR = risposta completa; FLC = catene leggere libere; PR = risposta parziale; SD = malattia stabile; sCR = risposta completa stringente; VGPR = risposta parziale molto buona aTutte le categorie di risposta richiedono due valutazioni consecutive eseguite prima dell’inizio di ogni terapia; tutte le categorie richiedono, anche, nessuna presenza diprogressione di malattia o di presenza dinuove lesioni all’analisi radiografica. Indagini radiologiche non sono richieste per soddisfare le richieste di queste risposte. bNon è necessaria la conferma della risposta attraverso aspirati midollari o biopsie. cPresenza/assenza di cellule clonali è basata sul rapporto κ/λo. Un rapporto κ/λ anormale agli esami di immunochimica e/o immunofluorescenza richiedono un minimo di 100 plasmacellule per l’analisi. Un rapporto sbilianciato che riflette la presenza di cloni anormali è un rapporto κ/λ >4:1 o <1:2. 22 siva riduzione dei valori del sangue (es. anemia, neutropenia), livelli elevati di calcio nel sangue, danni al sistema nerviosoi, o altri significativi danni dell’organo e del tessuto causati dal mieloma o dalle proteine del mieloma. Questi elementi che indicano la necessità di intraprendere un trattamento possono essere riassunti nella parola CRAB : Calcemia; insufficienza Renale; Anemia; lesioni dell’osso (B). L’obiettivo principale del trattamento è risolvere problemi specifici e raggiungere un controllo generale della malattia. Un riassunto dei vari tipi di trattamento è fornito nella Tabella 6, e i farmaci chemioterapici comunemente usati sono elencati nella Tabella 8. 1. TRATTAMENTO SISTEMICO ANTI-MIELOMA INTRODUZIONE Il primo tipo di trattamento per il mieloma è apparso quando il melphalan venne introdotto per la prima volta nel 1962. Sebbene l’uso di una semplice combinazione orale di melphalan più prednisone è ancora un valido approccio, ora diversi fattori influenzano la scelta del tipo di terapia. •Il melphalan può danneggiare le normali cellule staminali del midollo osseo ed è quindi evitato in pazienti in cui si è pianificato una raccolta di cellule. •Dato che l’età superiore ai 70 anni non è controindicazione assoluta a raccogliere cellule staminali e al trapianto, il ruolo del trapianto di cellule staminali deve essere valutato per ogni paziente su basi individuali. CHEMIOTERAPIA RACCOMANDATA SE LA RACCOLTA DI CELLULE STAMINALI NON È PREVISTA L’approccio terapeutico ha subito cambiamenti sostanziali dopo l’introduzione di nuovi agenti quali la talidomide, il bortezomib (VELCADE®) e la lenalidomide (Revlimid®). Sebbene l’associazione melphalan/prednisone (MP) risulta essere un‘opzione terapeutica per pazienti anziani, due nuove associazioni (Tabella 9) hanno dimostrato effetti superiori rispetto a quelli del regime MP per i pazienti non candidabili al trapianto: melphalan/prednisone/ talidomide (MPT) e bortezomib (VELCADE®)/melphalan/prednisone (VMP). Inoltre sia l’associazione talidomide/ (Tal/Dex) sia l’associazione lenalidomide (Revlimid®)/ desametasone a basse dosi (Rev/dex) sono disponibili per l’utilizzo nel campo non trapiantologico. Melphalan/Prednisone/Talidomide (MPT) – Tre studi clinici randomizzati hanno confrontato il regime MP con il regime MPT. Entrambi hanno dato alti tassi di risposta, remissioni e sopravvivenze libere da progressione più durature. Melfalan/prednisone/talidomide (MPT) – Tre studi randomizzati hanno confrontato il regime MP con il regime MPT. Ognuno ha mostrato un tasso di risposta più alto, una più lunga remissione, e una maggiore sopravvivenza libera da progressione (PFS) con il regime MPT. Il rischio di eventi trombotici venosi richiede profilassi del caso, a seconda delle caratteristiche individuali del paziente. (Vedere le linee guida dell’International Myeloma Working Group per la prevenzione della trombosi correlata al trattamento con talidomide e lenalidomide). Melfalan/prednisone/Revlimid® (MPR) – Risultati derivanti dallo studio clinico MM-015, ancora in corso, hanno dimostrato che il regime MPR ha un 23 TABELLA 8 I Farmaci Più Usati Nella Chemioterapia Nome Del Farmaco Melphalan* (M)** Altro Nome Di Trattamento Alkéran® (per os o endovena) Commenti Primo agente singolo utilizzato per il trattamento di mieloma. Cyclophosphamide* Cytoxan® (per os o (C o CY)** endovena) Simile come efficacia al M ma con più tossicità GI e GU e meno tossicità ematologica. BCNU* (B)** Bis-chloroNitrosurea® (endovena) Simile al M e al C ma meno efficace e più tossico specialmente nel midollo osseo e tossicità prolungata. Prednisone (P)** Direttamente attivo, agisce bene con Prednisolone® M, C, e B. Non produce soppressione (simile) (di solito al mese) midollare. Desametasone (D)** Decadron® (per os o endovena) Simile al prednisone ma più potente. Più effetti collaterali severi. Vincristina (V o O)** Oncovin® (endovena) Oggi non utilizzato come parte della combinazione VAD, (provata come inferiore alla combinazione VELCADE® / Adriamicina / dex) Doxorubicina (A)** Adriamycine® (endovena) Efficacité modeste, souvent associée à d’autres molécules (ex. VAD, ABCM, VMCP/VBAP) Busulfano* (B o BU)** Myleran® (per os o endovena) Simile attività al M e C, di solito parte di terapia ad alte dosi con trapianto (per es. regime BU/CY). VP–16 Etoposide® Modesta attività, usato da solo o in combinazione. Cisplatine (CP o P)** Platinol® (endovena) Da solo attività minima, ma è utilizzato come parte di combinazioni (per es. EDAP e DT-PACE). Nuovi Agenti Altro Nome Di Trattamento Commenti Doxorubicina liposomiale peghilata* Doxil® (endovena) In combinazione, attività promettente, meno tossica rispetto ad A Bortezomib (B, V, o P)** VELCADE® (endovena) Direttamente attivo, usato da solo o in combinazione Thalidomide (T) Thalomid® (per os) Direttamente attiva, approvato per l’uso in associazione con desametasone o altre combinazioni Lenalidomide (R o L) Revlimid® (per os) Direttamentre attiva, approvato per l’uso in associazione con desametasone o altre ombinazioni * Agenti Alchilanti ** Abbreviazioni Comuni 24 significativo vantaggio nella sopravvivenza libera da progressione rispetto al regime MP. Tuttavia, sono emersi delle preoccupazioni circa gli effetti collaterali, tra cui un piccolo rischio di sviluppo di secondi tumori primari che è attualmente sotto inchiesta. Bortezomib (Velcade®)/melfalan/prednisone (VMP) – Un grande studio randomizzato (VISTA) che coinvolge 682 pazienti con un’età mediana di 71 anni, ha mostrato che il regime VMP raggiunge migliori risultati rispetto al regime MP portando così all’approvazione da parte dell’FDA del VELCADE® in prima linea. Risposta, durata della remissione e sopravvivenza globale si sono dimostrati superiori con il regime VMP. L’avvertimento più importante è che il 13% dei pazienti trattati con VMP ha manifestato eventi di neuropatia grave (grado 3 o 4) con l’associazione di VELCADE®. Sebbene la neuropatia si sia risolta nella maggior parte dei pazienti, resta comunque una preoccupazione importante. Bortezomib (Velcade®)/melfalan/prednisone/Thalidomide (VMPT) – Il trattamento con VELCADE® settimanale più una dose ridotta di talidomide in associazione con MP (studio clinico GIMEMA) ha dimostrato avere migliori tassi di risposta e una sopravvivenza prolungata rispetto al regime VMP, con tassi ridotti di neuropatia periferica e di interruzione della terapia. Talidomide/desametasone (Thal/Dex) – e lenalidomide (Revlimid®)/Low- Dose Dex (RevloDex): Anche se non è stato testato esclusivamente nell’ambito non trapiantologico, sia Thal/Dex che RevloDex possono essere presi in considerazione, per pazienti non candidabili a trapianto immediato, così come per coloro che sono eleggibili al trapianto. Con l’approvazione di lenalidomide/ desametasone (Rev/dex) nel campo della recidiva e con sperimentazioni nel campo della terapia di prima linea, la combinazione RevloDex è diventata una scelta popolare per la terapia di induzione. Un importante studio ECOG (E4A03) ha mostrato risultati eccellenti con Revlimid® più desametasone a base dosi (settimanale) versus Revlimid® più dosi convenzionali di desametasone (ogni 4 giorni). I tassi di effetti collaterali all’inizio erano molto bassi, così come la probabilità di mortalità precoce, che è stata solo dello 0,5% (nei primi 4 mesi). RevloDex divenne così una scelta eccellente per il regime di induzione. L’unica cautela è maggiore per i pazienti che desiderano conservare come opzione la raccolta di cellule staminali. I ricercatori della Mayo Clinic hanno notato rendimenti inferiori post induzione con Rev/dex con una piccola percentuale di pazienti non in grado raccogliere un’adeguata quantità di cellule staminali per i trapianti con Neupogen®, singolo fattore di crescita per la raccolta. Ad oggi, il 98% dei pazienti negli Stati Uniti riceve la terapia di induzione, che comprende almeno un nuovo agente. Un recente sondaggio ha dimostrato che l’associazione RevloDex e le combinazioni a base di Velcade sono utilizzati in numero approssimativamente uguale nel campo della prima linea, con talidomide/dex ora meno spesso utilizzati. Revlimid®/Bortezomib (Velcade®)/desametasone (RVD) – Finora, studi clinici hanno mostrato risultati molto promettenti per questa combinazione. Studi di fase III nel campo della nuova diagnosi e della recidiva sono in corso. Sebbene non ancora approvato dall’FDA nel campo della prima linea o della recidiva, questo regime non è prescritto di rado negli Stati Uniti. 25 SINOSSI DEGLI INDICAZIONI PER LA TERAPIA DI PRIMA LINEA IN PAZIENTI NON CANDIDABILI AL TRAPIANTO Sia l’associazione MPT che l’associazione VMP hanno a loro favore eccellenti studi clinici di fase III. Un ulteriore periodo di follow up è richiesto per valutare i termini maggiori di sopravvivenza sia con l’associazione MPT sia con l’associazione VMP. Dati preliminari suggeriscono che l’associazione VMP può evitare l’impatto dei fattori prognostici negativi (vedi sopra). Il rischio che si manifesti una TVP è più probabile con l’associazione MPT, ma non con l’associazione VMP. Il regime MPT è una terapia completamente orale mentre l’associazione VMP prevede la somministrazione per via endovenosa del TABELLA 9 Associazioni Attualmente Disponibili MP Prima associazione standard utilizzata per la terapia di prima linea CP In alternativa all’MP ABCM Associazione utilizzata in Europa, in particolare nell’UK. Vantaggio minimo ulteriore rispetto l’MP VAD In passato l’alternativa all’MP più utilizzata, ora rimpiazzata con associazioni più attive che comprendono nuovi agenti. D or MD or CD D da solo o in associazione con M o C può essere usato in alternativa al VAD. Evita la necessità di eseguire infusioni di 4 giorni. TD (thal/dex) associazione di prima linea, ora ampiamente rimpiazzata con Rev/dex negli USA MPT (MP+thal) per aumentare l’efficacia di MP MPR (MP+Revlimid®) per aumentare l’efficacia di MP VMP (MP+VELCADE®) approvato dall’FDA per la terapia di prima linea VMPT (MP+ridotta frequenza di VELCADE® e dosi ridotte di thalidomide) per aumentare l’efficacia di MP con minore rischio di neuropatia RD or Rd (Rev/dex) associazione popolare di prima linea D = dose piena di dex; d = basse dosi di dex, un giorno a settimana BD or VD (VELCADE®/dex) approvato dall’FDA per la terapia di prima linea RVD (Revlimid®+ VELCADE®+dex) Associazione promettente negli ultimi studi clinici CVD (“CyborD”) (Cytoxan®+VELCADE®+dex) Associazione promettente in studi in recidiva e alla diagnosi 26 VELCADE®. Sia l’MPT che il VMP possono dare rischi di tipo neuropatico. La manifestazione della neuropatia è più probabile con l’associazione VMP. Le opzioni terapeutiche alternative quali, MP, Tal/Dex, Rev/Dex a basse dosi, possono essere scelte in base alla condizione clinica del paziente. SE SI PROGRAMMA UNA RACCOLTA DI CELLULE STAMINALI L’approccio nei confronti della terapia di prima linea o di unduzione si è evoluto ed ha subito icambiamenti durante le ultime due decadi. Chemioterapia VAD – Il protocollo VAD, introdotto nel 1984, divenne una popolare alternativa all’MP o all’induzione con CP. Notevoli svantaggi, tra cui possibili infezioni e problemi di coagulazione del sangue, così come i tassi di risposta con talidomide/desametasone, Revlimid®/desametasone, e bortezomib, con o senza desametasone, tutti superiori a quelli di VAD, hanno fatto del VAD un’opzione meno comunemente utilizzata in tutto il mondo. Talidomide/desametasone (Thal/Dex) – Thal/Dex è un’opzione standard per la terapia di prima linea, con un tasso di risposta del 64%. Tassi di risposta migliori e una bassa incidenza di neuropatia periferica con RevloDex hanno fatto di questa nuova VELCADE® – Nel giugno 2008, il VELCADE® è stato approvato per l’utilizzo in prima linea. Anche se si tratta di un agente molto attivo e unico, si prevede che verrà utilizzato per lo più come terapia di associazione, aggiungendolo così all’arsenale di opzioni a disposizione dei pazienti di nuova diagnosi, nonché in recidiva o refrattari. Sono ora disponibili una grande varietà di associazioni di bortezomib (VELCADE®): • Bortezomib/talidomide/desametasone (VTD) – Cavo et al. hanno di recente confrontato l’associazione talidomide/desametasone versus VTD in uno studio controllato, randomizzato che coinvolge 256 pazienti. Il tasso di CR più VGPR dopo 3 cicli di 21 giorni è stato significativamente più alto per il regime VTD (60%) rispetto al regime con talidomide/desametasone (27%). • Bortezomib/desametasone versus VAD – Diversi studi hanno mostrato tassi di risposta iniziale globale (ORR) del 70%–90% con bortezomib/ desametasone (Vel/dex) come terapia di prima linea. In uno studio recentemente segnalato, Harousseau et al. ha confrontato il regime Vel/dex con VAD come induzione pre-trapianto. I tassi di CR + VGPR sono stati: Vel/ dex 47% versus 19% VAD pre-trapianto, e Vel/dex 62% versus 42% VAD post-trapianto di cellule staminali autologhe. • Altre associazioni di bortezomib – numerose associazioni di bortezomib (VELCADE®) sono in corso di valutazione. Molti hanno prodotto risultati promettenti negli studi di fase II-III, tra cui: VCD (VELCADE®/Cytoxan®/ Dex, noto anche come CyborD) categoria 2A-NCCN; VELCADE®/Doxil® ± categoria Dex-NCCN 2B; VRd (VELCADE® / RevloDex)-NCCN categoria 2B NCCN. Un recente studio della Mayo di VRD vs VCD vs VCRD (VELCADE®/Cytoxan®/RevloDex) ha indicato che tutti i regimi hanno un’efficacia simile, ma che la combinazione di quattro farmaci ha causato più tossicità e riduzioni più frequenti di dose. Dati derivanti da un followup a lungo termine devono essere ancora raccolti ed esaminati. La Mayo anticipa conducendo uno studio di confronto tra VCD e VRD. 27 Inoltre, il bortezomib è parte di diverse combinazioni di nuovi farmaci, in cui è prevista una particolare sinergia (vedi le sezioni Recidiva/Nuovi farmaci alle pagine 35-37. Associazioni di Revlimid® nella fase di pre-trapianto – I risultati con l’associazione lenalidomide (Revlimid®)/desametasone sono stati già dimostrati. In sostanza, l’associazione Rev/Dex può essere usata come terapia di induzione quando si ha in programma la raccolta di cellule staminali o il trapianto, anche se per gli studi condotti fino ad ora essa non è stata l’opzione terapeutica prioritaria. I risultati nella terapia di induzione sono eccellenti e comparabili a quelli con bortezomib in associazione. La raccolta di cellule staminali può richiedere l’assunzione di fattori di crescita più ciclofosfamide o Plerixafor versus fattori di crescita da soli (es. Neupogen). Sono richiesti ulteriori studi per testare l’utilizzo del Revlimid® come terapia pre-trapianto. TABELLA 10 Test Richiesti Per Monitorare La Risposta Alla Terapie Test Sanguigni • Emocromo • Ematochimici • Prove di funzionalità epatica • Misurazione della proteina del mieloma (elettroforesi delle proteine più immunoglobuline quantitative) • Siero β2 microglobulina • Proteina C-reattiva • Labeling index su sangue periferico • Livello di eritropoietina nel siero Urine • Analisi sitematica delle urine • Urine 24-ore per la misurazione della proteina totale, elettroforesi, e immunoelettroforesi • Urine 24-ore per la clearance se la creatinina del siero è elevata Valutazione Ossea • Indagine scheletrica con raggi-X • MRI/CT per problemi speciali • FDG/PET scan sull’intero corpo se lo stato della malattia non è chiaro • Densitometria ossea della diagnosi per determinare il beneficio dei bifosfonati Midollo Osseo • Aspirato e biopsia per il monitoraggio diagnostico e periodico • Speciali test per determinare la prognosi (per vedere il numero dei cromosomi, le traslocazioni, le delezioni - es. FISH 13q-, t[4:14], 1q21, ecc.) Altri Test • Amiloidosi • Neuropatia • Complicazioni renali o infettive (speciali circostanze) 28 Indicazioni per la terapia di prima linea in pazienti candidabili al trapianto – Le opzioni terapeutiche previste dagli studi clinici di supporto di fase III sono: • Talidomide/Desametasone (TD) • VELCADE®/Desametasone (VD) • VELCADE®/Talidomide/Desametasone (VTD) • Revlimid®/Desametasone a basse dosi (Rd) Tutte queste 4 associazioni possono produrre risposte rapide e dare alti tassi di risposta. Le associazioni TD e Rd sono esclusivamente assunte per via orale; le combinazioni VTD e VD prevedono l’assunzione per via endovenosa di VELCADE® . Le combinazioni TD e Rd possono provocare problemi di circolazione (TVP) e richiedere un trattamento specifico con aspirina o anticoagulanti. La neuropatia è un effetto collaterale che si manifesta maggiormente con l’assunzione di VELCADE®. Selezionare il trattamento migliore per ogni paziente diventa, quindi, una sfida. Occorre, infatti, prendere in considerazione i rischi precoci legati al trattamento, le risposte, la durata della remissione, le eventuali TVP e il rischio di eventuali neuropatie, la convenienza e il costo. La presenza di fattori genetici negativi e/o di insufficienza renale possono influenzare l’orientamento della scelta terapeutica verso le associazioni che prevedono la somministrazione di VELCADE®. È, dunque, di rilevante importanza dialogare per capire quali sono “i pro e i contro”. 2. TRAPIANTO Terapia ad alte dosi (HDT) con trapianto autologo di cellule staminali • Il ruolo del trapianto autologo è stato ampiamente rivisto. • HDT con trapianto autologo di cellule staminali ha dimostrato di poter migliorare sia il tasso di risposta sia la sopravvivenza in pazienti con mieloma. Tuttavia, questo approccio non è curativo: sfortunatamente più del 90% dei pazienti recidiva. • I tassi di remissione completa con HDT in prima linea variano dal 24% al 75%. • I tassi di remissione parziale (ad esempio > PR) con HDT in prima linea variano dal 75% al 90%. • Il tempo di progressione della malattia (prima progressione o recidiva) è di 18-24 mesi. • La sopravvivenza mediana globale con HDT è nel range di 4–5 anni. Questo è risultato essere statisticamente superiore nello studio randomizzato di Attal (1996) e nello studio del MRC (2003), per esempio, come nello storico caso-controllato del Nordic Myeloma Study (2000). • Morbità e Mortalità – Con l’uso dei fattori di crescita, degli antibiotici, e delle altre terapie di supporto, la mortalità con HDT è inferiore al 5%. La maggior parte dei centri somministrano il melphalan ad alte dosi per via endovenosa da solo alla dose di 200mg/m² come regime preparativo. Dato che quando l’uso della total body irradiation (TBI) aggiunge tossicità senza chiari benefici di sopravvivenza, pochi centri raccomandano la TBI come parte del regime di condizionamento. • Sono state condotte analisi sia della qualità della vita sia del costo-bene- 29 TABELLA 11 Terapia Ad Alte-dosi Tipo Vantaggi Svantaggi Autotrapianto • 50% di remissioni eccellenti Singolo •A lmeno buono quanto la • Recidiva simile alla chemioterapia standard terapia standard riguardante • Più tossico e costoso la sopravvivenza globale e • I pazienti i quali traggono probabilmente migliore per i beneficio dal trapianto non pazienti con un’alta β2M. sono identificati •È la base della strategia per • Terapia di mantenimento ottenere remissioni lunghe ancora richiesta (per es. interferone, prednisone, • Nuovi regimi preparativi vaccino) possono produrre una vera remissione completa • 2002 aggiornamento dei dati • Il ruolo del doppio trapianto Doppio vs il singolo non è ancora dei Francesi indicano il benAutotrapianto chiaro eficio di sopravvivenza per un sottoinsieme di pazienti • Molto più tossico e costoso rispetto al singolo • Risultati eccellenti con il doppio trapianto (vedi testo) Trapianto Allogenico Tradizionale • Non vi è rischio di contaminazione di midollo/cellule staminali con mieloma • Effetto del trapianto contro il mieloma prolunga la remissione • Non sono somministrate chemioterapie anti-mieloma • Rischio di graft-vs-host disease • Pieni benefici ancora non chiari • Rischio di mortalità iniziale approssimativamente del 17% Trapianto Mini-Allo • Meno tossico dell’allo • Chemioterapia preparativa di solito ben tollerata • Non sono somministrate chemioterapie anti-mieloma • Rischio di graft-vs-host disease • Pieni benefici ancora non chiari • Rischio di mortalità iniziale approssimativamente del 17% Trapianto Singenico • No vi è il rischio di contaminazione del mieloma nel trapianto di cellule • Molto meno rischioso che il trapianto allogenico • Nessun effetto graft-vsmieloma • È necessario un gemello con età inferiore a < 55. ficio confrontando la terapia ad alte dosi rispetto alla chemioterapia alla dose standard. Il Nordic Myeloma Study ha mostrato sia il miglioramento della qualità sia la durata (sopravvivenza mediana di 62 mesi contro 44 mesi) della sopravvivenza ad un costo aggiuntivo. Raccomandazioni Correnti HDT con supporto di cellule staminali autologhe dovrebbe essere considerate come parte della terapia di prima linea per i pazienti recentemente diagnosticati con un mieloma sintomatico. a. Il regime di condizionamento standard è il melphalan 200mg/m². L’irradiazione corporea totale non è raccomandata. b. Il purging delle cellule staminali non è raccomandato a causa delle spese aggiuntive senza benefici clinici. c. Le cellule staminali periferiche sono raccomandate al posto del midollo osseo perché di più facile raccolta che per un attecchimento più rapido. d. Il regime di pre-trapianto includendo il VAD, desametasone, talidomide/ desametasone e Endoxan è discusso sopra. e. Numerose nuove combinazioni terapeutiche sono state introdotte come regimi di pre trapianto. Il ruolo dell’autotrapianto in prima recidiva Nel processo decisionale della terapia alla prima recidiva è importante valutare il ruolo del periodo di attesa prima dell’inizio della terapia. I dati di due trial randomizzati Francesci non indicano una riduzione nella sopravvivenza globale quando il trapianto è eseguito in recidiva. La qualità di vita diventa una considerazione importante. Da un lato, se il trapianto non viene eseguito come una strategia primaria pianificata, allora una terapia aggiuntiva, compresa di mantenimento, è necessaria, con le corrispettive tossicità ed effetti collaterali. Dall’altra parte, l’impatto maggiore del trapianto è differito, e per alcuni pazienti si tratta di una migliore scelta personale. Le terapie di combinazione che includono nuovi agenti quali talidomide, Revlimid®, e VELCADE® come trattamento di prima linea, hanno come conseguenza tassi di risposta e di sopravvivenza libera da malattia paragonabili a quelli dell’ASCT, permettendo ai pazienti ed ai loro medici di poter rinviare l’ASCT senza sacrificarne l’efficacia. Un ampio studio randomizzato statunitense-francese di prima linea di VRD vs VRD + ASCT aiuterà a determinare se l’aggiunta di ASCT a nuova terapie possa dare ulteriori benefici o meno. Raccolta e stoccaggio delle cellule staminali per uso futuro Vi è una forte riluttanza in molti centri nel raccogliere le cellule staminali senza un chiaro piano per l’utilizzo. Questa riluttanza risulta dalle priorità del protocollo, costo/utilizzo che vincola la raccolta e lo stoccaggio, così come numerosi altri fattori. Molti pazienti vogliono raccogliere le cellule staminali anche se non sono favorevoli ad iniziare la chemioterapia ad alte dosi. Raccomandazioni Correnti a. La raccolta e lo stoccaggio delle cellule staminali per l’uso futuro sono raccomandate valutando ogni singolo caso. b. Vi è un razionale medico e scientifico nello stoccare cellule staminali per un uso successivo. 30 31 c. Il posticipo del trapianto è un’opzione possibile di trattamento. Un secondo trapianto in un paziente è un’opzione realizzabile, specialmente se si è verificata una prima remissione superiore a 2 anni. (Vedere di seguito il paragrafo circa il “doppio trapianto”) IL RUOLO DEL DOPPIO TRAPIANTO • Attualmente il beneficio aggiunto del doppio trapianto contro un singolo trapianto autologo non è conosciuto. • I risultati previsti con il trapianto tandem (Terapia Totale 1, 2, 3, 4, e 5 presso l’Università dell’Arkansas) sono stati buoni. La sopravvivenza generale mediana è stata 68 mesi, con alcuni sotto-gruppi che hanno dimostrato avere una sopravvivenza anche maggiore. La terapia totale 3, che incorpora l’uso di VELCADE®, sembra offrire risposte precoci e un aumento dei tassi di risposta, anche in pazienti con fattori di rischio, tra cui l’età, alti livelli di LDH, anomalie citogenetiche, o di malattia avanzata, che non sono stati così in grado di raggiungere un esteso beneficio. • I risultati con trapianti doppi pianificati (Terapia Totale I e II dall’ Università del Arkansas ) sono stati buoni. La sopravvivenza mediana globale è stata di 68 mesi o anche più lunga. La Terapia Totale III, che incorpora l’uso di VELCADE®, sembra offire risposte più rapide e tassi di risposta maggiori, sebbene in pazienti con fattori di rischio, quali età avanzata, alti livelli di LDH, anormalità citogenetiche o malattia avanzata. • Recenti studi comparativi, includendo gli studi randomizzati dei Francesi, hanno mostrato benefici soprattutto per un sottogruppo di pazienti (coloro che non hanno raggiunto una CR). È possibile un follow-up più lungo che mostrerà dei benefici maggiori. Raccomandazioni attuali a. Attualmente, il doppio trapianto continua ad essere un’opzione nell’ambito di studi clinici e dovrebbe portato ai centri specializzati in questo approccio. b. Un secondo trapianto in un paziente, che ha risposto bene con un primo trapianto ed è recidivato dopo più di 2 anni, è un’opzione utile e realizzabile (Sirohi [ 2001]). c. Conservare ed immagazzinare abbastanza cellule staminali per un secondo o trapianto aggiuntivo, se necessario, è fortemente raccomandato. IL RUOLO DEL TRAPIANTO ALLOGENICO • I particolari dei risultati con il trapianto allogenico sono stati ampiamente rivisti • Malgrado i miglioramenti medici nelle ultime 2 decadi, il trapianto allogenico, anche con un donatore familiare perfettamente compatibile, è una procedura ad alto rischio nel mieloma multiplo. Il trattamento iniziale relativo alla morbidità e mortalità correlate al trattamento iniziale sono alte. Anche nei centri con un’esperienza maggiore, e senza fattori di rischio aggiuntivo, la mortalità iniziale è di almeno 15-20%. In altri centri è riportata una mortalità più alta del 20-30%. Le complicazioni polmonari sono spesso le più critiche per i pazienti affetti da mieloma. • I vantaggi potenziali del trapianto allogenico sono la reinfusione di cellule midollari sane e l’effetto del trapianto contro il mieloma. Ma, malgrado questi fattori, la cura con una lunga durata è rara. La recidiva continua 32 approssimativamente al tasso del 7% per anno con un follow-up di lunga durata. La Graft versus host disease può anche essere un problema continuo, richiedente la terapia e riducendo la qualità di vita. • L’effetto del trapianto contro il mieloma può essere aumentato usando infusioni di linfociti del donatore ed è risultato clinicamente favorevole in qualche caso. • Un recente gruppo cooperativo, ha presentato all’ASH 2010 uno studio randomizzato che valuta il trapianto non-mieloablativo o “mini” trapianto allogenico (Krishnan et al.). Purtroppo, questo processo ha dimostrato che l’aggiunta del mini-allo trapianto come parte della terapia di prima linea (trapianto vs auto doppio), ha introdotto un rischio aggiuntivo senza alcun beneficio sulla sopravvivenza. Così, l’esame di routine di questo approccio non è più raccomandato. Raccomandazioni Attuali a. Il trapianto allogenico convenzionale full-match è raccomandato raramente come strategia primaria perché i rischi sono troppo alti. b. “Il mini” trapianto allogenico è un nuovo promettente approccio, che richiede ulteriore valutazione come parte di trial clinici ben pianificati. c. Il trapianto singenico è una rara opzione, la cui procedura è sicura e ha buoni risultati ed è raccomandata quando un gemello identico è disponibile. 3. RADIOTERAPIA: La radioterapia è un’importante modalità per il trattamento del mieloma Per i pazienti con problemi localizzati severi come distruzione dell’osso, forte dolore, e/o compressione dei nervi o del midollo spinale, la radioterapia localizzata può avere ottimo beneficio. Il maggiore svantaggio della radioterapia è il danneggiamento in modo permanente delle cellule staminali del midollo osseo nell’area trattata . È utile evitare l’irradiazione di ampie zone di midollo osseo normale. La strategia generale è di affidarsi alla chemioterapia sistemica per ottenere un globale controllo della malattia, limitando l’uso della radioterapia alle aree con particolari problemi. Total Body Irradiation (TBI) – La Total body o le radiazioni sequenziali in parte del corpo sono utilizzate come parte del programma terapeutico delle alte dosi seguita da trapianto e/o nella gestione della malattia refrattaria o recidivante. Sebbene utilizzata in passato come regime preparatorio al trapianto, recenti studi hanno dimostrato che essa non aumenta i benefici, e purtroppo aumenta la tossicità. Quindi non è raccomandata come regime di condizionamento. Nei pazienti con malattia refrattaria, sequenziali FIGURA 5: Come Agisce Il Pamidronato 33 radiazioni localizzate possono essere utilizzate temporaneamente per controllare la malattia. È raro il successo della radioterapia per un lungo periodo, in particolar modo in pazienti con un mieloma attivo o aggressivo. Un ulteriore svantaggio dovuto alle radiazioni ad ampio campo è la distruzione delle cellule midollari rendendo impossibili le successive linee terapeutiche. VELCADE® non ha solamente dimostrato risultati migliori in termini di PFS e sopravvivenza globale, ma ha dimostrato come il suo uso nella terapia di mantenimento sia ben tollerato, portando così ad ottenere migliori tassi di risposta. Risultati iniziali indicano benefici anche in pazienti con delezione 17p e caratteristiche genetiche a basso rischio alla FISH. 4. TERAPIA DI MANTENIMENTO: 5. TERAPIA DI SUPPORTO: Interferone Alfa – Negli ultimi 15 anni, alcuni ricercatori hanno valutato gli effetti dell’interferone, un agente che associato alla terapia standard o alla terapia ad alte dosi prolunga la remissione. Sono stati ottenuti risultati contraddittori, ma si sono osservati piccoli benefici nel prolungamento della remissione. I benefici sono solo del 10-15% in termini di prolungamento della remissione e della sopravvivenza. Non è semplice provare in studi clinici differenze del 10-15% (es. 6-9 mesi). Altri studi includono la valutazione dell’interferone con la chemioterapia iniziale e la combinazione di interferone alfa con agenti come desametasone o IL-2 in mantenimento. L’utilizzo dell’Interferone alfa è stato valutato bilanciando i potenziali benefici con i potenziali effetti indesiderati, costi e svantaggi. Molti ricercatori pensano che l’interferone avrà un ruolo definito (sebbene piccolo) nella gestione del mieloma. Prednisone come Mantenimento – è molto difficile trovare una terapia che prolunga le remissioni e la sopravvivenza nei pazienti affetti da mieloma senza compromettere la qualità della vita, questo è il caso dell’interferone alfa. Tuttavia, nuovi studi hanno dimostrato negli anni ’80 che il prednisone è un efficace farmaco per il mantenimento, e probabilmente superiore all’interferone alfa. Il Prednisone è stato somministrato tre volte a settimana (es. dose iniziale 50 mg) con una tossicità accettabile prolungando la remissione e la sopravvivenza. Un particolare vantaggio è che il paziente può assumere prednisone per diversi anni senza sviluppare resistenza. Tuttavia, è rihiesta cautela perché è solitamente necessario valutare gli effetti collaterali a lungo termine. Farmaci immunomodulatori (IMiDs) – Risultati promettenti si stanno accumulando per il ruolo del Revlimid nel campo del mantenimento. Come riferito in occasione del meeting ASH 2010, il Revlimid® come terapia di mantenimento prolunga in modo significativo il tempo alla progressione rispetto al placebo, quando somministrato a pazienti con malattia stabile o meglio dopo alte dosi di melfalan/ASCT (CALGB, McCarthy et al.), prolungando in modo significativo la progressione libera da malattia quando somministrato ai pazienti dopo l’ASCT come terapia di consolidamento seguita da una dose più bassa di Revlimid® per la terapia di mantenimento (Attal et al.). Dati di follow-up derivanti dallo studio CALGB indicano che il mantenimento con Revlimid post-ASCT non solo raddoppia la progressione libera da malattia rispetto al placebo, ma aumenta anche la sopravvivenza globale. Purtroppo, contro questi dati si contrappone il basso rischio di un secondo tumore maligno nel braccio placebo dello studio. Ulteriori analisi sono in corso per determinare la natura di tale rischio. VELCADE® – Uno studio di fase III del gruppo HOVON / GMMG confronta VELCADE®, Adriamicina® e dexametasone (PAD) + mantenimento con VELCADE®, versus vincrinstina, Adriamicina®, e desametasone (VAD) + mantenimento con talidomide, è stato presentato alla ASH 2010. Il 34 Eritropoietina – L’eritropoietina è un ormone naturale ora disponibile attraverso tecniche di ingegneria genetica. L’eritropoietina viene somministrata per migliorare il livello di emoglobina nei pazienti affetti da anemia persistente. Iniezioni di eritropoietina (ad esempio, 40.000 unità settimanali SQ) sono in grado di dimostrare un beneficio nei livelli di emoglobina e di performance status. Essa dovrebbe essere fortemente considerata nei pazienti affetti da anemia persistente. Tuttavia, secondo nuove rigorose linee guida, l’eritropoietina deve essere utilizzata solo in caso di trattamenti per il mieloma attivo. L’eritropoietina deve essere interrotta nei pazienti che mostrano chiari benefici. Gli integratori di ferro possono essere richiesti per ottenere il massimo beneficio. Sulla base delle nuove linee guida dell’FDA, può diventare necessario per i pazienti firmare consensi informati per l’assunzione di eritropoietina. Come notato in precedenza, l’Epo ricombinante (ad esempio, Epogen® o Procrit®) deve essere usata con cautela alla luce delle recenti relazioni circa l’associazione di Epo, che indicano una crescita del tumore e una sopravvivenza ridotta nei pazienti con cancro, e l’identificazione dei recettori Epo sulle cellule del mieloma, anche se tale convinzione richiede ulteriori indagini. Bifosfonati – I Bifosfonati sono una classe di farmaci che legano la superficie dell’osso danneggiato in pazienti con mieloma multiplo. Questo legame inibisce il progredire della distruzione dell’osso e migliora la possibilità di rigenerazione dell’osso e della densità e solidità ossea. Uno studio randomizzato che utilizza bisfosfonato pamidronico (Aredia®) ha dimostrato particolari benefici in pazienti rispondenti alla chemioterapia. È attualmente raccomandato che la terapia con Bifosfonati venga utilizzata come terapia aggiuntiva in pazienti con problemi dell’osso (vedi Figura 5). Altri Bifosfonati sono attualmente disponibili incluso Clodronato, una soluzione orale utilizzata in Europa per il trattamento del mieloma, l’Acido Zolendronico (Zometa®), approvato negli USA e in Europa come trattamento per l’ipercalcemia e per la malattia dell’osso. Diversi nuovi bifosfonati sono utilizzati in sperimentazioni cliniche. Uno, chiamato Ibandronato (Boniva®), è ora utilizzato in Europa con gli pazienti con mieloma. Negli Stati Uniti, è attualmente approvato dall’FDA solo per l’utilizzo nel campo dell’osteoporosi post-menopausale. n occasione del meeting dell’American Society of Hematology 2010, uno studio randomizzato di acido zoledronico con clodronato come parte del processo MRC mieloma IX (Morgan et al.) ha dimostrato che l’acido zoledronico non solo era superiore al clodronato nella prevenzione di eventi scheletrici correlati (SRE), ma ha anche fornito un beneficio in termini di sopravvivenza autonoma indipendentemente dalla riduzione di SRE, supportando l’attività anti-mieloma dell’acido zoledronico. Diverse preoccupazioni sono emerse in relazione all’uso cronico con bisfosfonati. Due di questi, ossia il danno renalei o l’osteonecrosi della mascella (ONJ) sono affrontati in dettaglio all’interno di altri materiali educativi dell’IMF (Mieloma Today©, Messaggiero di Mieloma, Comprensione della Terapia 35 con Bifosfonati©). Entrambe le condizioni sono per fortuna relativamente rare, ma la consapevolezza di questi potenziali problemi è la chiave per la prevenzione. La funzione renale deve essere seriamente monitorata (in particolare i livelli di creatinina sierica prima di qualsiasi trattamento), in particolare con l’utilizzo dello Zometa®. Se la creatinina sierica aumenta da 0,5 a 1,0 mg/dL sono necessarie delle variazioni di dose di Aredia® o Zometa®. Per lo Zometa®, una delle più semplici variazioni è quella di estendere il tempo di infusione da 15 minuti a 30/45 minuti, il che riduce il rischio di insufficienza renale. Un’articolo dell’American Academy of Oral Medicine sulla gestione dell’ONJ correlata all’utilizzo di Bifosfonati (BONJ) è stato pubblicato nel Journal of American Dental Association, nel dicembre 2005. La prima raccomandazione è la prevenzione di BONJ attraverso regolari controlli dentistici. Se viene rilevato un problema, è fortemente raccomandato il dialogo con un esperto (ad esempio, chirurgo orale). Qualsiasi intervento chirurgico della mascella deve essere evitato fino a quando la consultazione non è avvenuta. Estrazioni dentali dovrebbero essere evitate fino che la consultazione completa non sia stata ottenuta. Le infezioni possono richiedere una terapia antibiotica. La Mayo Clinic ha pubblicato il Mayo Consensus Statement per l’utilizzo dei bifosfonati nel mieloma multiplo nel mese di agosto 2006, che include la seguente affermazione: “Il Pamidronato è favorito rispetto all’acido zoledronico in quanto non sono disponibili ulteriori dati sul rischio di complicanze (osteonecrosi della mandibola)”. Alcune modifiche di queste linee guida sono state proposte dall’IMF International Myeloma Working Group e pubblicate su Mayo Clinic Proceedings nel marzo 2007. In occasione del meeting dell’American Society of Hematology 2009, un’opinione chiave dei leader ha osservato che l’incidenza di osteonecrosi sembra essere diminuita drasticamente, probabilmente a causa di una migliore igiene dentale. Tuttavia, nuove preoccupazioni sono emerse con l’utilizzo di bifosfonati a lungo termine. Fratture atipiche (sottotrocanterica) del femore sono rare, e vi sono dati che stabiliscono un’associazione con cinque o più anni di trattamento con bifosfonati. Nel mese di ottobre 2010, l’FDA ha aggiunto la frattura sottotrocanterica del femore alle sezione “Precauzioni e avvertenze” del foglietto illustrativo di tutti i bifosfonati. Due recenti pubblicazioni discutono circa la possibile correlazione tra bifosfonati orali e il cancro dell’esofago. Utilizzando lo stesso database, un gruppo non ha trovato tale correlazione (Cardwell et al.), mentre l’altro gruppo ha riportato un aumento del rischio (Green et al.). Questi risultati richiedono un ulteriore valutazione. L’International Myeloma Working Group (IMWG) raccomanda di interrompere i bifosfonati dopo un anno di terapia per i pazienti che ottengono una risposta completa e/o la fase di plateau. Per i pazienti in cui la malattia è attiva, e non hanno raggiunto una risposta, o che sono a rischio di malattia ossea oltre due anni, la terapia può essere diminuita ogni tre mesi. Le attuali linee guida sul ruolo dei bisfosfonati nel mieloma multiplo dalla American Society of Clinical Oncology (ASCO;. Kyle et al, J Clin Oncology 2007) consigliamo il trattamento per un periodo di due anni, considerando la sospensione della somministrazione di bifosfonati nei pazienti la cui malattia è reattivo e stabile. L’uso continuato di bifosfonati dovrebbe essere a discrezione del medico. Antibiotici – Le infezioni sono un problema comune e ricorrente in pazienti affetti da mieloma. Un’attenta strategia per la gestione dell’infezione è richi- 36 esta. La terapia antibiotica deve essere istituita immediatamente se si ha il sospetto di un’infezione attiva. L’uso di antibiotici preventivi o di profilassi in fase di infezione ricorrente è controindicato. Un recente studio comparativo (URCC/ECOG, Vesole et al.) presentato all’ASH 2010 ha concluso che “l’uso di antibiotici per profilassi non diminuisce l’incidenza di infezioni gravi (> di grado 3 e/o ospedalizzazione), né di qualsiasi infezione entro i primi 2 mesi del trattamento. “ Sulla base di questo studio, gli autori raccomandano che gli antibiotici non devono essere raccomandati nei primi due mesi di trattamento, ma tale decisione deve essere considerata, caso per caso. La continuazione della profilassi antibiotica può aumentare il rischio di resistenza agli antibiotici, ma può anche ridurre il rischio di complicanze infettive ricorrenti. L’utilizzo di gammaglobulina ad alte dosi può essere richiesto in pazienti con infezioni ricorrenti acute e gravi. Il GM-CSF può essere utile per migliorare il livello dei globuli bianchi nel tentativo di superare le complicanze infettive. L’uso di G o GM-CSF è utile nella fase di recupero dopo il trapianto di midollo osseo o di cellule staminali. G e GM-CSF sono anche utilizzati nella raccolta di cellule staminali. Antivirali – Un aumento dell’incidenza di herpes zoster (fuoco di Sant’Antonio) è stato osservato in alcune popolazioni di pazienti affetti da mieloma (ma non di altri tumori maligni) che sono trattati con VELCADE®. Pertanto, una terapia profilattica antivirale deve essere considerata se viene somministrato il VELCADE®. Ciò ha portato alla necessità, per i pazienti arruolati in studi clinici con carfilzomib, un inibitore del proteasoma di seconda generazione, di ricevere una profilassi antivirale. I pazienti affetti da mieloma sono invitati a non sottoporsi al vaccino per l’herpes zoster (Zostavax®), in quanto si tratta di un virus vivo che presenta un rischio significativo per il sistema immunitario già compromesso. 6. GESTIONE DELLA MALATTIA RECIDIVANTE O REFRATTARIA: Come illustrato nella sezione fisiopatologia, un frequente problema che si verifica in pazienti con mieloma è la recidiva che può avvenire dopo un minimo di 1 anno fino a un massimo di 3 anni di remissione. Sebbene il mantenimento con interferone alfa, prednisone, Revlimid® o talidomide aiuta il prolungamento del periodo di remissione iniziale, la recidiva è inevitabile e richiede una nuova terapia. Di seguito vengono esposte le strategie per la gestione della malattia recidivante. FIGURA 6: Cellule Del Mieloma Mdr Se la prima recidiva avviene dopo un periodo di remissione di almeno 6 mesi – 1 anno, la prima strategia è di riutilizzare la terapia che ha indotto la remissione la prima volta. Approssimativamente il 50% dei pazienti raggiunge la seconda remissione con la medesima terapia che ha indotto la 37 prima. Questo è riscontrabile soprattutto in pazienti in remissione per più di un anno dopo la terapia di induzione. Per esempio, un paziente che ha ricevuto un trattamento con MP ottenendo la remissione può ricevere nuovamente MP. Se la remissione è durata meno di 6 mesi è richiesta una terapia alternativa. Una nuova terapia è richiesta anche nel caso in cui la recidiva si è verificata dopo il secondo o terzo utilizzo del farmaco somministrato in origine per la terapia di induzione. L’utilizzo del VAD ha un’importante ruolo in questo campo. VELCADE® (bortezomib) per il mieloma in recidiva – La disponibilità di VELCADE® per il trattamento delle recidive è stato un importante passo in avanti. Dopo la sua approvazione per i pazienti con mieloma multiplo che abbiano ricevuto almeno due precedenti linee terapeutiche e che hanno dimostrato una progressione della malattia in seguito alla precedente terapia, il VELCADE® è stato poi valutato in uno studio multicentrico di fase III “APEX”, randomizzato, di confronto tra VELCADE® e Desametasone ad alte dosi in 669 pazienti affetti da mieloma in 80 centri, e che avevano avuto una recidiva dopo 1-3 linee di trattamento. L’end point primario era il tempo alla progressione. L’APEX ha anche valutato il ruolo del VELCADE® come terapia di mantenimento nei pazienti responsivi. Questo studio ha reclutato pazienti a livello internazionale ed è stato il più grande studio mai completato nel campo del mieloma multiplo. In generale, c’è stato un miglioramento di circa il 30% nella sopravvivenza durante il primo anno con Bortezomib (Velcade®) rispetto al desametasone. Questa è stata ovviamente un’informazione molto utile, e ha fatto si che il ruolo del VELCADE® diventasse una piattaforma su cui basare le terapie di associazione per la recidiva (Vel/Doxil®, VR, VRD, VCD, ecc.) Altre opzioni – E ‘importante tenere a mente che sono disponibili una varietà di protocolli di chemioterapia singola e in associazione per il trattamento delle recidive e delle malattie refrattarie. A seconda del problema, possono essere disponibili una serie di interventi. Ad esempio, se la recidiva è associata allo sviluppo di uno o due lesioni ossee, le radiazioni dirette sulla parte interessata possono essere un modo soddisfacente per gestire la ricaduta. Se si verifica una ricaduta complessiva, il desametasone come singolo agente può essere molto utile per raggiungere il controllo globale della malattia. L’uso di desametasone è interessante perché può essere somministrato per via orale e non causa effetti collaterali significativi come la perdita di capelli o la riduzione dei valori del sangue periferico. Un altro punto importante è che la recidiva dopo il trapianto ad alte dosi ha, in molti casi, un modello simile alla recidiva dopo approcci standard. Le seconde, e a volte le terze remissioni, possono essere ottenute dopo il trapianto di midollo osseo. Se una seconda terapia ad alte dosi con trapianto è la più adeguata strategia a differenza di alcuni altri approcci chemioterapici a basso dosaggio è attualmente poco chiaro, e deve essere basata su considerazioni di ogni singolo paziente. Dato il continuo e rapido sviluppo di nuove terapie per il mieloma, tra cui inibitori del proteasoma di seconda generazione, farmaci immunomodulatori di terza generazione, anticorpi monoclinali, terapie mirate, nonché la ricerca di nuove combinazioni di agenti esistenti e nuovi, il trattamento nel contesto della sperimentazione clinica può essere un’opzione per i pazienti con mieloma in recidiva. 38 7. NUOVI ED EMERGENTI TRATTAMENTI: La maggior parte dei nuovi trattamenti sono disponibili nel contesto di studi clinici. Le fasi di studi clinici sono elencati nella Tabella 11. Una vasta gamma di agenti è attualmente in sperimentazione clinica, tra cui inibitori del proteasoma, agenti immunomodulatori, anticorpi monoclonali, istone deacetilasi (HDAC), Heat Shock Protein (HSP), inibitori, agenti chemioterapici e terapie mirate a percorsi specifici per il mieloma. I pazienti sono invitati a contattare l’IMF tramite telefono [800-452-CURE (2873) negli Stati Uniti e Canada, +1-818-487-7455 altrove] o Internet (myeloma.org) e per verificare con il proprio medico la disponibilità di nuovi studi clinici. Il Mieloma Matrix©, una pubblicazione dell’IMF che elenca tutti i farmaci attualmente in sperimentazione clinica per il mieloma, è disponibile con aggiornamenti periodici in formato cartaceo e con aggiornamenti costanti sul web. Una buona sintesi di nuove terapie è disponibile nelle relazioni dell’IMF derivanti dall’ASH, ASCO, EHA E IMWG (tutti disponibili contattando l’IMF o sul sito myeloma.org). TABELLA 12 Le Fasi Degli Studi Clinici I Test iniziali per valutare la tolleranza e la tossicità nei pazienti. IIUlteriori indagini per valutare quale sia la dose e il programma di trattamento efficace. IIIConfronto tra il nuovo trattamento e il trattamento(i) precedente(i) per determinare se il nuovo trattamento è superiore. IVSolitamente attivato dopo l’approvazione dell’FDA per accettare il rapporto costo-efficacia, impatto sulla qualità della vita ed altri relativi obiettivi. REFERENZE NOTA: I riferimenti vengono forniti, più che note accademiche, come materiale di partenza e di ulteriori ricerche per quanto riguarda le sezioni principali del libretto. In ogni sezione, gli articoli sono elencati in ordine alfabetico per autore.. GENERALI • Bataille R, Harousseau JL. Multiple myeloma. N Engl J Med. 1997; 336: 1657-1664. • Berenson James R. Biology and Management of Multiple Myeloma. Humana Press. 2004 ISBN 0-89603-706-1. • Gahrton G, Durie BGM, Samson DM. Multiple Myeloma and Related Disorders. Oxford University Press 2004 ISBN: 0-89603-706-1. • Kyle RA, Rajkumar SV. Multiple myeloma. Blood. 2008;111(6):2962-2972. • Mehta J, Singhal S, eds. Myeloma, Dunitz M. Taylor and Francis Group, 2002: ISBN 1-901865-50-9. • Palumbo A, Anderson L. Multiple myeloma. N Engl J Med. 2011; 364:1046-1060. STORIA • Kyle RA. History of multiple myeloma. In: Neoplastic Diseases of the Blood, 3rd edition. ( Wiernik PH, Canellos GP, Kyle RA, Schiffer CA, eds). New York: Churchill Livingstone, 1996. • Kyle RA. History of multiple myeloma. In: Neoplastic Diseases of the Blood, 2nd edition.( Wiernik PH, Canellos GP, Kyle RA, Schiffer CA, eds). New York: Churchill Livingstone, 1991: 325-32. EPIDEMIOLOGIA • American Cancer Society. Cancer Facts & Figures 2010. Atlanta: American Cancer Society; 2010. • Birmann BM, Giovannucci E, Rosner B, Anderson KC, Colditz GA. Body mass index, physical activity, and risk of multiple myeloma. Cancer Epidemiol Biomarkers Prev 2007; 16(7):1474-1478. • Brenner H, Gondos A, Pulte D. Recent major improvement in long-term survival of younger patients with multiple myeloma. Blood. 2008; 111:2521-2526. • Brown LM, Gridley G, Check D, Landgren O. Risk of multiple myeloma and monoclonal gammopathy of undetermined significance among white and black make United States veterans with prior autoimmune, infectious, inflammatory, and allergic disorders. Blood 2008; 111(7):3388-3394. • Herrington LJ, Weiss NS, Olshan AF. The epidemiology of myeloma. In: Myeloma Biology and Management (Malpas JS, Bergsagel DE, Kyle RA eds.). Oxford, England, Oxford University Press: 1995: 127-168. • Infante PF. Benzene exposure and multiple diagnosis: A detailed meta-analysis of Benzene cohort studies. Ann NY Acad Sci. 2006;1076:90-109. 39 • Jemal A, Thomas A, Murray T, Thun M. Cancer statistics 2002. CA Cancer J Clin 2002; 52: 23-47. • Jemal A, Siegel R, Xu J, Ward E. Cancer Statistics, 2010. CA Cancer J Clin. 2010; 60(5):277-300 • Kirkeleit J, Riise T, Bratveit M, Moen BE. Increased risk of acute myelogenous leukemia and multiple myeloma in a historical cohort of upstream petroleum workers exposed to crude oil. Cancer Causes Control 2008;19:13-23. • Kumar SK, Rajkumar SV, Dispenzieri A, et al. Improved survival in multiple myeloma and the impact of novel therapies. Blood 2008; 111:25162520. • LeMasters GK, Genaidy AM, Succop P, et al. Cancer risk among firefighters: A review and meta-analysis of 32 studies. J Occup Environ Med 2006;48(11):1189-1202. • Lynch HT, Ferrara K, Barlogie B, et al. Familial Myeloma. N Engl J Med 2008; 259(2):152-157. • Schottenfeld D, Fraumeni JF Jr. (eds). Cancer Epidemiology and Prevention, 2nd edn. New York: Oxford University Press; 1996:946-970. • Schwartz GG. Multiple myeloma: clusters, clues, and dioxins. Cancer Epidemiol Biomarkers Prev. 1997; 6: 49-56. MALATTIA DELL’OSSO • Bataille R, et al. Mechanism of bone destruction in multiple myeloma. The importance of an unbalanced process in determining the severity of lytic bone disease. J Clin Oncol 1989; 7: 1909. • Berenson J, et al. Long-term pamidronate treatment of advanced multiple myeloma reduces skeletal events. J Clin Oncol 1998; 16: 593-602. • Berenson J, et al. Efficacy of pamidronate in reducing skeletal events in patients with advanced multiple myeloma. N Engl J Med 1996; 334: 488-493. • Bredella MA, Steinbach L, Caputo G, et al. Value of FDG PET in the assessment of patients with multiple myeloma. AJR Am J Roentgenol 2005;184:1199-1204. • Dimopoulos M, Terpos E, Comenzo RL, et al. International myeloma working group (IMWG) consensus statement and guidelines regarding the current role of imaging techniques in the diagnosis and monitoring of multiple myeloma. Leukemia 2009; 23:1545-1559. • Durie BGM, Salmon SE, Mundy GR. Relation to osteoclast activating factor production to extent of bone disease in multiple myeloma. Br J Haematol 1981; 47: 21-26. • Durie BGM, Waxman AD, D’Agnolo A, Williams CM. Whole-body (18) F-FDG PET identifies high-risk myeloma. J Nucl Med 2002; 43:1457-1463. • Jadvar H, Conti PS. Diagnostic utility of FDG PET in multiple myeloma. Skeletal Radiol 2002;31:690-694. • Kato T, Tsukamoto E, Nishioka T, et al. Early detection of bone marrow involvement in extramedullary plasmacytoma by whole-body F-18 FDG positron emission tomography. Clin Nucl Med 2000;25:870-873. • Major P, et al. Zoledronic acid is superior to pamidronate in the treatment of hypercalcemia of malignancy: a pooled analysis of two randomised, controlled clinical trials. J Clin Oncol 2001; 19, 558-67. • Markowitz GS, Appel GB, Fine PL, Fenves AZ, Loon NR, Jagannath S et al. Collapsing focal segmental glomerulosclerosis following treatment with high-dose pamidronate. J Am Soc Nephrol 2001; 12: 1164-1172. • McCloskey EV, et al. A randomised trial of the effect of clodronate on skeletal morbidity in multiple myeloma. Br J Haematol 1998; 100: 317-25. • Moulopoulos LA, Dimopoulos MA, Weber D, et al. Magnetic resonance imaging in the staging of solitary plasmacytoma of bone. J Clin Oncol 1993;11:1311-1315. • Mundy, GR, Yoneda T. Bisphosphonates as anticancer drugs. N Engl J Med 1998; 339: 398-400. • Orchard K, Barrington S, Buscombe J, et al. Fluoro-deoxyglucose positron emission tomography imaging for the detection of occult disease in multiple myeloma. Br J Hematol 2002;117:133-135. • Roodman, GD. Bone building with bortezomib. J Clinic Invest 2008; 118(2):462-464. • Rosen LS, Gordon D, Antonio BS, et al. Zoledronic acid versus pamidronate in the treatment of skeletal metastases in patients with breast cancer or osteolytic lesions of multiple myeloma: a phase II, double blind, comparative trial. Cancer J. 2001; 7: 377-387. • Schirrmeister H, Bommer M, Buck AK, et al. Initial results in the assessment of multiple myeloma using 18F-FDG PET. Eur J Nucl Med Mol Imaging 2002.29:361-366. • Terpos E, Sezer O, Croucher P, Dimopoulos M-A. Myeloma bone disease and proteasome inhibition therapies. Blood 2007; 110(4):1098-1104. • Walker R, Barologie B, Haessler J, et al. Magnetic resonance imaging in multiple myeloma: Diagnostic and clinical implications. J Clin Oncol 2007; 25(9); 1121-1128. STADIAZIONE E FATTORI PROGNOSTICI • Bataille R, Boccadoro M, Klein B, et al. C-reactive protein and β2-microglobulin produce a simple and powerful myeloma staging system. Blood 1992; 80: 733-7. • Durie BGM, Stock-Novack D, Salmon SE, et al. Prognostic value of pre-treatment serum β2-microglobulin in myeloma: a Southwest Oncology Group study. Blood 1990; 75: 823-30. • Durie BGM, Salmon SE. A clinical staging system for multiple myeloma. Cancer 1975; 36: 842-54. • Facon T, et al. Chromosome 13 abnormalities identified by FISH analysis and serum β2-microglobulin produce a powerful myeloma staging system for patients receiving high-dose therapy. Blood 2001; 97: 1566-71. • Gahrton G, Durie BGM, Samson DM, editors. Multiple Myeloma and Related Disorders, The role of imaging in myeloma. A Hodder Arnold Publication, Oxford University Press, 2004; pp 155-63. • Greipp PR , Durie, BGM, et al. International Staging System for multiple myeloma. J Clin Oncol. 2005:23(15):3412-20. • Greipp RR, San Miguel JF, Fonesca R, Avet-Loiseau H, Jacobson JL, Durie BGM. Development of an International Prognostic Index (IPI) for myeloma: report of the International Myeloma Working Group. Haematol J 2003; 4 (suppl.1): p 7.1, S43-S44. • Greipp PR, et al. Value of β2-microglobulin level and plasma cell labeling indices as prognostic factors in patients with newly diagnosed myeloma. Blood 1988; 72: 219-23. • Hungria VTM, Maiolino A, Martinez G, et al. Confirmation of the utility of the International Staging System and identification of a unique pattern of disease in Brazilian patients with multiple myeloma. haematologica 2008; 93:791-792. • Jacobson J, Hussein M, Barlogie B, Durie BGM, Crowley J. A new staging system for multiple myeloma patients based on the Southwest Oncology Group (SWOG) experience. Br J Haematol 2003; 122: 441-450 • Kumar SK, Rajkumar SV, Dispenzieri A, et al. Improved survival in multiple myeloma and the impact of novel therapies. Blood 2008; 111(5):25162520. • Ludwig H, Durie BGM, Bolejack V, et al. Myeloma in patients younger than age 50 years presents with more favorable features and shows better survival: an analysis of 10549 patients from the International Myeloma Working Group. Blood 2008; 111(8):4039-4047. • Zojer N, et al. Deletion of 13q14 remains an independent prognostic variable in multiple myeloma despite its frequent detection by interphase fluorescence in situ hybridization. Blood 2001; 95: 1925-30. DEFINIZIONE DELLA RISPOSTA CLINICA • Durie BGM, Harousseau J-L, Miguel JS, et al. International uniform response criteria for multiple myeloma. Leukemia 2006; 20:1467-1473. • Rajkumar SV, Durie BGM. Eliminating the complete response penalty from myeloma response criteria. Blood 2008; 111(12):5759. CHEMOTERAPIA E RADIOTERAPIA • Alexanian R, et al. Primary dexamethasone treatment of multiple myeloma. Blood 1992; 80: 887-90. • Alexanian R, Barlogie B, Tucker S. VAD-based regimens as primary treatment for myeloma. Am J Hematol 1990; 33: 86-9. • Alexanian R, et al. Treatment for multiple myeloma: combination chemotherapy with different melphalan dose regimens. JAMA 1969; 208: 1680-5. • Durie BGM, Jacobson J, Barlogie B, et al. Magnitude of Response with Myeloma Frontline Therapy Does Not Predict Outcome: Importance of Time to Progression in Southwest Oncology Group Chemotherapy Trials. J Clin Oncol 2004; 22:1857-1863. • Durie BGM, Kyle RA, Belch A, et al. Myeloma management guidelines, a consensus report from the Scientific Advisors of the International Myeloma Foundation. The Hematology Journal 2003; 4:379-398. • Kumar A, Loughran MA, Durie BGM, et al. Management of multiple myeloma: a systematic review and critical appraisal of published studies. Lancet Oncology 2003; 4: 293-304. • MacLennan ICM, et al, for the MRC Working Party on Leukaemia in Adults. Combined chemotherapy with ABCM versus melphalan for treatment of myelomatosis. Lancet 1992; 339: 200-5. • Myeloma Trialists’ Collaborative Group. Combination chemotherapy versus melphalan plus prednisone as treatment for multiple myeloma: an overview of 6,633 patients from 27 randomized trials. J Clin Oncol 1998; 16: 3832-42. MALATTIA REFRATTARIA ANEMIA • Becker, PS, Miller CP, Wood BL, et al. Expression of erythropoietin receptors by plasma cells from patients with multiple myeloma: Potential relevance to pharmacological use of erythropoietin. J Clin Oncol 28:15s, 2010 (suppl; abstr 8124). • Alexanian R, Dimopoulus M. The treatment of multiple myeloma. N Engl J Med 1994; 330: 484-9. • Buzaid AC, Durie BGM. Management of refractory myeloma -a review. J Clin Oncol 1988; 6: 889-905. • Richardson P, Barlogie B, Berenson J, et al. A phase II multicenter study of the protease inhibitor bortezomib ( VELCADE® formerly PS-341) in multiple myeloma patients (pts) with relapsed/refractory disease. N Engl J Med 2003; 348:2609-2617. SINTOMI CLINICI CITOCHINE E SEGNALI DI TRASDUZIONE • Pruzanski W, Ogryzlo MA. Abnormal proteinuria in malignant diseases. Adv Clin Chem 1970;13:335-382. CROMOSOMI • Arzoumanian V, Hoering A, Sawyer J, et al. Suppression of abnormal karyotype predicts superior survival in multiple myeloma. Leukemia 2008; 22:850-855. • Avet-Loiseau H, Leleu X, Roussel M, et al. Bortezomib plus dexamethasone induction improves outcome of patients with t(4;14) myeloma but not outcome of patients with del(17p). J Clin Oncol 2010; 28(30):4630-4634. • Dewald GW, Therneau T, et al. Relationship of patient survival and chromosome anomalies detected in metaphase and/or interphase cells at diagnosis of myeloma. Blood. 2005;106(10):3553-8. • Dispenzieri A, Rajkumar SV, Gertz MA, et al. Treatment of newly diagnosed multiple myeloma based on Mayo stratification of myeloma and riskadapted therapy (mSMART): Consensus statement. Mayo Clin Proc 2007; 82(3):323-341. • Durie BGM, et al. Cytogenetic abnormalities in multiple myeloma. Epidemiology and Biology of Multiple Myeloma. New York: Springer-Verlag, 1991: 137-41. • Fonseca R, Avet-Loiseau H, et al. International myeloma working group molecular classification of multiple myeloma: spotlight review. Leukemia 2009; 23:2210-2222. • Jaksic W, Trudel S, Chang H, et al. Clinical outcomes in t(4,14) multiple myeloma: a chemotherapy sensitive disease characterized by rapid relapse and alkylating agent resistance. J Clin Oncol 2005;23(28):7069-73. • Konigsberg R, Zojer N, Ackermann J, et al. Predictive role of interphase cytogenetics for survival of patients with multiple myeloma. J Clin Oncol. 2000; 18: 804-812. • Stewart AK: A risk-adapted approach to myeloma therapy. ASCO Educational Book. 2008:380-84 (ISSN:1548-8748). MGUS E MIELOMA ASINTOMATICO • Kyle RA, Therneau TM, Rajkumar SV, Offord JR. A long-term study of prognosis in mono-clonal gammopathy of undetermined significance. N Engl J Med. 2002; 346: 564-569. • Kyle RA, Greipp PR. Smoldering multiple myeloma. N Engl J Med. 1980; 302: 1347-49. • Weber DM, et al. Prognostic features of asymptomatic multiple myeloma. Br J Haematol. 1997; 97: 810-4. 40 • Bladé J, Estve J. Viewpoint on the impact of interferon in the treatment of multiple myeloma: benefit for a small proportion of patients? Med Oncology 2000; 77-84. • Hideshima T, Bergsagel PL, Kuehl WM et al. Advances in biology of multiple myeloma: clinical applications. Blood 2004; 104:607-618. • Ludwig H, Fritz E, Kotzmann H, et al. Erythropoietin treatment of anemia associated with multiple myeloma. N Engl J Med 1990; 322: 1693-9. • Mandelli F, et al. Maintenance treatment with alpha 2b recombinant interferon significantly improves response and survival duration in multiple myeloma patients responding to conventional induction chemotherapy. Results of an Italian randomized study. N Engl J Med 1990; 322: 1430. • Musto P, et al. Clinical results of recombinant erythropoietin in transfusion-dependent patients with refractory multiple myeloma: role of cytokines and monitoring of erythropoiesis. Eur J Haematol 1997; 58: 314-19. TRAPIANTO AUTOLOGO • Abdelkefi A, Ladeb S, Torjman L, et al. Single autologous stem-cell transplantation followed by maintenance therapy with thalidomide is superior to double autologous transplantation in multiple myeloma: Results of a multicenter randomized clinical trial. Blood 2008; 111(4):1805-1810. • Attal M, Harousseau JL, Stoppa A-M, et al. A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. N Engl J Med 1996; 335: 91-97. • Attal M, Harousseau JL, Facon T, et al. Single versus double autologous stem-cell transplantation for multiple myeloma. N Engl J Med 2003;349:2495-2502. • Badros A, Barlogie B, Morris C, et al. High response rate in refractory and poor-risk multiple myeloma after allotransplantation using a nonmyeloablative conditioning regimen and donor lymphocyte infusions. Blood 2001;97:2574-2579. • Barlogie B, Jagannath S, Desikan KR, et al. Total therapy with tandem transplants for newly diagnosed multiple myeloma. Blood 1999; 93: 55-65. • Barlogie B, Kyle RA, Anderson KC, et al. Standard chemotherapy compared with high-dose chemoradiotherapy for multiple myeloma: final results of phase III US Intergroup Trial S9321. J Clin Oncol 2006;24:929-936. • Bensinger WI. The Role of Hematopoietic Stem Cell Transplantation in the Treatment of Multiple Myeloma. J NCCN 2004; 2: 371-378. • Bruno B, Rotta M, Patriarca F, et al. A comparison of allografting with autografting for newly diagnosed myeloma. M Engl J Med 2007;356:11101120. • Cavo M, Zamagni E, Tosi P, et al. Superiority of thalidomide and dexamethasone over vincristine-doxorubicin-dexamethasone ( VAD) as primary therapy in preparation for autologous transplantation for multiple myeloma. Blood. 2005;106:35-9. 41 • Cunningham D, et al. A randomized trial of maintenance interferon following high-dose chemotherapy in multiple myeloma: long-term follow-up results. Br J Haematol 1998; 102: 495-502. • Desikan KR, Barlogie B, Sawyer J, et al. Results of high-dose therapy for 100 patients with multiple myeloma: durable complete remissions and superior survival in the absence of chromosome 13 abnormalities. Blood 2000; 95: 4008-4010. • Dispenzieri A, Kyle RA, Lacy MQ, et al. Superior survival in primary systemic amyloidosis patients undergoing peripheral blood stem cell transplantation: a case-control study. Blood 2004; 103: 3960-3963. • Fernand JP, Ravaud P, Chevert S, et al. High-dose therapy and autologous peripheral blood stem cell transplantation in multiple myeloma: upfront or rescue treatment? Results of a multicenter sequential randomized clinical trail. Blood 1998; 92: 3131-3136. • Fernand JP, Katsahian S, Divine M, et al. High-dose therapy and autologous blood stem-cell transplantation compared with conventional treatment in myeloma patients aged 55-65 years: long term results of a randomized control trial from the Group Myelome-Autogreffe. J Clin Oncol 2005;23:9277-9233. • Garban F, Attal M, Michallet M, et al. Prospective comparison of autologous stem cell transplantation followed by dose-reduced allograft (IFM9903 trial) with tandem autologous stem cell transplantation (IFM99-04 trial) in high-risk de novo multiple myeloma. Blood 2006;107:3474-2480. • Gore ME, Viner C, Meldrum M. Intensive treatment of multiple myeloma and criteria for complete remission. Lancet 1989; 14:879-882. • Martinelli G, Terragna C, Zamagni E, et al. Molecular remission after allogeneic or autologous transplantation of hematopoietic stem cells for multiple myeloma. J Clin Oncol 2000; 18: 2273-81. • McElwain TJ, Powles RL. High-dose intravenous melphalan for plasma-cell leukaemia and myeloma. Lancet 1983; 2: 822-824. • Mehta J, Powles RL. Autologous blood and marrow transplantation. In: Leukaemia and Associated Diseases. ( Whittaker JA, Holmes JA, eds). Oxford: Blackwell Science, 1998; 455-81. TRAPIANTO ALLOGENICO E SINGENICO • Bensinger WI, Buckner CD, Anasetti C, et al. Allogeneic marrow transplantation for multiple myeloma: an analysis of risk factors on outcome. Blood 1996; 88: 2787-2793. • Bensinger WI, Demirer, T, Buckner CD, et al. Syngeneic marrow transplantation in patients with multiple myeloma. Bone Marrow Transplant 1996; 18: 527-31. • Durie BGM, Gale RP, Horowitz MM. Allogeneic and twin transplants for multiple myeloma: an IBMTR analysis. Multiple myeloma. From biology to therapy. Current concepts. INSERM, Mulhouse, 24-26 October, 1994 (abstract). • Gahrton G, et al. Progress in allogeneic hematopoietic stem cell transplantation for multiple myeloma. Bone Marrow Transplant 2000; 25 (suppl. 1): S54. • Gahrton G,. et al. Allogeneic bone marrow transplantation in multiple myeloma. Br J Haematol 1996; 92:251-254. • Maloney DG, Sahebi F, Stockerl-Goldstein KE, et al. Combining an allogeneic graft-vs.-myeloma effect with high-dose autologous stem cell rescue in the treatment of multiple myeloma [abstract]. Blood 2001; 98 (11. pt 1): 435a Abstract 2063. • Samson D. The current position of allogeneic and autologous BMT in multiple myeloma. Leukemia and Lymphoma 1992; 7:33. MANUTENZIONE • Attal M, Cristini C, Marit G, et al. Lenalidomide maintenance after transplantation for myeloma. J Clin Oncol 2010;28:15s (suppl; abstr 8018). • McCarthy PL, Owzar K, Anderson KC, et al. Phase III intergroup study of lenalidomide versus placebo maintenance therapy following single autologous stem cell transplant (ASCT) for multiple myeloma (MM): CALGB 100104. J Clin Oncol 2010;28:15s (suppl; abstr 8017). TERAPIA DI SUPPORTO • Abrahamsen B, Eiken P, Eastell R. Subtrochanteric and diaphyseal femur fractures in patients treated with alendronate: a register-based national cohort study. J Bone Miner Res 2009;24:1095-1102. • Bertolotti P, Bilotti E, Colson K, et al. Management of side effects of novel therapies for multiple myeloma: Consensus statements developed by the International Myeloma Foundation’s Nurse Leadership Board. Clin J Oncol Nursing 2008;S12(3):9-12. • Cardwell CR, Abnet CC, Cantwell MM, et al. Exposure to oral bisphosphonates and risk of esophageal cancer. JAMA 2010; 204:657-663. • Chanan-Khan A, Sonneveld P, Schuster MW, et al. Analysis of herpes zoster events among bortezomib-treated patients in the phase III APEX study. J Clin Oncol 2008;26:4784-4790. • Chapel HM, Lee M, Hargreaves R, et al. Randomized trial of intravenous immunoglobulin as prophylaxis against infection in plateau-phase multiple myeloma. Lancet. 1994; 343: 1059-1063. • Faiman B, Bilotti E, Mangan PA, Rogers K, IMF NLB. Steroid-associated side effects in patients with multiple myeloma: Consensus statement of the IMF Nurse Leadership Board. Clin J Oncol Nursing 2008;S12(3):53-62. • Green J, Czanner G, Reeves G, et al. Oral bisphosphonates and risk of cancer of the oesophagus, stomach, and colorectum: case-control analysis within a UK primary care cohort. BMJ 2010; 341c4444 doi:10.1136/bmj/c4444. • Hussein MA, Vrionis FD, Allison R, et al. The role of vertebral augmentation in multiple myeloma: International Myeloma Working Group Consensus Statement. Leukemia 2008; 22:1479-1484. • Johnson WJ, Kyle RA, Pineda AA, et al. Treatment of renal failure associated with multiple myeloma. Plasmapheresis, hemodialysis and chemotherapy. Arch Int Med. 1990; 150: 863-69. • Kyle RA, Gertz MA. Primary systemic amyloidosis: clinical and laboratory features in 474 cases. Semin Hematol. 1995; 32:45-59. • Kyle RA, Yee GC, Somerfield MR, et al. American Society of Clinical Oncology 2007 clinical practice guideline update on the role of bisphosphonates in multiple myeloma. J Clin Oncol 2007;25:2464-2472. • Ludwig H, Fritz E, Kotsmann H, et al. Erythropoietin treatment of anemia associated with multiple myeloma. N Engl J Med 1990; 233:1693-1699. • Mateos MV. Management of treatment-related adverse events in patients with multiple myeloma. Cancer Treat Rev 2010;36:Suppl2:S24-32. • Miceli T, Colson K, Gavino M, Lilleby K, IMF NLB. Myelosuppression associated with novel therapies in patients with multiple myeloma: Consensus statement of the IMF Nurse Leadership Board. Clin J Oncol Nursing 2008;S12(3):13-19. • Morgan G, Davies F, Gregory W, et al. Evaluating the effects of zoledronic acid (ZOL) on overall survival (OS) in patients (Pts) with multiple myeloma (MM): Results of the Medical Research Council (MRC) Myeloma IX study. J Clin Oncol 2010; 28:15s, (suppl; abstr 8021). • Oken M, Pomeroy C, Weisdorf D, et al. Prophylactic antibiotics for the prevention of early infection in multiple myeloma. Am J Med. 1996; 100: 624-28. • Osterborg A, Boogaerts MA, Cimino R, et al. Recombinant human erythropoietin in trans-fusion-dependent anemic patients with multiple myeloma and non-Hodgkin’s lymphoma-a randomized multicenter study. Blood 1996; 87:2675-2682. • Palumbo A, Rajkumar SV, Dimopoulos MA, et al. Prevention of thalidomide and lenalidomide associated thrombosis in myeloma. Leukemia 2008; 22:414-423. • Rajkumar SV, Durie BGM. Eliminating the complete response penalty from myeloma response criteria. Blood 2008; 111(12):5759. • Rome S, Doss D, Miller K, Westphal J, IMF NLB. Thromboembolic events associated with novel therapies in patients with multiple myeloma: Consensus statement of the IMF Nurse Leadership Board. Clin J Oncol Nursing 2008;S12(3):21-27. • Smith LC, Bertolotti P, Curran K, Jenkins B, IMF NLB. Gastrointestinal side effects associated with novel therapies in patients with multiple myeloma: Consensus statement of the IMF Nurse Leadership Board. Clin J Oncol Nursing 2008;S12(3):37-45. 42 • Tariman JD, Love G, McCullagh E, Sandifer S, IMF NLB. Peripheral neuropathy associated with novel therapies in patients with multiple myeloma: Consensus statement of the IMF Nurse Leadership Board. Clin J Oncol Nursing 2008;S12(3):29-35. • Vickrey E, Allen S, Mehta J, Singhal S. Acyclovir to prevent reactivation of varicella zoster virus (herpes zoster) in multiple myeloma patients receiving bortezomib therapy. Cancer 2009;115:229-232. NUOVE TERAPIE • Arzoumanian V, Hoering A, Sawyer J, et al. Suppression of abnormal karyotype predicts superior survival in multiple myeloma. Leukemia 2008; 22:850-855. • Barlogie B, Anaissie E, Bolejack V, et al. High CR and near-CR rates with bortezomib incorporated into up-front therapy of multiple myeloma with tandem transplants. J Clin Oncol 2006; 24: abstract #7519. • Barlogie B, Desikan KR, Eddelman P, et al. Extended survival in advanced and refractory multiple myeloma after single-agent thalidomide: identification of prognostic factors in a phase 2 study of 169 patients. Blood 2001; 32: 45-59. • Barlogie B, Shaughnessy Jr. JD, Crowley J. Duration of survival in patients with myeloma treated with thalidomide. New Engl J Med 2008; 359(2):210-212. • Berenson JR, Boccia R, Sigel D, et al. Efficacy and safety of melphalan, arsenic trioxide and ascorbic acid combination therapy in patients with relapsed or refractory multiple myeloma: a prospective, multicenter, phase II, single-arm study. Br J Haem 2006; 135:174-183. • Bruno B, Rotta M, Giaccone L, et al. New drugs for treatment of multiple myeloma Lancet Oncology 2004; 5( July) 1-16. • Dimopoulos MA, Kastritis E, Rajkumar SV. Treatment of plasma cell dyscrasias with lenalidomide. Leukemia 2008; 22:1343-1353 • Facon T, Mary JY, Hulin C, et al. Melphalan and prednisone plus thalidomide versus melphalan and prednisone alone or reduced-intensity autologous stem cell transplantation in elderly patients with multiple myeloma (IFM 99-06): A randomized trial. The Lancet 2007; 370:1209-1218. • Harousseau J-L, Marit G, Caillot D, et al. VELCADE/dexamethasone vs VAD as induction treatment prior to ASCT in newly diagnosed multiple myeloma: A preliminary analysis of the IFM 2005-01 randomized multicenter phase 3 trial. Blood 2006; 108:abstract #56. • Hussein MA, Mason J, Ravandi F, Rifkin R. A phase II clinical study of arsenic trioxide (ATO) in patients with relapsed or refractory multiple myeloma; a preliminary report. Blood 2001; 98: 378a. • Jagannath S, Durie BGM, et al. Bortezomib therapy alone and in combination with dexamethasone for previously untreated symptomatic multiple myeloma. Br J Haematol. 2005;129:776-83. • Niesvizky R, Jayabalan DS, Christos PJ, et al. BiRD (Biaxin [clarithromycin]/Revlimid [lenalidomide]/dexamethasone) combination therapy results in high complete- and overall-response rates in treatment-naïve symptomatic multiple myeloma. Blood 2008;111(3):1101-1109. • Niesvizsky R, Jayabalan DS, Furst JR, et al. Clarithromycin, lenalidomide and dexamethasone combination therapy as primary treatment of multiple myeloma. J Clin Oncol 2006; 24: abstract #7545. • Oakervee HE, Popat R., et al. PAD combination therapy (PS341/bortezomib, doxorubicin and dexamethasone) for previously untreated patients with multiple myeloma. Br J Haematol. 2005;129:755-62. • Orlowski RZ, Peterson BL, Sanford B, et al. Bortezomib and pegylated liposomal doxorubicin as induction therapy for adult patients with symptomatic multiple myeloma: Cancer and Leukemia Group B study 10301. Blood 2006; 108: abstract #797. • Orlowski RZ, Zhuang SH, Parekh T, et al. The combination of pegylated liposomal doxorubicin and bortezomib significantly improves time to progression of patients with relapsed/refractory multiple myeloma compared with bortezomib alone: results from a planned interim analysis of a randomized phase III study. Blood 2006; 108: abstract #404. • Palumbo A, Ambrosini MT, Benevolo G, et al. Bortezomib, melphalan, prednisone, and thalidomide for relapsed multiple myeloma. Blood 2007; 109(7):2767-2772. • Palumbo A, Facon T, Sonneveld P, et al. Thalidomide for treatment of multiple myeloma: 10 years later. Blood 2007; 111(8): 3968-3977. • Palumbo A, Ambrosini MT, Benevolo G, et al. Combination of bortezomib, melphalan, prednisone and thalidomide ( VMPT) for relapsed multiple myeloma: results of a phase I/II clinical trial. Blood 2006; 108: abstract #407. • Palumbo A, Flaco P, Falcone A, et al. Oral Revlimid® plus melphalan and prednisone (R-MP) for newly diagnosed multiple myeloma: results of a multicenter phase I/II study. Blood 2006; 108: abstract #800. • Palumbo A, Bertola A, et al. A prospective randomized trial of oral melphalan, prednisone, thalidomide (MPT) vs. oral melphalan, prednisone (MP): an interim analysis. [abstract] Blood. 2005;104(11):63a. Abstract 207. • Pineda-Roman M, Zangari M, van Rhee F, et al. VTD combination therapy with bortezomib-thalidomide-dexamethasone is highly effective in advanced and refractory multiple myeloma. Leukemia 2008; 22:1419-1427. • Rajkumar SV, Hussein M, Catalano J, et al. A multicenter, randomized, double-blind, placebo-controlled study of thalidomide plus dexamethasone versus dexamethasone alone as initial therapy for newly diagnosed multiple myeloma (MM 003). Blood 2006; 108: abstract #795. • Rajkumar SV, Rosinal L, Hussein M, et al. Multicenter, randomized, double-blind, placebo-controlled study of thalidomide plus dexamethasone compared with dexamethasone as initial therapy for newly diagnosed multiple myeloma. J Clin Oncol 2008;26(13):2171-2177. • Rajkumar SV, Hayman SR. Controversies surrounding the initial treatment of multiple myeloma. ASCO Educational Book 2008;369-374. • Rajkumar SV and Kyle R. Multiple Myeloma: Diagnosis and Treatment. Mayo Clinic Proc. 2005;80(10):1371-1382. • Rajkumar SV, Jacobus S, Callender N, et al. A randomized phase III trial of lenalidomide plus high-dose dexamethasone versus lenalidomide plus low-dose dexamethasone in newly diagnosed multiple myeloma (E4A03): a trial coordinated by the Eastern Cooperative Oncology Group. Blood 2006; 108: abstract #799. • Rajkumar SV. Multiple myeloma: the death of VAD as initial therapy. Blood. 2005;106:2. • Rajkumar SV, Hayman SR, Lacy MQ, et al. Combination therapy with CC-5013 (lenalidomide; Revlimid) plus dexamethasone (Rev/Dex) for newly diagnosed myeloma (MM) [abstract]. Blood. 2004;104:98a. Abstract 331. • Richardson PG, Jagannath S, Avigen DE, et al. Lenalidomide plus bortezomib (Rev-VEl) in relapsed and/or refractory multiple myeloma (MM): final results of a multicenter phase 1 trial. Blood 2006; 108: abstract #405. • Richardson P, Schlossman RL, Hideshima F, et al. A Phase I study of oral CC5013, an immunomodulatory thalidomide (Thal) derivative, in patients with relapsed and refractory multiple myeloma. Blood 2001; 98: 775a. • Richardson PG, Briemberg H, Jagannath S, et al. Frequency, characteristics, and reversibility of peripheral neuropathy during treatment of advanced multiple myeloma with bortezomib. J Clin Oncol 2006;24:3113-3120. • Richardson PG, Chanan-Khan A, Schlossman R, et al. Single-agent bortezomib in previously untreated, symptomatic multiple myeloma (MM): results of a phase 2 multicenter study. J Clin Oncol 2006; 24: abstract #7504. • Richardson PG, Sonneveld P, Schuster MW, et al. Bortezomib or high-dose dexamethasone for relapsed multiple myeloma. New Engl J Med 2005;352:2487-2498. • Richardson PG, Barlogie B, Berenson J, et al. Phase II study of the proteasome inhibitor PS341 in multiple myeloma patients with relapsed/ refractory disease. Proc Am Soc Clin Oncol 2002; 21: 11a. • San-Miguel J, Harousseau J-L, Joshua D, Anderson KC. Individualizing treatments of patients with myeloma in the era of novel agents. J Clin Oncol 2008; 26(16):2761-2766. • Thomas D, Cortes J, O’Brian SM, et al. R115777, a farnesyl transferase inhibitor (FTI), has significant anti-leukaemia activity in patients with chronic myeloid leukaemia (CML). Blood 2001; 98: 727a. 43
Scaricare