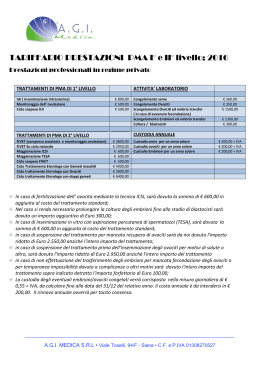
Il percorso clinico-diagnostico della coppia infertile Analisi morfo-funzionale degli ovociti De Santis L., Gismano E., Calzi F., Brigante C., Candiani M. Centro Scienze Natalità, Fisiopatologia della Riproduzione, H San Raffaele, Università Vita-Salute, Milano. I progressi nella medicina della riproduzione hanno reso evidente, in maniera incontrovertibile, che il più importante fattore nel determinare l'esito dello sviluppo embrionale è la qualità dell'ovocita. La capacità di definire la qualità degli ovociti è perciò di fondamentale importanza. Nonostante trent’anni siano trascorsi dall’introduzione della fecondazione in vitro (IVF) per il trattamento dell’ infertilità umana, tuttavia i criteri oggettivi di selezione degli ovociti competenti continuano ad essere difficili da definire. Questo non è sorprendente, nel caso dell'umano, in cui gli ovociti sono raramente disponibili per scopi di ricerca; tuttavia nel modello animale, pur essendo rilevante il numero di ovociti disponibili per la sperimentazione, i dati sulla qualità degli ovociti sono utili solo di riflesso e non sono sempre universalmente applicabili per le differenze sostanziali legate alla biologia dello sviluppo nelle diverse specie. Nonostante ciò è generalmente accettato che la qualità degli ovociti si riflette in caratteristiche facilmente rilevabili, come ad esempio il grado di espansione della massa del cumulo, l’estrusione del globulo polare, e l'assenza di evidenti anomalie citoplasmatiche e della zona pellucida (Veek, 1999). Tuttavia, queste caratteristiche non sono sufficienti per stabilire criteri oggettivi ed affidabili di selezione e per definire se un ovocita abbia realmente la capacità di sostenere una gravidanza a termine. L'acquisizione di competenza degli ovociti è un processo ancora poco conosciuto che si verifica durante l’oogenesi (Albertini et al., 2003). In particolare, subito prima dell'ovulazione entrambi i compartimenti - nucleare e citoplasmatico - sono coinvolti in una serie di cambiamenti coordinati. L’estrusione del 1° globulo polare (1st polar body o PBI) è il punto di riferimento cellulare della realizzazione di maturazione meiotica (pur non essendo univocamente vero, come vedremo più avanti). Benché il PBI non partecipi al processo di sviluppo, è stata comunque ipotizzata una possibile correlazione tra la morfologia del PBI e la competenza degli ovociti. Ad esempio, nel topo, l’incapacità del fuso meiotico di acquisire una morfologia normale migrando verso la corticale dell’uovo porta alla definizione di un piano di clivaggio anomalo e alla formazione di un PBI atipicamente grande. I report clinici presenti in letteratura sono controversi. Alcuni autori hanno riferito che gli ovociti con un PBI intatto di dimensioni normali si fecondano con un tasso paragonabile a quello di ovociti con PBI frammentato, ma producono un’incidenza significativamente minore di embrioni frammentati al Giorno 2, un più alto tasso di formazione di blastocisti e una maggiore frequenza di impianti e gravidanze evolutive (Ebner et al., 2000 e 2001). Queste correlazioni non sono state peraltro confermate da altri studi in cui la capacità di sviluppo di ovociti - che presentavano morfologia differente di PBI - non si è dimostrata diversa in termini di tasso di fecondazione, embrioni di buona qualità, numero relativo di blastomeri e capacità di sviluppo a blastocisti. Il “germinal vesicle breakdown” (GVBD) altrimenti definito stadio di Metafase I (MI) - benché temporalmente i due eventi siano in rapida successione - costituisce un momento cruciale nella ripresa della meiosi e, insieme all'emissione del PBI, definisce un momento funzionale essenziale all’intero processo meiotico. Tuttavia GVBD ed estrusione del PBI non garantiscono che l'apparato meiotico ovocitario sia effettivamente progredito correttamente allo stadio di Metafase II (MII) in preparazione per la fecondazione. Vari fattori, come ad esempio inappropriate condizioni di maturazione in vitro, possono turbare l'organizzazione del fuso e del citoscheletro (EichenlaubRitter et al., 2002; Sanfins et al., 2003) con la conseguenza che la segregazione in meiosi II ed i più ampi eventi fuso-mediati possono essere compromessi. Contemporaneamente, durante la maturazione finale, in ambiente citoplasmatico si svolgono vari eventi in grado di consentire all'ovocita di sostenere un ulteriore sviluppo. Questi eventi sono essenziali per generare oscillazioni periodiche intracellulari di Ca2+ in risposta al fattore di attivazione dello spermatozoo, e permettere così la fecondazione monospermica, la decondensazione della testa dello spermatozoo e la formazione del pronucleo e così fino a determinare lo sviluppo pre- e post-impianto (Cheung et al., 2000). L'acquisizione di questa competenza citoplasmatica dipende da fenomeni che sono solo parzialmente noti. Esempi di questa attività sono la re-distribuzione del reticolo endoplasmatico dalla regione centrale a quella sub-corticale (Mehlmann et al., 1995) e l’up-regolazione dei recettori inositolo trisfosfato (Mehlmann et al., 1996), necessari per le oscillazioni di Ca2+ intracellulare, la migrazione periferica dei granuli corticali e dei mitocondri ed infine per l'accumulo di glutatione necessario a ridurre i legami disolfuro delle protamine, al fine di eliminare queste ultime molecole dal nucleo dello spermatozoo (Perreault et al., 1988). Quando nel laboratorio di fecondazione assistita si procede con il recupero ovocitario si identificano inizialmente dal fluido follicolare i “complessi cumulo-corona-ovocita”. Questi complessi (dall’acronimo inglese detti COCs), a seconda dell’espansione della massa del cumulo e della presenza o meno di inclusi (Ebner, 2008 c) possono fornire indicazioni piuttosto precise sul grado di maturità dell’ovocita in essi contenuto. Ogni altra valutazione morfologica accurata può, invece, effettuarsi solo dopo la rimozione delle cellule del cumulo e della corona radiata e pertanto, in genere, è riservata agli ovociti destinati a cicli di ICSI o sottoposti a crioconservazione. Pertanto alla decumulazione gli ovociti possono presentarsi allo stadio di vescicola germinale (GV – Profase I), GVBD (MI - Metafase I) o già in seconda divisione meiotica (MII – Metafase II). Una percentuale compresa tra il 30 e il 70% degli ovociti recuperati in MI matura in vitro e raggiunge in alcune ore lo stadio di MII. Questi ovociti maturati in vitro hanno ridotte percentuali di fecondazione ma simile qualità embrionaria rispetto agli ovociti MII. Tuttavia, utilizzando embrioni provenienti da tali ovociti maturati in vitro (ma in realtà “aged”) sono riportate solo sporadiche gravidanze (Coetzee et al., 1996; Ubaldi et al., 1997). Altre invece le considerazioni sugli ovociti provenienti da cicli IVM (In Vitro Maturation) che non sono oggetto di questa trattazione. Per quanto riguarda la valutazione del citoplasma, un ovocita MII di buona morfologia dovrebbe averne uno chiaro, moderatamente granulare, con un piccolo spazio perivitellino, un primo globulo polare intatto e una zona pellucida non troppo spessa e priva di colore (De Sutter et al., 1996; Xia et al., 1997). Tuttavia, circa la metà degli ovociti recuperati presentano almeno una anomalia morfologica. Tali anomalie possono essere distinte in citoplasmatiche ed extracitoplasmatiche. Le prime possono essere rappresentate da citoplasma scuro, da eccessiva granularità diffusamente omogenea o aggregata nel centro, inclusioni, vacuoli o “refractile bodies”. In alcuni casi tali caratteristiche citoplasmatiche, isolate o associate tra loro, possono essere espressione di difetti ovocitari intrinseci che possono influenzare negativamente la competenza ovocitaria (Van Blerkom and Henry, 1992). Tuttavia non esiste univocità di vedute sul significato prognostico di una o più di queste anomalie morfologiche rispetto all’outcome clinico. Le anomalie extracitoplasmatiche, infine, sono rappresentate da irregolarità nella forma ovocitaria, aumentato spazio perivitellino con o senza presenza di detriti nel suo interno, frammentazioni del primo globulo polare, alterata consistenza dell’oolemma o della zona pellucida. Vari autori hanno cercato di correlare l'aspetto morfologico del citoplasma e la generale morfologia dell'ovocita con lo sviluppo preimpianto dell'embrione e con i risultati clinici, ma le conclusioni proposte da differenti studi non sono del tutto coerenti (De Sutter et al., 1996; Xia et al., 1997); infatti, al di là dei dismorfismi evidenti che sono chiaramente incompatibili con lo sviluppo normale, sembra difficile immaginare come semplici attributi morfologici possano riflettere i processi che si verificano a livello biochimico e subcellulare. In uno studio di oltre un decennio fa Balaban et al.(1998) non hanno trovato alcuna correlazione tra la morfologia degli ovociti e i risultati di cicli ICSI, mentre Serhal et al. (1997) e Loutradis et al. (1999) sono giunti a conclusioni opposte. Ancora un decennio dopo queste osservazioni, la pubblicazione di lavori, anche molto accurati, che hanno considerato e valutato numerosi parametri morfologici non sono giunti a conclusioni chiare, risultando, come già dimostrato, che siano le anomalie e i dismorfismi più accentuati gli unici parametri che posseggano una correlazione statisticamente significativa con l’outcome clinico (Rienzi et al., 2008 e 2010; Balaban et al., 2008; Ebner et al., 2006 e 2008 a,b,c). Si è discusso molto, ed ancora non ci sono risultati univoci, sull’effetto dei vari tipi di gonadotropine utilizzate per quanto riguarda il reclutamento follicolare, la qualità ovocitaria, la competenza embrionaria e quindi i tassi di gravidanza. A partire dalla metà degli anni ’90, subito dopo l’introduzione delle gonadotropine ricombinanti, sono stati condotti numerosi studi che hanno confrontato l’efficacia dell’FSH ricombinante con l’FSH urinario o con la combinazione FSH-LH urinario (HMG). I risultati sono stati conflittuali, verosimilmente a causa di fattori quali la variabilità etnica delle pazienti arruolate in studi multicentrici che potrebbe determinare una diversa distribuzione delle varianti alleliche dei recettori per l’FSH o alle possibili differenti caratteristiche delle pazienti arruolate (Huang et al., 2004) o ad altri fattori confondenti come l’età, il fumo di sigaretta, il polimorfismo dei recettori dell’FSH, il tipo di protocollo ed il dosaggio di gonadotropine utilizzato, il timing dell’induzione della maturazione ovocitaria finale e l’intervallo di tempo tra quest’ultimo e il prelievo ovocitario (Sherins et al., 1995; Greenblatt et al., 1995; Zenzes et al., 1997). Così, se da una parte non esiste la certezza che un determinato trattamento farmacologico assicuri oociti di qualità migliore, d’altra parte è certo che, indipendentemente dal tipo di gonadotropina utilizzato, la qualità ovocitaria è influenzata negativamente dall’ambiente endocrino creato farmacologicamente, il quale induce la maturazione anche di quei follicoli che fisiologicamente sarebbero andati incontro ad atresia. Verosimilmente nel pool di follicoli che arrivano al prelievo ovocitario alcuni hanno un’insufficiente vascolarizzazione e questo induce soprattutto un’asincronia tra maturità nucleare e maturità citoplasmatica dell’ovocita corrispondente (Van Blerkom et al., 1997). Una corretta ossigenazione infatti sembra essere un fattore fondamentale per un’adeguata formazione del fuso meiotico, con conseguente aggregazione cromosomica e maturità citoplasmatica (Van Blerkom et al., 1997; Gaulden, 1992) e alcuni autori hanno riportato un’associazione tra riduzione della flusso ematico follicolare, alterazioni del fuso meiotico e anomalie cromosomiche (Van Blerkom et al., 1997). Evidenze scientifiche generate dal confronto di ovociti maturati in vivo e in vitro hanno inoltre suggerito che la formazione del PBI possa essere coinvolta in fenomeni in grado di spiegare la generazione di ovociti di qualità mediocre in condizioni di maturazione insufficienti. In particolare è stato osservato che, in ovociti di topo maturati in vivo, alcune componenti del citoscheletro, quali i centri di organizzazione dei microtubuli (MOTCs) sono esclusi dal PBI e segregano interamente all'interno del citoplasma dell'ovocita, mentre quando si verifica la maturazione in vitro, anche questi elementi segregano nel PBI (Sanfins et al., 2003). Pertanto, i modelli sperimentali sostengono l'idea che alcune anomalie nella formazione del globulo polare PBI possano sottolineare perturbazioni importanti dei processi con cui viene acquisita la competenza ovocitaria (Cooke et al., 2003). Tuttavia un globulo polare di questo tipo si osserva in un numero relativamente limitato di casi e pertanto non può essere considerato un criterio di selezione dell’ovocita. Nonostante tali limitazioni, lo sforzo di individuare criteri affidabili per la valutazione della qualità ovocitaria resta una priorità. Sulla base del fatto che l’estrusione del PBI segna un passaggio importante per l'acquisizione della competenza meiotica, diversi autori hanno considerato la possibilità che la morfologia di questa struttura possa esprimere, almeno in parte, la competenza del gamete. Eichenlaub-Ritter et al. (1995) per primi hanno proposto che un’elevata frammentazione del PBI possa riflettere l’invecchiamento post-ovulatorio dell'ovocita. Un possibile legame tra morfologia del PBI e qualità ovocitaria è supportata anche da studi condotti sui topi in cui le femmine geneticamente modificate sono infertili e generano ovociti con globuli polari anomalmente grandi (Choi et al., 1996). In una serie di studi, Ebner ha esteso l'ipotesi di una correlazione tra morfologia del PBI e qualità degli ovociti, descrivendo che un PBI senza segni di frammentazione, con una superficie liscia e di dimensioni normali rappresenta un fattore prognostico favorevole per la fecondazione e per la generazione di embrioni di qualità elevata (Ebner et al., 2000), per la capacità di sviluppo a blastocisti e per aumentati tassi di impianto (Ebner et al., 1999; Ebner et al., 2002). Alcuni autori hanno contestato questi studi. In particolare, Verlinsky (2003) non ha trovato alcuna correlazione tra morfologia del PBI e tassi di fecondazione, numero medio di blastomeri al Giorno 2 e tassi di formazione di blastocisti. Lo stesso Autore ha esteso poi questi risultati, concludendo che l'incidenza delle aneuploidie al Giorno 3 di sviluppo embrionario valutata attraverso la diagnosi pre-impianto (PGD) non è associata alla morfologia del PBI. Qualche anno fa, Ciotti e collaboratori (2004) e De Santis et al. (2005) hanno ulteriormente messo in dubbio le prove prodotte da Ebner, riferendo che la qualità degli embrioni e dei risultati clinici non sono connessi alla frammentazione del PBI. In uno studio pubblicato su una rivista minore Fancsovits (2006) ha analizzato un numero piuttosto elevato di globuli polari di ovociti recuperati da cicli IVF, definendoli Metafase II, e dividendoli in 5 gruppi in base alla morfologia del PBI considerando fra questi anche quelli che emettevano il globulo polare dopo il recupero. Tuttavia, sembra discutibile che un ovocita nel processo di estrusione del proprio PBI possa essere confrontato con quelli che hanno già completato il processo. In realtà, la maggior parte degli autori che hanno affrontato questa tematica (Ebner et al., 2000, Ciotti et al., 2004, Verlinsky et al., 2003 e De Santis et al., 2005) si riferiscono sempre a 4 classi di PBI. Inoltre, un aspetto molto importante da non trascurare in questo tipo di osservazioni è rappresentato dalla finestra temporale in cui è stata effettuata la valutazione dell’ovocita rispetto alla somministrazione di hCG; ciò può anche spiegare perché l’apparente assenza del fuso non coincida in ogni singolo caso con l’incapacità dell’ovocita di andare incontro a fecondazione. In altri termini, al momento dell’osservazione gli ovociti possono trovarsi in stadi precedenti la Metafase II (MII), tipicamente Telofase I o Pro-metafase II, circostanza che non è compatibile con l’osservazione di un fuso ben organizzato. Tale condizione può infatti introdurre un certo grado di variabilità tra ovociti (Cohen et al., 2004). Infine si deve considerare come un PBI estruso nello spazio perivitellino non corrisponda necessariamente ad una piena competenza ovocitaria (MII), dato che è ben noto dalla letteratura e supportato anche dall’analisi in microscopia a luce polarizzata (De Santis et al., 2005, Montag et al., 2006), dove si evidenziano chiaramente immagini di ovociti che in luce trasmessa appaiono in MII ed in luce polarizzata si rivelano in Telofase I. Oltre al globulo polare, nell’ultimo decennio si sta facendo sempre più strada la convinzione che informazioni utili alla determinazione della qualità ovocitaria possano derivare dall’osservazione del fuso meiotico. Questa struttura altamente dinamica, sul cui piano equatoriale sono disposti i cromosomi, è costituita da microtubuli ed è localizzata alla periferia dell’ovocita. Il fuso meiotico è responsabile della corretta segregazione cromosomica dopo l’attivazione e la sua integrità è necessaria per la sequenza di eventi che portano al completamento della meiosi e della fecondazione. La struttura del fuso meiotico risulta essere altamente sensibile a modificazioni chimico-fisiche che si possono verificare durante la manipolazione (Pickering et al., 1990; Almeida et al., 1995; Zenzes et al., 2001; Wang et al., 2001 a,b) Inoltre anche parametri fisiologici come l’età materna avanzata sono associati ad una alterazione della sua architettura (Battaglia et al., 1996). La più drammatica conseguenza di un danneggiamento fisiologico o indotto del fuso meiotico è la formazione di embrioni aneuploidi. Quindi, l’integrità della sua struttura, deputata al controllo dei movimenti dei cromosomi durante la meiosi, rappresenta un punto di fondamentale importanza nelle potenzialità di sviluppo. La visualizzazione del fuso meiotico e la sua localizzazione in rapporto al primo globulo polare sembrano essere fattori predittivi per la qualità e la potenzialità di sviluppo ovocitario. Da un punto di vista operativo in laboratorio ed in modo non invasivo, l’analisi del fuso meiotico è stata resa possibile da un sistema di microscopia (di cui il primo e più noto è stato lo Spindle View - detto anche Polscope- seguito dalle successive versioni “Oosight” o dall’innovativo Octax) che, utilizzando la luce polarizzata, permette l'osservazione delle strutture subcellulari altamente ordinate, come i microtubuli, nel fuso negli ovociti di mammifero. L’uso del Polscope non pregiudica la vitalità cellulare, consentendo osservazioni ripetute e soprattutto offrendo l’opportunità di selezionare e impiegare per il trattamento terapeutico gli ovociti sottoposti ad analisi. Il Polscope offre il vantaggio unico di essere totalmente non invasivo, preservando la vitalità dell'ovocita (Keefe et al., 2003). La funzione biologica del fuso meiotico è ampiamente riconosciuta per quanto riguarda la segregazione dei cromosomi durante la meiosi, mentre non è sempre apprezzato il fatto che questa struttura sia fondamentale anche per la fecondazione e lo stabilirsi di una polarità ovocitaria in previsione del futuro sviluppo. Se da un lato il Polscope non è in grado di fornire informazioni accurate sulla struttura fine del fuso, dall’altro l’analisi del fuso può essere condotta quantitativamente, in quanto la “ritardata propagazione del segnale” - detta retardance e che rappresenta la quantità fondamentale misurata dallo strumento - è direttamente proporzionale alla densità dei microtubuli organizzati nelle strutture fortemente ordinate (Oldenbourg et al., 1998). Le misurazioni di tale parametro può avere rilevanza clinica (Wang et al., 2001 a) perché è probabile che la densità dei microtubuli possa influenzare la funzione del fuso, con ovvie conseguenze sull’allineamento e la segregazione dei cromosomi durante la meiosi II. Poiché l’analisi sul significato della morfologia del PBI e l’osservazione qualitativa (in termini di presenza/assenza) del fuso in relazione alla qualità dell'ovocita restano controverse, al fine di stabilire criteri alternativi per la selezione degli ovociti, si è cercata una correlazione fra valori di retardance ed età delle pazienti. Essendo l’età materna avanzata uno dei fattori prognostici che più pesano negativamente sulla buona riuscita di un ciclo di PMA è ipotizzabile che la qualità degli ovociti e quella degli embrioni che ne derivano possa correlare con l’intensità di segnale del fuso inteso come riflesso dell’ordine e della densità dei microtubuli che lo costituiscono. Nelle pazienti di età più avanzata (35-39 e ancor più ≥40 anni), è stata osservata una tendenza tra bassi livelli di retardance e scarsa qualità degli embrioni, anche se in generale l'associazione tra valori di retardance dell’ovocita e performance dello sviluppo non ha raggiunto la significatività statistica (De Santis et al., 2005). Inoltre, l’utilizzo del Polscope ha consentito di osservare che in una proporzione consistente di ovociti il fuso meiotico non si trova esattamente nella zona subcorticale corrispondente al PBI. Poiché si ritiene che il fuso, una volta formatosi non sia soggetto a spostamenti significativi, questa osservazione lascia supporre che il PBI possa essere dislocato a causa dell’azione meccanica normalmente impiegata per la rimozione delle cellule del cumulo. Pertanto il Polscope potrebbe essere adoperato anche per stimare il grado di stress meccanico a cui sono sottoposti gli ovociti durante le normali manipolazioni di laboratorio. I dati relativi al valore predittivo della localizzazione del fuso meiotico in rapporto alla posizione del primo globulo polare sono anche in questo caso discordanti. Moon e collaboratori (2003) non hanno osservato differenze significative in termini di percentuale di fecondazione e di sviluppo embrionario a seconda delle differenti localizzazioni del fuso meiotico in rapporto al primo globulo polare. Al contrario, altri autori hanno osservato tassi di fecondazione significativamente più bassi quando l’angolo formato tra le due strutture supera i 90° (Rienzi et al., 2003). Infine, recentemente, l’utilizzo della microscopia in luce polarizzata ha dimostrato l’esistenza di una correlazione tra la birifrangenza della zona pellucida e l’outcome clinico (Shen et al., 2005). La zona pellucida è costituita da tre strati di glicoproteine che cambiano conformazione dopo l’estrusione dei granuli corticali e la fecondazione. La sua funzione è meccanica, di separazione fisica dell’oocita dalle cellule follicolari, ma anche trofica grazie alla presenza di proiezioni citoplasmatiche che attraversano la zona durante la fase di accrescimento e maturazione dell’ovocita e consentono lo scambio di molecole con le cellule somatiche. E’ stato dimostrato che l’assenza di questi scambi, a causa di irregolarità nella zona, determina subfertilità. La struttura è fondamentale per la fecondazione dell’oocita e l’impianto dell’embrione, previene la polispermia e protegge l’embrione dagli stress meccanici prima dell’impianto. Anormalità della zona pellucida sono associate a problemi di fecondazione e a difetti dello sviluppo (Liu et al., 1996; Rankin et al., 2001). Lo spessore della zona e l’aspetto dei singoli strati cambia in base allo stadio di maturazione dell’oocita e allo sviluppo post-fecondazione dell’embrione. Qualcuno ha suggerito che la morfologia della zona possa essere influenzata dall’omeostasi ormonale e dall’età riproduttiva della donna (Bertrand et al., 1996) e che lo spessore della zona di embrioni diversi di una stessa paziente possa correlare con la loro capacità di sviluppo e col tasso di impianto (Gabrielsen et al., 2001). La maggior parte delle tecniche per l’osservazione della zona si basano su meccanismi standard di contrasto che consentono la semplice misurazione dello spessore di quella che appare come una struttura a singolo strato. Il sistema Spindle View, invece, produce automaticamente un’analisi quantitativa della densità, dell’orientamento e dello spessore di ciascuno dei tre strati glicoproteici, e questi dati possono contribuire a fornire un’analisi comparativa della qualità ovocitaria. Con questa tecnica, infatti, Pelletier e colleghi hanno dimostrato che il valore di ritardanza della zona pellucida negli oociti cambia in modo dipendente dallo stadio di maturità (Pelletier et al., 2004), in accordo con le osservazioni precedenti sull’aumento di spessore che si verifica progressivamente durante la maturazione e l’assottigliamento dopo la fecondazione e prima dell’hatching (Dirnfeld et al., 2003; Pelletier et al., 2004). Shen e colleghi, infine, hanno dimostrato con uno studio retrospettivo che gli oociti delle pazienti che hanno portato a termine la gravidanza dopo ICSI, rispetto alla pazienti che non hanno concepito, possiedono una zona pellucida dalla morfologia più omogenea, dallo spessore maggiore di 1.3 µm e con un valore di ritardanza superiore del 30% (Shen et al., 2005). Quest’ultimo parametro in particolare sembra essere un buon criterio di selezione ovocitaria (Montag et al., 2008 a e b). Un ulteriore enorme dilemma da affrontare nell’analisi morfologica degli ovociti è rappresentato dalla valutazione degli ovociti da destinare alla crioconservazione o dalla valutazione di quelli derivanti da cicli di scongelamento/re-warming. Se da un lato il congelamento degli embrioni è diventato un evento fondamentale e consolidato nella gestione globale dei trattamenti di procreazione assistita nel mondo, dall’altro la crioconservazione ovocitaria non solleva questioni etiche, quali la proprietà e il destino degli embrioni e rappresenta una metodica essenziale per la conservazione del materiale in esubero specialmente nelle realtà in cui la conservazione degli embrioni è vietata o limitata. Come è noto il vero problema da affrontare, nella criopreservazione dell’ovocita è rappresentato dal tasso di sopravvivenza ridotto dopo scongelamento (De Santis et al., 2007 a). Anche piccoli cambiamenti nella durata dell'esposizione al crioprotettore prima del raffreddamento possono portare a drastici cambiamenti di idratazione cellulare (Paynter et al., 2005). Tali fattori possono potenzialmente influenzare la capacità della cellula di sopravvivere allo stress indotto durante le fasi successive del protocollo di crioconservazione (De Santis et al., 2007 b). Sebbene l’introduzione ed il consolidarsi delle tecniche di vitrificazione abbiano in gran parte superato il bias legato alla sopravvivenza ovocitaria post-scongelamento (correttamente detto “warming”) (Rienzi et al., 2010), tuttavia i risultati clinici non sono ancora totalmente in favore di questa metodologia rispetto al “congelamento lento” (Gook and Edgar, 2009). Bianchi et al., (2005), hanno anche suggerito che, dopo crioconservazione il fuso meiotico si riorganizzi dopo una scomparsa transitoria, ma la sua “retardance” risulta notevolmente diminuita nella maggior parte degli ovociti congelati/scongelati. Questi tentativi preliminari di valutazione quantitativa del fuso meiotico utilizzando il Polscope non sono conclusivi, ma suggeriscono percorsi alternativi per l'identificazione di nuovi criteri in grado di predire la qualità degli ovociti (De Santis et al., 2007 c). Gran parte delle metodologie, quali la microscopia confocale o lo studio dell’espressione genica, tendenti a stabilire criteri oggettivi di qualità ovocitaria, richiedono trattamenti che non preservano la vitalità cellulare e pertanto non possono essere applicate per la selezione diretta dei gameti. Per questa ragione, al di là dell’osservazione morfologica in luce trasmessa e delle inferenze che si possono fare tramite l’applicazione della luce polarizzata, hanno suscitato grande interesse e rinnovate speranze le indagini più strettamente funzionali quali quelle che valutano lo stato metabolico delle cellule in coltura. In conclusione, le osservazioni collettive sembrano confermare la difficoltà di determinare la qualità degli ovociti da un punto di vista strettamente morfologico. I dati non supportano l'ipotesi che la morfologia del PBI sia indicativa del potenziale di sviluppo. Tuttavia, non si può escludere che un'analisi più ampia possa rivelare che gli ovociti con grandi PBI – pur rappresentando un evento infrequente - siano evolutivamente compromessi. Sono necessari ulteriori studi per determinare se la valutazione quantitativa della birifrangenza del fuso meiotico sia in grado di prevedere la capacità dell'ovocita di svilupparsi in un embrione vitale. I risultati ottenuti con studi in immunofluorescenza e microscopia confocale sembrano mettere in dubbio che la reale struttura del fuso possa rispecchiare quella osservata in luce polarizzata poiché l’analisi quantitativa non è in grado di predire l’esatta configurazione del fuso e la distribuzione dei relativi cromosomi (Coticchio et al., 2010) Nella nostra esperienza la selezione ovocitaria basata su criteri esclusivamente morfologici non si è dimostrata sufficiente a controbilanciare i limiti di operare in conformità alla legge 40/2004 almeno fino al pronunciamento della Corte Costituzionale del Maggio 2009 - né si è dimostrata in grado di selezionare positivamente gli ovociti di pazienti di età avanzata. L’applicazione della microscopia in luce polarizzata può fornire informazioni sia qualitative che quantitative sul fuso meiotico e sulla zona pellucida anche se il suo potere di selezione positiva appare ancora parziale. L’analisi così condotta si è altresì rivelata utile sia su ovociti freschi che criopreservati ma solo in termini di “selezione negativa”, per identificare i non idonei al trattamento. L’analisi del “secretoma” (Botros et al., 2008; Seli et al., 2010) , che tante speranze ha dato nel potere predittivo degli embrioni con maggiori possibilità di sviluppo ed impianto attende ancora una risposta certa sull’applicazione effettiva dell’analisi dei profili metabolici dell’ovocita competente. Le maggiori limitazioni di questa tecnica applicata agli ovociti (precisamente alla valutazione delle cellule del cumulo che lo circondano) risiede infatti nella breve permanenza del gamete femminile nel terreno di coltura prima dell’inseminazione/iniezione e alle basse concentrazioni di secreto rispetto all’embrione metabolicamente attivo. Complessivamente, come suggerito dal titolo di questo capitolo, tenendo presente la vasta panoramica di osservazioni ed analisi non invasive a disposizione e considerando che ogni manifestazione morfologica è l’esito di uno stato funzionale, l’approccio valutativo moderno nel laboratorio di embriologia clinica dovrebbe essere sempre di carattere morfofunzionale. BIBLIOGRAFIA Albertini DF, Sanfins A and Combelles CM 2003. Origins and manifestations of oocyte maturation competencies. Reprod Biomed Online 6: 410-415. Almeida PA, Bolton VN. 1995 The effect of temperature fluctuations on the cytoskeletal organisation and chromosomal constitution of the human oocyte. Zygote 3: 357-365 Balaban B, Urman B, Sertac A, et al. 1998. Oocyte morphology does not affect fertilization rate, embryo quality and implantation rate after intracytoplasmic sperm injection. Hum Reprod 13: 3431-3433. Balaban B, Ata B, Isiklar A, et al. 2008. Severe cytoplasmic abnormalities of the oocyte decrease cryosurvival and subsequent embryonic development of cryopreserved embryos. Hum Reprod. 23:1778-85. Battaglia DE, Goodwin P, Klein NA, et al. 1996. Influence of maternal age on meiotic spindle assembly in oocytes from naturally cycling women. Hum Reprod 11: 2217-2222. Bertrand E, Van den Bergh M, Englert Y 1996. Clinical parameters influencing human zona pellucida thickness. Fertil Steril 66: 408-411 Bianchi V, Coticchio G, Fava L, et al. 2005. Meiotic spindle imaging by Polscope in human oocytes frozen with a slow freezing procedure involving high sucrose concentration. Hum Reprod 20: 1078-1083. Botros L, Sakkas D, Seli E. 2008.Metabolomics and its application for non-invasive embryo assessment in IVF.Mol Hum Reprod 14:679-90 Cheung A, Swann K and Carroll J 2000. The ability to generate normal Ca(2+) transients in response to spermatozoa develops during the final stages of oocyte growth and maturation. Hum Reprod 15: 1389-1395. Choi T, Fukasawa K, Zhou R, et al. 1996. The Mos/mitogen-activated protein kinase (MAPK) pathway regulates the size and degradation of the first polar body in maturing mouse oocytes. PNAS 93, 7032-7035. Ciotti PM, Notarangelo L, Morselli-Labate AM, et al. 2004. First polar body morphology before ICSI is not related to embryo quality or pregnancy rate. Hum Reprod 19: 2334-2339. Coetzee K. and Windt ML. 1996. Fertilization and pregnancy using metaphase I oocytes in an ICSI program J. Assist. Reprod. Genet. 13:768-71 Cohen Y, Malcov M, Schwartz T, et al. 2004. Spindle imaging: a new marker for optimal timing of ICSI? Hum Reprod 19:649-654. Cooke S, Tyler JP and Driscoll GL 2003. Meiotic spindle location and identification and its effect on embryonic cleavage plane and early development. Hum Reprod 18:2397-2405. Coticchio G, Sciajno R, Hutt K, et al. 2010. Comparative analysis of the metaphase II spindle of human oocytes through polarized light and high-performance confocal microscopy. Fertil Steril 93: 2056-2064 De Santis L, Cino I, Rabellotti E, et al.2005. Polar body morphology and spindle imaging as predictors of oocyte quality. Reprod Biomed Online 11: 36-42 De Santis L, Cino I, Rabellotti E, et al. 2007. Oocyte cryopreservation: clinical outcome of slow-cooling protocols differing in sucrose concentration. Reprod Biomed Online 14:57-63. De Santis L, Coticchio G, Paynter S, et al. 2007 . Permeability of human oocytes to ethylene glycol and their survival and spindle configurations after slow cooling cryopreservation. Hum Reprod. 22:2776-83. De Santis L, Cino I, Coticchio G, et al. 2007. Objective evaluation of the viability of cryopreserved oocytes. Reprod Biomed Online 15:338-45. De Sutter P, Dozortsev D, Qian C, et al. 1996. Oocyte morphology does not correlate with fertilization rate and embryo quality after intracytoplasmic sperm injection. Hum Reprod. 11:595-7 Dirnfeld M, Shiloh H, Bider D, et al.2003. A prospective randomized controlled study of the effect of short coincubation of gametes during insemination on zona pellucida thickness. Gynecol Endocrinol 17: 397-403 Ebner T, Moser M, Yaman C, et al. 1999. Elective transfer of embryos selected on the basis of first polar body morphology is associated with increased rates of implantation and pregnancy. Fertil Steril 72: 599-603. Ebner T, Yaman C, Moser M, et al. 2000. Prognostic value of first polar body morphology on fertilization rate and embryo quality in intracytoplasmic sperm injection. Hum Reprod 15: 427-430. Ebner T, Yaman C, Moser M, et al., 2001.Embryo fragmentation in vitro and its impact on treatment and pregnancy outcome. Fertil Steril 76:281-5. Ebner T, Moser M, Sommergruber M, et al. 2002. First polar body morphology and blastocyst formation rate in ICSI patients. Hum Reprod 17: 2415-2418. Ebner T, Moser M, Tews G.2006. Is oocyte morphology prognostic of embryo developmental potential after ICSI? Reprod Biomed Online 12:507-12. Ebner T, Shebl O, Moser M, et al., 2008. Developmental fate of ovoid oocytes. Hum Reprod 23 :62-6 Ebner T, Moser M, Shebl O, et al. 2008. Prognosis of oocytes showing aggregation of smooth endoplasmic reticulum. Reprod Biomed Online 16:113-8. Ebner T, Moser M, Shebl O et al., 2008. Blood clots in the cumulus-oocyte complex predict poor oocyte quality and post-fertilization development. Reprod Biomed Online 16:801-7. Eichenlaub-Ritter U, Schmiady H, Kentenich H, et al. 1995. Recurrent failure in polar body formation and premature chromosome condensation in oocytes from a human patient: indicators of asynchrony in nuclear and cytoplasmic maturation. Hum Reprod 10: 2343-2349. Eichenlaub-Ritter U, Shen Y and Tinneberg HR 2002. Manipulation of the oocyte: possible damage to the spindle apparatus. Reprod Biomed Online 5: 117-124. Fancsovits P, Tóthné ZG, Murber A, et al. 2006. Correlation between first polar body morphology and further embryo development. Acta Biol Hung 57: 331-8. Gabrielsen A, Lindemberg S and Petersen K 2001. The impact of the zona pellucida thikness variation of human embryos on pregnancy outcome in relation to suboptimal embryo development. A prospective randomized controlled study. Hum Reprod. 16: 2166-2170 Gaulden ME. 1992. Maternal age effect: the enigma of Down syndrome and other trisomic conditions. Mutat. Res. 296 :69-88 Gook D A and Edgar D H, 2009. Factors influencing the clinical efficiency of oocyte cryopreservation da “Preservation of human oocytes”, Borini A and Coticchio G Eds, INFORMA Healthcare Greenblatt EM, Meriano JS and Casper RF. 1995. Type of stimulation protocol affects oocyte maturity, fertilization rate, and cleavage rate after intracytoplasmic sperm injection. Fertil. Steril. 64:557-63 Huang FJ, Lan KC, Kung FT, et al. 2004. Human cumulus-free oocyte maturational profile and in vitro developmental potential after stimulation with recombinant versus urinary FSH. Hum Reprod. 19:306-15 Keefe D, Liu L, Wang W, et al. 2003. Imaging meiotic spindles by polarization light microscopy: principles and applications to IVF. Reprod Biomed Online 7: 24-29. Liu C, Litscher ES, Mortillo S, et al. 1996. Targeted disruption of the mZP3 gene results in production of eggs lacking a zona pellucida and infertility in female mice. PNAS 93: 5431-5436 Loutradis D, Drakakis P, Kallianidis K et al. 1999. Oocyte morphology correlates with embryo quality and pregnancy rate after intracytoplasmic sperm injection Fertil Steril 72: 240-244 Mehlmann LM, Terasaki M, Jaffe LA, et al. 1995. Reorganization of the endoplasmic reticulum during meiotic maturation of the mouse oocyte. Dev Biol 170: 607-615. Mehlmann LM, Mikoshiba K and Kline D 1996. Redistribution and increase in cortical inositol 1,4,5trisphosphate receptors after meiotic maturation of the mouse oocyte. Dev Biol 180: 489-498. Montag M, Schimming T and Van der Ven H. 2006. Spindle imaging in human oocytes: the impact of the meiotic cell cycle. Reprod Biomed Online 12:442-6. Montag M, Schimming T, Köster M, et al., 2008 Oocyte zona birefringence intensity is associated with embryonic implantation potential in ICSI cycles. Reprod Biomed Online 16:239-44. Montag M, van der Ven H. 2008 Symposium: innovative techniques in human embryo viability assessment. Oocyte assessment and embryo viability prediction: birefringence imaging. Reprod Biomed Online 17:45460. Moon JH, Hyun CS, Lee SW, et al. 2003. Visualization of the metaphase II meiotic spindle in living human oocytes using the Polscope enables the prediction of embryonic developmental competence after ICSI. Hum Reprod 18: 817-820. Oldenbourg R, Salmon ED and Tran PT 1998. Birefringence of single and bundled microtubules. Biophysical Journal 74: 645-654. Paynter S, Borini A, Bianchi V, et al. 2005. Volume changes of mature human oocytes on exposure to cryoprotectant solution used in slow cooling procedures Hum Reprod 20:1194-1199 Pelletier C, Keef DL and Trimarchi JR 2004. Non invasive polarized light microscopy quantitatively distinguishes the multilaminar structure of the zona pellucida of living human eggs and embryos. Fertil Steril 81: 850-856 Perreault SD, Barbee RR and Slott VL 1988. Importance of glutathione in the acquisition and maintenance of sperm nuclear decondensing activity in maturing hamster oocytes. Dev Biol 125: 181-186. Pickering S, Braude P, Johnson M et al. 1990. Transient cooling to room temperature can cause irreversible disruption of the meiotic spindle in the human oocyte. Fertil. Steril. 54:102-108 Rankin TL, O’Brien M, Lee E, et al. 2001. Defective zonae pellucidae in Zp2-null mice disrupt folliculogenesis, fertility anddevelopment. Development 128: 1119-1126 Rienzi L, Ubaldi F, Martinez F et al. 2003. Relationship between meiotic spindle location with regard to the polar body position and oocyte developmental potential after ICSI. Hum Reprod. 18:1289-1293 Rienzi L, Ubaldi FM, Iacobelli M et el., 2008. Significance of metaphase II human oocyte morphology on ICSI outcome. Fertil Steril. 90:1692-700. Rienzi L, Vajta G and Ubaldi F 2010. Predictive value of oocyte morphology in human IVF: a systematic review of the literature. Hum Reprod. Update Jul 16. [Epub ahead of print] Sanfins A, Lee GY, Plancha CE, et al. 2003. Distinctions in meiotic spindle structure and assembly during in vitro and in vivo maturation of mouse oocytes. Biol Reprod 69, 2059-2067. Seli E, Robert C, Sirard MA.2010 OMICS in assisted reproduction: possibilities and pitfalls. Mol Hum Reprod.16: 513-30. Serhal PF, Ranieri DM, Kinis A, et al. 1997. Oocyte morphology predicts outcome of intracytoplasmic sperm injection. Hum Reprod 12: 1267-1270. Shen Y, Stalf T, Mehnert C, et al. 2005. High magnitude of light retardation by the zona pellucida is associated with conception cycles. Hum Reprod. 20:1596-1606 Sherins RJ, Thorsell LP, Dorfmann A, et al. 1995. Intracytoplasmic sperm injection facilitates fertilization even in the most severe forms of male infertility: pregnancy outcome correlates with maternal age and number of eggs available. Fertil. Steril. 64:369-75 Ubaldi F., Nagy Z., Janssenwillen C., et al. 1997. Repeated hCG administration to trigger ovulation in the "empty follicle syndrome" yields normal fertilization and cleavage in an ICSI cycle and a twin clinical pregnancy in a subsequent frozen-thawed cycle. Hum Reprod. 12:454-6 Van Blerkom J and Henry G. 1992. Oocyte dysmorphism and aneuploidy in meiotically mature human oocytes after ovarian stimulation. Hum Reprod. 7:379-90 Van Blerkom J, Antczak M and Schrader R. 1997. The developmental potential of the human oocyte is related to the dissolved oxygen content of follicular fluid: association with vascular endothelial growth factor levels and perifollicular blood flow characteristics. Hum Reprod. 12:1047-55 Veeck L. 1999. “An atlas of human gametes and conceptuses.” Parthenon Publishing group, New York. Verlinsky Y, Lerner S, Illkevitch N, et al. 2003. Is there any predictive value of first polar body morphology for embryo genotype or developmental potential? Reprod Biomed Online 7:336-341. Wang WH, Meng L, Hackett RJ, et al. 2001a. Developmental ability of human oocytes with or without birefringent spindles imaged by Polscope before insemination. Hum Reprod 16, 1464-1468. Wang WH, Meng L, Hackett RJ et al. 2001 b. Limited recovery of meiotic spindles in living human oocytes after cooling-rewarming observed using polarized light microscopy. Hum Reprod. 16:2374-2378 Xia P 1997. Intracytoplasmic sperm injection: correlation of oocyte grade based on polar body, perivitelline space and cytoplasmic inclusions with fertilization rate and embryo quality. Hum Reprod 12, 1750-1755. Zenzes MT, Reed TE, Casper RF. (1997) Effects of cigarette smoking and age on the maturation of human oocytes. Hum Reprod. 12:1736-41 Zenzes MT, Bielecki R, Caspera RF, Leibo SP. (2001) Effects of chilling to 0°C on the morphology of meiotic spindles in human metaphase II oocytes. Fertil. Steril. 75:769-777
Scaricare