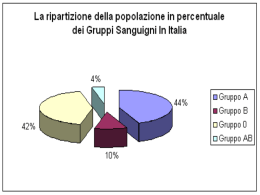
Il locus AB0 presenta 4 alleli: A1, A2, B, 0 Ciò comporta l’esistenza di 6 fenotipi e 10 genotipi. • LE SPECIFICITÀ ABH SONO LEGATE ALLA COMPONENTE SACCARIDICA E AL TIPO DI LEGAMI CHE QUATTRO ZUCCHERI ASSUMONO SULLA PARTE TERMINALE DI UNA CATENA SACCARIDICA DEFINITA SOSTANZA DI BASE SULLA QUALE SI HA LA BIOSINTESI DEGLI ANTIGENI ABH, MA ANCHE DI ALTRI COME I LEWIS, P, I e i. GENE GLYCOSYL TRASFERASE IMMUNODOMINANT SUGAR H L-Fucosyltransferase L-Fucose A N-Acetyl-galactosaminyl- N- Acetyltransferase galactoseamine B D- Galactosyltransferase D-Galactose L’assenza degli antigeni A e B nel fenotipo O derivano dalla delezione di una singola base nucleotidica nella porzione del DNA codificante le transferasi e responsabile dello spostamento della cornice di lettura con conseguente sintesi di una proteina sprovvista di attività transferasica. ALLELI A B O 258 G G Delezione 523 C G C 700 G A G 793 C A C Base n° Legenda G=guanina C=citosina A=adenina Differenze nucleotidiche riscontrate fra gli alleli ABO Gli antigeni eritrocitari o gruppi sanguigni • polisaccaridici •AB0 •Lewis •P •H •I • proteici •Rh Rh protein family Proteine Antigeni Localizzazione genica Famiglia delle proteine Rh RhD D 1p36.13-p34.3180 RhCcEe Ce,CE,ce,cE 1p36.13-p34.3180 6p21.1-p1117,75,174 RhAG Proteine accessorie LW LW 19p13.3181 IAP Non conosciuta 3q1385 GPB ‘N, ‘S, s, U 4q28-q31 Band 3 Diego 17q12-q21182 Avent N., Blood 2000 Rh protein family Il 40% di omologia indica una relazione ancestrale 12 domini transmembrana con le estremità N-terminale e C-terminale rivolti verso la porzione intracitoplasmatica I primi 41 aminoacidi all’estremità Nterminale sono identici RhD differisce da RhCE solo per 30-35 aa lungo l’intera sequenza della proteina. Nonostante questa omologia le proteine RhCcEe non esprimono l’antigene D e viceversa Avent N., Blood 2000 Soggetti RhRh-negativi Nella popolazione Caucasica i soggetti RhD- hanno la delezione del gene RhD In altre popolazioni come i Giapponesi o gli Africani il fenotipo D- non è legato alla perdita del gene. Avent N., Blood 2000 Sistema LEWIS Gli Ag sono correlati con quelli AB0; i G.R.acquisiscono il fenotipo adsorbendoli dal plasma; il gene è distinto ma correlato con quello del carattere di “secretore” Sistema P La maggioranza degli uomini è P1+; le reazioni trasfusionali sono rare ma gravi Sistema MN Gli Ag sono glicoforine; gli Ac anti-M o N umani sono rari; se IgG→eritroblastosi Sistema KELL e Sistema Duffy Possono causare reazioni trasfusionali gravi, evitabili con la prova crociata maggiore Gli antigeni K e Fy(a) / (b) sono buoni immunogeni ed evocano la produzione di anticorpi di isotipo IgG I principali obiettivi del trasfusionista sono due: il primo è prevenire la reazione trasfusionale identificando i pazienti immunizzati e fornendo loro sangue compatibile; il secondo è prevenire la produzione di anticorpi, scegliendo i donatori più simili, come caratteristiche gruppoematiche, al paziente. COMPATIBILITY TESTING What is Compatibility Testing? • Pre Transfusion Protocol to insure the Patients health and the survival of transfused red cells. It includes: – Patient Identification, Labeling, Collection of patient sample, ABO, Rh, Crossmatch search for irregular antibodies. PROVE DI COMPATIBILITA’ Prove crociate IL SIERO DEL PAZIENTE VIENE INCUBATO A 37C°CON I GLOBULI ROSSI DELLE UNITA’ DI SANGUE DA TRASFONDERE CONSENTE DI RILEVARE: L’ INCOMPATIBILITA’ PER IL SISTEMA ABO ED EVENTUALI Ab DIRETTI CONTRO Ag a FREQUENZA MOLTO BASSA Steps In Compatibility Testing Review available Recipient Records FOR: – – – PREVIOUS ABO & Rh Any PRIOR UNEXPECTED Antibodies Any PRIOR ADVERSE REACTIONS to transfusion Correct identification of Donor Unit by Confirming 1. The unit ID with the ID on the donor unit’s records 2. The unit’s ABO & Rh on the record for consistency with that of the patient Gli anticorpi verso gli antigeni eritrocitari • anticorpi naturali • anticorpi irregolari Comprendono: l’anti-A dei soggetti B, l’anti B dei soggetti A e l’anti-A, anti-B e anti-AB dei soggetti 0. Oltre questi ricordiamo, gli anticorpi irregolari anti-A1 che si ritrovano nei soggetti con fenotipo A2 e A2B e l’anti-H che si può ritrovare in alcuni soggetti A1, A1B, B ed in tutti i soggetti con fenotipo Bombay. Anti-A1: i sieri dei soggetti B e 0 contengono una miscela di anti-A e anti-A1. L’anti-A1 è anche presente nel 2% dei soggetti A2 e nel 25% nei soggetti A2B Anti-H: esistono 3 tipi di anti-H, uno attivo a 37°C che si osserva nei soggetti con fenotipo Bombay, uno “freddo” con optimum termico a 4°C (nei soggetti A1, A1B o B non secretori di sostanze gruppo specifiche) e uno che viene formato come autoanticorpo. Anticorpi Irregolari Per “ricerca di anticorpi irregolari”, si intende quell’insieme di procedure atte alla evidenziazione della presenza di anticorpi “inattesi” nel siero di un paziente. Ricerca di anticorpi: 1. Prove di compatibilità 2. Coombs diretto 3. Prova indiretta del gruppo sanguigno Test di Coombs •Test di emoagglutinazione in vitro utilizzato per evidenziare anticorpi eritrocitari •Test diretto •Test indiretto ANTIGRAM L’ANTIGRAM di un pannello eritrocitario ad 11 cellule costituito da aliquote di emazie del gruppo 0 provenienti da singolo donatore selezionate per la loro composizione antigenica ci mostra i più frequenti anticorpi che si possono trovare nel siero di un paziente. REAZIONI TRASFUSIONALI ACUTE IMMUNOLOGICHE emolitiche febbrili non emolitiche Allergiche (cutanee e anafil.) edema polmonare non cardiogeno (TRALI) NON IMMUNOLOGICHE contaminazione batterica sovraccarico circolatorio emolisi fisica/chimica danni da conservazione EDEMA POLMONARE NON CARDIOGENO transfusion related acute lung injury (TRALI) Grave sindrome respiratoria, caratterizzata dal classico quadro radiologico e sintomatologico senza insufficienza cardiaca, che interviene durante o entro 6 ore dal termine della trasfusione con una frequenza variabile 1:5000 1:190000 eventi trasfusionali (le forme lievi frequentemente non vengono diagnosticate) E’ causato da una reazione tra leucoagglutinine del donatore e leucociti del ricevente con formazione di aggregati leucocitari che, intrappolati nel microcircolo polmonare, ne alterano la permeabilità vasale REAZIONI TRASFUSIONALI RITARDATE IMMUNOLOGICHE emolitiche ritardate alloimmunizzazione leucociti piastrine porpora post-trasfusionale da HPA1-a NON IMMUNOLOGICHE emosiderosi indotta dalle trasfusioni trasmissione malattie infettive (virali) REAZIONI IMMUNOLOGICHE EMOLITICHE RITARDATE SINTOMI febbre, ittero, ANEMIA inattesa (7-10gg dopo l’infusione) puo’ essere necessaria un’altra trasfusione talvolta asintomatiche EZIOLOGIA anticorpi IgG risposta anamnestica • Rh,Kell,Duffy, Kidd, MNS anticorpi siero - eluato Complicanze infettive • virali: epatite B, C HIV1-2 Mononucleosi infettiva CMV HTLV 1 -2 Parvovirus •batteriche endogene (dal sangue del donatore) treponema,brucella,rickettsia,yersinia,campylobacter,staph.aureus, strept.viridans esogene (dalla cutedel donatore o dall’ambiente) staph.epidermidis,micrococcus,sarcina,pseudomonas,flavobacterium bacillus •parassiti •malaria,tripanosoma,toxoplasma,babesia,leishmania • La disponibilità di sangue è limitata • da ciò deriva la necessità di stabilire i criteri per un uso congruo di tale risorsa Pazienti di competenza chirurgica Abitualmente viene richiesta una quantità di sangue eccedente le reali necessità, con conseguente sequestro delle unità non utilizzate da parte dei reparti per almeno due o tre giorni e conseguente invecchiamento del sangue stesso e quindi a rischio di scadenza. La soluzione a questo problema è l’assegnazione “a disposizione” e la prova rapida di compatibilità. Pazienti di competenza medica Ai pazienti di competenza medica è raccomandata la seguente strategia: 1. Tipizzazione eritrocitaria per il maggior numero di antigeni prima di iniziare le trasfusioni. 2. Prova di compatibilità per ogni unità assegnata. 3. Ricerca di anticorpi irregolari. 4. Controllo autologo. Donne in gravidanza Devono essere sottoposte alle seguenti indagini: 1. Tipizzazione eritrocitaria. 2. Ricerca di allo-anticorpi irregolari. 3. Nel caso di compatibilità A B 0 eventualmente cross-match con le emazie del marito. Donatori di sangue La ricerca di anticorpi irregolari si esegue per i seguenti motivi. Evidenziare la presenza di anticorpi. Nel caso in cui sangue di gruppo 0 venga impiegato per un ricevente di altro gruppo. GLI EMOCOMPONENTI Gli emocomponenti sono i prodotti della separazione degli elementi costituitivi del sangue e vengono ottenuti sia da una donazione tradizionale di sangue intero sia da una donazione mediante aferesi con separatore cellulare. Gli emocomponenti si distinguono in due grandi categorie: USO TRASFUSIONALE USO TOPICO Emocomponenti: Classificazione Per uso Trasfusionale Concentrati eritrocitari convenzionali o modificati Concentrati piastrinici convenzionali o modificati Plasma fresco congelato Concentrati leucocitari Concentrati di c. staminali da sangue periferico Emocomponenti Sangue placentare Per uso Topico Colla di fibrina Gel piastrinico Emocomponenti: Uso più frequente Preparazione di C.E. ; P.F.C. ; C.P. (da Buffycoat) Partendo da una donazione di 450 ml di sangue intero in sacca quadrupla Prima centrifugazione (a.T.A.) Parte superiore della sacca Strato intermedio tra il plasma e i globuli rossi Parte inferiore della sacca Alta velocità Emocomponenti Caratteristiche Plasma povero di piastrine 200 200--250 ml di plasma (contiene la maggior parte del plasma da congelare.) Buffy - coat Globuli Rossi 50 ml Contenenti: 10% di globuli rossi 70% di leucociti 80% delle piastrine 160 160--180 ml di globuli rossi + 100 ml di S.A.G.M (contengono circa il 30 30% % di leucociti) Seconda Centrifugazione (a.T.A.) Emocomponenti Parte superiore della sacca Bassa velocità Caratteristiche Concentrato Piastrinico Da BuffyBuffy-coat 1) Da singolo B.C. 1) 50 ml contenenti: 50 50--60 x 109 piastrine 2) Da pool di 44-6 B.C. B.C 2) 350350-400 ml contenenti: 280 280--360 x 109 piastrine Parte inferiore della sacca B.C. povero di piastrine Contiene circa il 10 10% % di globuli rossi e il 70 70% % di leucociti donati CONCENTRATI ERITROCITARI E PIASTRINICI MODIFICATI C. Eritrocitari leucodepleti C. Eritrocitari lavati Concentrati Eritrocitari Modificati C. Eritrocitari irradiati C. Eritrocitari congelati C. Eritrocitari per uso pediatrico C. Eritrocitari “universali” C. Piastrinici leucodepleti Concentrati Piastrinici Modificati C. Piastrinici lavati C. Piastrinici irradiati C. Piastrinici congelati Quando si trasfonde ? • Emazie • Piastrine •Plasma Chemioterapia Trapianto Anemia Aplastica Mielodisplasie Insufficienza midollare Chemioterapia Trapianto Anemia Aplastica Mielodisplasie Insufficienza midollare CID Trombocitopatie CID HUS-TTP sovradosaggio di: anticoagulanti orali agenti trombolitici In caso di emorragia acuta ….. La trasfusione di emazie dovrebbe in teoria essere effettuata tanto rapidamente quanto è necessario per correggere il deficit di trasporto di ossigeno nella emorragia acuta una unità di emazie aumenterà il livello di emoglobina di 1 g/dl in una persona di 70 chilogrammi (3-4 ml/kg di emazie concentrate). TRASFUSIONE DI GLOBULI ROSSI NELL’ANEMIA CRONICA L’obiettivo della trasfusione di globuli rossi in questi pazienti è di ridurre gli effetti deleteri dell’anemia portando il tasso di emoglobina o l’ematocrito al di sopra del livello stabilito. Sintomi dell’anemia insorgono di solito quando il tasso di emoglobina scende al di sotto di 4.5-5 g/dL. I sintomi includono tachicardia, dispnea/tachipnea, sensazione di “testa vuota”, sincope, astenia od intolleranza allo sforzo muscolare, angina, cefalea, claudicatio ed affaticamento. I sintomi possono esordire precocemente (ad esempio con tasso di emoglobina di 7 g/dL) in pazienti con età avanzata e/o con ridotta funzionalità cardiorespiratoria. Pazienti con tasso di emoglobina superiore ad 8 g/dL raramente richiedono trasfusione di globuli rossi. Indicazioni per la trasfusione di un concentrato eritrocitario Indicato per incrementare l’apporto di ossigeno ai tessuti : Hb < 8g/dl o Ht < 24% Hb < 9 g/dl in pazienti in programma per intervento Hb < 10 g/dl in paziente sintomatico per anemia in cardiopatia e/o pneumopatia Neonati con Hb <13g/dl ed exsanguinotrasfusione. Non sono indicati: per espandere il volume ematico in caso di carenza marziale e/o vitaminica in condizioni cliniche stabili Note di buona pratica clinica Per valutare l’efficacia della trasfusione occorre valutare le modificazioni dei parametri ematologici e riportarli nella cartella clinica La quantità di CE da trasfondere può essere calcolata con la seguente formula : Corrected Count Increment Q. tà sangue da trasfondere = 251 x peso Pz. in Kg x l’incremento di Hb desiderato/Ht medio unità da trasfondere Emazie congelate •Congelate entro 7 giorni dal prelievo Metodica ad “alto glicerolo”conservate da –60°C a -80°C Metodica a “basso glicerolo” conservate in vapori di azoto liquido a temperatura compresa tra -140°C e -150°C Possono essere conservate per 10 anni Scongelate, lavate e ricostituite, sospese in una soluzione fisiologica. Conservate tra +2 e +6 °C per non più di 24 ore CQ: Ht compreso tra 0,65 e 0,75% Hb >36g/unità 9 Leucociti < 1x10 Concentrati piastrinici Indicati: Per il trattamento e profilassi delle emorragie dovute a carenza qualitativa o quantitativa delle piastrine Per i pazienti medici stabili e senza complicazioni il valore soglia è 10.000/ µL Terapia dell’emorragia nei pazienti medici con piastrine 20.000/µL Per i pazienti chirurgici il valore soglia è 50.000/ µL Se il conteggio è compreso tra 50.000 e 100.000/ µL la trasfusione di piastrine è indicata solo in condizioni particolari (procedure a cielo coperto, neurochirurgia, campi operatori altamente vascolarizzati). CQ: Contenuto in piastrine = 45-85 x 109 Plasma = 50-60 ml. Leucociti < 1x109 Eritrociti<1x109 Ph tra 6,4-7,4 Consevate tra 20°°-24°°C in continua agitazione per 5gg Non indicati: •Nelle piastrinopenie da eccessiva distruzione (porpora trombocitopenica idiopatica, porpora trombotica trombocitopenica, sindrome uremicaemolitica, coagulazione intravascolare disseminata) nella circolazione extracorporea e nella trasfusione massiva a scopo profilattico come profilassi se il conteggio è >10.000/microlitro e il paziente è in condizioni stabili Trasfusione di Piastrine Valutazione clinica della risposta alla trasfusione piastrinica Viene effettuata tramite la formula del corretto incremento (Correct Count Increment) CCI = incremento della conta piastrinica (migliaia/µL) x superficie corporea in mq /numero di piastrine trasfuse (x 1011) La trasfusione viene considerata: efficace CCI >7500 parzialmente efficace CCI 5000-7500 inefficace CCI <5000 Plasma per uso clinico •Prodotto da sangue intero o da aferesi di donatori periodici e volontari Congelato entro 6 ore dalla donazione Congelato in maniera uniforme, entro 1 ora Conservato per 24 mesi se stoccato a - 40°C Scongelato in bagno con continua agitazione a temperatura tra + 30° e + 37°C Utilizzato nel più breve tempo possibile, non oltre 24 ore se conservato tra 2°- 6°C CQ: Deve contenere almeno il 70% del contenuto originale di Fattore VIII Proteine totali > 50 g/L Assenza di anticorpi irregolari clinicamente significativi 9 Emazie residuo < 6 x10 9 Leucociti residuo <0,1x10 9 Piastrine residuo < 50x10 Assenza di precipitati visibili Sterilità Pretransfusion INR Predicts the Effect of FFP Change in INR/unit FFP 0.9 0.6 0.3 0.1 (0.0) 0 (0.0) (0.0) -0.3 (0.1) (0.1) (0.4) -0.6 -0.9 1.1 1.2 1.3 1.4 1.5 Pre-transfusion INR 1.6 >1.6 Crioprecipitato •Costituito dalla frazione crioglobulinica del plasma fresco Scongelato lentamente a 2°- 6°C per 12 ore e concentrato ( per centrifugazione o sifonamento) in un volume finale di 10-20 ml Contiene fatt.VIII,fatt. di Von Willebrand, fibrinogeno, fatt.XIII e fibronectina CQ : Fatt.VIII ≥ 70% del contenuto di partenza Indicazioni alla raccolta di sangue autologo. Tipo intervento Predeposito Recupero Interventi di chirurgia vascolare maggiore Si Si Interventi a cuore aperto Si Si Protesi totale d’anca Si Si Protesi totale di ginocchio Si No Interventi correttivi per scoliosi Si Si Prostatectomia radicale Si Si Placenta previa Si No Gravidanza plurima Si No Trapianto di fegato Si Si Emocomponenti per uso non trasfusionale Gel di piastrine azione di stimolo sulla rigenerazione tessutale derivato dall’associazione del concentrato piastrinico ( fonte di fattori di crescita) con il crioprecipitato ( fonte di fibrinogeno, fibronectina e altri fattori procoagulanti) Colla di fibrina azione adesiva ed emostatica derivato da plasma (ricco fibrinogeno, fibronectina ed altre proteine plasmatiche con scarsa presenza di piastrine) Per essere utilizzati clinicamente devono essere attivati, utilizzando cloruro di calcio ( o gluconato di calcio) e trombina autologa o batroxobina Piastrine e plasma rappresentano una fonte autologa o omologa di fattori di crescita e proteine procoagulanti, clinicamente impiegabili (PRP) L’AFERESI SEPARATORE A FLUSSO DISCONTINUO SEPARATORE A FLUSSO CONTINUO L’AFERESI Densità g/cm3 Diametro Volume µm3 Plasma 1.026 Piastrine 1.058 2.5 16 Monociti 1.062 10.4 740 Linfociti 1.070 6.5 230 Neutrofili 1.082 8.0 270 Eritrociti 1.096 5.5 87 L’AFERESI AFERESI PRODUTTIVA SINGLE COMPONENT PLT PFC MULTI COMPONENT GR - PLT PFC - PLT DOPPIA PLT GR - PFC DOPPIA GR CELLULE STAMINALI DA SANGUE PERIFERICO Vengono raccolti da donatore mediante leucoaferesi dopo mobilizzazione nel torrente circolatorio con fattori di crescita GM-CSF. Per ottenere un numero adeguato di cellule CD 34 è necessario procedere afereticamente da 3 a 4 volte il volume ematico (200 ml/kg di peso). Le cellule staminali da sangue periferico P.B.S.C. (Peripheral Blood Stem Cell) vengono sospesi in una soluzione contenente un crioprotettore (DMSO (DMSO) ) e proteine (plasma (plasma--albumina albumina) ) congelati e conservati a -180 °C in fase gassosa di azoto. Devono essere trasfuse scongelamento a 37 °C. subito dopo SANGUE PLACENTARE Contiene i progenitori emopoietici indispensabili ai fini del trapianto di midollo osseo sia autologo che allogenico ed è in grado di determinare un completo ripopolamento cellulare. Prelevato subito dopo la resezione del cordone ombelicale viene congelato nel più breve tempo possibile (in DMSO 10%). Viene conservato in azoto liquido a -140 °C fino a 15 anni . Volume sacca ≈: 60 ml; cellularità totali: >800*106; determinazioni in citofluorimetria delle cellule CD34 Tipizzazione HLA. Tale volume però non consente nell’ adulto di somministrare la dose minima cellulare raccomandato (20 (20 milioni di cellule nucleate/kg di peso c o r p o r e o). Per ovviare a questi inconvenienti sono possibili programmi di espansione cellulare con aumenti in due settimane di circa 100 volte il numero di cellule staminali.
Scaricare