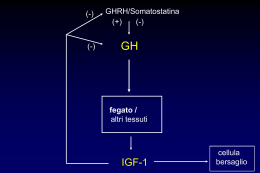
IPOFISI • L’adenoipofisi deriva da una estroflessione della cavità orale detta “tasca di Ratke” • Cresce posteriormente e si colloca nella sella turcica perdendo le connessioni con la cavità orale intorno alla 11ma settimana IPOFISI • Due porzioni funzionalmente distinte – Adenoipofisi – Neuroipofisi IPOFISI • La persistenza della connessione attraverso il dotto craniofaringeo dà origine ad un tumore benigno: il craniofaringioma. IPOFISI • La neuroipofisi deriva da un diverticolo del pavimento del terzo ventricolo; migra verso la sella e si connette con l’adenoipofisi primitiva verso l’ottava settimana di gestazione. IPOFISI • Classificazione delle cellule dell’adenoipofisi basata sull’ematossilinaeosina: – acidofile (rosse) – basofile (blue) – cromofobe (non colorate) Cellule dell’adenoipofisi • • • • Tipo cellulare: somatotropo Ormone: Ormone della crescita (GH) Colorazione: acidofila Localizzazione: soprattutto nelle porzioni laterali dell’adenoipofisi. Copre circa il 50% della popolazione Meccanismo di stimoli sul GH sonno esercizio stress iperaminoacidemia e ipoglicemia postprandiale ACTH ADH clonidina propranololo 5HT dopaminergici encefaline + GHRH SRIF + iperglicemia postprandiale acidi grassi elevati somatostatina somatomedina C progesterone glucocorticoidi fentolamina isoproterenolo HGH Meccanismo d’azione del GH • effetti acuti insulinosimili – positivizzazione del bilancio azotato – riduzione della massa adiposa – riduzione dell’utilizzazione dei glucidi • effetti ritardati – – – – lipolisi dei trigliceridi aumentata sensibilità alle catecolamine inibizione captazione ed utilizzazione del glucosio stimolazione secrezione di insulina • azioni in gran parte mediata dalle somatomedine Effetti metabolici del GH • azioni sul metabolismo proteico: + trasporto aminoacidi nelle cellule + sintesi proteica - catabolismo proteico • azioni sul metabolismo lipidico: + mobilizzazione dal tessuto adiposo + acidi grassi liberi plasmatici + ossidazione acidi grassi • Azioni sul metabolismo glucidico: - glicolisi + glicogenosintesi + glicemia Somatomedine • somatomedina C (IGF 1) – PM 7500 – simile alla proinsulina – recettori specifici IGF 1 e recettori insulinici – azione: crescita cellulare – stretta dipendenza dal GH • IGF 2 – recettori spcifici IGF 2 – azione: crescita cellulare – dipendenza dal GH, da chiarire • somatomedina A – proteina neutra, simile alla somatomedina C • somatomedina B – identica all’epidermal growth factor (EGF) Meccanismi d’azione dei fattori di crescita • Il GH e le somatomedine agiscono attivando cascate di protein chinasi • Il GH attiva un recettore associato a JAK-STAT, che attiva la trascrizione genica • Le somatomedine attivano un recettore-tirosin chinasi, che attiva la cascata di fosforilazione MAP • Tra le proteine fosforilate dalla cascata MAP ci sono anche fattori di regolazione della trascrizione nucleare come c-Jun • Ifattori nucleari attivati dal GH e dalle somatomedine possono interagire con i recettori tiroidei Accrescimento osseo Durante lo sviluppo, le ossa lunghe si allungano nelle regioni cartilaginee poste in prossimità delle epifisi. Terminato lo sviluppo queste zone di accrescimento scompaiono e l’osso si salda in un corpo unico Acromegalia •L’acromegalia è una condizione clinica che risulta da un prolungato eccesso di GH circolante nell’adulto dopo la saldatura delle cartilagini di coniugazione •1886 Pierre Marie descrive per la prima volta l’ipertrofia delle estremità incluse faccia mani e piedi •1891 Minkoski nota che tale ipertrofia è associata ad allargamento dell’ipofisi •1909 Cushing nomina Iperpituitarismo tale condizione •1922 Evans dimostra che l’iniezione di estratto di ghiandola ipofisaria anteriore provoca gigantisno nel ratto non adulto e sindrome acromegaly-lyke nel cane adulto Epidemiologia •Prevalenza circa 50 casi per milione •Incidenza annua 3-4 casi per milione •Uguale frequenza nei due sessi •Colpisce maggiormente intorno alla 3°-4° decade di vita Eziopatogenesi •99% dei casi l’eccesso di GH è dovuto ad un Adenoma ipofisario che nel 70% è un Macroadenoma e nel 30% è un Microadenoma •Casi rari <1% dovuti a ipertrofia delle cellule somatotrope mediata dal GHRH prodotto in eccesso dall’ipotalamo (gangliocitomi o amartomi) •Secrezione extraipofisaria di GH è stata documentata in un solo caso Manifestazioni cliniche •L’acromegalia è una patologia a lenta progressione quindi spesso la diagnosi è tardiva quando le complicanze sono già presenti •L’ipersecrezione di GH esercita i suoi effetti con azione diretta sul metabolismo ma soprattutto attraverso l’aumentata sintesi epatica di IGF-1 che è responsabile delle alterazioni ossee cartilaginee e viscerali Manifestazioni cliniche Le manifestazioni più precoci sono: • Ipertrofia dei tessuti molli • Accrescimento delle parti acrali (mani, piedi naso e mandibola) • Cambiamento dei caratteri fisiognomici: “Facies Acromegalia” caratterizzata da 1. Prognatismo 2. Diastasi dentaria e malocclusione 3. Sporgenza delle bozze frontali 4. Deformazione piramide nasale Manifestazioni cliniche •La cute è spessa seborroica e sudata con accentazione delle pieghe cutanee •L’ipertrofia della laringe e l’ampliamento dei seni nasali porta all’abbassamento del timbro della voce •Astenia e debolezza •Iperidrosi •L’ipertrofia osteocartilaginea può condurre ad artrite degenerativa cifoscoliosi a volte stenosi spinale •Sindrome del tunnel carpale Manifestazioni cliniche Visceromegalia: •Oligo-amenorrea (72%) •Mal di testa (55%) •Impotenza (36%) •Ghiandole salivari •Fegato (epatomegalia) •Milza (splenomegalia) •Reni •Tiroide (gozzo) •Lingua (macroglossia) Manifestazioni cliniche Compressivi locali: •Cefalea •Emianopsia temporale •Idrocefalo (raro) •Rinorrea del liquor •Epilessia temporale Complicanze e prognosi L’acromegalia si associa ad aumentata mortalità e morbilità con una diminuzione dell’aspettativa di vita (in media <10 anni) Complicanze respiratorie •50% dei pazienti presentano ostruzione delle vie aeree superiori •Sleep-apnea è una delle complicanze più serie, si presenta in circa il 70% dei pz. Complicanze e prognosi Complicanze neoplastiche È noto che GH ed IGF-1 sono potenti stimoli alla proliferazione di cellule sia sane che neoplastiche e possono agire come fattori permissivi per l’azione di altri fattori di crescita •Studi sono condotti per valutare il ruolo del GH e dell’IGF-1 nella patogenesi di neoplasie soprattutto di mammella colon apparato linfoematopoietico •Il 50% degli acromegalici sviluppa poliposi del colon Complicanze e prognosi Complicanze metaboliche •Insulino resistenza 80% dei pz •Alterato metabolismo glucidco 20-40% dei pz •Diabete mellito tipo 2 13-25%dei pz Diabete ipofisario • Un eccesso di GH provoca chetosi e iperglicemia, (diabete ipofisario) similmente al diabete pancreatico. • nel diabete ipofisario, il glucosio entra nelle cellule ma non viene utilizzato. • Un prolungato stato di iperglicemia può esaurire le cellule produttrici di insulina del pancreas, e provocare diabete pancreatico secondario. Complicanze e prognosi Complicanze cardiovascolari e ipertensione arteriosa •Più importante causa di morte in questi pz •Ipertrofia concentrica con fibrosi interstiziale •Alterazioni elettrocardiografiche di ipertrofia ventricolare sinistra •Aritmie •Ispessimento parete arteriosa •Prevalenza di ipertensione 13-60% dei pz Diagnosi La diagnosi di acromegalia si basa su: •Segni e sintomi clinici •Elevati livelli plasmatici di GH ed IGF-1 •Alterata risposta del GH e dell’IGF-1 ai test dinamici •Alterazione del ritmo circadiano del GH •Radiologica (TAC/RMN) Diagnosi Alterazione del normale ritmo circadiano del GH: Ritmo del GH Nell’acromegalia si ha una maggior frequenza di picchi secretori e assenza del picco secretorio notturno Diagnosi Alterazione dei Test dinamici: Test OGTT 8 7 Test OGTT: Nei soggetti normali l’iperglicemia determina una riduzione dei livelli di GH mentre negli acromegalici non si registra questo effetto inibitorio I tumori GH-secernenti rispondono a stimoli che non hanno nessun effetto nei soggetti normali “RISPOSTA PARADOSSA”: Test al TRH al GnRH-test 6 Valori di Glicemia 5 Normale 4 Acromegalia 3 2 1 0 1 Tem pi Allo stimolo con GHRH il GH può rimanere invariato o mostrare una risposta eccessiva rispetto al normale Diagnosi Dopo che i test di laboratorio hanno confermato il sospetto clinico di acromegalia è necessaria una valutazione radiologica del cranio: •RMN Ipofisi: 1) per valutare se si tratta di un Macroadenoma o un microadenoma o un’iperplasia 2) per valutare l’eventuale presenza di complicanze delle strutture adiacenti per una scelta terapeutica •RX cranio: Terapia Ci sono tre terapeutici: possibili 1.Terapia chirurgia 2.Terapia medica 3.Terapia radiante approcci 1.Terapia chirurgica L’adenectomia per via transfenoidale rappresenta l’intervento di prima scelta La percentuale di successo varia in base all’esperienza del chirurgo con indici di guarigione dell’80% per i microadenomi e del 50% per i macroadenomi Vantaggi: •Decompressione delle strutture adiacenti Complicanze •Ipopituitarismo post-chirurgico 2.Terapia medica Dopamino-Agonisti: Cabergolina e Bromocriptina Usati soprattutto nei pz con tumori a secrezione mista GH/PRL Abbassano i livelli di GH nel 20% e dell’IGF-1 nell’8% Analoghi della somatostatina: Octreotide Lanreotide Si somministrano sottocute. Oggi esistono dei preparati LAR che possono essere somministrati 1 volta/28 giorni Antagonisti del recettore del GH: Pegvisomant 3.Terapia radiante Si può ricorrere alla terapia radiante nei pz che hanno una persistente ipersecrezione postoperatoria o presentino controindicazioni all’intervento chirurgico Il tempo che intercorre tra l’irradiazione e la risposta clinica è lungo (anni) quindi va associata una terapia medica Effetti collaterali e complicanze: Locali (1-2%) Ipopituitarismo (50%) •Lesione dei nervi ottici dopo 10 anni dal •Paralisi dei nervi cranici trattamento •Necrosi tissutale •Disturbi della memoria •Letargia Nuove metodiche: Radiochirurgia (gamma knife) Cellule dell’adenoipofisi • • • • Tipo cellulare: Lattotropo Ormone: Prolattina Colorazione: Acidofila o cromofoba Localizzazione: Sparse, specie regione posterolaterale; circa il 15% IPOTALAMO PRF (+) DOPAMINA (-) ? TRH ? VIP ? IPOFISI Prolattina Mammella Cellule galattotrope Eziopatogenesi Cause di iperprolattinemia: 1. Deficit di controllo inibitorio dell’ipotalamo mediante secrezione di Dopamina (adenoma non-secernente) 2. Difetto dei meccanismi della Dopamina di trasporto 3. Resistenza recettoriale alla Dopamina 4. Adenoma Prolattino-secernente (causa più frequente) 5. Da farmaci (es. antidepressivi) Manifestazioni cliniche • Femmine: – Galattorrea (3080%) – Amenorrea – Infertilità – Diminuzione libido • Maschi: – Impotenza – Diminuzione libido – Galattorrea (<30%) Manifestazioni cliniche Compressivi locali: •Cefalea •Emianopsia temporale •Idrocefalo (raro) •Rinorrea del liquor •Epilessia temporale Diagnosi La diagnosi di iperprolattinemia si basa su: •Segni e manifestazioni cliniche •Test dinamici •Dosaggio sierico della PRL basale •Dosaggio della curva della PRL •RMN encefalo/ipofisi •Campo visivo Terapia Terapia chirurgica: Adenectomia transfenoidale Terapia medica: Dopamino-Agonisti: Bromocriptina Cabergolina: hanno un effetto positivo sia sui livelli ematici di PRL sia sulle dimensioni del tumore essendo per questo talvota utilizzati come trattamento pre-chirurgico
Scaricare