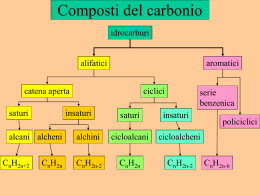
Dal carbonio agli idrocarburi 1. I composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani 3. L’isomeria 4. La nomenclatura degli idrocarburi saturi Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 Dal carbonio agli idrocarburi 5. Proprietà fisiche e chimiche degli idrocarburi saturi 6. Gli idrocarburi insaturi: alcheni e alchini 7. Gli idrocarburi aromatici Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 1. I composti organici Per composto organico si intende un qualsiasi composto del carbonio. Salvo I carbonati, il diossido di Carbonio che appartengono alla chimica inorganica. 1. I composti organici I composti organici contengono soprattutto atomi di carbonio, idrogeno, ossigeno e azoto; altri elementi presenti in tracce sono zolfo, magnesio e fosforo. A volte anche alogeni. 1. I composti organici I composti organici possono formare lunghe catene grazie alla capacità del carbonio di dare luogo a quattro legami. A seconda che le coppie di elettroni condivisi siano una, due o tre, si possono formare: 2. Gli idrocarburi saturi: alcani e cicloalcani Gli idrocarburi sono composti binari formati soltanto da atomi di carbonio e idrogeno. 2. Gli idrocarburi saturi: alcani e cicloalcani Gli idrocarburi vengono classificati, secondo la nomenclatura tradizionale, in • alifatici quando sono costituiti da catene lineari o ramificate; • aromatici quando presentano una particolare struttura ciclica. Come nel caso del benzene (vedi diapositive successive) 2. Gli idrocarburi saturi: alcani e cicloalcani Gli idrocarburi saturi sono costituiti da catene di atomi di carbonio uniti soltanto da un legame semplice. 2. Gli idrocarburi saturi: alcani e cicloalcani Il metano (CH4) è l’esemplificazione dell’ibridazione sp3 degli atomi di carbonio degli idrocarburi saturi; la molecola di metano presenta quindi geometria tetraedrica con angoli di legame di 109,5°. 2. Gli idrocarburi saturi: alcani e cicloalcani Una serie omologa è una serie di composti in cui ciascun termine differisce dal successivo di un’unità costante. Per gli idrocarburi, l’unità è il gruppo —CH2—. 2. Gli idrocarburi saturi: alcani e cicloalcani Gli alcani sono idrocarburi alifatici con formula bruta CnH2n+2. La forma di rappresentazione più semplice utilizza le formule condensate. Es. 2. Gli idrocarburi saturi: alcani e cicloalcani A ciascuna delle posiibili formule che può assumere una molecola, a causa della rotazione intorno al legame semplice C—C, si attribuisce il nome di conforme. I cosiddetti conformeri. (vedi scheda a parte sull’isomeria) 2. Gli idrocarburi saturi: alcani e cicloalcani I cicloalcani sono idrocarburi alifatici che, a partire dal propano, possono chiudere la catena di atomi di carbonio con la perdita di due atomi di idrogeno. La formula generale dei cicloalcani è CnH2n. 2. Gli idrocarburi saturi: alcani e cicloalcani Il cicloalcano più interessante dal punto di vista biologico è il cicloesano, che presenta due strutture possibili: a sedia (più stabile) e a barca (meno stabile). 3. L’isomeria Si dicono isomeri i composti che hanno medesima formula bruta, ma che differiscono per • il modo in cui gli atomi si legano tra loro (isomeri di struttura); • la disposizione spaziale (stereoisomeri). 3. L’isomeria All’aumentare del numero di atomi di carbonio, aumenta il numero dei possibili isomeri. 3. L’isomeria L’isomeria di posizione si ha quando una molecola presenta atomi diversi oltre a quelli di carbonio e idrogeno; questi atomi si possono legare in punti diversi della catena carboniosa 3. L’isomeria La stereoisomeria è riferita alla diversa orientazione degli atomi nello spazio. L’isomeria geometrica è connessa alla presenza di doppi legami nella molecola. Es. Isomeri cis o trans 3. L’isomeria Si dicono chirali tutti gli oggetti distinguibili dalla loro immagine speculare, ovvero non sovrapponibili a essa. Le tue mani sono un esempio di oggetti chirali. 3. L’isomeria L’atomo di carbonio tetraedrico è un centro chirale o stereocentro e forma due isomeri ottici detti enantiomeri. 3. L’isomeria Gli enantiomeri hanno identiche proprietà chimiche e fisiche, e differiscono solo per l’attività ottica. Ma in biologia un enantiomero può essere attivo e il suo “gemello” on esserlo. Gli enantiomeri infatti fanno ruotare dello stesso angolo, ma in direzione opposta, il piano della luce polarizzata (sono cioè antipodi ottici). 3. L’isomeria Il miscuglio al 50% di due enantiomeri è chiamato racemo e non è otticamente attivo. 4. La nomenclatura degli idrocarburi saturi La nomenclatura degli Atomi di carbonio prefisso 1 met- -ano. 2 et- I primi quattro termini 3 prop- 4 but- 5 pent- 6 es- alcani prevede la desinenza presentano nomi particolari poi, a partire, dalla catena a 5 atomi di carbonio, il prefisso è numerico. 4. La nomenclatura degli idrocarburi saturi Alle catene idrocarburiche lineari si antepone n- al nome della catena. 4. La nomenclatura degli idrocarburi saturi I carboni di una catena si identificano in primari, secondari, terziari o quaternari a seconda che siano legati rispettivamente a uno, due, tre o quattro atomi di carbonio. 4. La nomenclatura degli idrocarburi saturi Nelle catene ramificate si numerano gli atomi di carbonio in modo che i radicali sostituiti abbiano il numero più piccolo possibile. 5. Proprietà fisiche e chimiche degli idrocarburi saturi I composti appartenenti alla stessa serie omologa presentano • proprietà chimiche simili; • proprietà fisiche differenti dipendenti dal peso molecolare e dalla forma della molecola. 5. Proprietà fisiche e chimiche degli idrocarburi saturi Il punto di ebollizione aumenta all’aumentare della massa molecolare. Le catene lineari hanno punti di ebollizione superiori a quelli delle catene ramificate. 5. Proprietà fisiche e chimiche degli idrocarburi saturi I punti di fusione sono superiori per le catene ramificate rispetto a quelle lineari. 5. Proprietà fisiche e chimiche degli idrocarburi saturi Alcani e cicloalcani sono composti apolari e fungono da solventi per le sostanze apolari, come per esempio i grassi. Alcani e cicloalcani sono insolubili in acqua perché non riescono a formare legami a idrogeno né legami dipolodipolo. 5. Proprietà fisiche e chimiche degli idrocarburi saturi Alcani e cicloalcani non sono particolarmente reattivi; tuttavia, in specifiche condizioni, vengono usati come combustibili perché danno reazioni di combustione con l’ossigeno. La maggior parte dei combustibili usati sono idrocarburi saturi, come metano, etano, propano, butano e poi anche benzene (ottani), cherosene e gasolio con più di 12 atomi di C. 5. Proprietà fisiche e chimiche degli idrocarburi saturi Alcani e cicloalcani in opportune condizioni reagiscono con gli alogeni, dando luogo a reazioni di alogenazione in cui uno o più idrogeni sono sostituiti da alogeni. 6. Gli idrocarburi insaturi:alcheni e alchini Gli alcheni sono idrocarburi che presentano almeno un doppio legame nella molecola, ibridazione sp2, geometria planare e angoli di legame di 120°. Gli alchini sono idrocarburi con almeno un triplo legame nella molecola, ibridazione sp, geometria lineare e angoli di legame di 180°. 6. Gli idrocarburi insaturi:alcheni e alchini 6. Gli idrocarburi insaturi:alcheni e alchini La formula generale degli alcheni è CnH2n La formula generale degli alchini è CnH2n-2 6. Gli idrocarburi insaturi:alcheni e alchini La nomenclatura degli alcheni è simile a quella degli alcani, con il suffisso –ene. La nomenclatura degli alchini segue quella degli alcani, con il suffisso –ino. 6. Gli idrocarburi insaturi:alcheni e alchini Se due gruppi diversi si trovano dalla stessa parte del piano rispetto al doppio legame, l’isomero si dice cis; se i due gruppi si trovano da parti opposte l’isomero si dice trans. 6. Gli idrocarburi insaturi:alcheni e alchini Gli isomeri cis-trans sono stereoisomeri. 7. Gli idrocarburi aromatici Il capostipite degli idrocarburi aromatici è il benzene, C6H6. Molto diverso dal Cicloesano visto sopra In quanto il cicloesano ha due atomi di H per ogni carbonio, qui invece solamente uno. 7. Gli idrocarburi aromatici Il benzene viene rappresentato come ibrido di risonanza di due forme limite che differiscono per la posizione dei doppi legami. 7. Gli idrocarburi aromatici La nomenclatura dei composti aromatici usa nomi tradizionali. 7. Gli idrocarburi aromatici Nei composti aromatici bisostituiti si formano isomeri che prendono i prefissi • orto- se sono legati a carboni adiacenti; • meta- se legati ai carboni 1 e 3; • para- se sono legati a carboni opposti. 7. Gli idrocarburi aromatici
Scaricare