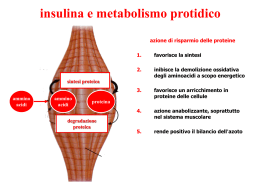
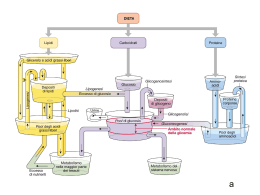
Integrazione del metabolismo Gli effetti metabolici dell’insulina e del glucagone Aspetti generali: il fegato, il tessuto adiposo, il muscolo e l’encefalo sono i quattro tessuti che svolgono un ruolo dominante nel metabolismo energetico perché contengono un corredo di enzimi particolare che permette loro di specializzarsi nell’accumulo, nell’utilizzo e nella produzione di specifiche sostanze combustibili. Questi tessuti sono collegati l’un l’altro attraverso un sistema di comunicazione che dipende dal sistema nervoso, dalla disponibilità di sostanze nel circolo sanguigno e dalla variazione del livello degli ormoni plasmatici. L’integrazione del metabolismo è controllata principalmente da insulina e glucagone e supportata dalle catecolamine, adrenalina e noradrenalina. Il livello circolante di tali ormoni permette all’organismo di accumulare energia e di utilizzare l’energia accumulata a seconda delle condizioni metaboliche. Insulina Ormone polipeptidico prodotto dalle cellule β degli isolotti di Langerhans (1-2% del parenchima pancreatico) del pancreas. E’ l’ormone più importante nel coordinamento dell’utilizzo delle sostanze nutrienti da parte dei tessuti. Ha effetti metabolici di tipo anabolico che favoriscono in particolare la sintesi del glicogeno, dei triacilgliceroli e delle proteine. Struttura dell’insulina Sintesi dell’insulina Peptide C: è indispensabile per il corretto ripiegamento della proinsulina e poiché la sua emivita plasmatica è più lunga è un buon indicatore della produzione e della secrezione dell’insulina nella diagnosi di diabete giovanile. L’insulina è conservata in granuli citoplasmatici che si liberano per esocitosi se stimolati. E’ degradata dalla insulinasi (fegato e reni). La breve emivita plasmatica (6 minuti ca.) permette la rapida variazione della concentrazione dell’ormone in circolo. Regolazione della secrezione dell’insulina La stimolazione della secrezione dell’insulina. La sintesi e la secrezione dell’insulina sono stimolate da: a) il glucosio (glucochinasi delle cellule β) b)gli amminoacidi (arginina) c)gli ormoni gastrointestinali (secretina) che provocano un aumento anticipato del livello dell’insulina nella vena porta, prima che si verifichi un effettivo aumento del livello ematico di glucosio. L’inibizione della secrezione dell’insulina La sintesi e la secrezione dell’insulina diminuiscono quando le sostanze nutrienti della dieta scarseggiano e nei periodi di stress (febbre o infezione). Questi effetti sono mediati principalmente dall’adrenalina secreta dalla midolla surrenale in risposta allo stress, a un trauma o a un esercizio fisico molto intenso. In tali condizioni la liberazione dell’adrenalina è controllata soprattutto dal sistema nervoso. Questo ormone ha un effetto diretto sul metabolismo energetico e provoca una rapida mobilizzazione delle riserve energetiche, tra cui il glucosio presente nel fegato (prodotto per glicogenolisi o per gluconeogenesi) e gli acidi grassi del tessuto adiposo. L’adrenalina può talvolta precedere e annullare la normale liberazione di insulina stimolata dal glucosio. Nelle situazioni di emergenza, il sistema nervoso simpatico si sostituisce al livello plasmatico del glucosio come fattore di controllo della secrezione da parte delle cellule β. Gli effetti metabolici dell’insulina 1) Gli effetti sul metabolismo dei carboidrati (fegato, muscolo e tessuto adiposo). - Fegato: l’insulina fa diminuire la sintesi di glucosio inibendo la gluconeogenesi e glicogenolisi. - Muscolo e fegato: l’insulina fa aumentare la glicogenosintesi. - Muscolo e tessuto adiposo: l’insulina fa aumentare l’assunzione di glucosio aumentando il numero dei relativi trasportatori presenti sulla membrana plasmatica. 2) Gli effetti sul metabolismo dei lipidi. -Diminuzione della degradazione dei triacilgliceroli: l’insulina fa diminuire il livello degli acidi grassi in circolo inibendo l’attività della lipasi sensibile agli ormoni nel tessuto adiposo (defosforilazione). -L’aumento della sintesi dei triacilgliceroli: l’insulina fa aumentare sia il trasporto del glucosio negli adipociti, che il suo metabolismo per produrre acidi grassi e glicerolo 3fosfato per la sintesi dei triacilgliceroli. Inoltre fa aumentare la sintesi della lipoproteina lipasi del tessuto adiposo, per cui nelle cellule si accumulano acidi grassi esterificabili. 3) Gli effetti sulla sintesi delle proteine: nella maggior parte dei tessuti l’insulina stimola l’ingresso degli amminoacidi nelle cellule e la sintesi delle proteine. Meccanismo d’azione dell’insulina L’insulina si lega a specifici recettori ad alta affinità presenti nella membrana plasmatica delle cellule nella maggior parte dei tessuti, tra cui il fegato, il muscolo e il tessuto adiposo innescando una serie di reazioni a cascata che produce una varietà di effetti biologici. 1. Il recettore dell’insulina 2. la traduzione del segnale (proteine substrato del recettore dell’insulina IRS) Meccanismo d’azione dell’insulina 3. Gli effetti dell’insulina sulle membrane (trasportatori del glucosio insulina sensibili GLUT-4) (muscolo scheletrico e tessuto adiposo). 4. La regolazione dei recettori (down-regulation) 5. I tempi delle risposte all’insulina (induzione, sintesi di glucochinasi, fosfofruttochinasi e piruvato chinasi). Caratteristiche del trasporto del glucosio in vari tessuti Alcuni tessuti hanno un sistema di trasporto del glucosio indipendente dall’insulina. Per esempio gli epatociti, gli eritrociti e certe cellule del tessuto nervoso, della mucosa intestinale, dei tubuli renali e della cornea non necessitano dell’insulina per assumere glucosio. Il glucagone Il glucagone è un ormone polipeptidico secreto dalle cellule α degli isolotti di Langerhans del pancreas. Assieme all’adrenalina, al cortisolo e all’ormone della crescita (ormoni controregolatori) contrasta molte delle azioni dell’insulina. Mantiene costante il livello ematico di glucosio attivando la glicogenolisi epatica e la gluconeogenesi. Il glucagone è un’unica catena polipeptidica composta da 29 amminoacidi (la stessa in tutte le specie di mammiferi esaminate a tutt’oggi). Il glucagone è sintetizzato sottoforma di un precursore più grande che poi è convertito nell’ormone vero e proprio attraverso una serie di tagli proteolitici selettivi, simili a quelli che avvengono nella biosintesi dell’insulina. La stimolazione della secrezione del glucagone Le cellule α rispondono a una varietà di stimoli che segnalano un’ipoglicemia effettiva o potenziale. I fattori che aumentano la secrezione del glucagone sono: 1) un basso livello ematico del glucosio.(digiuno notturno o prolungato). 2) gli amminoacidi.(pasto proteico: aumenta sia insulina che glucagone). 3) l’adrenalina. L’inibizione della secrezione del glucagone La secrezione del glucagone è ridotta in modo significativo da un elevato livello ematico di glucosio e di insulina. Entrambe le sostanze aumentano in seguito all’assunzione di glucosio o di un pasto ricco di carboidrati. Gli effetti metabolici del glucagone: 1) Gli effetti sul metabolismo dei carboidrati 2) Gli effetti sul metabolismo dei lipidi 3) Gli effetti sul metabolismo delle proteine Meccanismo d’azione del glucagone Ipoglicemia La sindrome ipoglicemica è caratterizzata da: 1) Sintomi che coinvolgono il SNC, quali stato confusionale, comportamento aberrante o coma. 2) Allo stesso tempo, un livello del glucosio ematico pari o inferiore a 40mg/dL. 3) Sintomi che scompaiono dopo pochi minuti dalla somministrazione di glucosio. L’ipoglicemia è un’emergenza medica, perché il SNC ha l’assoluta necessità di un continuo apporto ematico di glucosio, per alimentare il proprio metabolismo energetico. L’ipoglicemia transitoria può provocare una disfunzione cerebrale, mentre l’ipoglicemia grave e prolungata provoca la morte cerebrale. Non sorprende quindi che l’organismo disponga di molteplici meccanismi per impedire o correggere l’ipoglicemia. I cambiamenti ormonali più importanti per contrastare l’ipoglicemia sono l’aumento del glucagone e dell’adrenalina, insieme alla diminuzione del rilascio di insulina. I sintomi dell’ipoglicemia:sono suddivisi in due categorie, adrenergici e neuroglicopenici. I sintomi adrenergici (ansia, palpitazioni, tremori e sudorazione) sono mediati dalla secrezione di adrenalina, regolata dall’ipotalamo in risposta all’ipoglicemia. Si verificano quando il livello del glucosio ematico crolla improvvisamente. I sintomi neuroglicopenici, cioè la cessazione della fornitura di glucosio all’encefalo, compromette le funzioni di quest’organo provocando cefalea, stato confusionale, difficoltà della parola, convulsioni, coma e morte. Sono dovuti spesso a una graduale diminuzione del glucosio ematico a un livello inferiore a 40mg/dL. Sistemi glucoregolatori Negli esseri umani ci sono due sistemi sovrapposti di regolazione del glucosio, entrambi attivati dall’ipoglicemia: 1) gli isolotti di Langerhans che liberano il glucagone. 2) alcuni recettori dell’ipotalamo che rispondono a concentrazioni anormalmente basse del glucosio ematico. I glucorecettori ipotalamici possono innescare sia la secrezione di adrenalina (mediata dal sistema nervoso autonomo, sia la liberazione dell’ACTH e dell’ormone della crescita (GH) da parte dell’ipofisi anteriore. Il glucagone, l’adrenalina e il cortisolo sono a volte chiamati ormoni “controregolatori”, perché ciascuno di essi contrasta l’azione dell’insulina sull’utilizzazione del glucosio. • Glucagone e adrenalina • Cortisolo e ormone della crescita I tipi di ipoglicemia Vengono considerati tre tipi di ipoglicemia: 1) Ipoglicemia indotta dall’insulina: si verifica spesso in pazienti diabetici sottoposti ad insulina. A pazienti coscienti con leggera ipoglicemia si somministrano oralmente carboidrati. A pazienti ipoglicemici che perdono coscienza o non riescono più a coordinare la deglutizione si somministra glucagone per via sottocutanea o intramuscolare. 2) Ipoglicemia post-prandiale (ipoglicemia reattiva): è piuttosto frequente e consiste in una eccessiva liberazione di insulina dopo un pasto, determinando un’ipoglicemia transitoria che cessa senza assunzione di cibo. ( Terapia:frequenti piccoli pasti). 3) Ipoglicemia da digiuno, inclusa quella da intossicazione alcolica: è piuttosto rara e tende a produrre i sintomi della neuroglicopenia e può dipendere da una riduzione della velocità alla quale il fegato produce il glucosio. Ciò può dipendere da un danno epatico, da insufficienza surrenalica oppure si può manifestare in individui a digiuno che abbiano assunto una quantità rilevante di etanolo. Oppure da un aumento della velocità alla quale i tessuti periferici consumano il glucosio in seguito a un livello elevato di insulina provocato da un tumore pancreatico delle cellule β. Senza trattamento il paziente affetto da ipoglicemia da digiuno può perdere coscienza, avere le convulsioni o entrare in coma. Ipoglicemia da intossicazione alcolica a) la gluconeogenesi normale se non si assume etanolo b) l’inibizione della gluconeogenesi epatica da metabolismo dell’etanolo nel fegato
Scaricare