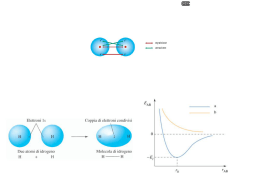
Considerazioni generali __________________________________________________________________ 2 Legame ionico__________________________________________________________________________ 4 Legami covalenti _______________________________________________________________________ 6 Legame covalente puro (omopolare) _______________________________________________________ 6 Legame covalente polare (eteropolare) _____________________________________________________ 7 Legame covalente dativo (o di coordinazione)________________________________________________ 8 Legame metallico _______________________________________________________________________ 9 Prof. Riccardo Peccolo Pagina 1 di 10 Considerazioni generali Le sostanze elementari ovvero, gli elementi chimici, che attualmente conosciamo sono circa un centinaio. Tuttavia i composti che possiamo ottenere attraverso reazioni di sintesi, partendo da tali elementi, sono molti di più. Si pensi che l’insieme dei composti che si possono ottenere combinando tra loro il carbonio, l’idrogeno, l’ossigeno e pochi altri elementi variandone il tipo, il numero e la disposizione geometrica sono svariati milioni e di giorno in giorno se ne preparano di nuovi. Questa grande varietà di composti deriva dunque dalla capacità degli atomi di legarsi tra loro. Ma perché gli atomi si legano? La risposta è tanto semplice da apparire addirittura banale: si legano perché uniti stanno meglio che separati. E’ un po’ quello che accade agli esseri umani che sentono il bisogno di creare dei legami sentimentali e quanto più forte è il legame tanto più stabile è la coppia. In chimica la stabilità, il benessere, si misura in termini di energia. Un sistema è tanto più stabile quanto minore è il suo livello di energia. Così per la formazione di un legame chimico l’energia potenziale chimica degli atomi slegati (lo stato iniziale del processo) è maggiore di quella degli atomi legati (lo stato finale). Da ciò consegue che la formazione di un legame è un processo esoergonico e l’energia liberata viene definita Energia di legame. A + B → A-B + Elegame Se analizziamo la reazione nel verso opposto risulta chiaro che affinché possa essere rotto il legame A -B è necessario fornire un quantitativo di energia pari a Elegame, per cui il legame sarà tanto più forte quanto maggiore sarà tale valore. Una seconda domanda è: “Che cosa utilizzano gli atomi per legarsi?”. Gli atomi si legano attraverso gli elettroni del guscio più esterno, ovvero il guscio di valenza. Per capire il meccanismo di formazione del legame proviamo dapprima ad immaginare un atomo singolo con un elettrone nel guscio di valenza. Esso sarà attratto dal proprio nucleo con una forza direttamente proporzionale alla Zeff (carica nucleare efficace) e inversamente proporzionale al quadrato della sua distanza da esso. Se ora immaginiamo di avvicinare a questo un secondo atomo, anch’esso con un elettrone spaiato, si verificherà, da una certa distanza in poi, una situazione per cui gli elettroni dei due atomi risentiranno della forza attrattiva di entrambi i nuclei. Questa attrazione reciproca costituisce di fatto il legame. Dobbiamo però considerare che l’avvicinamento, oltre a creare le condizioni sopra descritte, porterà i nuclei dei due atomi (positivi ovviamente) a respingersi. Esisterà dunque una distanza alla quale il bilancio tra l’attrazione elettronica sarà massima compatibilmente con la repulsione nucleare. A quella distanza, che viene definita distanza di legame si realizzeranno le condizioni maggiormente favorevoli per la formazione del legame. Distanza di legame Pagina 2 di 10 Un atomo ha la possibilità di legarsi contemporaneamente con più atomi. La retta immaginaria che passa per i due nuclei angolo di legame degli atomi legati viene definita asse di legame mentre l’angolo formato da due assi di legame viene chiamato angolo di legame. I valori degli angoli di legame derivano dalla necessità di rendere minima la repulsione tra i doppietti elettronici del guscio di valenza degli atomi di una molecola, argomento oggetto di una asse di legame specifica teoria ( teoria VSEPR ) che non verrà però affrontata in questa dispensa. La coppia di elettroni che formano il legame viene definita doppietto elettronico di legame. Ciascun atomo esercita una forza attrattiva sul doppietto elettronico di legame che dipende dalle sue caratteristiche e che è proporzionale al valore di una grandezza chiamata elettronegatività. Nella scala Pauling i valori di elettronegatività variano nell’intervallo 0-4. L’elettronegatività, nella tavola periodica degli elementi, aumenta dal basso verso l’alto e da sinistra a destra. Pertanto, gli elementi più elettronegativi sono i non metalli (con l’eccezione, chiaramente, dei gas nobili che non formando legami hanno elettronegatività nulla), quelli meno elettronegativi sono i metalli. Gli atomi, nel formare dei legami, cederanno, acquisteranno o metteranno in condivisione questi elettroni in modo da far sì che la loro configurazione elettronica esterna risulti simile a quella del gas nobile più vicino per numero atomico: a otto elettroni nella maggior parte dei casi (regola dell’ottetto), a due per gli elementi prossimi all’elio. Infine, a seconda della differenza di elettronegatività tra gli atomi legati si potranno verificare differenti situazioni che corrispondono a diversi tipi di legame che descriviamo di seguito. Pagina 3 di 10 Legame ionico Una grande differenza di elettronegatività tra gli atomi legati avrà come conseguenza il gravitare di entrambi gli elettroni del doppietto nel campo di attrazione dell’atomo più elettronegativo, determinando di fatto la perdita di un elettrone da parte dell’atomo meno elettronegativo a favore dell’altro atomo legato. Si avrà la formazione di un catione (ione positivo) e di un anione (ione negativo) che avendo carica opposta si attrarranno reciprocamente dando origine ad un legame che viene definito ionico e che risulta il più forte tra i legami primari. Convenzionalmente si ritiene che il legame ionico si realizzi tra due atomi aventi una differenza di elettronegatività maggiore di 1,67 unità Pauling. Il limite, tuttavia, non è così rigido e si può ritenere che in prossimità di tale valore si abbiano legami con caratteristiche non completamente ioniche. Valutando i valori di elettronegatività degli elementi possiamo concludere che tale tipo di legame si realizzerà normalmente tra metalli e non metalli. Un tipico composto ionico è il cloruro di sodio NaCl (la differenza tra l’elettronegatività del cloro (3.0) e del sodio (0.9) è 2.1) in cui coesistono ioni Na+ e Cl-. Si noti che nel formare lo ione Na+ il sodio perde, rispetto all’atomo neutro, un elettrone passando da 11 a 10, diventando isolelettronico con il Neon e assumendo, pertanto, una configurazione di particolare stabilità qual è quella del gas nobile. Cosa simile accade al cloro che nel diventare ione Cl- passa da 17 elettroni a 18, gli stessi del gas nobile che lo segue nella tavola periodica, cioè l’Argon. La cessione di un elettrone del sodio a favore del cloro (che giusto di un elettrone aveva bisogno per diventare stabile) fa sì che il rapporto di combinazione tra i due ioni sia di 1:1, espresso chiaramente da quella che viene definita formula minima del composto: NaCl. Gli indici stechiometrici della formula minima saranno dunque determinati dal numero di elettroni che devono essere ceduti o acquistati dagli atomi neutri per diventare stabili nella formazione degli ioni corrispondenti (valenza ionica). Per esempio il composto ionico che si forma tra alluminio e ossigeno avrà formula minima Al2O3 . Infatti, il n° complessivo di elettroni ceduti dall’alluminio deve essere necessariamente uguale a quello degli elettroni acquistati dagli atomi di ossigeno e quindi coincidente con il minimo comune multiplo (6) delle valenze ioniche dei due elementi (3 e 2). Ne consegue che saranno necessari 2 atomi di alluminio per cedere, diventando ioni Al3+ i 6 elettroni che potranno stabilizzare, diventando anioni O2- i 3 atomi di ossigeno. I composti ionici Struttura cristallina Allo stato solido le sostanze ioniche non esistono in forma di molecole bensì di cristalli. I loro ioni si alternano lungo tre direzioni spaziali, definite assi cristallografici, dando forma ad una struttura geometrica regolare chiamata reticolo cristallino. Tale reticolo può essere anche pensato come la ripetizione lungo i tre assi cristallografici di una figura geometrica solida elementare che viene definita cella elementare o cella unitaria. Na+ Na+ ClClNa+ Na+ Na+ Cl- Cl- ClNa+ Na+ ClClNa+ ClNa+ Na+ Cl- Na+ ClNa+ Cl- ClCella elementare Reticolo cristallino Pagina 4 di 10 Caratteristiche fisiche La fusione di un cristallo comporta la rottura di tali legami del reticolo cristallino. Se consideriamo che il legame ionico è molto forte risulta evidente che tale operazione richiederà parecchia energia. Non a caso le temperature di fusione del composti ionici sono normalmente molto elevate. La conducibilità elettrica è invece legata alla possibilità di libero movimento degli ioni. Infatti nei conduttori di seconda specie (elettroliti) la corrente elettrica si configura come un flusso di ioni. Allo stato solido ciò comporta la rottura dei legami ionici che, abbiamo gia visto, richiede una notevole energia. Ne consegue che i composti ionici non sono in grado di condurre la corrente elettrica allo stato solido. Lo fanno, invece, quando i loro ioni sono liberi di muoversi, cioè allo stato fuso o quando questi sono posti in soluzione. Le soluzioni saranno invece realizzate con solventi polari, come l’acqua, perché in tal modo si realizza una buona interazione tra gli ioni e le molecole del solvente, portando alla formazione di un sistema omogeneo. Relativamente alle proprietà meccaniche i solidi ionici sono duri e fragili. La fragilità di tali composti può essere interpretata in base al modello di legame se immaginiamo che l’applicazione di una intensa forza sulla superficie di un cristallo provocherà lo slittamento di interi piani di ioni, portando ad affacciarsi, al contrario di ciò che è normalmente, ioni con la stessa carica. La repulsione che si determina in tal caso porta i piani ionici interessati ad allontanarsi con la conseguente frattura del cristallo. percussione Pagina 5 di 10 Legami covalenti Una seconda tipologia di legami si ha quando si ritrovano legati atomi non metallici aventi una differenza di elettronegatività inferiore a 1.67 uP. In tal caso il doppietto elettronico di legame è attratto in misura forte dai due nuclei (ricordiamoci che si tratta di non metalli e quindi con discreti o addirittura alti valori di elettronegatività) ed è soggetto all’azione attrattiva di entrambi gli atomi. Per questo motivo si avrà la condivisione di tale doppietto parlando allora di legame covalente. In particolare quando è solo uno il doppietto condiviso si definisce il legame semplice; nel caso in cui i doppietti condivisi siano due o tre si parla genericamente di legami multipli o più specificatamente di doppio (due doppietti condivisi) o triplo (tre) legame. Al contrario del precedente che portava alla formazione di strutture cristalline, questo legame realizza strutture di tipo molecolare. Legame covalente puro (omopolare) Nel caso particolare in cui i due atomi non metallici abbiano la stessa elettronegatività, cosa che avviene normalmente quando si legano due atomi dello stesso elemento, il o i doppietti di legame saranno equamente condivisi per cui, al contrario del legame precedente, su gli atomi legati non avremo lo stabilirsi di alcun tipo di carica. Ciò significa che la geometria delle orbite degli elettroni intorno ai due nuclei avrà caratteristiche simmetriche. Inoltre gli stessi mediamente passeranno il loro tempo in misura maggiore nella zona compresa tra i due nuclei poiché in tale regione essi eserciteranno la maggiore attrazione. In questo caso il legame che si stabilisce tra gli atomi viene definito covalente puro o omopolare. Un altro modo di vedere le cose prende in considerazione le posizioni medie nel tempo dei baricentri delle cariche elettriche positive (nuclei) e negative (elettroni). Il baricentro delle cariche è il punto che dove possiamo immaginare sia condensato un sistema di cariche. Nell’esempio descritto sopra il baricentro dei nuclei sarà collocato esattamente a metà della distanza di legame. Quello del doppietto di legame è situato ad ogni istante a metà della distanza tra i due elettroni ed è quindi destinato a spostarsi continuamente. Tuttavia, visto il campo di forze assolutamente simmetrico generato dai due nuclei, non c’è motivo di pensare che la sua posizione media nel tempo non debba collocarsi anch’essa all’esatta metà della distanza di legame, ovvero dove si trova il baricentro delle cariche positive. Potremmo definire quindi il legame covalente puro o omeopolare quello in cui tra due atomi non metallici aventi la stessa elettronegatività i baricentri delle cariche elettriche positive e negative coincidono mediamente nel tempo. ± Anche in questo caso, così come nel legame ionico, il legame porta alla stabilizzazione degli atomi in quanto i doppietti essendo condivisi possono ritenersi di appartenenza di ciascun atomo. H H O O N N molecola di idrogeno: ogni atomo ha nel guscio di valenza 2 elettroni (il doppietto di legame) come l’elio molecola di ossigeno: ogni atomo di ossigeno nel guscio di valenza ha un ottetto di elettroni, due doppietti non condivisi e due condivisi nel doppio legame molecola di azoto: ogni atomo di azoto ha un ottetto di elettroni nel guscio di valenza, un doppietto non condiviso e tre condivisi nel triplo legame Pagina 6 di 10 Legame covalente polare (eteropolare) Tale legame rappresenta, se vogliamo, una situazione intermedia tra quelle precedentemente analizzate. La differenza di elettronegatività tra gli atomi è compresa tra i valori 0 del legame covalente puro e 1.67 oltre il quale si configura il legame ionico. La distribuzione della carica sarà, pertanto, una via di mezzo tra quella di tali legami. Ragionando in termini di posizione dei baricentri di carica dovremo concludere che poiché un atomo, seppure non in modo drammatico, è più elettronegativo dell’altro il baricentro medio nel tempo degli elettroni non sarà più coincidente con quello dei nuclei e risulterà spostato verso l’atomo più elettronegativo in misura tanto maggiore quanto maggiore sarà la differenza di elettronegatività. Di conseguenza la distribuzione della carica sarà asimmetrica determinando, rispetto alla equa distribuzione che caratterizza il legame covalente puro, un incremento densità elettronica nei pressi nell’atomo più elettronegativo ed un conseguente deficit di pari entità dalla parte opposta. Si creeranno, quindi, in corrispondenza degli atomi legati delle parziali cariche positive e negative che vengono convenzionalmente indicate con la lettera greca δ (delta) e che corrispondono come valore ad una frazione della carica dell’elettrone. +- δ+ Più la differenza di elettronegatività ∆x sarà prossima al valore 0 ( legame covalente puro) più la quantità di carica δ avrà valore nullo; più si avvicinerà al valore 1.67 più δ assumerà valori vicini all’unità corrispondenti al passaggio di un elettrone da un atomo all’altro, evento che si realizza appunto nel legame ionico. ∆x 1.67 δ- Legame Ionico δ 1 Covalente polare 0 Covalente puro 0 Momento dipolare elettrico di legame Un sistema come quello rappresentato dal legame covalente polare è, da un punto di vista fisico, quello che viene definito dipolo elettrico. Un dipolo elettrico è un sistema costituito da due cariche elettriche di eguale quantità ma di segno opposto rigidamente vincolate ad una distanza d. Ma se per misurare una semplice carica elettrica è sufficiente una grandezza scalare, la possibilità di un dipolo elettrico di essere diversamente orientato nello spazio richiede che la sua misura avvenga attraverso una grandezza di tipo vettoriale. Questa grandezza è il momento dipolare elettrico: un µ Q+ µ Qvettore che ha come direzione µ µ=Qxd l’asse che congiunge le due d cariche elettriche, µ verso dalla carica positiva a quella negativa e modulo dato dal prodotto della quantità di carica (positiva o negativa non importa … δδ+ tanto sono uguali) per la distanza tra le cariche stesse. L’unità di misura del momento H Cl dipolare elettrico è il debye (D) che corrisponde a 3,3 x 10-12 C m. Ora, un legame covalente polare è esattamente un dipolo elettrico in quanto due cariche Pagina 7 di 10 uguali come quantità ( δ ) e opposte come segno si trovano rigidamente collocate sugli atomi legati alla distanza di legame. Potremo allora descrivere in termini vettoriali la polarità di tali legami attraverso una grandezza che chiameremo, appunto, momento dipolare di legame. Il momento dipolare di legame risulterà estremamente utile in seguito quando dovremo valutare la polarità di una molecola. Legame covalente dativo (o di coordinazione) I legami covalenti che abbiamo visto fino a questo momento assomigliano molto alla formazione di una società tra due soci: entrambi concorrono alla sua costituzione con una eguale quota di capitale ( l’elettrone spaiato ). Il capitale sociale ( il doppietto elettronico di legame ) è condiviso e la formazione della società garantisce profitto e benessere a ciascuno dei due soci ( stabilità degli atomi legati ). Questo non è l’unico modo di formare una società. Supponiamo che la possibilità di fare grandi profitti sia legata alla realizzazione di un particolare progetto. Supponiamo anche che ci siano due persone: la prima dotata di notevoli risorse finanziarie ma assolutamente incapace di realizzare il progetto, la seconda senza il becco di un quattrino ma con le conoscenze adatte per attuarlo (cioè possiede quello che si definisce il know how). Le due persone, singolarmente, non sarebbero in grado realizzare il progetto e di trarne i relativi benefici, cosa che diventerebbe invece possibile se esse formassero una società in cui una fornisce l’intero capitale sociale e l’altra il know how. Questa situazione si presenta anche in chimica in quanto esistono atomi che hanno bisogno di un doppietto elettronico per raggiungere una configurazione stabile (e per questo vengono definiti elettron-deficienti) e altri che, nel guscio di valenza possiedono del doppietti elettronici non impegnati in legami. In queste condizioni, la condivisione del doppietto fornito dall’atomo (donatore) con l’atomo con deficit elettronico (accettore) porta alla formazione di un legame che viene definito covalente (..condivisione) dativo o di coordinazione. Da un punto di vista grafico mentre i normali legami covalenti vengono rappresentati con trattini (i doppietti di legame) che uniscono gli atomi, il covalente dativo si indica con una freccia orientata dal doppietto donato all’atomo accettore. Per fare qualche esempio, lo ione H+ che viene generato in acqua dalle sostanze acide, ha una configurazione elettronica 1s0 avendo l’idrogeno perso, nella ionizzazione, l’unico elettrone che possedeva. La configurazione più stabile prossima a questa è la 1s2, cioè quella dell’elio, il gas nobile più vicino come numero atomico all’idrogeno. Ecco, allora, che lo ione H+ si trova nella necessità, per stabilizzarsi, di condividere un doppietto elettronico con qualche atomo donatore. L’ossigeno delle molecole dell’acqua, ha a disposizione nel guscio di Legame dativo valenza, non uno ma addirittura due doppietti non donatore accettore condivisi. Uno di questi verrà, pertanto, impegnato in O H H H+ O H un legame covalente dativo + con lo ione H determinando H H la formazione dello ione 0 + 1s poliatomico H3O nel quale l’ossigeno non perde la sua 1s2 stabilità mentre l’idrogeno accettando il doppietto la acquista. Situazione identica quando si realizza il legame dativo tra l’ammoniaca ( NH3 ) e il tricloruro di boro ( BCl3 ). In questo caso è l’atomo di boro ad avere un deficit di elettroni ( ne ha 6 … gliene mancano 2 per raggiungere l’ottetto) e l’azoto dell’ammoniaca ad avere un doppietto disponibile per il legame. Si noti che con la formazione del legame covalente dativo l’azoto non perde stabilità perché mantiene, comunque, la configurazione otteziale e il boro la acquista condividendo, a legame formato, 4 doppietti elettronici. H Cl H N B H Cl Cl H Cl H N B H Cl Legame dativo Atomo elettron-deficiente Pagina 8 di 10 Cl I composti covalenti I composti in cui gli atomi sono legati da legami covalenti sono in genere cattivi conduttori di elettricità di prima specie in quanto la grande forza con cui i nuclei trattengono gli elettroni ostacola in modo importante il flusso degli stessi per azione di campi elettrici. Per questo motivo alcuni di questi, in particolare le materie plastiche, vengono abitualmente utilizzati come isolanti ( ricoprono per esempio i fili elettrici o gli attrezzi che si utilizzano in presenza di corrente elettrica ). Per questi materiali la mobilizzazione degli elettroni e quindi la conduzione elettrica può avvenire solo attraverso l’applicazione di differenze di potenziale molto elevate. Possono invece diventare conduttori di seconda specie (elettroliti) quando generano ioni per dissociazione come succede agli acidi nell’acqua. Legame metallico I metalli allo stato solido hanno una struttura cristallina. Ciò vuol dire che i loro atomi sono sistemati in un reticolo cristallino analogamente a quanto avviene nei composti ionici. Trattandosi di atomi dello stesso elemento, verrebbe la tentazione di affermare che, avendo la stessa elettronegatività, sono legati da un legame covalente puro. Questa affermazione, però, contrasta con le caratteristiche tipiche dei metalli quale, per esempio, la buona conducibilità elettrica. Infatti, se il legame fosse covalente puro il doppietto di legame dovrebbe essere fortemente trattenuto e localizzato tra due atomi e questo non spiegherebbe la facilità con cui si realizza il flusso di elettroni (la corrente nei conduttori di prima specie) quanto i metalli sono sottoposti a differenze di potenziale anche di basso valore. Ne consegue che il modello interpretativo per il legame metallico deve essere del tutto diverso da quello covalente e, chiaramente, deve poter spiegare il fenomeno che abbiamo descritto poco fa prevedendo l’esistenza di elettroni mobili e/o facilmente mobilizzabili. Altre considerazioni portano ad escludere per i metalli un legame di tipo covalente. Dalle analisi risulta che ogni atomo metallico è circondato, allo stato solido, da un numero elevato (8 o 12) di atomi vicini ed equidistanti. Ammesso che i legami fossero covalenti, la loro quantità non è giustificabile dal numero di elettroni spaiati che in genere possiedono gli atomi nel guscio di valenza. Il modello che verrà ora proposto pur non essendo in grado di spiegare in modo esauriente tutte le caratteristiche dei metalli ha il vantaggio di essere molto semplice e di riuscire a interpretare le proprietà e i fenomeni più comuni che li riguardano. I metalli, avendo basse energie di ionizzazione, possono dare agevolmente ioni positivi. Si immagina che, allo stato solido, tali elementi siano costituiti da un reticolo cristallino di tali cationi metallici. Tuttavia, se è facile comprendere la ionizzazione dei metalli, diventa difficile, al contrario, capire come tali ioni possano legarsi perché, avendo segno positivo, dovrebbero respingersi anziché attrarsi. Si pensa allora che il “legante” sia costituito da una nube di elettroni (quelli prodotti dalla ionizzazione) che avvolge e permea all’interno del reticolo cristallino. Gli elettroni, essendo negativi, esercitano una forza attrattiva nei confronti dei cationi metallici dando solidità alla struttura. Inoltre, essendo poco attratti dai rispettivi nuclei (bassa elettronegatività dei metalli) non orbitano più attorno al proprio nucleo ma, al contrario, sono in grado di muoversi liberamente (si definiscono “delocalizzati”) all’interno della struttura cristallina. Na+ Na+ Na+ Na+ Na+ Na+ Na+ + Pagina 9 di 10 Na+ Na+ Na+ Na+ Na+ Na Na+ Na+ Na+ Na+ Na Na+ Na+ Na+ + Na+ Na+ Na+ Caratteristiche dei metalli Conducibilità elettrica Come abbiamo già detto i metalli conducono bene la corrente elettrica. Tale proprietà è facilmente interpretabile in base al modello che è stato presentato in quanto esso prevede l’esistenza di elettroni delocalizzati e poco trattenuti dai rispettivi nuclei e, pertanto, facilmente mobilizzabili sotto l’effetto di una differenza di potenziale anche di lieve entità. E’ interessante anche l’interpretazione che si può dare dell’aumento della resistenza elettrica che si riscontra nei metalli all’aumentare della temperatura. I cationi metallici, tranne che allo zero assoluto, compiono dei moti oscillatori attorno ad una posizione di equilibrio la cui ampiezza è direttamente proporzionale alla temperatura. I cationi rappresentano perciò specie di barriere mobili nei confronti di un T2 > T1 T1 flusso di elettroni innescato da una differenza di potenziale. Più aumenta la temperatura più l’ostacolo esercitato da queste barriere diventa efficace in quanto si restringe la “luce” (lo spazio utile) a disposizione degli elettroni nel loro fluire. A temperature prossime allo zero assoluto (-273.15 °C), quando le oscillazioni sono minime, si può osservare il fenomeno della superconduttività che comporta in pratica l’annullamento della resistenza elettrica e quindi la possibilità di evitare fenomeni ad essa correlati, come l’effetto Joule (dissipazione di energia sottoforma di calore da parte di un conduttore percorso da elettricità), anche lavorando con valori di intensità di corrente molto elevati. Dilatazione termica L’aumento delle dimensioni dei metalli all’aumentare della temperatura e legato ovviamente all’incremento dell’ampiezza delle oscillazioni degli atomi. Questo comporta anche la diminuzione della densità poiché, ad una temperatura superiore, la stessa massa è distribuita su un volume maggiore. Proprietà meccaniche Come è noto i metalli sono duttili e malleabili (possono essere ridotti facilmente in sottili fili e lamine). Queste caratteristiche esprimono la lavorabilità meccanica dei metalli. Ma perché i metalli possono essere facilmente deformati senza spezzarsi come invece accade per i solidi ionici? La ragione può essere compresa utilizzando il modello di legame. L’applicazione di una forza di sufficiente intensità sulla superficie di un pezzo metallico comporta, come per le sostanze ioniche, lo slittamento di piani di ioni. Tuttavia, mentre come abbiamo visto per quest’ultime ciò detrmina la vicinanza di ioni dello stesso segno e, di conseguenza, la frattura del cristallo, per i metalli la presenza degli elettroni delocalizzati tra i piani di atomi garantisce comunque un effetto legante. Il pezzo metallico allora si deformerà senza, tuttavia, rompersi (un po’ come avviene quando si colpisce lateralmente un mazzo di carte da gioco: le carte scorrono le une sulle altre cambiando la forma del mazzo ma restano, comunque, accatastate). percussione Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Pagina 10 di 10 Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+
Scarica