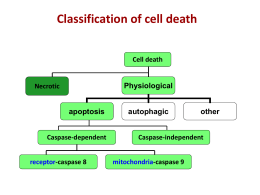
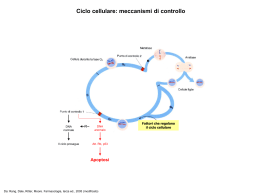
MORTE CELLULARE • apoptosi • necrosi • senescenza • autofagia • catastrofe mitotica NECROSI • è una morte passiva, non fisiologica • il danno primario è a livello della membrana plasmatica • aumento del volume cellulare a causa della perdita di controllo del flusso ionico (richiamo di H2O) • formazione di microvescicole • lesioni a carico degli organelli intracellulari • alterazioni a livello cromatinico • lisi cellulare per dissoluzione della membrana • riversamento dei componenti intracellulari nello spazio extracellulare • reazione antiinfiammatoria CELLULA NECROTICA APOPTOSI Processo fisiologico di eliminazione delle cellule danneggiate, invecchiate, potenzialmente dannose per l’architettura dell’intero tessuto-organo o cellule non piùutili all’organismo • termine adottato negli anni ‘70 • struttura e integrità della membrana vengono mantenute • gli organelli mantengono la loro funzione • alterazioni a carico del mitocondrio • modificazioni nucleari caratteristiche • modificazioni a livello della membrana plasmatica • frammentazione della cellula in “corpi apoptotici” CELLULA APOPTOTICA QUANDO SI ATTIVA IL PROCESSO APOPTOTICO? • quando l’organismo vuole eliminare cellule non desiderate attraverso l’attivazione di una sequenza di eventi coordinati e programmati • parte integrante dello sviluppo embrionale e fetale dell’organismo e dell’omeostasi tissutale dell’adulto (evidente nella metamorfosi del girino e nel feto) • in cellule infettate da virus può interrompere la replicazione virale • usata anche nel sistema immunitario per rimuovere i linfociti che non formano un recettore dell’antigene funzionale • viene indotta in cellule soggette a un esteso danno al DNA APOPTOSI distruzione di cellule durante l’embriogenesi controllo del numero di cellule modellamento di strutture involuzione ormono-dipendente nell’adulto morte cellulare durante neoplasie morte delle cellule immunitarie autoreattive morte delle cellule danneggiate da diversi stimoli STIMOLI APOPTOTICI • • • • farmaci radiazioni ionizzanti mancanza di stimolazione ormonale death receptors DIFETTO DI APOPTOSI • cellule tumorali • malattie a base autoimmune • infezioni virali ECCESSO DI APOPTOSI • sindrome dell’immunodeficienza acquisita • malattie neurodegenerative • sindromi mielodisplasiche • ischemia VIA ESTRINSECA VIA INTRINSECA VIA ESTRINSECA I recettori di morte sono proteine transmembrana in grado di legare citochine pro-apoptotiche, quali FasL, TNFa, TRAIL, e trasmettere il segnale di morte cellulare mediante l’attivazione di pathways specifici Si assemblano sotto forma di trimeri per favorire il riconoscimento del ligando CASPASI Il termine deriva dal fatto che tali enzimi hanno una cisteina © nel loro sito attivo e tagliano le proteine dopo residui di acido aspartico. procaspasi Iniziatrici caspasi 8 e 10 estrinseco, 9 intrinseco Effettrici 3, 6 e 7 Sono responsabili del taglio: -della matrice nucleare -delle proteine del citoscheletro Questi tagli producono le classiche alterazioni strutturali, sia del nucleo, sia del citoplasma, che si osservano nelle cellule apoptotiche VALUTAZIONE DELL’APOPTOSI TEST PIU’ UTILIZZATI: • valutazione mediante microscopia elettronica VALUTAZIONE DELL’APOPTOSI MEDIANTE MICROSCOPIA ELETTRONICA VALUTAZIONE DELL’APOPTOSI TEST PIU’ UTILIZZATI: • valutazione mediante microscopia elettronica • tunel assay TUNEL ASSAY • La rottura del DNA durante l’apoptosi dà luogo a frammenti di DNA con rotture del doppio filamento a basso o alto PM; • questi frammenti possono essere identificati marcando l’estremità 3’-OH libera per mezzo di un enzima, la TdT che catalizza la polimerizzazione di nucleotidi alle estremità 3’; • se si utilizzano dei nucleotidi marcati con fluorescenza questi frammenti di DNA possono essere identificati in microscopia e/o citofluorimetria. IN PRATICA: • si fissano le cellule in parafolmaldeide • si permeabilizzano con una soluzione contenente Triton • si marcano i frammenti di DNA con TdT e nucleotidi fluorescenti • si analizzano le cellule in microscopia a fluorescenza o in citofluorimetria VALUTAZIONE DELL’APOPTOSI MEDIANTE TUNEL ASSAY VALUTAZIONE DELL’APOPTOSI TEST PIU’ UTILIZZATI: • valutazione mediante microscopia elettronica • tunel assay • comet assay COMET ASSAY • le cellule trattate vengono risospese in agarosio, depositate su un vetrino e lisate • i vetrini vengono posti in una cella elettroforetica orizzontale e fatti correre per 20’ a 25 V • i vetrini vengono poi incubati con bromuro di etidio e osservati VALUTAZIONE DELL’APOPTOSI TEST PIU’ UTILIZZATI: • valutazione mediante microscopia elettronica • tunel assay • comet assay • DAPI/ colorazione con ioduro di propidio IN PRATICA: DAPI si fissano le cellule su vetrino con etOH 96% lavaggio in acqua 30 minuti di incubazione in una soluzione di DAPI lavaggio in PBS Microscopia-eccitazione UV VALUTAZIONE DELL’APOPTOSI TEST PIU’ UTILIZZATI: • valutazione mediante microscopia elettronica • tunel assay • comet assay • DAPI • colorazione con ioduro di propidio • frammentazione del DNA FRAMMENTAZIONE DEL DNA • • • • trattamento delle cellule con il composto in esame estrazione del DNA separazione dei frammenti su gel di agarosio visualizzazione dopo colorazione con bromuro di etidio OSSERVAZIONE dei NUCLEI APOPTOTICI staccare le cellule contare le cellule centrifugare a 1300 rpm per 10’ risospendere le cellule in Hoechst (5 mg/ml in PBS) alla concentrazione di 100 ml/ 106 cells incubare 15’ a 37°C centrifugare a 1900 rpm per 10’ risospendere il pellet in PI (50 mg/ml in PBS) alla concentrazione di 50 ml/ 106 cells deporre su vetrino e osservare al microscopio a fluorescenza AUTOFAGIA Il termine deriva dal greco e significa “mangiare sé stessi” E’ un processo di auto-degradazione lisosoma-mediato Esistono tre tipi di autofagia: macro-, micro-autofagia e autofagia chaperone-mediata Nella microautofagia porzioni di citosol vengono sequestrate e degradate direttamente dai lisosomi L’autofagia chaperone-mediata richiede il riconoscimento di proteine lisosomiali da parte di (heat shock protein) Hsp70 e Hsp73 E’ il principale meccanismo di regolazione del turnover di elementi citosolici e Organelli, ma è anche indotta rapidamente da stimoli quali la starvation e la deprivazione di fattori di crescita Metodi per evidenziare l’autofagia • osservazione mediante microscopia elettronica • colorazione con Arancio di Acridina e visualizzazione mediante microscopio a fluorescenza e/o citofluorimetro - seminare le cellule trattare incubare 15’ con AO (1 mg/ml) visualizzare
Scaricare