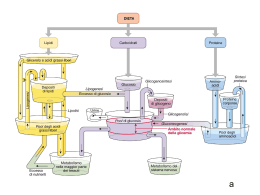
Ormoni pancreatici Due tipi di cellule: Acinose, secernono enzimi digestivi Agglomerati sferici concentrici isole del Langerhans – sensibili alla glicemia Quattro tipi di cellule costituiscono le isole del Langerhans : Cellule , secernono glucagone (stimola la glicogenolisi epatica e promuove l’immissione in circolo del glucosio) Cellule , secernono insulina (permette il metabolismo del glucosio attivando la glicolisi, la glicogenosintesi epatica, l’immagazzinamento dei grassi) Cellule , secernono somatostatina (inibisce la secrezione di insulina e glucagone e la sintesi dell’ormone della crescita ipofisario) Cellule PP secernono il peptide pancreatico (regola la secrezione pancreatica esocrina) DIABETE MELLITO Sintomatologia: polifagia (fame), polidipsia (sete), poliuria (eccesso di urine) Diabete di tipo 1 • Insulino-dipendente (IDDM), si verifica quando le cellule delle isole del Langerhans sono distrutte, probabilmente per un processo autoimmune. • Sintomi acuti, rapido calo di peso e comparsa di glucosio nelle urine • Sviluppo di -chetoacidosi diabetica. • Trattato con insulina. Diabete di tipo 2 • Non insulino-dipendente (NIDDM), spesso associato all’obesità. I livelli serici di insulina sono normali o elevati (insulino-resistenza) • Insorgenza insidiosa (spesso asintomatica); si rivela solo con esami clinici di routine • Raramente si riscontra -chetoacidosi diabetica. 3 • Terapia con insulina non sempre necessaria. Fattori che regolano la secrezione di insulina I livelli ematici di glucosio rappresentano il fattore più importante. Il glucagone potenzia il rilascio di insulina, ma si oppone ad alcuni dei suoi effetti periferici, aumentando il glucosio del plasma. Polipeptide amiloide (37 aa) delle isole, si deposita nel pancreas dei pazionti affetti da DM-2 Insulina, mg/mL Grafico delle due fasi di secrezione dell’insulina osservate durante un’infusione costante di glucosio. La prima fase è assente nel diabete mellito di tipo 2; entrambe mancano nel diabete mellito di tipo 1. La prima fase può anche venire stimolata da amminoacidi, sulfoniluree, glucagone e ormoni del tratto gastrointestinale. Metabolismo del glucosio Aminoacidi Glicogeno Aminoacidi Glicogeno Glucosio Glucosio Utilizzazione periferica Utilizzazione periferica Azione del glucagone (+) Azione dell’insulina (-) 6 7 Ormoni pancreatici (Isole di Langherans) Glucagone (cellule ), 29 aa, catena singola His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-AspSer-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Thr-Leu-Met-Asn-Thr Attività: previene l’ipoglicemia; stimola la glicogenolisi e la gluconeogenesi Meccanismo: Agisce su recettori specifici nel fegato stimolando l’adenilato ciclasi (azione simile a quella dell’adrenalina sui recettori β) per dare inizio alla glicogenolisi ed agli eventi correlati a cAMP (attivazione fosforilasi) Uso: trattamento dell’ipoglicemia in pazienti in stato di incoscienza; antidoto di dosi eccessive di insulina; somministrazione i.m. o s.c., ed anche e.v. 8 Ormoni pancreatici (Isole di Langherans) Insulina (cellule ), 51 aa Proteina dimerica, 2 catene: A (21 a.a.) e B (30 a.a.); pHi=5,30-5,35; 5733 D (insulina bovina). Proviene da un precursore inattivo a catena singola (proinsulina) idrolizzato da enzimi tripsinosimili. Cristallizza con tracce di Zn; quantità maggiori di Zn stabilizzano la molecola nei confronti di enzimi idrolitici (insulinasi). Forma complessi poco solubili con proteine basiche (protamina, globine, istoni), che migliorano la stabilità. Attività: stimola il catabolismo del glucosio, abbassa il tasso glicemico favorendo la sintesi di glicogeno epatico e inibendo glicogenolisi e gluconeogenesi Meccanismo: favorisce la permeazione del glucosio attraverso le membrane. Uso: cura del diabete mellito di tipo 1, stimolante dell’appetito. Pericoli: iperdosaggio ipoglicemia con convulsioni; rare reazioni allergiche con insuline eterologhe, ormai superate con i preparati biotecnologici. 9 Effetto dell’insulina su uptake e metabolismo del glucosio Binding al recettore (1) e attivazione a cascata (2) di: translocazione del trasportatore Glut-4 alla membrana plasmatica e influsso di glucosio (3), glicogeno sintesi (4), glicolisi (5) e sintesi di acidi grassi (6). Meccanismo d’azione Il recettore è un complesso glicoproteico transmembrana costituito da 2 subunità α (extracellulari, contengono il sito di legame dell’insulina) e da 2 subunità β (transmembrana, manifestano attività tirosinchinasica, autofosforlandosi quando l’ins. si lega al recettore). Sono schematicamente rappresentati gli eventi della trasduzione che mediano le risposte biologiche dell’insulina. Legenda Ras: superfamiglia di proteine (piccole GTPasi) coinvolte nella trasduzione del segnale IRS: substrato per il recettore dell’insulina (parecchie forme 1-4) Dominio SH2 (Src Homology 2): dominio altamente conservato, descritto per la prima volta come prodotto dell’oncogene Src Meccanismo con cui il glucosio entra nelle cellule adipose, muscolari ed epatiche: GLUCOSIO INSULINA (livelli ematici elevati) (cellule ) GLUT-4 Insulina Recettore (trasporto alla superficie cellulare) Cellule epatiche Trasporto di glucosio in: Cellule adipose Cellule muscolari -chetoacidosi (coma diabetico) AA Glucosio NH3 nel sangue Complicazioni del diabete A livelli abnormi di glucosio, viene attivato l’enzima aldosoreduttasi che trasforma il glucosio in eccesso nel corrispondente alcool (sorbitolo), molto polare e incapace di attraversare le membrane biologiche. Il sorbitolo è solo parzialmente metabolizzato a fruttosio. Quando l’osmolarità cellulare diventa molto alta si ha lisi cellulare. Problemi all’apparato visivo Nefropatia diabetica Aterosclerosi e altre complicazioni vascolari Struttura dell’insulina umana La forma attiva si ottiene dalla proinsulina dopo la eliminazione del peptide connettore. La catene A e B restano legate fra loro soltanto da due ponti disolfuro. peptide A: 21 a.a. proinsulina peptide B: 30 a.a. peptide C : 35 a.a. insulina Il peptide C (35 a.a.) viene ulteriormente modificato attraverso il distacco di un frammento dipeptidico da entrambe le estremità e secreto nel sangue insieme all’insulina in quantità stechiometrica. Gln Leu Ser Gly Ala Gly Pro Gly Gly Gly Leu Leu Glu Glu Peptide C Val Gly COOSer Gln 21 Asn 86 ponti S-S: Leu Gly 20 A7-B7 Val Gln Cys A20-B19 Gln Tyr Lys NH3+ A6-A11 Asn Leu Arg Catena A 1 1 Gln 1 Phe Asp 66 Gly Leu Val Ile Glu S-S Gln Asn Val 6 7 8 9 10 11 Ala Tyr Glu Gly Gln Cys Cys Thr Ser Ile Cys Ser Leu Glu His Arg Leu 30 Arg 7 Struttura primaria Cys Thr 30 Lys Catena B Gly determinata da Pro Ser 19 Sanger negli anni Thr His Leu Val Tyr 14 Glu Ala Leu Tyr Leu Val Cys Gly Glu Arg Gly Phe Phe 1950 20 a.a. A8, A9, A10, B30 caratteristici della specie Ala Leu Pro Insuline di varie specie animali Catena A Specie Bue Pecora Cavallo Maiale Coniglio Uomo Pos. 8 Ala Ala Thr Thr Thr Thr Pos. 9 Ser Gly Gly Ser Ser Ser Pos. 10 Val Val Ile Ile Ile Ile Catena B Pos. 30 Ala Ala Ala Ala Thr Thr Nota la struttura primaria di almeno 28 specie animali; quelle di più grande interesse sono la bovina e la porcina Effetti di variazioni strutturali: La sostituzione degli NH2 basici (es. acetilazione, carbammilazione o metilazione) non influenza l’attività La sostituzione dei gruppi acidi (acetilazione di OH fenolici e/o esterificazione di COOH) porta ad inattivazione La riduzione dei legami S-S porta a inattivazione reversibile per la possibilità di riformare il ponte disolfuro mediante ossidazione (insuline ibride) Le proprietà immunologiche risiedono nella catena A 15 Solo come monomero l’insulina è capace di interagire con i recettori (conc. fisiologiche < 0.1 M). Dimerizza a concentrazioni più alte (0.6 mM), tipiche dei preparati farmaceutici; a pH neutro in presenza di Zn++ forma esameri (forme di deposito nell’uomo). A conc. > 0.2 mM, esameri si formano anche in assenza di Zn. Zn-insulina (esamero) Immagine generata al computer (viola: residui His leganti lo ione Zn++). Modello space-filling del monomero (C, verde; H, bianco; N, blu; O, rosso) Rappresentazione “ribbon” dell’esamero (catena A, blu; catena B, celeste; ponti disolfuro, giallo; ione zinco, violetto) • Catena A: in questa conformazione un certo numero di residui idrofobici sono “coperti” all’interno del peptide, con conseguente miglioramento di solubilità in acqua e stabilità • Catena B: 1 -elica e 1 -turn; regione B21-B30 presente come -strand Degradazione chimica (pH 2-3) O N H O NH2 OH R pH 2-3 O H N H2N -NH3 O O O Asn A21 (Asn C-terminale) Phe N-terminale A1 O H2O N H Se conservato a 25 °C, il derivato deammidato inattivo costituisce il 90% della proteina totale dopo 6 mesi. A 4 °C la reazione di deammidazione procede ad una velocità di 1-2% al mese. O N H OH OH O OH O H N O R Degradazione chimica (pH 7) O N H O O NH2 O N H O R pH 7 N N H -NH3 O R Asn B3 +H2O O N H O OH H N O Aspartato R O N H R H N OH O O Isoaspartato Se l’insulina è conservata a pH neutro, si hanno reazioni completamente differenti. La deammidazione avviene al residuo Asn B3 e i prodotti, le insuline contenenti aspartato e isoaspartato, sono attive come l’insulina nativa. Preparati insulinici Insulina ad azione rapida Insulina regolare amorfa, bassa concentrazione di Zn. Trattamento di emergenza: coma diabetico Insulina ad azione media Insulina-Zn-Protamina, modesta concentrazione di Zn e di protamina. Terapia antiperglicemica Insulina ad azione prolungata Insulina-Zn-Protamina, alta concentrazione di Zn e di protamina. Solubile, messa in circolo più lentamente, ha funzione ritardo. Limitazioni: solo via parenterale, insulino-resistenza (produzione di anticorpi). 20 Gly Ser Leu Glu Gln Leu Ser Gly Ala Gly Pro Gly Gly Gly Ala Leu Pro Peptide C COO- Leu 1 Phe 1 Val Asn Gln His Arg Catena A Gln 66 Gly 1 Ile S-S Val 6 7 8 10 11 9 Glu Gly Cys Cys Thr Ser Ile Cys Ser Leu Asn Gln Leu Gln Tyr Leu Cys 7 Gly Ser Val Tyr Lys Catena B Thr 19 His Leu Val Glu Ala Leu Tyr Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Val Gln Gly 21 Asn 86 20 Cys Gln NH3+ Leu Glu Leu Asp Glu Ala Glu Arg Arg 30 Thr 30 Lys Pro 20 Insuline ricombinanti Insuline 28 29 30 WT Pro Lys Thr LISPRO Lys Pro Thr ASPART Asp Lys Thr GLARGINE Azione rapida AsnA21Gly + ArgB31ArgB32 Azione lenta Analoghi insulinici ad azione rapida • INSULINA LISPRO (Humalog) • INSULINA ASPART (Novorapid) Insuline ricombinanti. LISPRO differisce da quella umana per inversione di due aa nella catena B: Lys28 e Pro29 ASPART differisce da quella umana per la sostituzione con Asp della Pro28 nella catena B. Queste modificazioni strutturali riducono la tendenza dell’insulina a formare aggregati polimerici di più difficile assorbimento. Si ha quindi assorbimento immediato, azione rapida. Es. LISPRO: insorgenza d’azione dopo 15 min; durata d’azione 2-4 ore L’insulina ASPART ha un inizio di azione leggermente più ritardato e una durata di azione più lunga rispetto all’insulina LISPRO. Possono essere iniettate subito prima del pasto ed hanno una durata d’azione più breve rispetto all’insulina regolare. 22 Analoghi insulinici ad azione lenta INSULINA GLARGINE (LANTUS) • Insulina ricombinante. • Sostituzione della Asn21 (catena A) con una Gly e addizione di due Arg al residuo C-terminale della catena B (Arg31 e 32). Queste modificazioni aumentano la tendenza dell’insulina a formare aggregati polimerici ordinati. • Assorbimento relativamente rapido (2h) ed azione prolungata (24h). La concentrazione ematica si mantiene costante per un tempo abbastanza lungo senza mai raggiungere picchi di rilievo. 23 Ipoglicemizzanti orali Ipoglicemizzanti orali Tiadiazolo solfonammidi CH3 R= CH3 N N H2N SO2 NH Gliprotiazolo CH R S CH3 R= C CH3 Glibutiazolo CH3 SOLFONILUREE O R SO2 NH NH R' Meccanismo d’azione: Stimolano la secrezione di insulina , riducendo la conc. plasmatica di glucosio, e la proteggono dall’azione dell’insulinasi. Interagiscono con i recettori ad alta affinità sulle cellule del pancreas, bloccando i canali K+ ATP-dipendenti; di conseguenza, riducono la permeabilità al K+ delle cellule β, causando depolarizzazione, influsso di Ca2+ e secrezione di insulina. Sopprimono la gluconeogenesi nel fegato. Efficaci anche nei diabetici di tipo 2 (intatta capacità di secernere insulina, perduta capacità di produrre insulina malgrado alti livelli di glicemia). Si possono avere casi di ipoglicemia. 25 Proprietà chimico-fisiche delle solfoniluree R1 O S N O H O pKa ≈ 5 N R2 H R1 O S N O O N R2 H + H Forte legame alle proteine plasmatiche (60100%); interazione con dicumarolo (aumento PT, emorragie) Effetti collaterali • Nausea, vomito, diarrea, reazioni allergiche • Diuretiche (acetoesamide, tolazamide e glibenclamide) o antidiuretiche (clorpopamide) • Raramente discrasie ematiche Possibile antagonismo da parte di composti con effetti ipoglicemizzanti (glucocorticoidi, contraccettivi orali, simpaticomimetici) 26 Solfoniluree – 1a generazione Le SU di I e II generazione condividono molte caratteristiche; quelle di III generazione sono notevolmente differenti. R1 O S N O H O • LP = 65 97% N R2 H • Durata d’azione = 6 18 ore (clorpropamide, fino a 60 ore) Nome generico Nome commerciale Tolbutamide Orinase CH3 CH2CH2CH2CH3 Clorpropamide Diabinese Cl CH2CH2CH3 Tolazamide Tolinase CH3 N R1 R2 O Acetoesamide Dimelor CH3 27 Solfoniluree – 2a generazione R1 O S N O H O • Più attive di quelle di 1a generazione N R2 H • LP = 92 99% • Breve durata d’azione (fino a 24 ore) Nome generico Nome R1 commerciale Glibenclamide (Gliburide) Micronase Glinase PresTab R2 Cl HN O OCH3 N Glipizide Glucotrol HN H3C N O Consigliata una sola dose giornaliera. Entrambi disponibili in forma micronizzata. Subiscono 28 trasformazioni simili a quelli di prima generazione. Solfoniluree di 3a generazione e composti correlati Rapida insorgenza e lunga durata d’azione H3C O N H3C HN O S N O H O N H CH3 O Glimepiride Può legarsi ad una proteina diversa del recettore delle SU; effetto ipoglicemizzante con minore secrezione di insulina Può causare il trasferimento di GLUT-4 dal citoplasma ad un sito attivo della membrana cellulare Azione ipoglicemica dovuta ad effetti extraepatici (minori effetti collaterali; es. ipoglicemia) N H N O O COOH Repaglinide • Approvata nel 1998 per NIDDM • Azione più rapida rispetto agli altri ipoglicemizzanti orali • Minori effetti collaterali dovuti ad iperinsulinemia prolungata (es. aumento di peso, ipoglicemia) 29 Glinidi REPAGLINIDE (Novonorm) NATEGLINIDE (Fastic, Starsin) O N H N O O O N H H3C OH Phe CH3 COOH Meccanismo d’azione simile alle solfoniluree Si possono usare in monoterapia o in associazione con metformina (biguanide) Nateglinide: insorgenza più rapida e più breve durata di azione 30 Gli effetti ipoglicemici della guanidina sono noti dal 1918, ma i suoi effetti tossici ne impedirono l’uso. Le biguanidi furono introdotte negli anni 1950. Biguanidi • Classificati come Inibitori della produzione di glucosio epatico • Promuovono l’utilizzazione periferica degli zuccheri (Inib-fosfat-InsulTKR) • Possono dare acidosi lattica CH2 NH HN C NH (CH2)n NH C N H NH C C N NH2 H NH2 H2N n = 10: Sintalina A; n = 12: Sintalina B Introdotti in terapia negli anni 1920 e abbandonati nel 1930 per la loro tossicità cronica Fenformina Introdotta nel 1957 e ritirata dal mercato nel 1977. Produce aumento di acido lattico nel siero (acidosi lattica) H CH3 NH C C CH3 CH2 NH CH3 CH2 NH C NH2 Galegina (naturale) N NH NH C C CH3 N NH2 H Metformina Uso approvato nel 1995 (USA); incidenza di acidosi < 1 per 31 1000 Meccanismi d’azione Solfoniluree Aminoacidi Glicogeno Glucosio Utilizzazione periferica a) stimolano produz. e rilascio di insulina b) inibiscono la insulinasi insulina Biguanidi a) inibiscono la fosforilazione ossidativa b) inibiscono la neoglucogenesi c) aumentano la sensibilità tissutale all’insulina d) aumentano l’utilizzazione periferica del 32 glucosio Pathogenesis of type 2 diabetes with obesity. Genetic factors and environmental impositions confer susceptibility to weight gain, insulin resistance, and pancreatic β cell dysfunction. Excess adiposity promotes insulin resistance, which is initially compensated for by increased insulin concentrations. When the insulin concentrations are 33 unable to overcome the insulin resistance then hyperglycaemia develops. Continued deterioration of β cell function causes further impairment of glucose homoeostasis into type 2 diabetes Main sites of action of agents currently used to treat hyperglycaemia in type 2 diabetes. *Bromocriptine, colesevelam, and pramlintide are not licensed for the treatment of hyperglycaemia 34 in Europe. DPP-4, dipeptidyl peptidase 4; GLP-1, glucagon-like peptide 1 Effetto delle incretine (stimolano il rilascio dell’ insulina) DDP-4 : Dipeptidil peptidasi ( amminopeptidasi) 35 Meccanismo di azione delle Incretine ed inibizione della DDP-4 X 36 Meccanismo di azione delle Incretine ed inibizione della DDP-4 37 Saxagliptin : inibitore selettivo della DPP4 Usato nel diabete mellito tipo II in monoterapia o, meglio, in combinazione con Metformina 38 Linagliptin : inibitore selettivo della DPP4 Usato nel diabete mellito tipo II in monoterapia o, meglio, in combinazione con Metformina 39 Liraglutide (GLP1-like, agonist) 40 Lixisenatide Lixisenatide is a once-daily injectable GLP-1 receptor agonist ; 44 aas 41 Exenatide E’ un peptide di 39 aa, analogo dell’ orrmone peptidico GLP-1. 42 Virtually all the glucose filtered is reabsorbed, and none appears in the urine. The locations for sodium–glucose co-transporter 2 (SGLT2) and SGLT1 are shown. 43 Dapaglifozin ( Forxiga) Canaglifozin (Invokana) Diabete mellito tipo II. Selective Inhibition of human SGLT2 44 Glitazoni (tiazolidindioni) Riducono le concentrazioni di glucosio ematico, migliorando la sensibilità all’insulina dei tessuti adiposo, muscolo-scheletrico ed epatico O O HO NH S O O O O S Troglitazone Ciglitazone N O NH NH O O (epatotossico, rit. 2000) O CH3 N NH S Rosiglitazone (Avandia) O N O Pioglitazone (Actos) S O Meccanismo di azione: Agonisti recettore nucleare PPARg (Peroxisome-Proliferator-Activated Uso Terapeutico: Receptor g) che si lega preferenzialmente al DNA attivando la trascrizione di una varietà di regolatori metabolici 45 Da soli o in associazione con metformina e solfoniluree nel NIDDM Inibitori dell’-glucosidasi Metabolismo dei carboidrati complessi ridotto assorbimento Per essere assorbiti dal tratto GI, i carboidrati complessi ingeriti con la dieta (soprattutto amido e saccarosio) devono essere prima idrolizzati a monosaccaridi. Gli inibitori dell’glucosidasi, prevenendo l’idrolisi dei disaccaridi, riducono l’assorbimento dei monosaccaridi. L’amido generalmente viene digerito dall’-amilasi salivare e pacreatica per dare disaccaridi (es. maltosio), trisaccaridi (es. maltotriosio) e oligosaccaridi (destrina). Le oligosaccaridasi responsabili dell’idrolisi finale di questi materiali sono tutte localizzate nell’orletto a spazzola dell’intestino tenue. Le -glucosidasi agiscono sugli -zuccheri come maltosio, isomaltosio46e saccarosio. Inibitori dell’-glucosidasi ACARBOSIO (Glucobay) O OH HO 4,6-didesossi-4-ammino-D-glucosio O OH O OH HO OH HO H3C O O OH OH HO NH OH OH OH Carvosina • Sostanza naturale di origine microbica (actinomiceti) • Somministrata per os non viene assorbita. Assunto all’inizio dei pasti. • Tossicità epatica • Uso nel diabete mellito di tipo-2 (NIDDM) Meccanismo d’azione: Inibisce l’amilasi pancreatica e la -glucosidasi. NH impedisce ad un gruppo COOH essenziale dell’-glucosidasi di protonare l’O dei legami glicosidici del substrato 47 CH2OH VOGLIBOSIO OH OH CH2OH N H OH OH CH2OH MIGLITOLO CH2 CH2OH CH2OH N OH OH OH Derivati semisintetici natura basica. Attivi per os. Stesso effetto (rallentata idrolisi di zuccheri e polisaccaridi) e stesso meccanismo di acarbosio (inibizione della -glucosidasi). Assorbiti parzialmente ed eliminati nelle urine inalterati. Mostrano maggiore potenza, minori effetti collaterali e minore epatotossicità. DIA ADDIZIONALI 49 Metabolismo di glibenclamide e glipizide O S N O H R1 O N R2 H R1 O S N O H O N H OH trans-4’-OH (maggiore) “attiva” (15%) O H3C HN O S N O H inattiva O N H R1 O S N O H OH O N H cis-4’-OH (minore) Metabolismo di tolbutamide e tolazamide H3C O S N O H O N R2 H HOH2C O S N O H O N R2 H “Attiva” (35%) H3C O S N O H O OH N N H 4-OH-tolazamide (“attiva”) HOOC O S N O H O N R2 H Inattiva La tolbutamide (R2 = n-Bu) è metabolizzata nel fegato a idrossi-tolbutamide (ritiene il 35% dell’attività del suo precursore) che viene rapidamente convertito ad acido carbossilico inattivo. Perciò la tolbutamide è la meno potente delle SU. La 4-OH-tolazamide è meno potente della tolazamide, ma più della tolbutamide. Metabolismo di pioglitazone Studiato in ratti e cani, ha condotto alla scoperta di oltre 8 metaboliti risultanti dall’ossidazione di entrambi gli atomi di C adiacenti all’anello piridinico (variamente coniugati in urine e bile). O HOOC NH N S O N O Pioglitazone O M-5 OH HOOC N O R M-1 N M-3 Solfato coniugato O R OH N O R M-4 O N O R Glucuronide coniugato Taurina coniugato M-2 I metaboliti M-1, M-2 ed M-3 sembrano contribuire all’attività biologica del pioglitazone. R
Scarica